文档内容
}#}#}=}=AAAABFAIFFJBQQqARAAAuoCAAAQBRREGggaaLCgAGEJBkQkQs0ECkCaGaX0wQQK5CDhCBAAATNBIkA4IiiggwgUwSSYYZZBBAAQQQQ{{##{{}#}#}=}=AAAABFAIFFJBQQqARAAAuoCAAAQBRREGggaaLCgAGEJBkQkQs0ECkCaGaX0wQQK5CDhCBAAATNBIkA4IiiggwgUwSSYYZZBBAAQQQQ{{##{{}#}#}=}=AAAABFAIFFJBQQqARAAAuoCAAAQBRREGggaaLCgAGEJBkQkQs0ECkCaGaX0wQQK5CDhCBAAATNBIkA4IiiggwgUwSSYYZZBBAAQQQQ{{##{{}#}#}=}=AAAABFAIFFJBQQqARAAAuoCAAAQBRREGggaaLCgAGEJBkQkQs0ECkCaGaX0wQQK5CDhCBAAATNBIkA4IiiggwgUwSSYYZZBBAAQQQQ{{##{{2025届青岛高三上学期期初调研检测化学
试题+答案
2024 年高三年级期初调研检测
化学试题
2024.09
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试
卷上无效。
一、选择题:本题共 10 小题,每小题 2分,共 20分。每小题只有一个选项符合题目要求。
1.汉·陈琳《武军赋》:“铠则东胡阙巩,百炼精钢”。下列说法正确的是( )
A.钢是合金,合金是指含有两种或两种以上金属的混合物
B.炼铁常用的焦炉气可通过煤的气化获得
C.铁比铜活泼,铁的发现、大量冶炼和使用均早于铜
D.铁是比较活泼的金属,自然界中不存在游离态的铁
2.化学品在人类生产生活中有重要应用,下列说法错误的是( )
A.氢氧化铝可用于治疗胃酸过多
B.硫氢化钠可用作工业废水中铅离子的沉淀剂
C.硫磺可用于制造杀虫剂
D.四氧化三铁可用作红色颜料
3.下列化学用语或图示正确的是( )
A.2p 电子云图: B.P 的球棍模型:
z 4
C. 的命名:顺-3-氯-3-己烯 D.邻羟基苯甲醛的分子内氢键:
4.CO 低压合成甲醇反应为CO +3H =CH OH+H O,反应涉及的4种物质沸点最高的是( )
2 2 2 3 2
A.CO B.H C.CH OH D.H O
2 2 3 2
5.下列物质性质与用途对应关系错误的是( )
A.聚乙炔在掺杂状态下具有较高的电导率,用于制作导电材料
B.聚四氟乙烯塑料耐腐蚀,用于制作滴定管
C.高纯度二氧化硅透光性好,用于制作太阳能电池板
D.氧化钙具有良好的吸水性,用于制作食品干燥剂
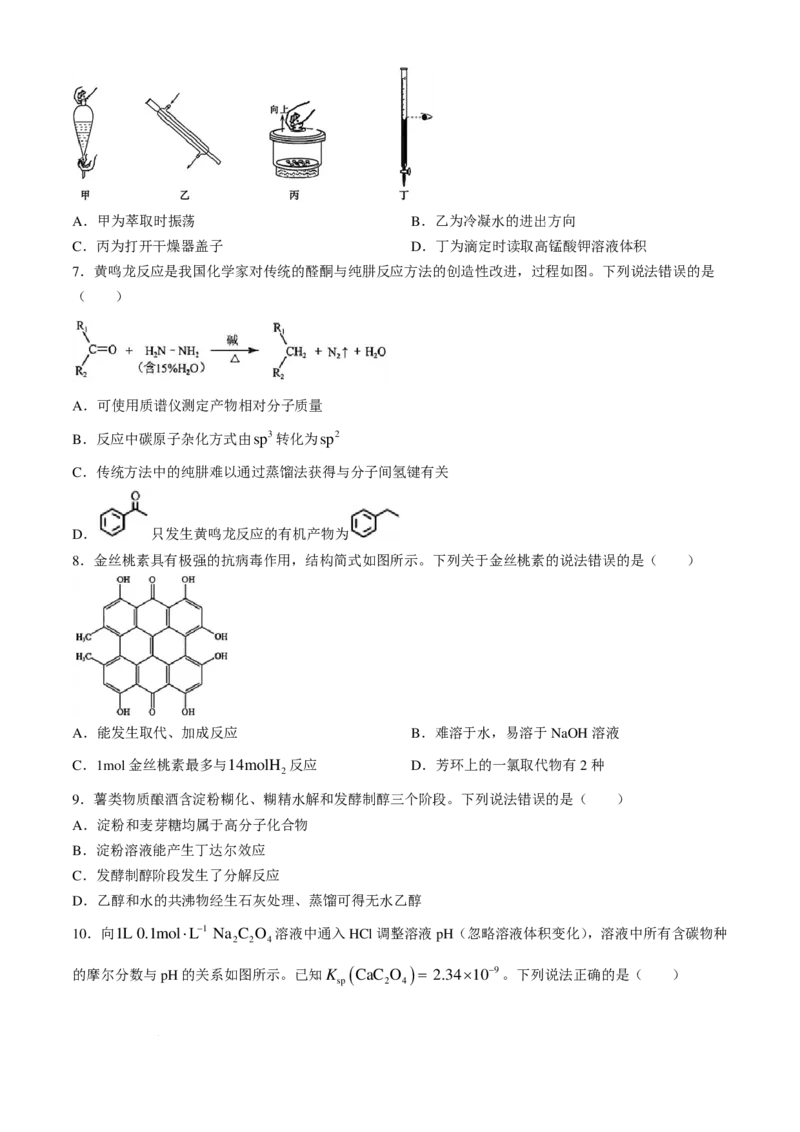
6.下列图示实验中,操作规范的是( )
学科网(北京)股份有限公司A.甲为萃取时振荡 B.乙为冷凝水的进出方向
C.丙为打开干燥器盖子 D.丁为滴定时读取高锰酸钾溶液体积
7.黄鸣龙反应是我国化学家对传统的醛酮与纯肼反应方法的创造性改进,过程如图。下列说法错误的是
( )
A.可使用质谱仪测定产物相对分子质量
B.反应中碳原子杂化方式由sp3转化为sp2
C.传统方法中的纯肼难以通过蒸馏法获得与分子间氢键有关
D. 只发生黄鸣龙反应的有机产物为
8.金丝桃素具有极强的抗病毒作用,结构简式如图所示。下列关于金丝桃素的说法错误的是( )
A.能发生取代、加成反应 B.难溶于水,易溶于NaOH溶液
C.1mol金丝桃素最多与14molH 反应 D.芳环上的一氯取代物有2种
2
9.薯类物质酿酒含淀粉糊化、糊精水解和发酵制醇三个阶段。下列说法错误的是( )
A.淀粉和麦芽糖均属于高分子化合物
B.淀粉溶液能产生丁达尔效应
C.发酵制醇阶段发生了分解反应
D.乙醇和水的共沸物经生石灰处理、蒸馏可得无水乙醇
10.向1L 0.1mol⋅L−1 Na C O 溶液中通入HCl调整溶液pH(忽略溶液体积变化),溶液中所有含碳物种
2 2 4
的摩尔分数与pH的关系如图所示。已知K ( CaC O )= 2.34×10−9。下列说法正确的是( )
sp 2 4
学科网(北京)股份有限公司A.曲线Ⅰ表示C O2−的变化情况
2 4
B.H C O 的K 约为10−5.4
2 2 4 a2
C.当溶液中c
(
C
O2−)
=c
(
HC
O−)
时,c
( Na+)
=4c
( Cl−)
2 4 2 4
D.pH=0时,向溶液中加入0.1molCaCl 固体,会产生CaC O 沉淀
2 2 4
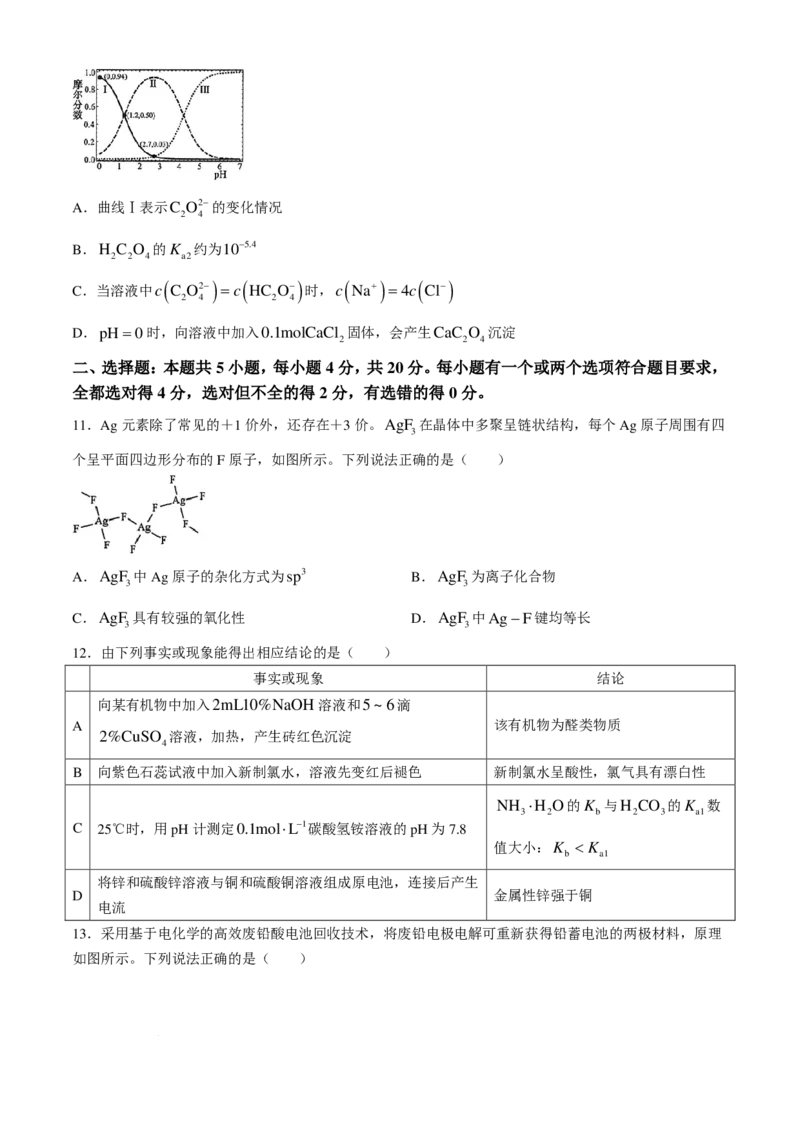
二、选择题:本题共 5小题,每小题 4分,共20分。每小题有一个或两个选项符合题目要求,
全都选对得 4分,选对但不全的得 2分,有选错的得 0分。
11.Ag元素除了常见的+1价外,还存在+3价。AgF 在晶体中多聚呈链状结构,每个Ag原子周围有四
3
个呈平面四边形分布的F原子,如图所示。下列说法正确的是( )
A.AgF 中Ag原子的杂化方式为sp3 B.AgF 为离子化合物
3 3
C.AgF 具有较强的氧化性 D.AgF 中Ag−F键均等长
3 3
12.由下列事实或现象能得出相应结论的是( )
事实或现象 结论
向某有机物中加入2mL10%NaOH溶液和5~6滴
A 该有机物为醛类物质
2%CuSO 溶液,加热,产生砖红色沉淀
4
B 向紫色石蕊试液中加入新制氯水,溶液先变红后褪色 新制氯水呈酸性,氯气具有漂白性
NH ⋅H O的K 与H CO 的K 数
3 2 b 2 3 a1
C 25℃时,用pH计测定0.1mol⋅L−1碳酸氢铵溶液的pH为7.8
值大小:K < K
b a1
将锌和硫酸锌溶液与铜和硫酸铜溶液组成原电池,连接后产生
D 金属性锌强于铜
电流
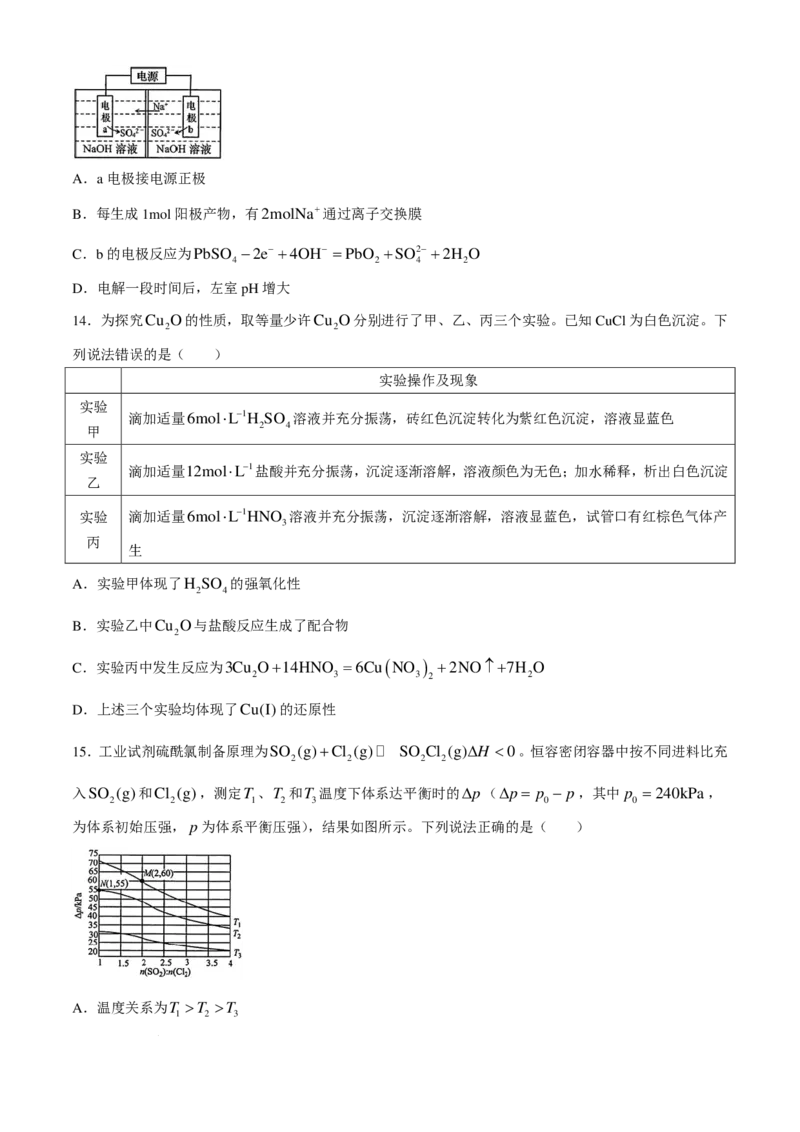
13.采用基于电化学的高效废铅酸电池回收技术,将废铅电极电解可重新获得铅蓄电池的两极材料,原理
如图所示。下列说法正确的是( )
学科网(北京)股份有限公司A.a电极接电源正极
B.每生成1mol阳极产物,有2molNa+通过离子交换膜
C.b的电极反应为PbSO −2e− +4OH− =PbO +SO2− +2H O
4 2 4 2
D.电解一段时间后,左室pH增大
14.为探究Cu O的性质,取等量少许Cu O分别进行了甲、乙、丙三个实验。已知CuCl为白色沉淀。下
2 2
列说法错误的是( )
实验操作及现象
实验
滴加适量6mol⋅L−1H SO 溶液并充分振荡,砖红色沉淀转化为紫红色沉淀,溶液显蓝色
甲 2 4
实验
滴加适量12mol⋅L−1盐酸并充分振荡,沉淀逐渐溶解,溶液颜色为无色;加水稀释,析出白色沉淀
乙
实验 滴加适量6mol⋅L−1HNO 溶液并充分振荡,沉淀逐渐溶解,溶液显蓝色,试管口有红棕色气体产
3
丙
生
A.实验甲体现了H SO 的强氧化性
2 4
B.实验乙中Cu O与盐酸反应生成了配合物
2
C.实验丙中发生反应为3Cu O+14HNO =6Cu ( NO ) +2NO↑+7H O
2 3 3 2 2
D.上述三个实验均体现了Cu(I)的还原性
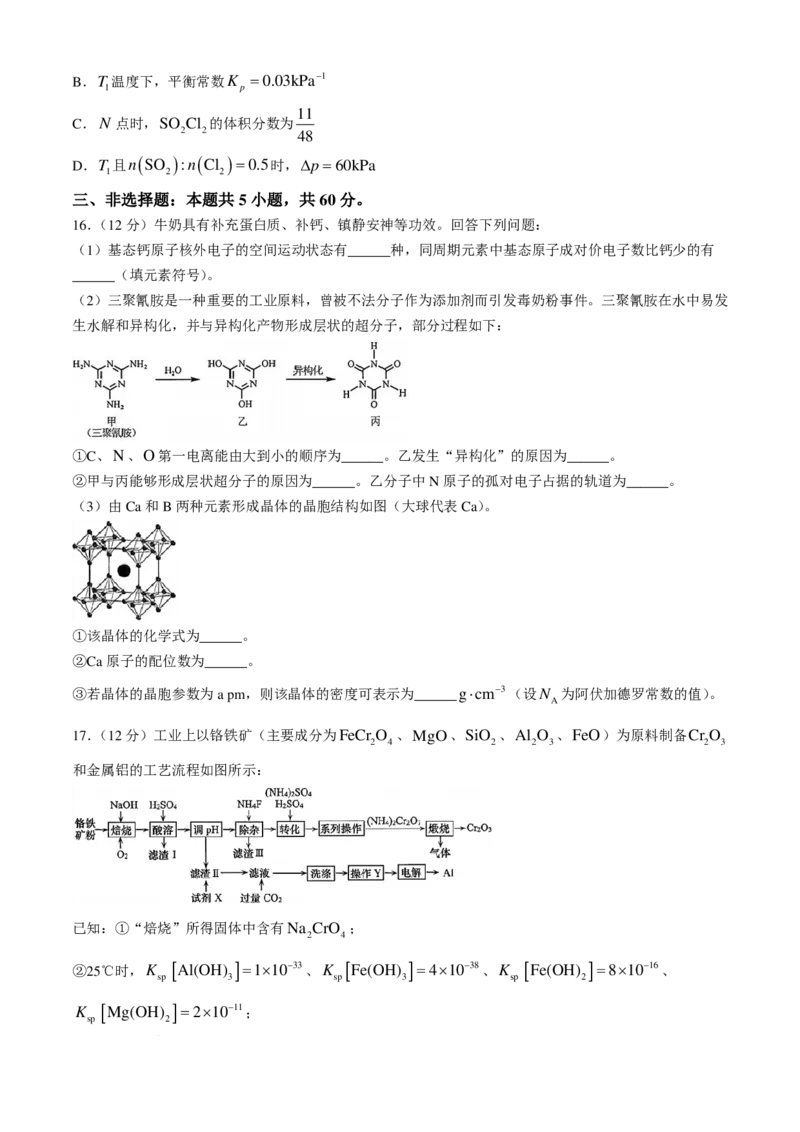
15.工业试剂硫酰氯制备原理为SO (g)+Cl (g) SO Cl (g)∆H <0。恒容密闭容器中按不同进料比充
2 2 2 2
入SO (g)和Cl (g),测定T 、T 和T 温度下体系达平衡时的∆p(∆p = p − p,其中 p =240kPa,
2 2 1 2 3 0 0
为体系初始压强, p为体系平衡压强),结果如图所示。下列说法正确的是( )
A.温度关系为T >T >T
1 2 3
学科网(北京)股份有限公司B.T 温度下,平衡常数K =0.03kPa−1
1 p
11
C.N 点时,SO Cl 的体积分数为
2 2 48
D.T 且n ( SO ) :n ( Cl )=0.5时,∆p =60kPa
1 2 2
三、非选择题:本题共 5小题,共 60分。
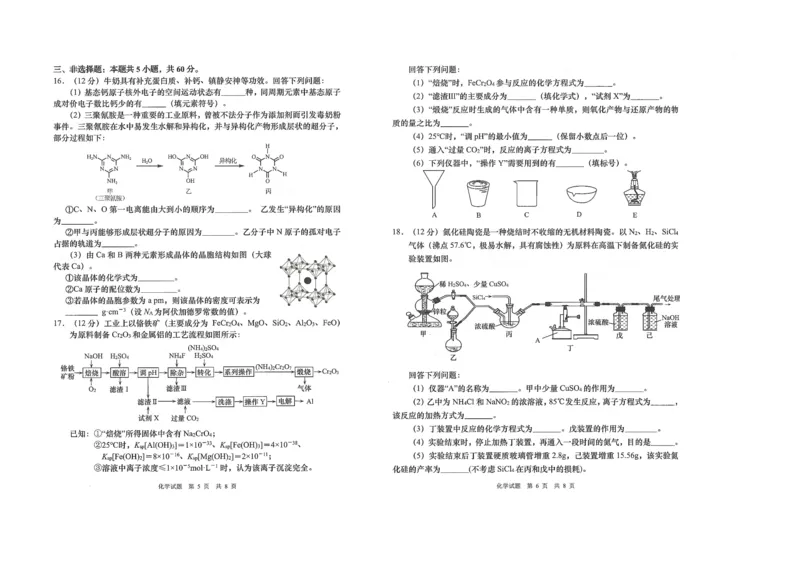
16.(12分)牛奶具有补充蛋白质、补钙、镇静安神等功效。回答下列问题:
(1)基态钙原子核外电子的空间运动状态有______种,同周期元素中基态原子成对价电子数比钙少的有
______(填元素符号)。
(2)三聚氰胺是一种重要的工业原料,曾被不法分子作为添加剂而引发毒奶粉事件。三聚氰胺在水中易发
生水解和异构化,并与异构化产物形成层状的超分子,部分过程如下:
①C、N、O第一电离能由大到小的顺序为______。乙发生“异构化”的原因为______。
②甲与丙能够形成层状超分子的原因为______。乙分子中N原子的孤对电子占据的轨道为______。
(3)由Ca和B两种元素形成晶体的晶胞结构如图(大球代表Ca)。
①该晶体的化学式为______。
②Ca原子的配位数为______。
③若晶体的晶胞参数为a pm,则该晶体的密度可表示为______g⋅cm−3(设N 为阿伏加德罗常数的值)。
A
17.(12分)工业上以铬铁矿(主要成分为FeCr O 、MgO、SiO 、Al O 、FeO)为原料制备Cr O
2 4 2 2 3 2 3
和金属铝的工艺流程如图所示:
已知:①“焙烧”所得固体中含有Na CrO ;
2 4
②25℃时,K [ Al(OH) ]=1×10−33、K [ Fe(OH) ]=4×10−38、K [ Fe(OH) ]=8×10−16、
sp 3 sp 3 sp 2
K
[
Mg(OH)
]=2×10−11;
sp 2
学科网(北京)股份有限公司③溶液中离子浓度≤1×10−5mol⋅L−1时,认为该离子沉淀完全。
回答下列问题:
(1)“焙烧”时,FeCr O 参与反应的化学方程式为______。
2 4
(2)“滤液Ⅲ”的主要成分为______(填化学式),“试剂X”为______。
(3)“煅烧”反应时生成的气体中含有一种单质,则氧化产物与还原产物的物质的量之比为______。
(4)25℃时,“调pH”的最小值为______(保留小数点后一位)。
(5)通入“过量CO ”时,反应的离子方程式为______。
2
(6)下列仪器中,“操作Y”需要用到的有______(填标号)。
A B C D E
18.(12分)氮化硅陶瓷是一种烧结时不收缩的无机材料陶瓷。以N 、H 、SiCl 气体(沸点57.6℃,极
2 2 4
易水解,具有腐蚀性)为原料在高温下制备氮化硅的实验装置如图。
回答下列问题:
(1)仪器“A”的名称为______,甲中少量CuSO 的作用为______。
4
(2)乙中为NH Cl和NaNO 的浓溶液,85℃发生反应,离子方程式为______,该反应的加热方式为______。
4 2
(3)丁装置中反应的化学方程式为______。戊装置的作用为______。
(4)实验结束时,停止加热丁装置,再通入一段时间的氮气,目的是______。
(5)实验结束后丁装置硬质玻璃管增重2.8g,已装置增重15.56g,该实验氮化硅的产率为______(不考虑
SiCl 在丙和戊中的损耗)。
4
19.(12分)有机化合物W是一种镇痛药物的中间体,其一种合成路线如图所示:
已知:
学科网(北京)股份有限公司① ,(R为烃基或H,下同);
②
回答下列问题:
(1)B的名称为______。W中的含氧官能团名称为______。
(2)E的结构简式为______。C→D的反应类型为______。
(3)满足下列条件的C的同分异构体共有______种(不考虑立体异构)。
①含有苯环,且仅有两个侧链;
②过FeCl 溶液显紫色;
3
③与新制Cu(OH) 悬浊液加热条件下反应,产生砖红色沉淀。
2
(4)F→G反应的化学方程式为______。
(5)结合上述信息,以 为原料三步合成 的路线为
,其中“一定条件”为______,M的结构简式为______。
20.(12分)工业上通过在高温条件下用焦炭还原Ca ( PO ) 来生产白磷。为优化生产条件,往往会向原
3 4 2
料中添加石英砂。过程中发生下列反应:
2Ca ( PO ) (s)+10C(s) 6CaO(s)+P (g)+10CO(g) (I) ∆H >0
3 4 2 4 1
CaO(s)+SiO (s) CaSiO (s) (II) ∆H <0
2 3 2
(1)2Ca ( PO ) (s)+10C(s)+6SiO (s) 6CaSiO (s)+P (g)+10CO(g) (III)的反应热∆H =
3 4 2 2 3 4 3
______(用代数式表示)。
(2)在一真空恒容密闭容器中加入足量的焦炭、Ca ( PO ) 、SiO ,控制反应温度为T ,发生以上三个
3 4 2 2 1
反应。下列能证明反应达到平衡状态的有______(填标号)。
A.气体中P 的百分含量不再变化 B.容器内压强不再变化
4
C.气体的密度不再变化 D.气体的平均相对分子质量不再变化
(3)CH 也可以作为制取白磷的还原剂,反应方程式为
4
6Ca ( PO ) (s)+10CH (g)+18SiO (s) 18CaSiO (s)+3P (g)+10CO(g)+20H O(g)(IV)
3 4 2 4 2 3 4 2
∆H >0。在一容器中加入足量的Ca ( PO ) 、SiO 并通入一定量的CH ,在不同的压强下,反应体系
4 3 4 2 2 4
达到平衡时测得CH 体积分数随温度T的变化关系如图所示:
4
学科网(北京)股份有限公司①上图中压强由高到低的顺序为______,判断依据是______。
②M 点与N 点以CO表示的正反应速率大小关系为v ______v (填“>”、“=”或“<”)。
M N
③温度为T 时,若p =100kPa,则CH 的平衡转化率为______,反应Ⅳ的平衡常数K =______(列出
0 1 4 p4
算式即可)。
学科网(北京)股份有限公司2024 年高三年级期初调研检测
化学参考答案及评分标准
一、选择题:本题共 10 小题,每小题 2分,共 20分。每小题只有一个选项符合题意。
1.B 2.D 3.A 4.D
5.C 6.D 7.B 8.C
9.A 10.D
二、选择题:本题共 5小题,每小题 4分,共 20分。每小题有一个或两个选项符合题意,全
都选对得 4分,选对但不全的得 2分,有选错的得 0分。
11.C 12.D 13.BC 14.AD
15.BD
三、非选择题:本题共 5小题,共 60分。
16.(12分)
(1)10(1分) K、Cr(2分)
(2)①N>O>C(1分)
烯醇式结构不稳定或碳氧双键比碳氮双键稳定或乙中羟基氢有酸性氮有碱性(1分)
②分子间氢键作用(1分) sp2杂化轨道(1分)
106
(3)①CaB (1分) ②24(2分) ③ ×1030(2分)
6 N a3
A
17.(12分)
△
(1)4FeCr O +16NaOH+7O 2Fe O +8Na CrO +8H O(2分)
2 4 2 2 3 2 4 3
(2)MgF (1分) NaOH溶液(1分)
2
(3)1:1(2分) (4)4.7(2分)
(5)[Al(OH)]− +CO =Al(OH)] ↓+HCO−(2分)
4 2 3 3
(6)BE(2分)
18.(12分)
(1)酒精喷灯(1分) 在锌表面产生少量铜,形成原电池,加快反应速率(2分)
85℃
(2)NH + +NO− N ↑+2H O(2分) 水浴加热(1分)
4 2 2 2
高温
(3)3SiCl +2N +6H Si N +12HCl(2分)
4 2 2 3 4
防止己中的水蒸气进入前面的反应装置中(1分)
(4)将装置内残留的HCl和SiCl 气体排出(1分)
4
学科网(北京)股份有限公司(5)60%(2分)
19.(12分)
(1)4-乙基苯酚或对乙基苯酚(1分) 羧基、醚健、(酮)羰基(2分)
(2) (1分) 加成反应(1分)
(3)36(2分)
(4) (2分)
(5)浓硫酸,加热(1分) (2分)
20.(12分)
(1)∆H +6∆H (2分)
1 2
(2)BG(2分)
(3)①p >p >p (1分) 该反应为气体分子数目增多的反应,增大压强平衡逆向移动,CH 的体
1 2 3 4
积分数增大(2分)
②<(1分)
10 1010×2020×33
③ 或13%(2分) kPa23(2分)
77 6710
学科网(北京)股份有限公司