文档内容
2023-2024 学年第一学期 11 月高三阶段测试卷
化学
注意事项:
1.本试卷共100分,考试时间75分钟。
2.请将各题答案填在答题卡上。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 S:32 Re:
186
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项符合题目要求。
1. 2023年第19届杭州亚运会上出现了很多新材料,其中用到天然有机高分子材料的是
A. 竞赛自行车整体车架采用高模量碳纤维
B. 运动员房间的漱口杯、衣架采用麦秸秆材质
C. 白色棚罩“云之翼”的顶部覆盖了带二氧化钛涂层的PTFE(聚四氟乙烯)膜
D. 亚运火炬“薪火”的金属部分采用1070铝合金旋压成型
2. 下列表述正确且可以用“相似相溶”原理解释的是
A. 二氧化氮可以用排水法收集 B. 碘水可以用乙醇萃取
.
C 氯化氢可以做喷泉实验 D. 二氧化硫可以用NaOH溶液吸收
3. 下列化学用语正确的是
A. N 的结构式:N=N
2
B. S2-结构示意图:
C. 用电子式表示KCl的形成过程:
D. 质量数为2的氢核素:
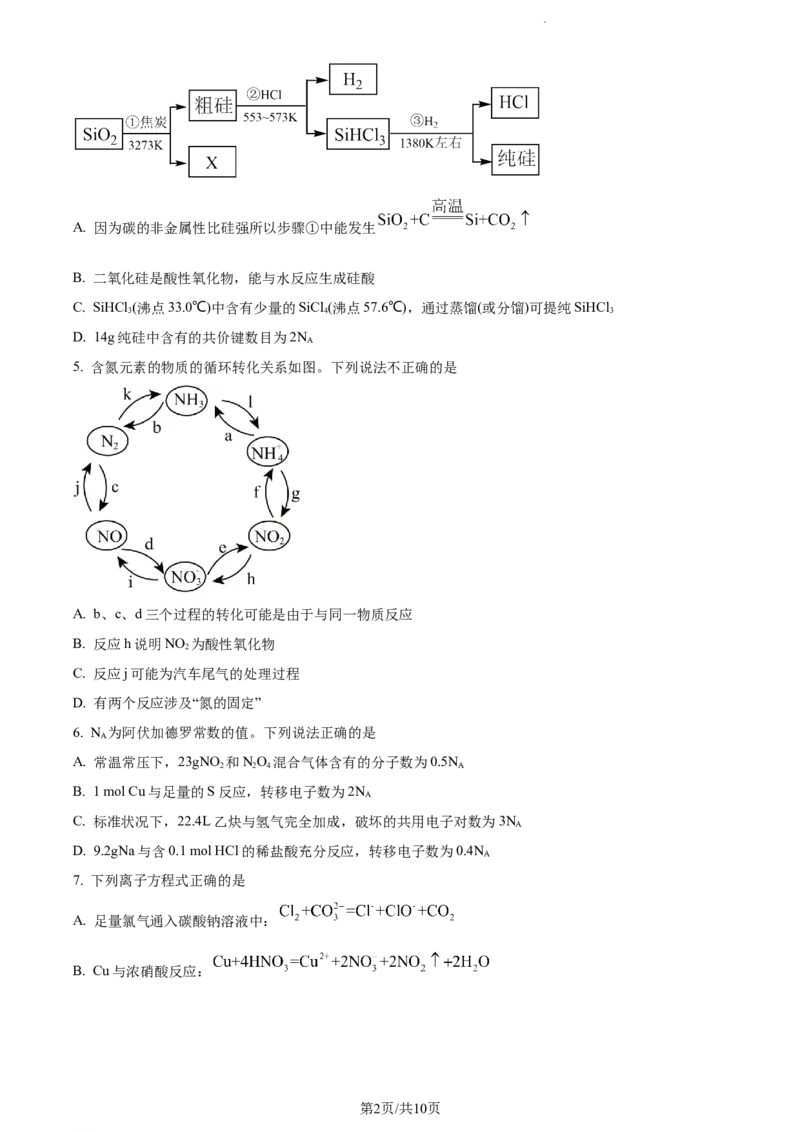
4. 2023年9月华为推出了举世瞩目的“中国芯”——麒麟芯。制备“中国芯”的主要原料是单晶硅,制取纯硅
的过程如下图。下列说法正确的是
第1页/共10页
学科网(北京)股份有限公司A. 因为碳的非金属性比硅强所以步骤①中能发生
B. 二氧化硅是酸性氧化物,能与水反应生成硅酸
C. SiHCl (沸点33.0℃)中含有少量的SiCl (沸点57.6℃),通过蒸馏(或分馏)可提纯SiHCl
3 4 3
D. 14g纯硅中含有的共价键数目为2N
A
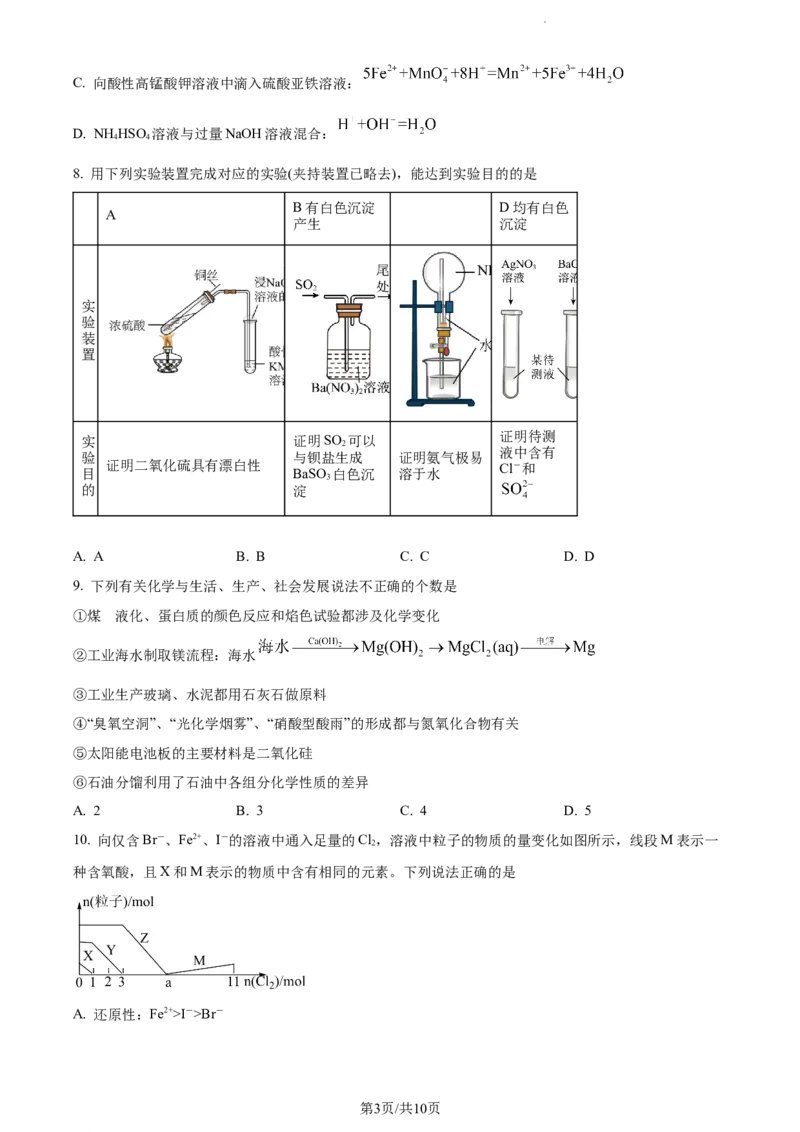
5. 含氮元素的物质的循环转化关系如图。下列说法不正确的是
A. b、c、d三个过程的转化可能是由于与同一物质反应
B. 反应h说明NO 为酸性氧化物
2
C. 反应j可能为汽车尾气的处理过程
D. 有两个反应涉及“氮的固定”
6. N 为阿伏加德罗常数的值。下列说法正确的是
A
A. 常温常压下,23gNO 和NO 混合气体含有的分子数为0.5N
2 2 4 A
B. 1 mol Cu与足量的S反应,转移电子数为2N
A
C. 标准状况下,22.4L乙炔与氢气完全加成,破坏的共用电子对数为3N
A
D. 9.2gNa与含0.1 mol HCl的稀盐酸充分反应,转移电子数为0.4N
A
7. 下列离子方程式正确的是
A. 足量氯气通入碳酸钠溶液中:
B. Cu与浓硝酸反应:
第2页/共10页
学科网(北京)股份有限公司C. 向酸性高锰酸钾溶液中滴入硫酸亚铁溶液:
D. NH HSO 溶液与过量NaOH溶液混合:
4 4
8. 用下列实验装置完成对应的实验(夹持装置已略去),能达到实验目的的是
B有白色沉淀 D均有白色
A
产生 沉淀
实
验
装
置
证明待测
实 证明SO 可以
2
液中含有
验 与钡盐生成 证明氨气极易
证明二氧化硫具有漂白性 Cl-和
目 BaSO 白色沉 溶于水
3
的 淀
A. A B. B C. C D. D
9. 下列有关化学与生活、生产、社会发展说法不正确的个数是
①煤 的液化、蛋白质的颜色反应和焰色试验都涉及化学变化
②工业海水制取镁流程:海水
③工业生产玻璃、水泥都用石灰石做原料
④“臭氧空洞”、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
⑤太阳能电池板的主要材料是二氧化硅
⑥石油分馏利用了石油中各组分化学性质的差异
A. 2 B. 3 C. 4 D. 5
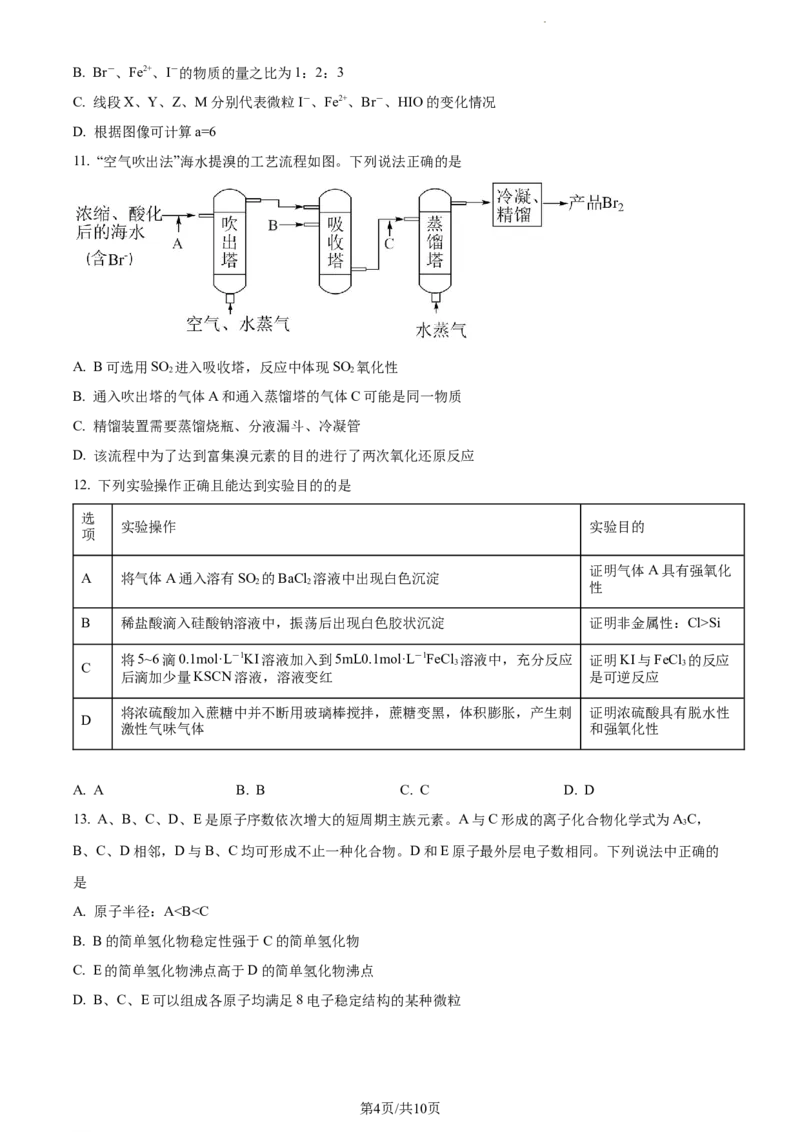
10. 向仅含Br-、Fe2+、I-的溶液中通入足量的Cl,溶液中粒子的物质的量变化如图所示,线段M表示一
2
种含氧酸,且X和M表示的物质中含有相同的元素。下列说法正确的是
A. 还原性:Fe2+>I->Br-
第3页/共10页
学科网(北京)股份有限公司B. Br-、Fe2+、I-的物质的量之比为1:2:3
C. 线段X、Y、Z、M分别代表微粒I-、Fe2+、Br-、HIO的变化情况
D. 根据图像可计算a=6
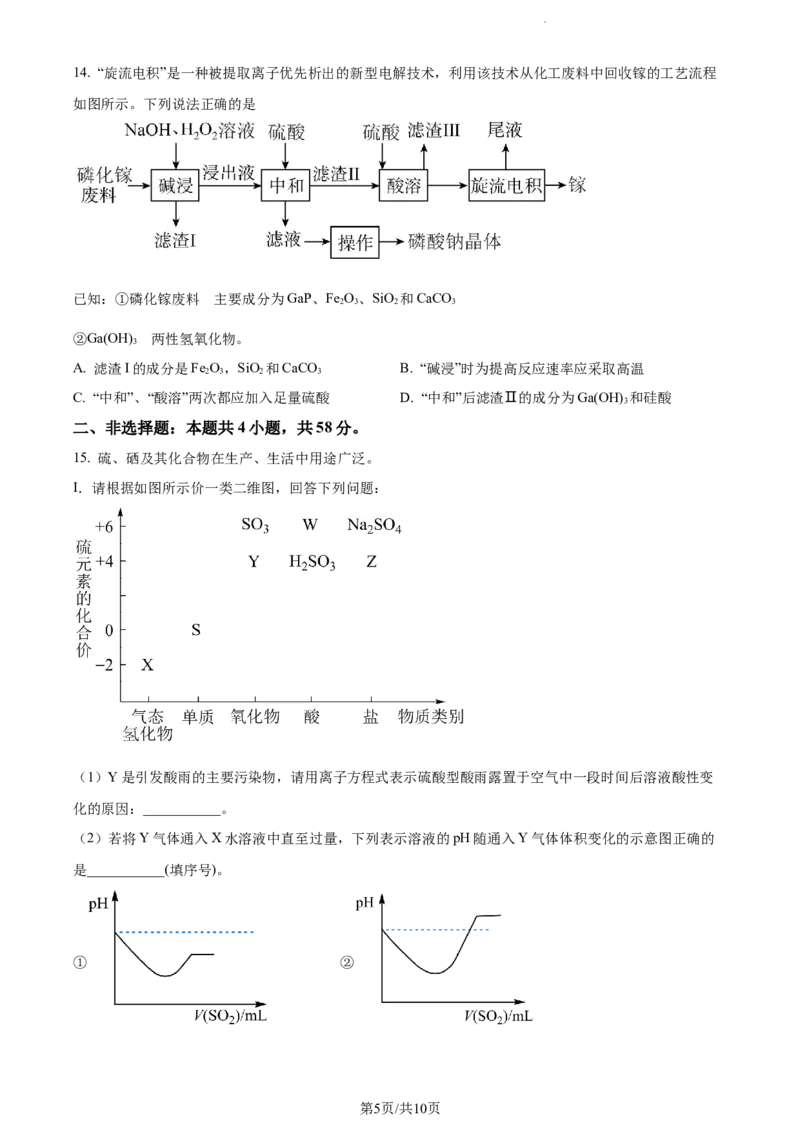
11. “空气吹出法”海水提溴的工艺流程如图。下列说法正确的是
A. B可选用SO 进入吸收塔,反应中体现SO 氧化性
2 2
B. 通入吹出塔的气体A和通入蒸馏塔的气体C可能是同一物质
C. 精馏装置需要蒸馏烧瓶、分液漏斗、冷凝管
D. 该流程中为了达到富集溴元素的目的进行了两次氧化还原反应
12. 下列实验操作正确且能达到实验目的的是
选
实验操作 实验目的
项
证明气体A具有强氧化
A 将气体A通入溶有SO 的BaCl 溶液中出现白色沉淀
2 2 性
B 稀盐酸滴入硅酸钠溶液中,振荡后出现白色胶状沉淀 证明非金属性:Cl>Si
将5~6滴0.1mol·L-1KI溶液加入到5mL0.1mol·L-1FeCl 溶液中,充分反应 证明KI与FeCl 的反应
C 3 3
后滴加少量KSCN溶液,溶液变红 是可逆反应
将浓硫酸加入蔗糖中并不断用玻璃棒搅拌,蔗糖变黑,体积膨胀,产生刺 证明浓硫酸具有脱水性
D
激性气味气体 和强氧化性
A. A B. B C. C D. D
13. A、B、C、D、E是原子序数依次增大的短周期主族元素。A与C形成的离子化合物化学式为AC,
3
B、C、D相邻,D与B、C均可形成不止一种化合物。D和E原子最外层电子数相同。下列说法中正确的
是
A. 原子半径:AH S>HO B.硒的非金属性比氧弱,但比溴强
2 2 2
C.热稳定性:HSe>H S>HO D.酸性:HClO>H SO >H SeO
2 2 2 3 2 4 2 4
E.还原性:Se2->S2-
(6)食品添加剂含有短周期元素A、B、C、D、E、F,其最高正化合价或最低负化合价与原子序数的关
系如图所示:
①A、B、C、D、E、F元素形成的简单离子中半径最大的是_______(用离子符号表示)。
②以下说法不正确的是___________(填字母)。
A.BA 可用于自来水的消毒
2
B.A、C形成的一种化合物常用作氧化剂和漂白剂,加热氧化效果更好
第6页/共10页
学科网(北京)股份有限公司C.E、F与A形成的化合物均能与NaOH溶液反应
D.实验室中用CS 洗涤残留在试管壁上的F单质,利用了F单质的还原性
2
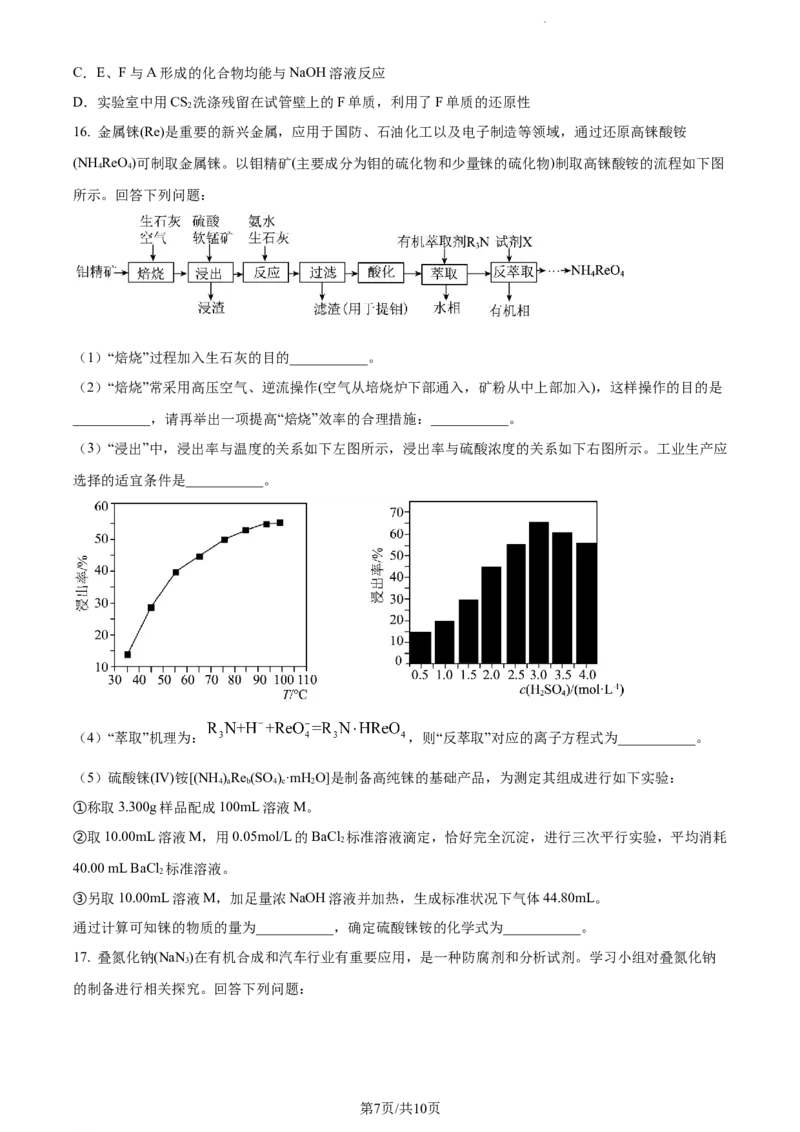
16. 金属铼(Re)是重要的新兴金属,应用于国防、石油化工以及电子制造等领域,通过还原高铼酸铵
(NH ReO)可制取金属铼。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵的流程如下图
4 4
所示。回答下列问题:
(1)“焙烧”过程加入生石灰的目的___________。
(2)“焙烧”常采用高压空气、逆流操作(空气从培烧炉下部通入,矿粉从中上部加入),这样操作的目的是
___________,请再举出一项提高“焙烧”效率的合理措施:___________。
(3)“浸出”中,浸出率与温度的关系如下左图所示,浸出率与硫酸浓度的关系如下右图所示。工业生产应
选择的适宜条件是___________。
(4)“萃取”机理为: ,则“反萃取”对应的离子方程式为___________。
(5)硫酸铼(IV)铵[(NH )Re (SO )·mHO]是制备高纯铼的基础产品,为测定其组成进行如下实验:
4 a b 4 c 2
①称取3.300g样品配成100mL溶液M。
②取10.00mL溶液M,用0.05mol/L的BaCl 标准溶液滴定,恰好完全沉淀,进行三次平行实验,平均消耗
2
40.00 mL BaCl 标准溶液。
2
③另取10.00mL溶液M,加足量浓NaOH溶液并加热,生成标准状况下气体44.80mL。
通过计算可知铼的物质的量为___________,确定硫酸铼铵的化学式为___________。
17. 叠氮化钠(NaN )在有机合成和汽车行业有重要应用,是一种防腐剂和分析试剂。学习小组对叠氮化钠
3
的制备进行相关探究。回答下列问题:
第7页/共10页
学科网(北京)股份有限公司方案一:在异丙醇[(CH )CHOH]和HSO 的混合溶液中逐滴加入NaNO 溶液,将反应容器置于冰盐浴中,
3 2 2 4 2
控制温度低于0℃。反应1h后生成的亚硝酸异丙酯[(CH ) CHONO]浮在表面上,分离出上层的油状物,
3 2
接着用NaCl和NaHCO 的混合溶液洗涤(CH)CHONO三次,干燥后得到(CH)CHONO。将一定量NaOH
3 3 2 3 2
溶于无水乙醇中,取其上层清液于仪器A中,先加入NH 加热,随后加入(CH)CHONO并加热一小时,
2 4 3 2
待NaN 析出后冰浴冷却,过滤后用无水乙醇洗涤三次,干燥后得到NaN 粗产品。
3 3
相关物质 的性质见下表
颜色、
物质 沸点 溶解性
状态
无色晶 300℃,受热 易溶于水,微溶于
NaN
3 体 易分解 乙醇,不溶于乙醚
无色液 微溶于水,与乙
(CH)CHOH 82℃
3 2 体 醇、乙醚混溶
无色油 不溶于水,与乙
(CH)CHONO 39℃
3 2 状液体 醇、乙醚混溶
(1)图中仪器A的名称是___________。
(2)用含NaHCO 的混合溶液洗涤(CH)CHONO的目的是___________。
3 3 2
(3)NaN 粗产品提纯时可以按以下步骤:使用适量的___________溶解粗产品,然后___________、
3
___________、___________得到纯净NaN 固体。
3
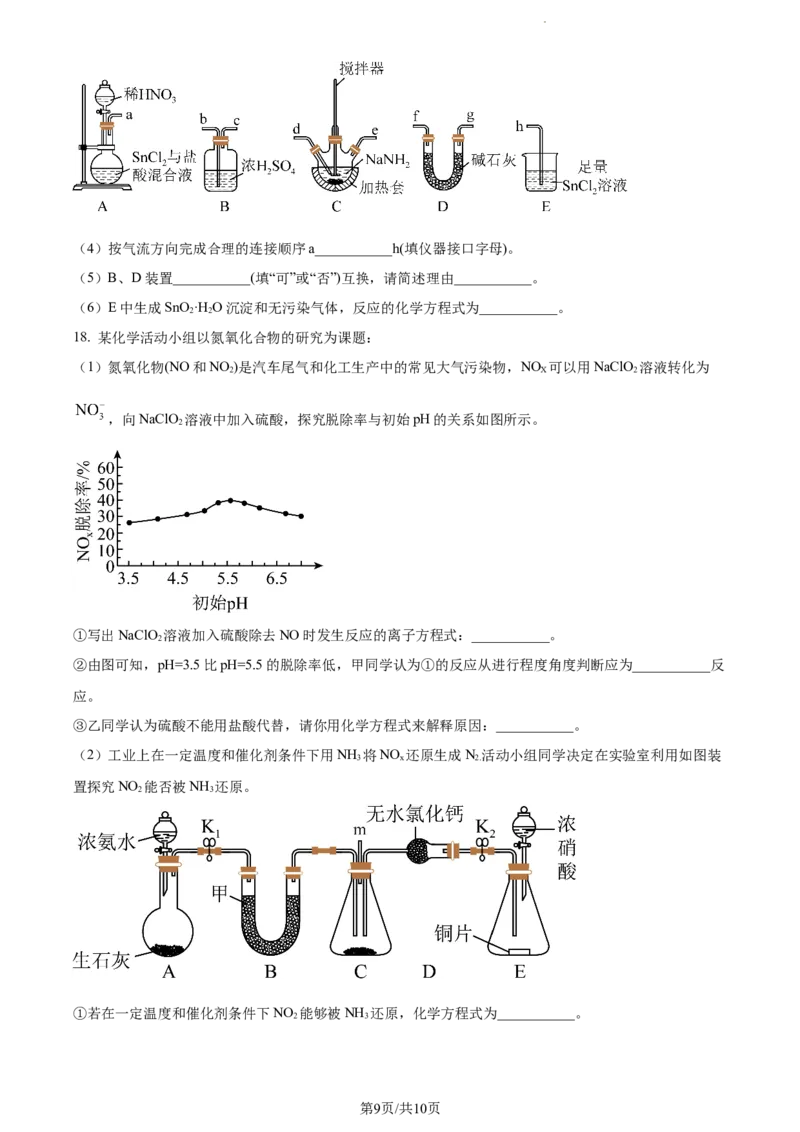
方案二:查阅资料:
I.氨基钠(NaNH )熔点为208℃,易潮解和氧化;NO有强氧化性,不与酸、碱反应;叠氮酸(HN )不稳定,
2 2 3
易分解爆炸。
II. ,
第8页/共10页
学科网(北京)股份有限公司(4)按气流方向完成合理的连接顺序a___________h(填仪器接口字母)。
(5)B、D装置___________(填“可”或“否”)互换,请简述理由___________。
(6)E中生成SnO ·H O沉淀和无污染气体,反应的化学方程式为___________。
2 2
18. 某化学活动小组以氮氧化合物的研究为课题:
(1)氮氧化物(NO和NO )是汽车尾气和化工生产中的常见大气污染物,NO 可以用NaClO 溶液转化为
2 X 2
,向NaClO 溶液中加入硫酸,探究脱除率与初始pH的关系如图所示。
2
①写出NaClO 溶液加入硫酸除去NO时发生反应的离子方程式:___________。
2
②由图可知,pH=3.5比pH=5.5的脱除率低,甲同学认为①的反应从进行程度角度判断应为___________反
应。
③乙同学认为硫酸不能用盐酸代替,请你用化学方程式来解释原因:___________。
(2)工业上在一定温度和催化剂条件下用NH 将NO 还原生成N 活动小组同学决定在实验室利用如图装
3 x 2.
置探究NO 能否被NH 还原。
2 3
①若在一定温度和催化剂条件下NO 能够被NH 还原,化学方程式为___________。
2 3
第9页/共10页
学科网(北京)股份有限公司②甲同学认为装置B中可以和D放入同一物质,观点___________(填“正确”或“错误”),若“错误”你的建议
是___________。
③乙同学发现此实验装置的不足之处是___________,画出补充装置并标注盛装药品名称___________。
第10页/共10页
学科网(北京)股份有限公司