文档内容
2004 年江苏高考化学真题及答案
第一卷 (选择题共74分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 C1 35.5
Mn 55 Fe 56 Zn 65 Ag 108 Ba 137
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的
土壤中吸附着数百万吨的 ,每百吨 核聚变所释放出的能量相当于目前人类一年消耗的能量。
在地球上,氮元素主要以 的形式存在。下列说法正确的是 ( )
A. 原子核内含有4个质子
D. 和 互为同位素
C. 原子核内含有3个中子
D. 的最外层电子数为2,所以 具有较强的金属性
2.下列各项中表达正确的是 ( )
A.F—的结构示意图: B.CO 的分子模型示意图:
2
C.NaCl的电子式: D.N 的结构式: :N≡N:
2
3.2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为
中不符合这一主题的是 ( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
4.下列关于浓硫酸的叙述正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
5.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是 ( )
A.碳酸氢钠溶液中滴加稀盐酸
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液
D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
6.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
第1页 | 共9页D.Y的单质能将X从NaX的溶液中置换出来
7.下列实验操作正确的是 ( )
A.将氢氧化钠固体放在滤纸上称量
B.用10mL量筒量取8.58mL蒸馏水
C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集
D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
8.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应
中消耗的HCl和NaOH物质的量之比为 ( )
A.1:1 B.2:1 C.3:1 D.1:3
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个
或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,
只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.下列分离或提纯物质的方法错误的是 ( )
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
10.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好
被完全中和时,消耗盐酸和醋酸溶液的体积分别为V 和V,则V 和V 的关系正确的是
l 2 l 2
( )
A.V>V B.Vc(HCO)
2 4 2 2 4
D.c(K+)=c(HCO)+c(HCO-)+c(CO2—)
2 2 4 2 4 2 4
18.在容积固定的密闭容器中存在如下反应: A(g)+3B(g) 2C(g); △H<0某研究
小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是 ( )
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
第3页 | 共9页第二卷 (非选择题共76分)
三、(本题包括2小题,共22分)
19.(10分)请按要求填空:
(1)用已准确称量的1.06gNaCO 固体配制0.100mol·L-1NaCO 溶液100mL,所需要的仪器为: 。
2 3 2 3
(2)除去NaNO 固体中混有的少量KNO,所进行的实验操作依次为: 、蒸发、结晶、 。
3 3
(3)除去KCl溶液中的SO2-离子,依次加入的溶液为(填溶质的化学式): 。
4
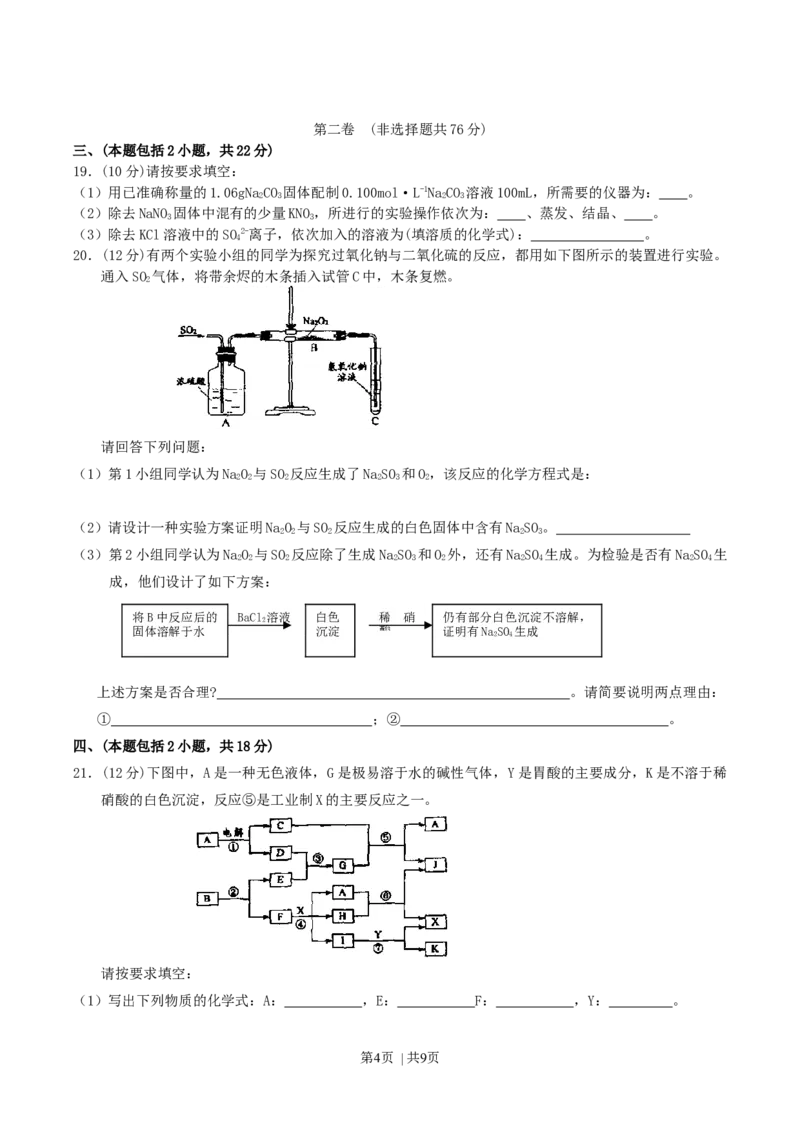
20.(12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。
通入SO 气体,将带余烬的木条插入试管C中,木条复燃。
2
请回答下列问题:
(1)第1小组同学认为NaO 与SO 反应生成了NaSO 和O,该反应的化学方程式是:
2 2 2 2 3 2
(2)请设计一种实验方案证明NaO 与SO 反应生成的白色固体中含有NaSO。
2 2 2 2 3
(3)第2小组同学认为NaO 与SO 反应除了生成NaSO 和O 外,还有NaSO 生成。为检验是否有NaSO 生
2 2 2 2 3 2 2 4 2 4
成,他们设计了如下方案:
将B中反应后的 BaCl 溶液 白色 稀 硝 仍有部分白色沉淀不溶解,
2
固体溶解于水 沉淀 酸 证明有NaSO 生成
2 4
上述方案是否合理? 。请简要说明两点理由:
① ;② 。
四、(本题包括2小题,共18分)
21.(12分)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀
硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出下列物质的化学式:A: ,E: F: ,Y: 。
第4页 | 共9页(2)反应⑤的化学方程式为: 。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为:
。
22.(6分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等
电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外
层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质
中,与NO-互为等电子体的分子有: 、 。
2
五、(本题包括2小题,共18分)
23.(8分)含有氨基(—NH)的化合物通常能够与盐酸反应,生成盐酸盐。如:
2
R-NH+HCl →R-NH·HCl (R代表烷基、苯基等) 现有两种化合物A和B,它们互为同分异构体。已知:
2 2
①它们都是对位二取代苯;
②它们的相对分子质量都是137;
③A既能被NaOH溶液中和,又可以跟盐酸成盐,但不能与 FeCl 溶液发生显色反应;B既不能被NaOH
3
溶液中和,也不能跟盐酸成盐;
④它们的组成元素只可能是C、H、O、N、Cl中的几种。
请按要求填空:
(1)A和B的分子式是 。
(2)A的结构简式是 ;B的结构简式是 。
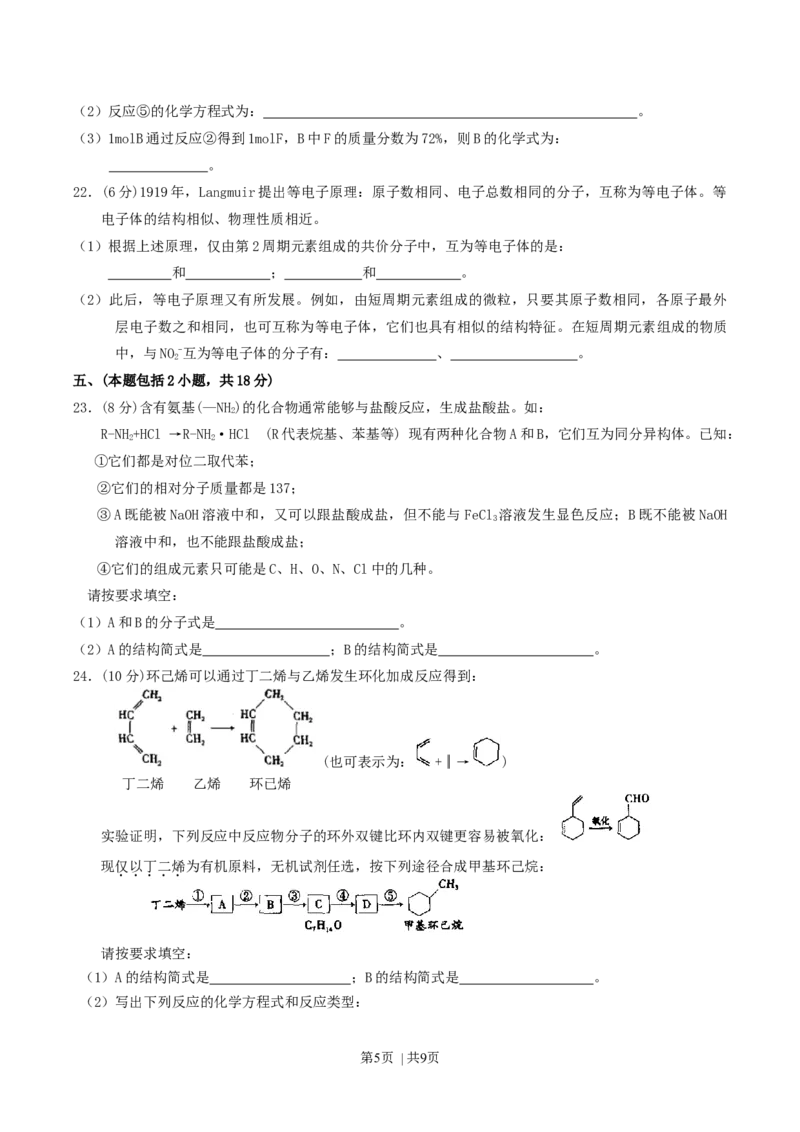
24.(10分)环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
(也可表示为: +║→ )
丁二烯 乙烯 环已烯
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
请按要求填空:
(1)A的结构简式是 ;B的结构简式是 。
(2)写出下列反应的化学方程式和反应类型:
第5页 | 共9页反应④ ,反应类型 反应⑤ ,
反应类型 。
六、(本题包括2小题,共18分)
25.(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为 1.96g的该结晶水合物,分别
制成溶液。一份加入足量Ba(OH) 溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加
2
热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到
白色固体2.33 g。另一份加入含0.001 molKMnO 的酸性溶液,MnO-恰好完全被还原为Mn2+。
4 4
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
26.(10分)石油化工是江苏省的支柱产业之一。聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利
用下列工艺生产聚氯乙烯的单体氯乙烯:
CH=CH+Cl →CHCI—CHC1…………………①
2 2 2 2 2
第6页 | 共9页CHCI—CHC1→CH=CHCl+HCl………………②
2 2 2
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率= ×100%)为98%,反应②中氯乙烯和氯化氢的产率均
为95%,则2.8t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t。(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH=CH+4HCl+0→2 CHCI—CHC1+2H0………—③
2 2 2 2 2 2
由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供
反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①、③中二氯乙烷的产率依次为 a%、c%;
二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:反应①、③中乙烯的投料比为多少时,新
工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也
不消耗氯化氢)。
化学试题参考答案
一、(本题包括8小题,每小题4分,共32分)
1.B 2.A 3.B 4.D 5.A 6.C 7.D 8.C
二、(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分)
9.C 10.A 11.BD 12.D 13.BC 14.AC 15.D 16.C 17.CD 18.AB
三、(本题包括2小题,共22分)
19.(10分) ⑴100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管
⑵溶解 过滤 (3)BaCl[或Ba(OH)]、KCO、HCl
2 2 2 3
20.(12分)(1)2NaO+2SO=2NaSO+O
2 2 2 2 3 2
第7页 | 共9页(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留NaO,它溶于水后能将亚硫酸根氧化成硫酸根
2 2
四、(本题包括2小题,共18分)
21.(12分)(1)HO N Ag HCl (2)4NH+5O2 4NO+6HO (3)AgN,
2 2 3 2 3
22.(6分)(1)N CO; CO NO (2)SO、 O
2 2 2 2 3
五、(本题包括2小题,共10分)
23.(8分)(1)CHNO(或写成CHON) ⑵
7 7 2 7 7 2
24.(10分)
(1) (或 )
(或 )
(2) +HO
2
(或 +HO)
2
消去反应
十H
2
(或 十H )
2
加成反应
六、(本题包括2小题,共18分)
25.(8分)
(1)NH+、Fe2+,SO2-)
4 4
(2)据题意:n(SO2-)= =0.01mol
4
5Fe2+ + Mn0—+ 8H+ = 5Fe3+ + Mn2+ + 4HO
4 2
5 1
第8页 | 共9页n(Fe2+) O.001 mo1
n(Fe2+)=O.001 mol×5=0.005mol
根据离子化合物中阴、阳离子电荷平衡的原理,n(NH+)+2n(Fe2+)=2n(SO2—)
4 4
n(NH+)=O.01 mol
4
n(HO)=
2
=O.03 mol
该结晶水合物的化学式为(NH)Fe(SO)•6HO [或(NH)SO•FeSO•6HO]
4 2 4 2 2 4 2 4 4 2
26.(10分) (1)5.8; 3.4
(2)设投入反应①、③的乙烯物质的量分别为x、y,则:
由反应①生成的二氯乙烷为x·a%,
由反应③生成的二氯乙烷为y·c%,
则由反应①、③共制得二氯乙烷的物质的量为(x•a%+y•c%),通过反应②可获得HCl的物质的量为
(x•a%+y•c%)·b%。
据题意,反应③消耗的HCl为2•y•c%,则:
2•y•c%=(x•a%+y•c%)•b%
解得: = 反应①、③中乙烯的投料比应为 。
第9页 | 共9页