文档内容
广东省清远市2025-2026学年高二上学期11月期中化学试题
一、单选题
1.已知某中和反应的反应热可表示为 ,则该反应的其中
一种反应物可以为
A.浓硫酸 B.稀硝酸 C.稀氨水 D.冰醋酸
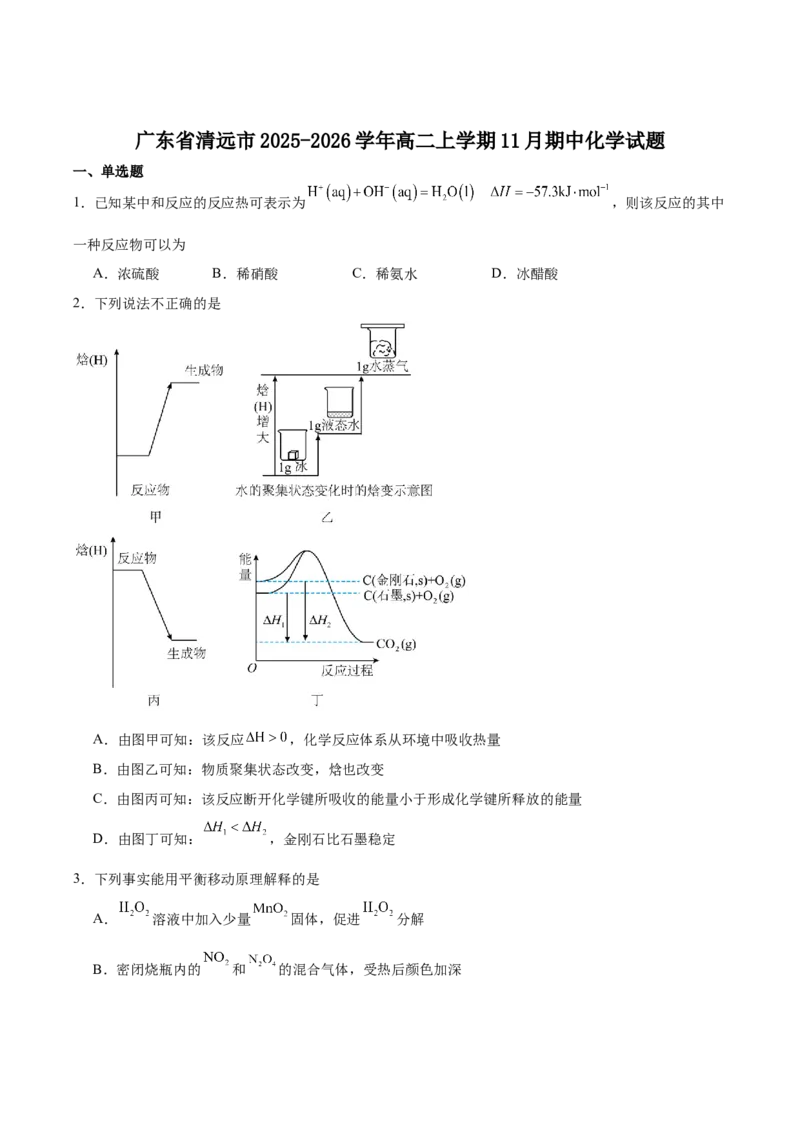
2.下列说法不正确的是
A.由图甲可知:该反应 ,化学反应体系从环境中吸收热量
B.由图乙可知:物质聚集状态改变,焓也改变
C.由图丙可知:该反应断开化学键所吸收的能量小于形成化学键所释放的能量
D.由图丁可知: ,金刚石比石墨稳定
3.下列事实能用平衡移动原理解释的是
A. 溶液中加入少量 固体,促进 分解
B.密闭烧瓶内的 和 的混合气体,受热后颜色加深C.铁钉放入浓 中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀 反应过程中,加入少量 固体,促进 的产生
4.反应C H(g) C H(g)+H(g) H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能
2 6 2 4 2
提高乙烷平衡转化率的是 △
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
5.某温度下,反应CH=CH (g)+HO(g) CHCHOH(g)在密闭容器中达到平衡,下列说法正确的是
2 2 2 3 2
A.增大压强, ,平衡常数增大
B.加入催化剂,平衡时 的浓度增大
C.恒容下,充入一定量的 ,平衡向正反应方向移动
D.恒容下,充入一定量的 , 的平衡转化率增大
6.下列选项中为弱电解质的是
A.NH •H O B.NaSiO C.MgCl D.CaCO
3 2 2 3 2 3
7.下列溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6mol·L-1溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
8.下列因素能影响水的电离平衡,且能使水的电离平衡向右移动的是
A.CHCOOH B.NaCl C.升高温度 D.NaOH
3
9.下列各项中电解质的电离方程式正确的是
A.熔融态的 :
B. 的水溶液:
C. 的水溶液:D.熔融态的 :
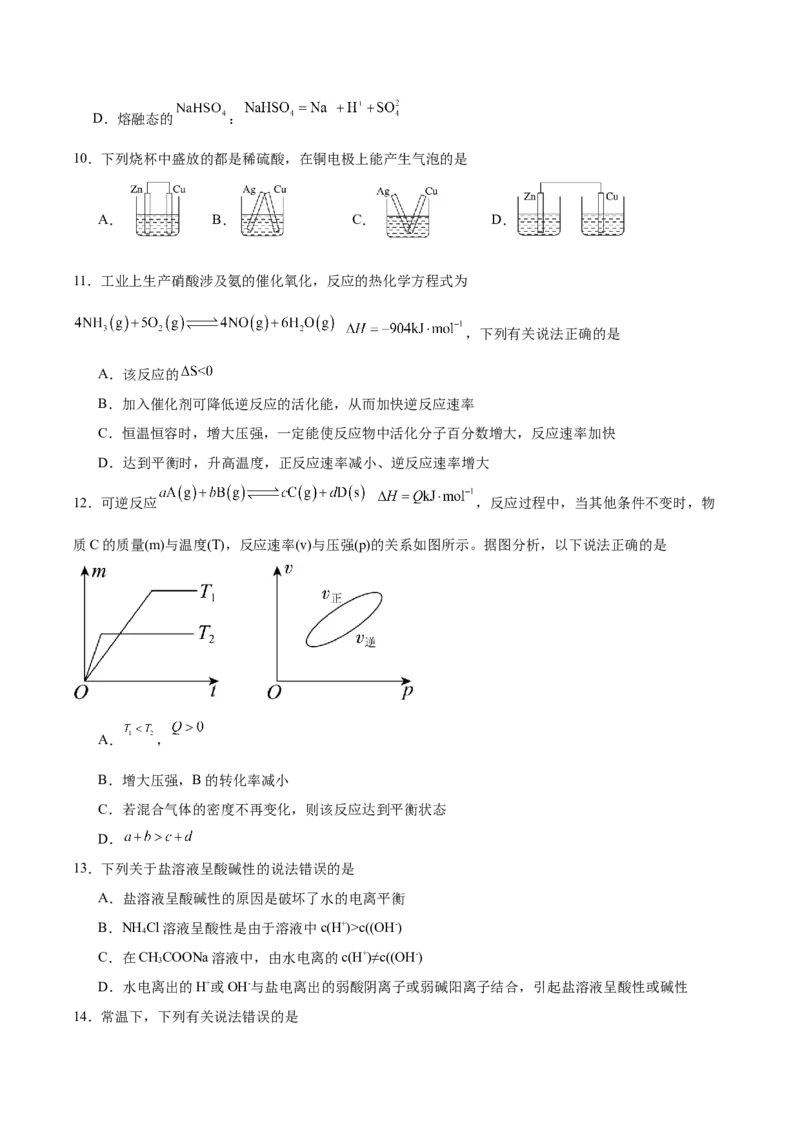
10.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是
A. B. C. D.
11.工业上生产硝酸涉及氨的催化氧化,反应的热化学方程式为
,下列有关说法正确的是
A.该反应的
B.加入催化剂可降低逆反应的活化能,从而加快逆反应速率
C.恒温恒容时,增大压强,一定能使反应物中活化分子百分数增大,反应速率加快
D.达到平衡时,升高温度,正反应速率减小、逆反应速率增大
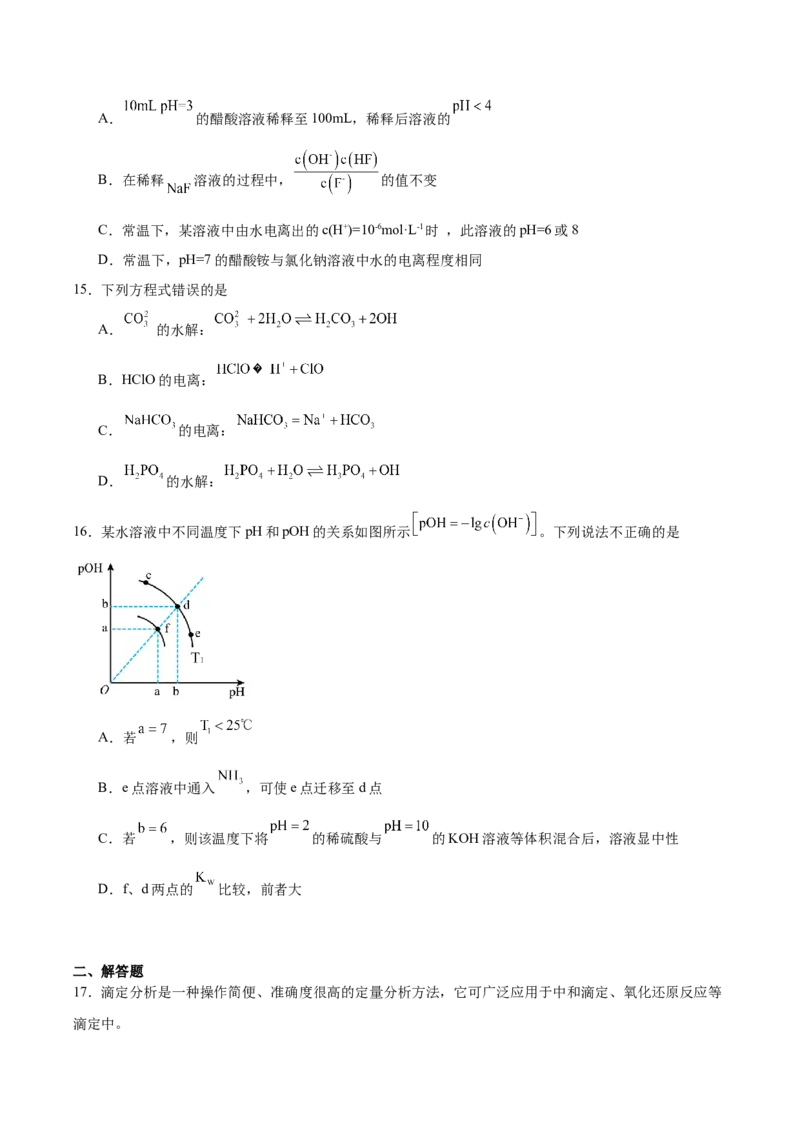
12.可逆反应 ,反应过程中,当其他条件不变时,物
质C的质量(m)与温度(T),反应速率(v)与压强(p)的关系如图所示。据图分析,以下说法正确的是
A. ,
B.增大压强,B的转化率减小
C.若混合气体的密度不再变化,则该反应达到平衡状态
D.
13.下列关于盐溶液呈酸碱性的说法错误的是
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH Cl溶液呈酸性是由于溶液中c(H+)>c((OH-)
4
C.在CHCOONa溶液中,由水电离的c(H+)≠c((OH-)
3
D.水电离出的H+或OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,引起盐溶液呈酸性或碱性
14.常温下,下列有关说法错误的是A. 的醋酸溶液稀释至100mL,稀释后溶液的
B.在稀释 溶液的过程中, 的值不变
C.常温下,某溶液中由水电离出的c(H+)=10-6mol·L-1时 ,此溶液的pH=6或8
D.常温下,pH=7的醋酸铵与氯化钠溶液中水的电离程度相同
15.下列方程式错误的是
A. 的水解:
B.HClO的电离:
C. 的电离:
D. 的水解:
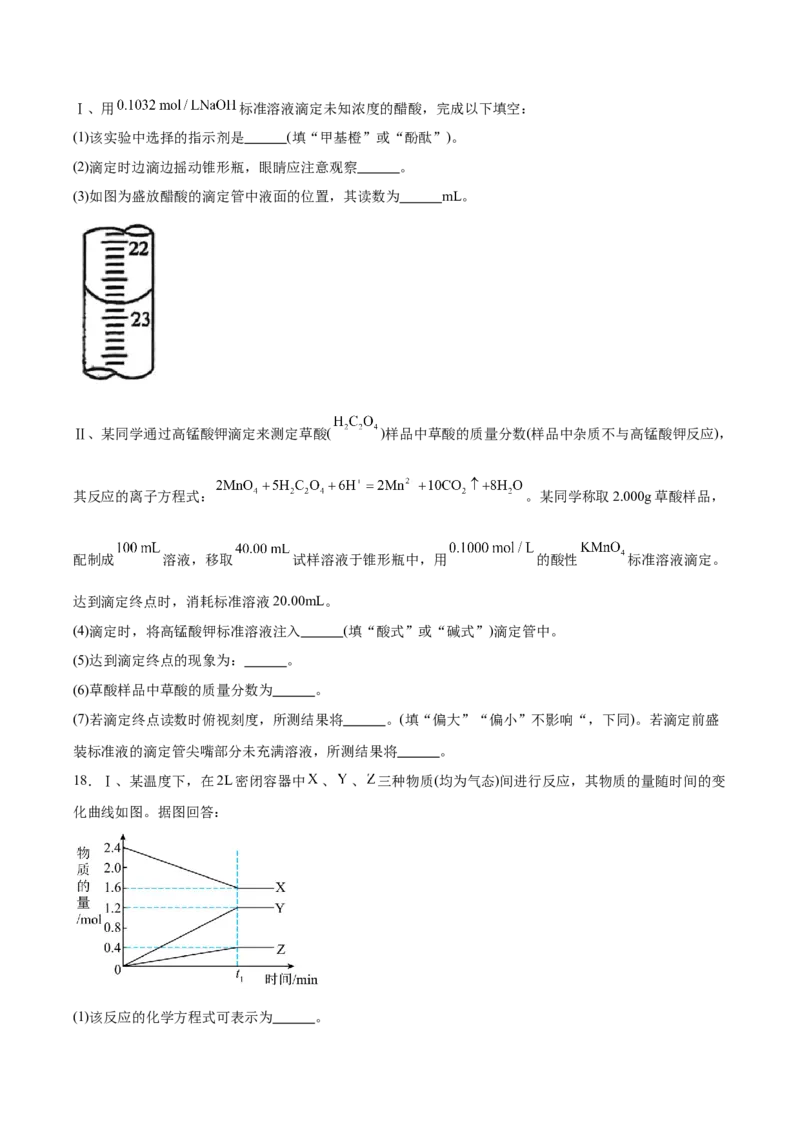
16.某水溶液中不同温度下pH和pOH的关系如图所示 。下列说法不正确的是
A.若 ,则
B.e点溶液中通入 ,可使e点迁移至d点
C.若 ,则该温度下将 的稀硫酸与 的KOH溶液等体积混合后,溶液显中性
D.f、d两点的 比较,前者大
二、解答题
17.滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等
滴定中。Ⅰ、用 标准溶液滴定未知浓度的醋酸,完成以下填空:
(1)该实验中选择的指示剂是 (填“甲基橙”或“酚酞”)。
(2)滴定时边滴边摇动锥形瓶,眼睛应注意观察 。
(3)如图为盛放醋酸的滴定管中液面的位置,其读数为 mL。
Ⅱ、某同学通过高锰酸钾滴定来测定草酸( )样品中草酸的质量分数(样品中杂质不与高锰酸钾反应),
其反应的离子方程式: 。某同学称取2.000g草酸样品,
配制成 溶液,移取 试样溶液于锥形瓶中,用 的酸性 标准溶液滴定。
达到滴定终点时,消耗标准溶液20.00mL。
(4)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。
(5)达到滴定终点的现象为: 。
(6)草酸样品中草酸的质量分数为 。
(7)若滴定终点读数时俯视刻度,所测结果将 。(填“偏大”“偏小”不影响“,下同)。若滴定前盛
装标准液的滴定管尖嘴部分未充满溶液,所测结果将 。
18.Ⅰ、某温度下,在2L密闭容器中 、 、 三种物质(均为气态)间进行反应,其物质的量随时间的变
化曲线如图。据图回答:
(1)该反应的化学方程式可表示为 。(2)反应起始至tmin(设t=5), 的平均反应速率是 ,X的转化率为 (用百分数表示,保留一位
1 1
小数)。
(3)一定能使该反应的反应物转化率增大的措施有 (已知:该反应为吸热反应)。
A.其他条件不变,及时分离出产物
B.适当降低温度
C.其他条件不变,增大X的浓度
D.使用高效催化剂
E.恒容条件下充入氮气,使压强增大
Ⅱ、在一定体积的密闭容器中,进行如下化学反应: ,其化学平衡常数
和温度t的关系如下表:
t℃ 700 800 850 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(4)该反应的化学平衡常数表达式为K= 。
(5)该反应为反应 (填“吸热”、“放热”)。
(6)将上述反应改在恒压容器中进行,充入一定量氩气,达新平衡时,CO的体积分数 (填“变大”变
小”或“不变”)。
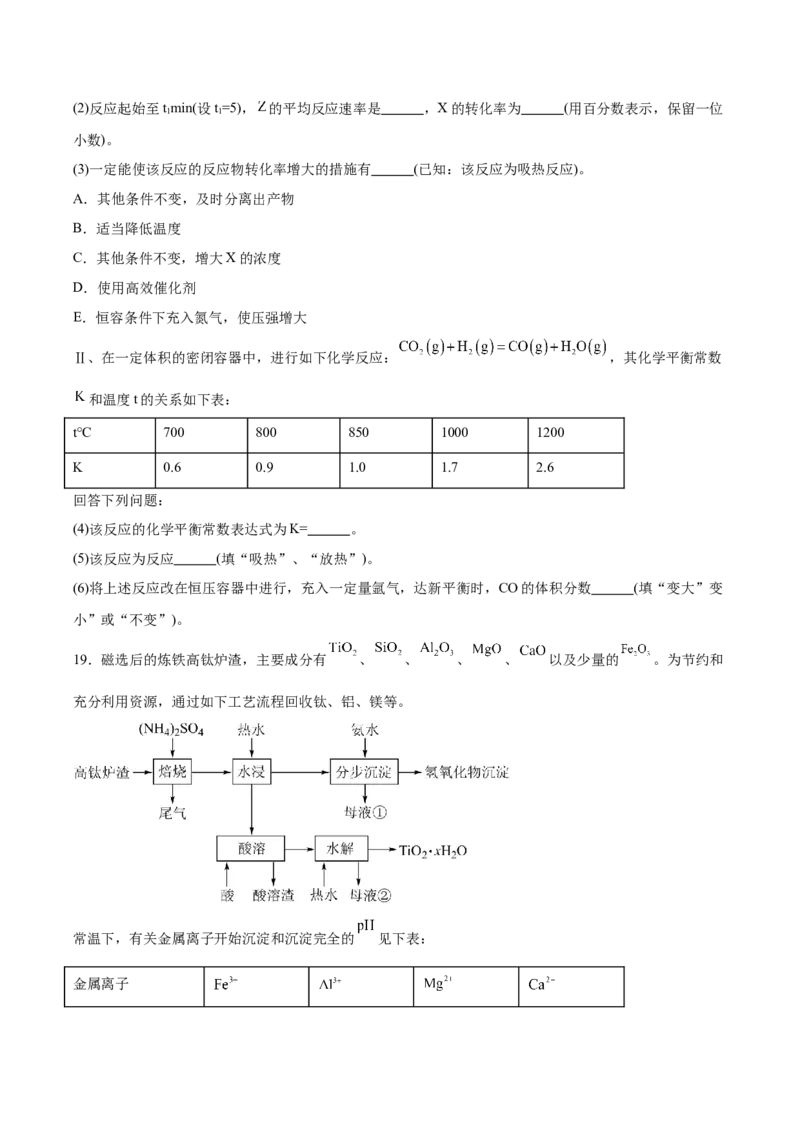
19.磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和
充分利用资源,通过如下工艺流程回收钛、铝、镁等。
常温下,有关金属离子开始沉淀和沉淀完全的 见下表:
金属离子开始沉淀(
)的 1.5 3.4 8.9 12.0
沉淀完全(
2.8 4.7 10.9 13.8
)的
已知:①“焙烧”中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐;
② 。
(1)为了加快“焙烧”速率,可采用的物理方法为 (填一种即可)。
(2) “焙烧”时,转化为 。
① 在水中的电离方程式为 。
②明矾( )净水的原理为 (用离子方程式表示)。
(3)在“分步沉淀”时用氨水逐步调节pH至11.6,最先析出的离子为 (填离子符号)。
(4)水漫渣在160℃“酸溶”,最适合的加热方式为 (填“水浴”或“油浴”)加热。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式为 。
(6)利用表中数据,可计算出 。
三、填空题
20.实验室(室温下)存放着如下几种试剂:
① 溶液② 溶液③ 溶液④ 盐酸⑤
氨水⑥ 溶液⑦ 溶液⑧ 溶液
回答下列问题:
(1)溶液的 ,且促进水的电离的试剂是 (填序号,下同)。(2)试剂①、④、⑥中由水电离的氢离子浓度 由大到小的顺序是 。
(3)试剂⑤、⑦、⑧溶液中 由大到小的顺序是 。
(4)将试剂⑤和试剂⑦等体积混合后测得混合溶液显碱性,则混合溶液中离子浓度由大到小的顺序是 。
(5)试剂⑧中电荷守恒的表达式是 。
(6)已知醋酸的电离常数 ,将试剂①和试剂②等体积混合后, 的水解常数
。已知亚硫酸的电离常数 , 。向 溶液中加入过量试剂①发生反应的离
子方程式是 。参考答案
1.B
2.D
3.B
4.D
5.C
6.A
7.B
8.C
9.A
10.A
11.B
12.C
13.C
14.D
15.A
16.B
17.(1)酚酞
(2)锥形瓶内溶液颜色的变化
(3)22.80
(4)酸式
(5)最后半滴高锰酸钾溶液滴入时,溶液颜色变成浅红色且30s内不褪色
(6)56.25%
(7) 偏小 偏大
18.(1)2X(g) 3Y(g)+Z(g)
(2) 0.04mol∙L-1∙mol-1 33.3%
(3)A
(4)
(5)吸热
(6)不变19.(1)将炉渣粉碎
(2)
(3)Fe3+
(4)油浴
(5)TiO2+ + (x+1)H O = TiO · xH O ↓ + 2 H⁺
2 2 2
(6)1 × 10-11.2
20.(1)②
(2)⑥>①>④
(3)⑧>⑦>⑤
(4)
(5)