文档内容
大名一中高二年级2024-2025学年第二学期开学考试 A.阴极发生的反应为
(考试时间:75分钟;满分:100分)
B.电解一段时间,溶液中溶质的浓度不变
出题人:杨延庆
C.在电解槽底部产生含Pb的阳极泥
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Mn55 Fe56 Co59 Sn119
D.当阴极质量增加11.9g,电路中通过电子为0.2mol
一、选择题(共14小题,每小题3分,共42分。每小题只有一个选项符合题意。)
1.下列元素中电负性最大的是
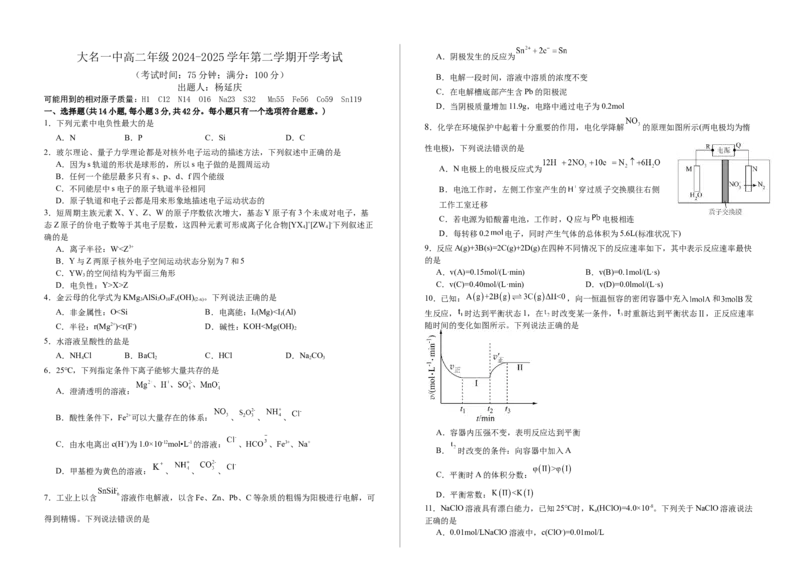
8.化学在环境保护中起着十分重要的作用,电化学降解 的原理如图所示(两电极均为惰
A.N B.P C.Si D.C
性电极),下列说法错误的是
2.玻尔理论、量子力学理论都是对核外电子运动的描述方法,下列叙述中正确的是
A.因为s轨道的形状是球形的,所以s电子做的是圆周运动
A.N电极上的电极反应式为
B.任何一个能层最多只有s、p、d、f四个能级
C.不同能层中s电子的原子轨道半径相同 B.电池工作时,左侧工作室产生的 穿过质子交换膜往右侧
D.原子轨道和电子云都是用来形象地描述电子运动状态的
工作工室迁移
3.短周期主族元素X、Y、Z、W的原子序数依次增大,基态Y原子有3个未成对电子,基
C.若电源为铅酸蓄电池,工作时,Q应与 电极相连
态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物[YX ]+[ZW ]-下列叙述正
4 4
D.每转移0.2 电子,同时产生气体的总体积为5.6L(标准状况下)
确的是
A.离子半径:W-X>Z C.v(C)=0.40mol/(L·min) D.v(D)=0.0lmol/(L·s)
4.金云母的化学式为KMg AlSi O F(OH) 。下列说法正确的是 10.已知: ,向一恒温恒容的密闭容器中充入 和 发
3 3 10 x (2-x)
A.非金属性:Oc(ClO-)=c(Na+)
12.下列说法不正确的是(温度均为25℃)
A. 的 和 的 溶液等体积混合后溶液呈酸性
B.氨水和 溶液等体积混合后的溶液可能呈酸性、中性或碱性
C. 的稀硫酸与 的 溶液混合,溶液呈中性,则
D. 的硝酸和 的氢氧化钡溶液按照体积比为 混合,混合液的pH为10 已知25℃时, , ,
13.下列说法错误的是
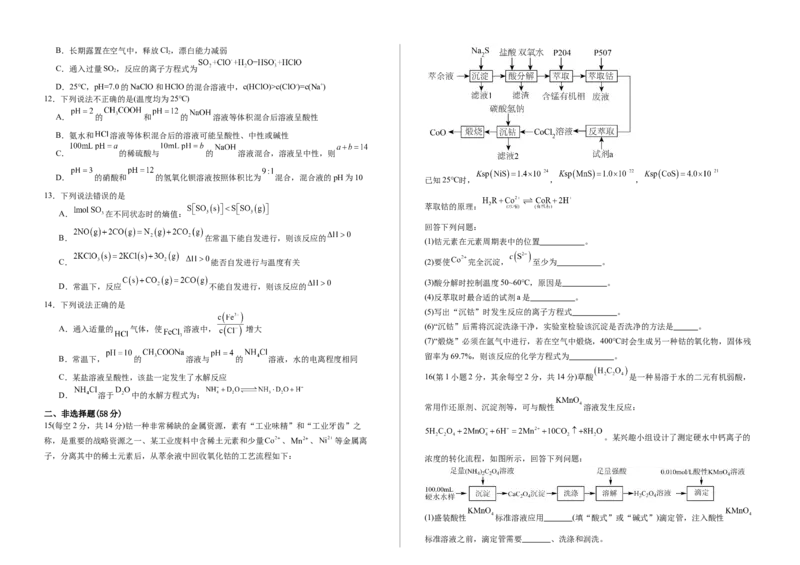
萃取钴的原理:
A. 在不同状态时的熵值:
回答下列问题:
B. 在常温下能自发进行,则该反应的
(1)钴元素在元素周期表中的位置 。
C. 能否自发进行与温度有关 (2)要使 完全沉淀, 至少为 。
(3)酸分解时控制温度50~60℃,原因是 。
D.常温下,反应 不能自发进行,则该反应的
(4)反萃取时最合适的试剂a是 。
14.下列说法正确的是
(5)写出“沉钴”时发生反应的离子方程式 。
A.通入适量的 气体,使 溶液中, 增大 (6)“沉钴”后需将沉淀洗涤干净,实验室检验该沉淀是否洗净的方法是 。
(7)“煅烧”必须在氩气中进行,若在空气中煅烧,400℃时会生成另一种钴的氧化物,固体残
留率为69.7%,则该反应的化学方程式为 。
B.常温下, 的 溶液与 的 溶液,水的电离程度相同
C.某盐溶液呈酸性,该盐一定发生了水解反应 16(第1小题2分,其余每空2分,共14分)草酸 是一种易溶于水的二元有机弱酸,
D. 溶于 中的水解方程式为:
常用作还原剂、沉淀剂等,可与酸性 溶液发生反应:
二、非选择题(58分)
15(每空2分,共14分)钴一种非常稀缺的金属资源,素有“工业味精”和“工业牙齿”之
。某兴趣小组设计了测定硬水中钙离子的
称,是重要的战略资源之一、某工业废料中含稀土元素和少量 、 、 等金属离
子,分离其中的稀土元素后,从萃余液中回收氧化钴的工艺流程如下:
浓度的转化流程,如图所示,回答下列问题:
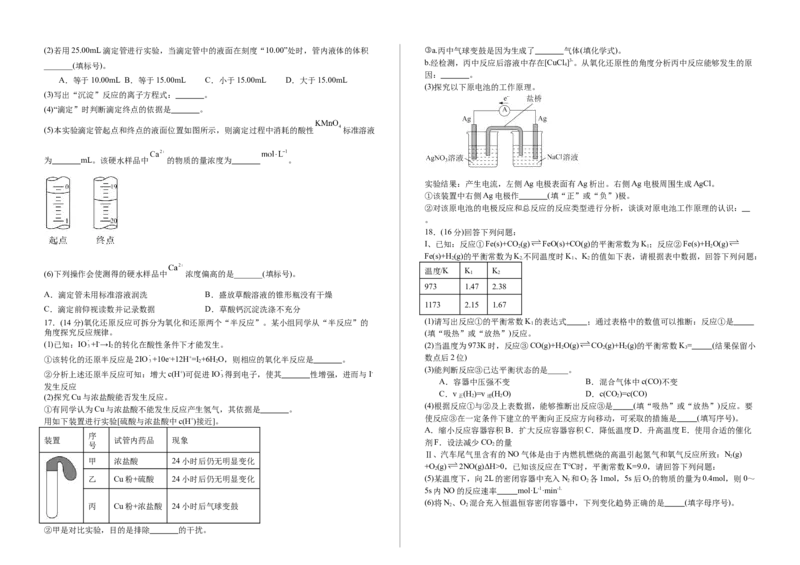
(1)盛装酸性 标准溶液应用 (填“酸式”或“碱式”)滴定管,注入酸性
标准溶液之前,滴定管需要 、洗涤和润洗。(2)若用25.00mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处时,管内液体的体积 ③a.丙中气球变鼓是因为生成了 气体(填化学式)。
b.经检测,丙中反应后溶液中存在[CuCl ]3-。从氧化还原性的角度分析丙中反应能够发生的原
_______(填标号)。 4
因: 。
A.等于10.00mL B.等于15.00mL C.小于15.00mL D.大于15.00mL
(3)探究以下原电池的工作原理。
(3)写出“沉淀”反应的离子方程式: 。
(4)“滴定”时判断滴定终点的依据是 。
(5)本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的酸性 标准溶液
为 mL。该硬水样品中 的物质的量浓度为 。
实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作 (填“正”或“负”)极。
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:
。
18.(16分)回答下列问题:
I、已知:反应①Fe(s)+CO (g) FeO(s)+CO(g)的平衡常数为K;反应②Fe(s)+H O(g)
2 1 2
Fe(s)+H (g)的平衡常数为K 不同温度时K、K 的值如下表,请根据表中数据,回答下列问题:
2 2. 1 2
温度/K K K
(6)下列操作会使测得的硬水样品中 浓度偏高的是_______(填标号)。 1 2
973 1.47 2.38
A.滴定管未用标准溶液润洗 B.盛放草酸溶液的锥形瓶没有干燥
1173 2.15 1.67
C.滴定前仰视读数并记录数据 D.草酸钙沉淀洗涤不充分
17.(14分)氧化还原反应可拆分为氧化和还原两个“半反应”。某小组同学从“半反应”的 (1)请写出反应①的平衡常数K 1 的表达式 ;通过表格中的数值可以推断:反应①是
角度探究反应规律。 (填“吸热”或“放热”)反应。
(1)已知:IO +I-→I 的转化在酸性条件下才能发生。 (2)当温度为973K时,反应③CO(g)+HO(g) CO(g)+H(g)的平衡常数K= (结果保留小
2 2 2 2 3
①该转化的还原半反应是2IO +10e-+12H+=I +6H O,则相应的氧化半反应是 。 数点后2位)
2 2
(3)能判断反应③已达平衡状态的是_____。
②分析上述还原半反应可知:增大c(H+)可促进IO 得到电子,使其 性增强,进而与I-
A.容器中压强不变 B.混合气体中c(CO)不变
发生反应
C.v (H )=v (H O) D.c(CO)=c(CO)
(2)探究Cu与浓盐酸能否发生反应。 正 2 逆 2 2
(4)根据反应①与②及上表数据,能够推断出反应③是 (填“吸热”或“放热”)反应。要
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是 。
使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 (填写序号)。
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
A.缩小反应容器容积B.扩大反应容器容积C.降低温度D.升高温度E.使用合适的催化
序
装置 试管内药品 现象 剂F.设法减少CO 的量
号 2
Ⅱ、汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N(g)
2
甲 浓盐酸 24小时后仍无明显变化
+O (g) 2NO(g)ΔH>0,已知该反应在T℃时,平衡常数K=9.0,请回答下列问题:
2
乙 Cu粉+硫酸 24小时后仍无明显变化 (5)某温度下,向2L的密闭容器中充入N 和O 各1mol,5s后O 的物质的量为0.4mol,则0~
2 2 2
5s内NO的反应速率 mol·L-1·min-1.
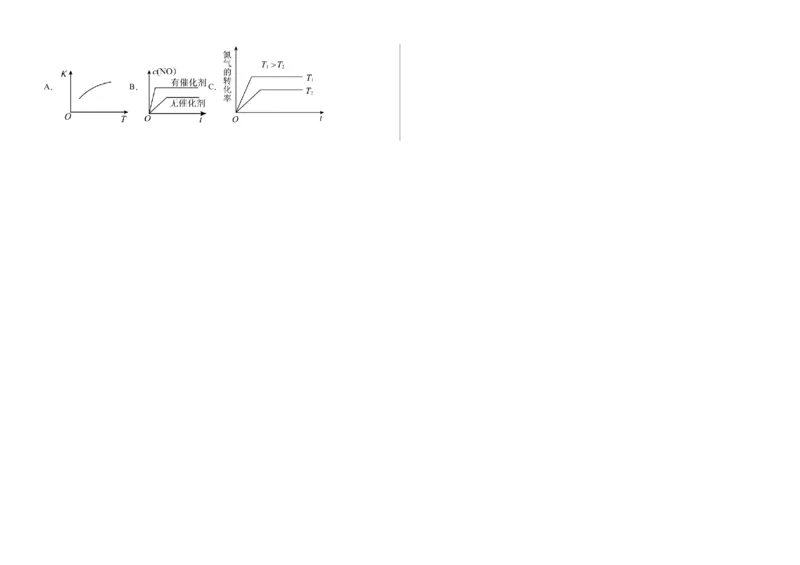
(6)将N、O 混合充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
丙 Cu粉+浓盐酸 24小时后气球变鼓 2 2
②甲是对比实验,目的是排除 的干扰。A. B. C.