文档内容
广东省韶关市 2025 届高三综合测试 (一)化学试题
本试卷共8页,20小题,满分为 100分。考试用时为75分钟。 2024.11
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、准考证号、学校和班级填写在答
题卡指定的位置上
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;
如需改动、用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3. 非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应
位置上; 如需改动,先划掉原来的答案,然后再写上新的答案; 不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4. 考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
5. 可能用到的相对原子质量:H-1 C-12 O - 16 C l-35.5 N i-59 Z n-65
一、选择题: 本题共16小题, 共44分。第1~10小题, 每小题2分; 第11~16小题, 每小题4分。在
每小题给出的四个选项中,只有一项是符合题目要求的。
1. 中华文明源远流长,衣、食、住、行都是中华民族智慧的结晶。下列文明载体与硅酸盐材料有关
的是
衣 食 住 行
A. 岭南非遗服饰 (粤绣) B. 广东名菜 (白斩鸡) C. 客家围屋 D. 出行马车 (车辇)
2. 化学助力科技。下列说法正确的是
A. “蛟龙号”载人深潜器采用钛合金材料,钛为第ⅣA 族元素
B. “碲化镉薄膜太阳能电池”能有效地将化学能转化为电能
C. “核磁共振波谱法”使用的与空气中的N 互为同位素
D. “祝融号”火星车上采用的新型碳化硅材料为共价晶体
₂
3.《本草纲目》富载中医药文化和科学知识。其中记载“冬月灶中所烧薪柴之灰。令人以灰淋汁,
取碱浣衣”。下列有关解释错误的是
A. “烧薪柴”主要是纤维素等有机物的燃烧
B“以灰淋汁”所涉及的分离操作有溶解、分液
C“薪柴之灰”可作农用肥,但不可与铵态氮肥混用
D. “取碱浣衣”与酯的水解有关
化学试题 第1页 (共8页)4. 下列物质的应用与性质不对应的是
A 维生素 C 作抗氧化剂——还原性 B. ClO 作自来水消毒剂——氧化性
C. SO 作葡萄酒保鲜剂——漂白性 D. Na₂HCO 可做抗酸药物——弱碱性
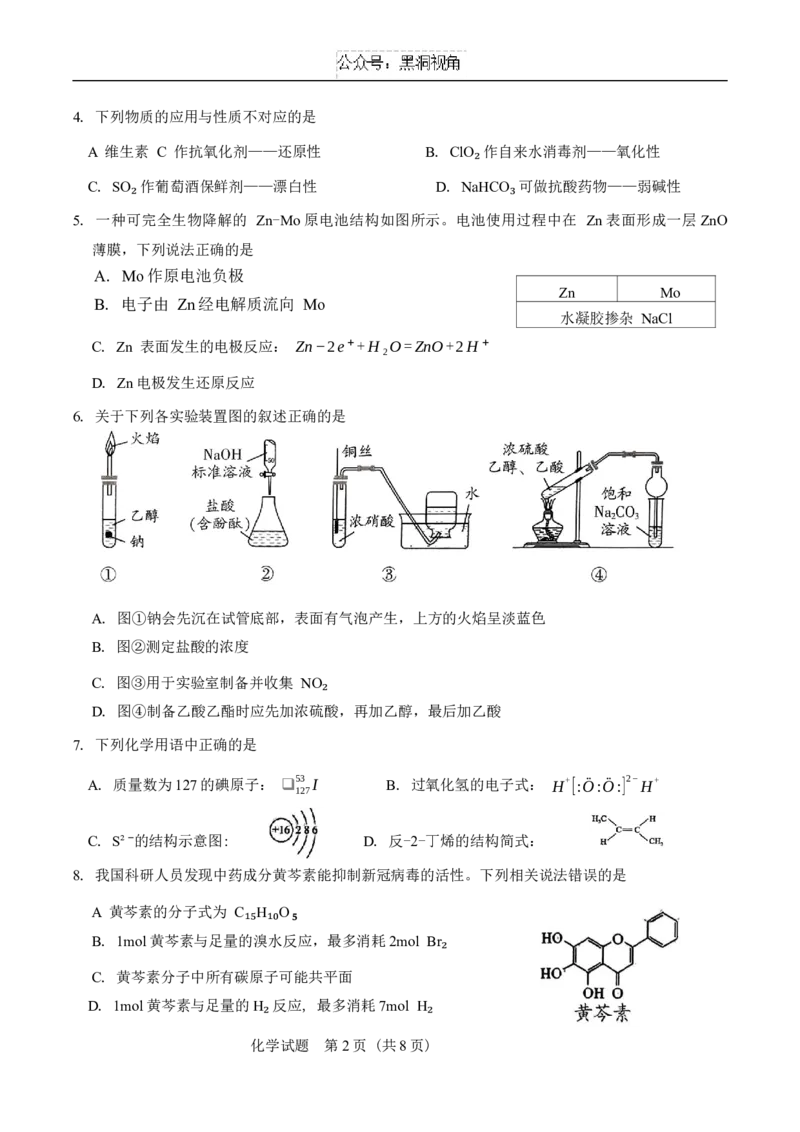
5. 一种可₂ 完全生物降解的 Zn-Mo原电池结构如图所示。电池使用₃过程中在 Zn表面形成一层ZnO
薄膜,下列说法正确的是
A. Mo作原电池负极
Zn Mo
B. 电子由 Zn经电解质流向 Mo
水凝胶掺杂 NaCl
C. Zn 表面发生的电极反应: Zn−2e⁺+H₂O=ZnO+2H⁺
D. Zn电极发生还原反应
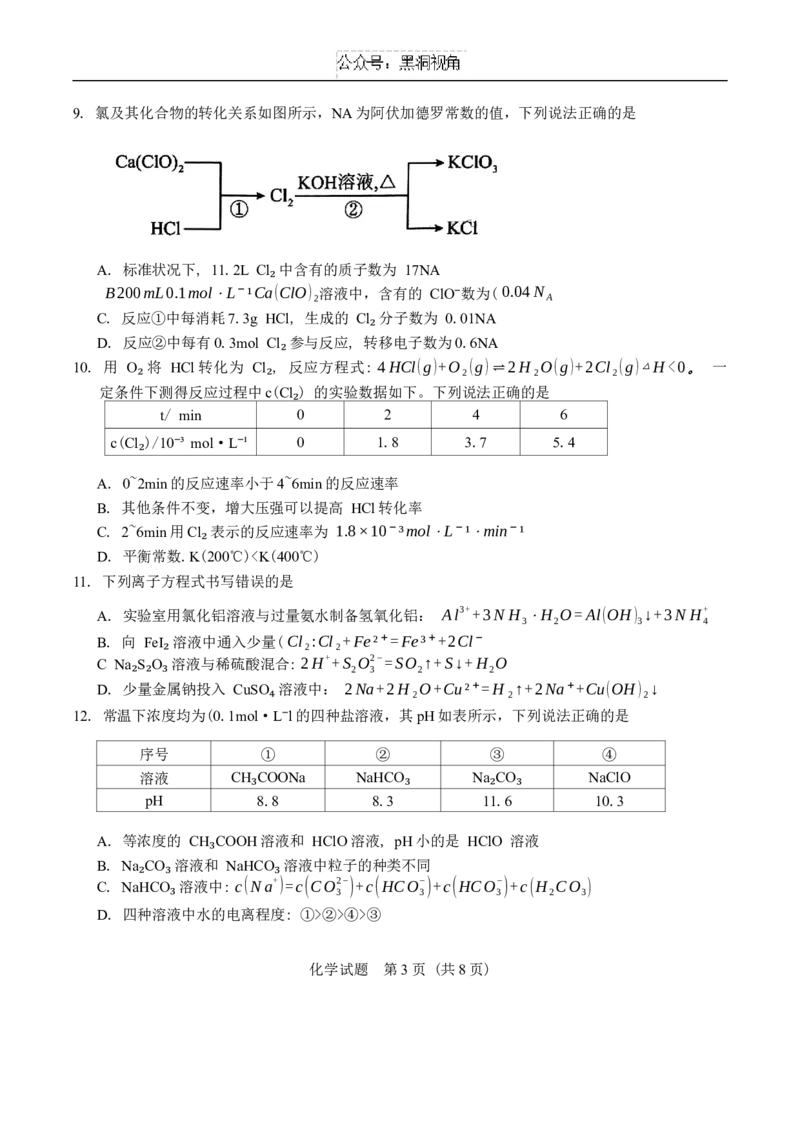
6. 关于下列各实验装置图的叙述正确的是
A. 图①钠会先沉在试管底部,表面有气泡产生,上方的火焰呈淡蓝色
B. 图②测定盐酸的浓度
C. 图③用于实验室制备并收集 NO
D. 图④制备乙酸乙酯时应先加浓硫酸,再加乙醇,最后加乙酸
₂
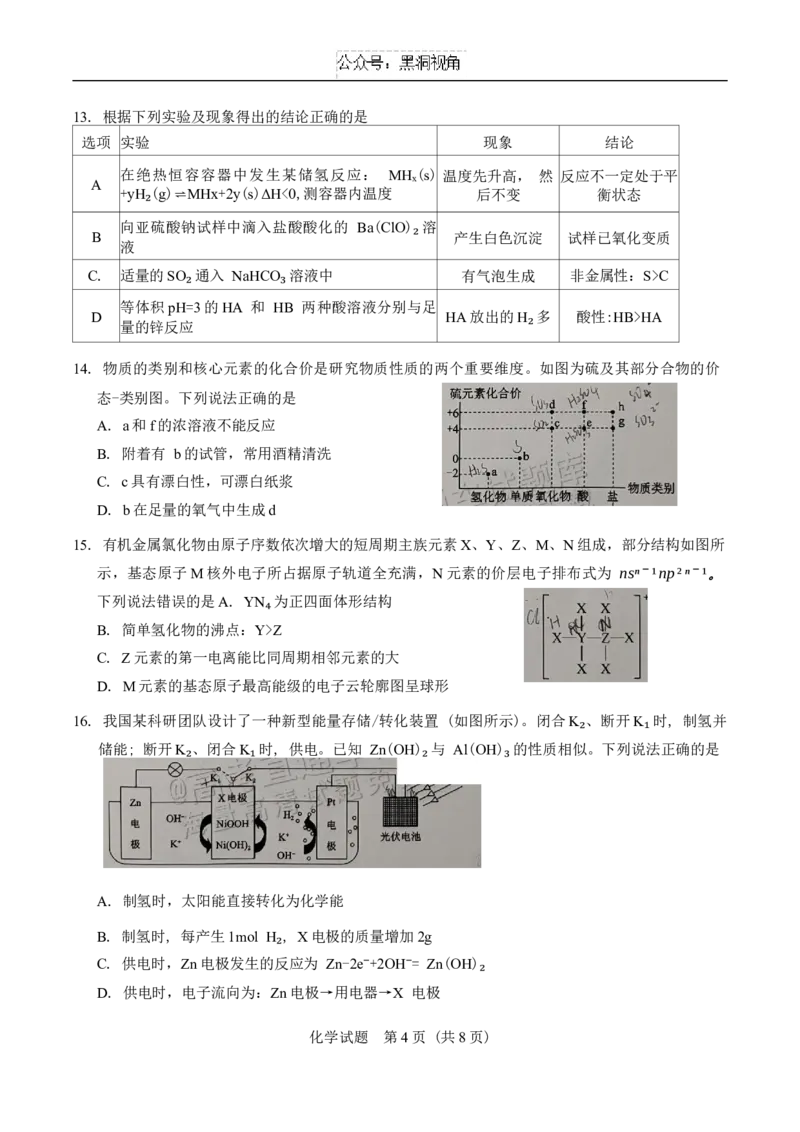
7. 下列化学用语中正确的是
A. 质量数为127的碘原子: ❑ 53 I B. 过氧化氢的电子式: H+[:O¨ :O¨ :] 2− H+
127
C. S²⁻的结构示意图: D. 反-2-丁烯的结构简式:
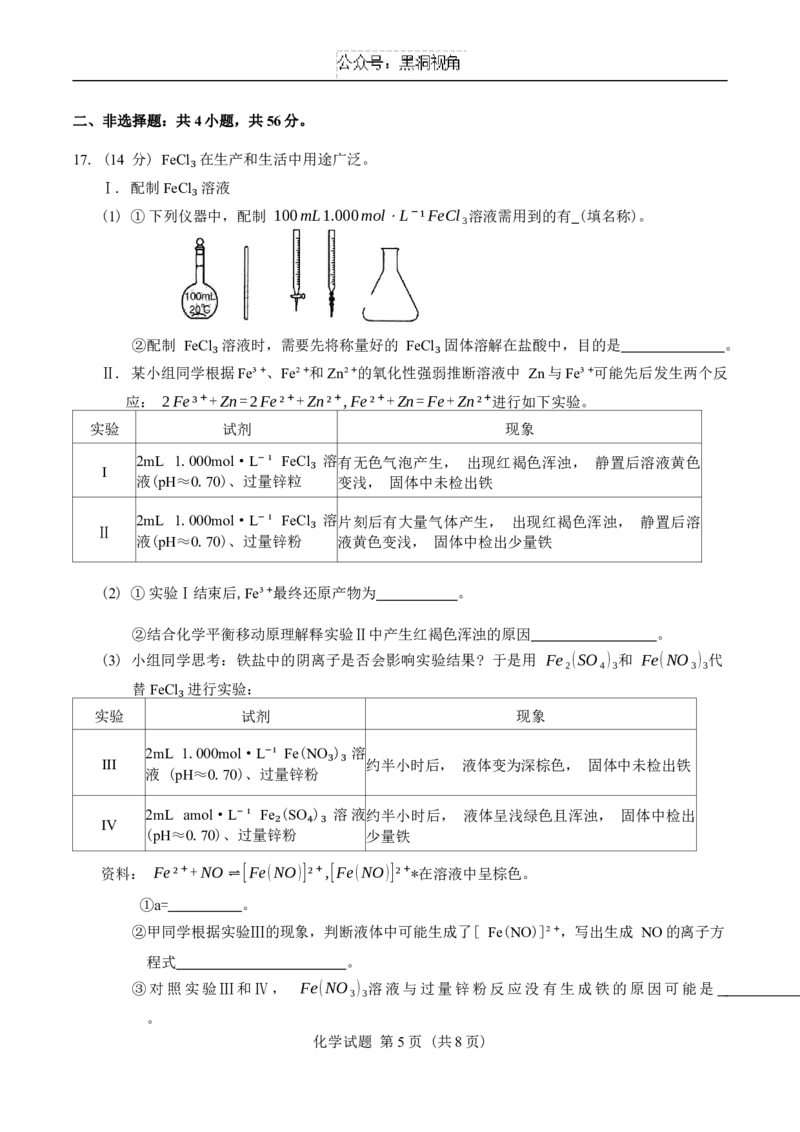
8. 我国科研人员发现中药成分黄芩素能抑制新冠病毒的活性。下列相关说法错误的是
A 黄芩素的分子式为 C H O₅
B. 1mol黄芩素与足量的溴水反应,最多消耗2mol Br
₁₅ ₁₀
C. 黄芩素分子中所有碳原子可能共平面 ₂
D. 1mol黄芩素与足量的H 反应, 最多消耗7mol H
₂ ₂
化学试题 第2页 (共8页)9. 氯及其化合物的转化关系如图所示,NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下, 11.2L Cl 中含有的质子数为 17NA
B200mL0.1mol⋅L⁻¹Ca(ClO)₂溶液中,含有的 ClO⁻数为( 0.04N
₂ A
C. 反应①中每消耗7.3g HCl, 生成的 Cl 分子数为 0.01NA
D. 反应②中每有0.3mol Cl 参与反应, 转移电子数为0.6NA
₂
10. 用 O 将 HCl转化为 Cl , 反应方程式: 4HCl(g)+O₂(g)⇌2H₂O(g)+2Cl₂(g)△H<0。 一
₂
定条件下测得反应过程中c(Cl ) 的实验数据如下。下列说法正确的是
₂ ₂
t/ min 0 2 4 6
₂
c(Cl )/10⁻³mol·L⁻¹ 0 1.8 3.7 5.4
₂
A. 0~2min的反应速率小于4~6min的反应速率
B. 其他条件不变,增大压强可以提高 HCl转化率
C. 2~6min用Cl 表示的反应速率为 1.8×10⁻³mol⋅L⁻¹⋅min⁻¹
D. 平衡常数.K(200℃)②>④>③
₃
化学试题 第3页 (共8页)13. 根据下列实验及现象得出的结论正确的是
选项 实验 现象 结论
在绝热恒容容器中发生某储氢反应: MHₓ(s) 温度先升高, 然 反应不一定处于平
A
+yH (g) ⇌MHx+2y(s)ΔH<0,测容器内温度 后不变 衡状态
向亚₂硫酸钠试样中滴入盐酸酸化的 Ba(ClO) 溶
B 产生白色沉淀 试样已氧化变质
液
₂
C. 适量的SO 通入 NaHCO 溶液中 有气泡生成 非金属性:S>C
等体积pH=₂3的HA 和 H₃B 两种酸溶液分别与足
D HA放出的H 多 酸性:HB>HA
量的锌反应
₂
14. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。如图为硫及其部分合物的价
态-类别图。下列说法正确的是
A. a和f的浓溶液不能反应
B. 附着有 b的试管,常用酒精清洗
C. c具有漂白性,可漂白纸浆
D. b在足量的氧气中生成d
15. 有机金属氯化物由原子序数依次增大的短周期主族元素X、Y、Z、M、N组成,部分结构如图所
示,基态原子M核外电子所占据原子轨道全充满,N元素的价层电子排布式为 nsⁿ⁻¹np²ⁿ⁻¹。
下列说法错误的是A. YN 为正四面体形结构
B. 简单氢化物的沸点:Y>Z
₄
C. Z元素的第一电离能比同周期相邻元素的大
D. M元素的基态原子最高能级的电子云轮廓图呈球形
16. 我国某科研团队设计了一种新型能量存储/转化装置 (如图所示)。闭合K 、断开K 时, 制氢并
储能; 断开K 、闭合K 时, 供电。已知 Zn(OH) 与 Al(OH) 的性质相似。下列说法正确的是
₂ ₁
₂ ₁ ₂ ₃
A. 制氢时,太阳能直接转化为化学能
B. 制氢时, 每产生1mol H , X电极的质量增加2g
C. 供电时,Zn电极发生的反应为 Zn-2e⁻+2OH⁻= Zn(OH)
₂
D. 供电时,电子流向为:Zn电极→用电器→X 电极
₂
化学试题 第4页 (共8页)二、非选择题:共4小题,共56分。
17. (14 分) FeCl 在生产和生活中用途广泛。
Ⅰ. 配制FeCl 溶液
₃
(1) ①下列仪器中,配制 100mL1.000mol⋅L⁻¹FeCl₃溶液需用到的有 (填名称)。
₃
②配制 FeCl 溶液时,需要先将称量好的 FeCl 固体溶解在盐酸中,目的是 。
Ⅱ. 某小组同学根据Fe³⁺、Fe²⁺和Zn²⁺的氧化性强弱推断溶液中 Zn与Fe³⁺可能先后发生两个反
₃ ₃
应: 2Fe³⁺+Zn=2Fe²⁺+Zn²⁺,Fe²⁺+Zn=Fe+Zn²⁺进行如下实验。
实验 试剂 现象
2mL 1.000mol·L⁻¹ FeCl 溶有无色气泡产生, 出现红褐色浑浊, 静置后溶液黄色
I
液(pH≈0.70)、过量锌粒 变浅, 固体中未检出铁
₃
2mL 1.000mol·L⁻¹ FeCl 溶片刻后有大量气体产生, 出现红褐色浑浊, 静置后溶
Ⅱ
液(pH≈0.70)、过量锌粉 液黄色变浅, 固体中检出少量铁
₃
(2) ①实验Ⅰ结束后,Fe³⁺最终还原产物为 。
②结合化学平衡移动原理解释实验Ⅱ中产生红褐色浑浊的原因 。
(3) 小组同学思考:铁盐中的阴离子是否会影响实验结果? 于是用 Fe₂(SO₄)₃和 Fe(NO₃)₃代
替FeCl 进行实验:
实验 试剂 现象
₃
2mL 1.000mol·L⁻¹ Fe(NO ) 溶
III 约半小时后, 液体变为深棕色, 固体中未检出铁
液 (pH≈0.70)、过量锌粉
₃ ₃
2mL amol·L⁻¹ Fe (SO ) 溶液约半小时后, 液体呈浅绿色且浑浊, 固体中检出
IV
(pH≈0.70)、过量锌粉 少量铁
₂ ₄ ₃
资料: Fe²⁺+NO⇌ [Fe(NO)]²⁺,[Fe(NO)]²⁺*在溶液中呈棕色。
①a= 。
②甲同学根据实验Ⅲ的现象,判断液体中可能生成了[ Fe(NO)]²⁺,写出生成 NO的离子方
程式 。
③对照实验Ⅲ和Ⅳ, Fe(NO₃)₃溶液与过量锌粉反应没有生成铁的原因可能是
。
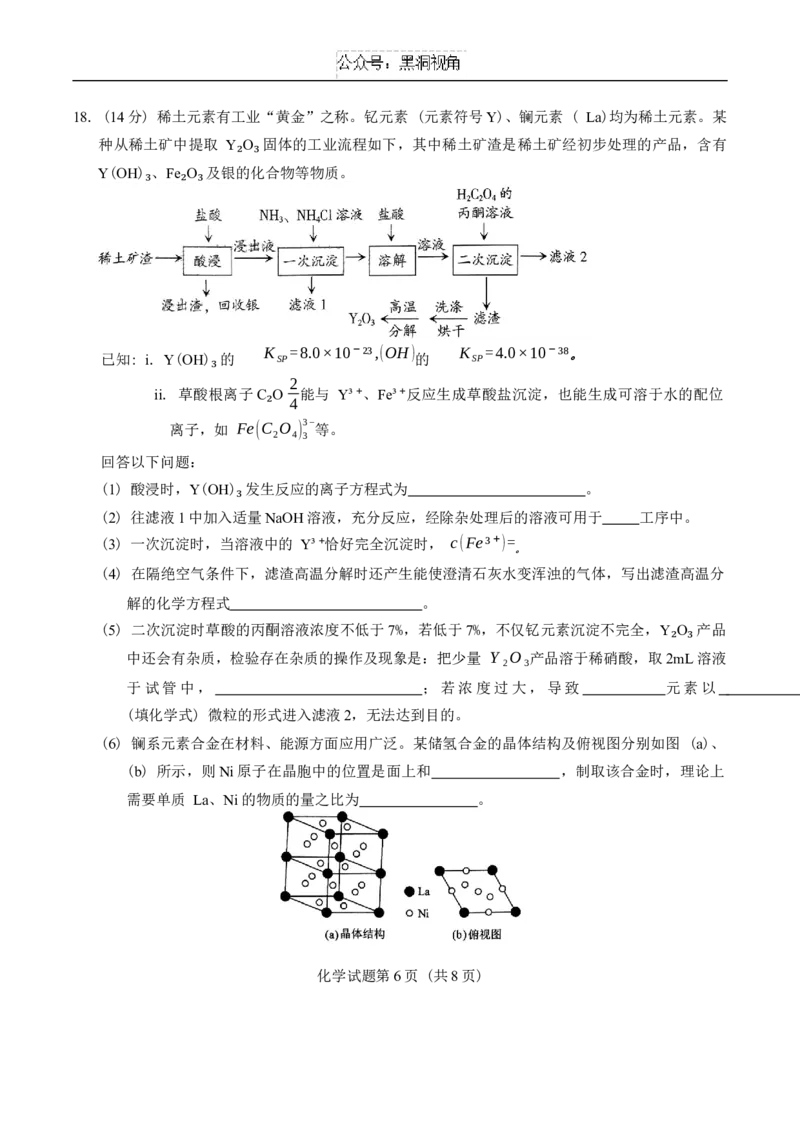
化学试题 第5页 (共8页)18. (14分) 稀土元素有工业“黄金”之称。钇元素 (元素符号Y)、镧元素 ( La)均为稀土元素。某
种从稀土矿中提取 Y O 固体的工业流程如下,其中稀土矿渣是稀土矿经初步处理的产品,含有
Y(OH) 、Fe O 及银的化合物等物质。
₂ ₃
₃ ₂ ₃
K =8.0×10⁻²³,(OH) K =4.0×10⁻³⁸。
已知: i. Y(OH) 的 SP 的 SP
2
ii. 草酸根₃ 离子C O 能与 Y³⁺、Fe³⁺反应生成草酸盐沉淀,也能生成可溶于水的配位
4
离子,如 Fe(C₂ O ) 3− 等。
2 4 3
回答以下问题:
(1) 酸浸时,Y(OH) 发生反应的离子方程式为 。
(2) 往滤液1中加入适量NaOH溶液,充分反应,经除杂处理后的溶液可用于 工序中。
₃
(3) 一次沉淀时,当溶液中的 Y³⁺恰好完全沉淀时, c(Fe³⁺)=
。
(4) 在隔绝空气条件下,滤渣高温分解时还产生能使澄清石灰水变浑浊的气体,写出滤渣高温分
解的化学方程式 。
(5) 二次沉淀时草酸的丙酮溶液浓度不低于7%,若低于7%,不仅钇元素沉淀不完全,Y O 产品
中还会有杂质,检验存在杂质的操作及现象是:把少量 Y₂O₃产品溶于稀硝酸,取2mL溶液
₂ ₃
于试管中, ;若浓度过大,导致 元素以
(填化学式) 微粒的形式进入滤液2,无法达到目的。
(6) 镧系元素合金在材料、能源方面应用广泛。某储氢合金的晶体结构及俯视图分别如图 (a)、
(b) 所示,则Ni原子在晶胞中的位置是面上和 ,制取该合金时,理论上
需要单质 La、Ni的物质的量之比为 。
化学试题第6页 (共8页)19. (14分) 为了减缓温室效应,实现碳中和目标,将 CO或CO 转化为甲醚、甲醇等产品是有效措
施之一。
₂
I. CO 与H 制二甲醚( (CH₃OCH₃)的主要反应如下
CO₂(g)+H₂(g)⇌CO(g)+H₂O(g)△H₁
₂ ₂
CO(g)+2H₂(g)⇌CH₃OH(g) ΔH
2CH₃OH(g)⇌CH₃OCH₃(g)+H₂O(g)△H₃
₂
(1) 总反应2 2CO₂(g)+6H₂(g)⇌CH₃OCH₃(g)+3H₂O(g)的ΔH = ;
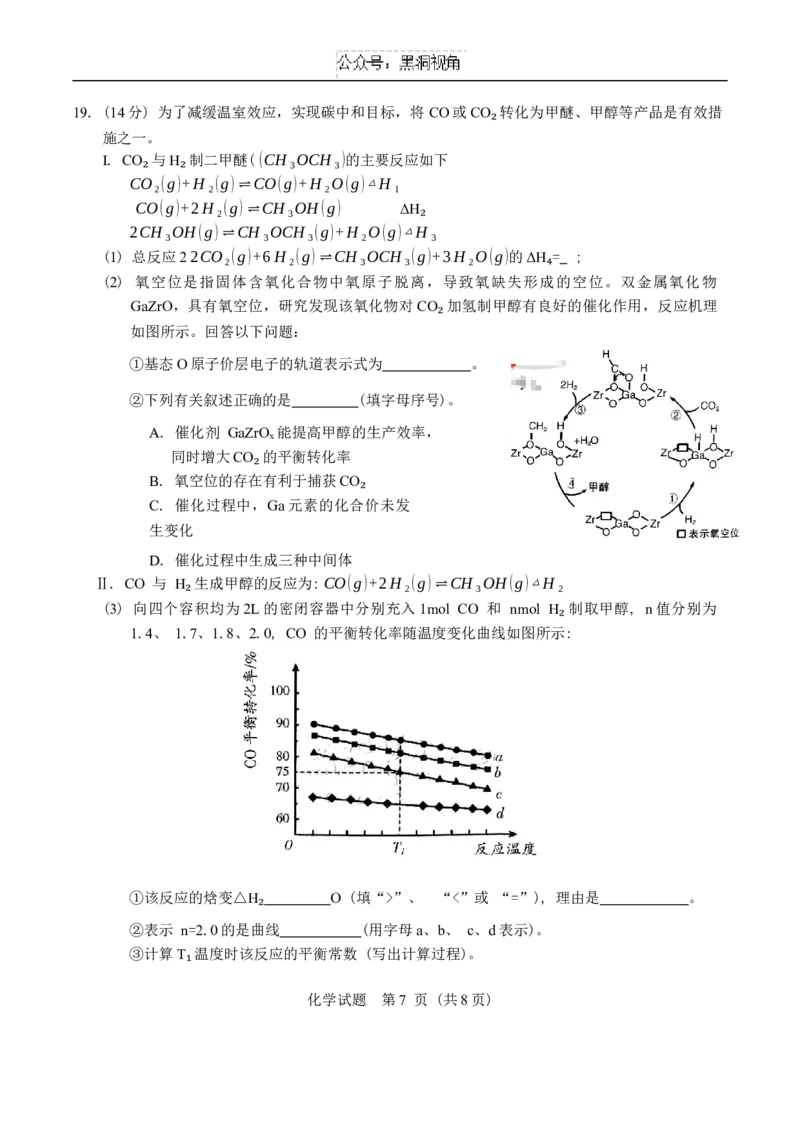
(2) 氧空位是指固体含氧化合物中氧原子脱离,导致氧缺失形成的空位。双金属氧化物
₄
GaZrO,具有氧空位,研究发现该氧化物对CO 加氢制甲醇有良好的催化作用,反应机理
如图所示。回答以下问题:
₂
①基态O原子价层电子的轨道表示式为 。
②下列有关叙述正确的是 (填字母序号)。
A. 催化剂 GaZrOₓ能提高甲醇的生产效率,
同时增大CO 的平衡转化率
B. 氧空位的存在有利于捕获CO
₂
C. 催化过程中,Ga元素的化合价未发
₂
生变化
D. 催化过程中生成三种中间体
Ⅱ. CO 与 H 生成甲醇的反应为: CO(g)+2H₂(g)⇌CH₃OH(g)△H₂
(3) 向四个容积均为2L的密闭容器中分别充入1mol CO 和 nmol H 制取甲醇, n值分别为
₂
1.4、 1.7、1.8、2.0, CO 的平衡转化率随温度变化曲线如图所示:
₂
①该反应的焓变△H O (填“>”、 “<”或 “=”), 理由是 。
②表示 n=2.0的是曲₂线 (用字母a、b、 c、d表示)。
③计算T 温度时该反应的平衡常数 (写出计算过程)。
₁
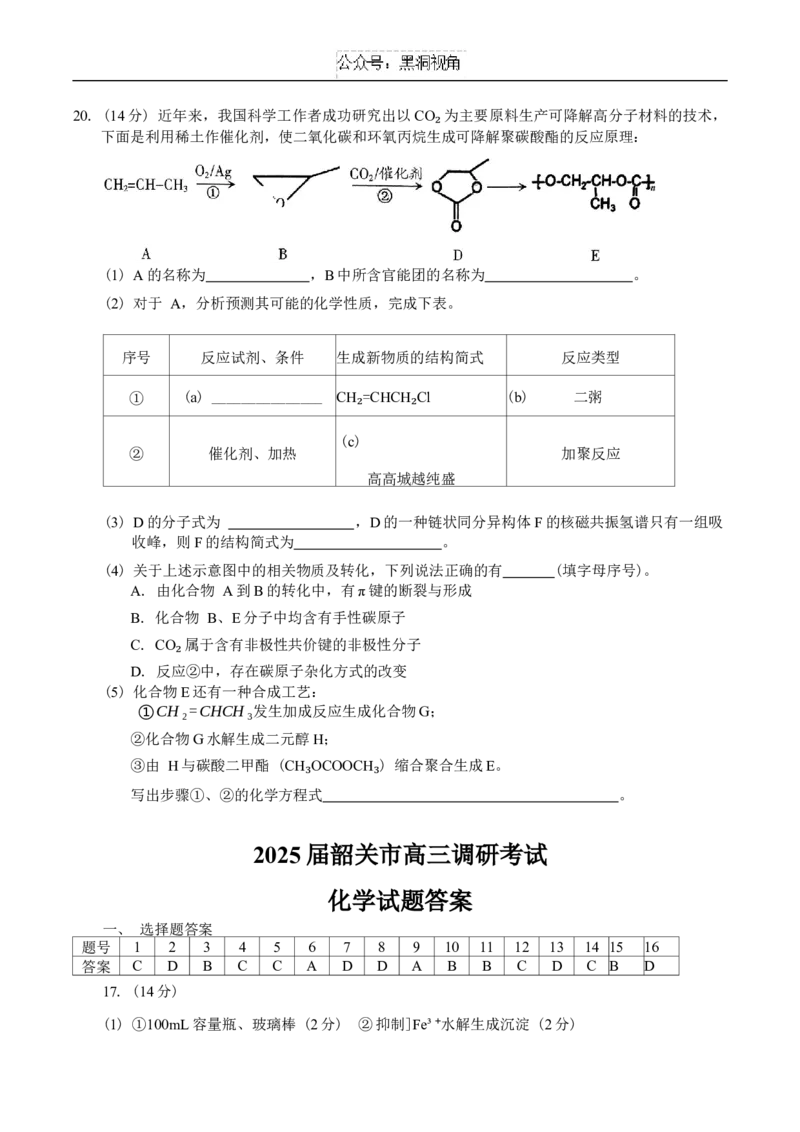
化学试题 第7 页 (共8页)20. (14分) 近年来,我国科学工作者成功研究出以CO 为主要原料生产可降解高分子材料的技术,
下面是利用稀土作催化剂,使二氧化碳和环氧丙烷生成可降解聚碳酸酯的反应原理:
₂
(1) A的名称为 ,B中所含官能团的名称为 。
(2) 对于 A,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 生成新物质的结构简式 反应类型
① (a) _______________ CH =CHCH Cl (b) 二粥
₂ ₂
(c)
② 催化剂、加热 加聚反应
高高城越纯盛
(3) D的分子式为 ,D的一种链状同分异构体F的核磁共振氢谱只有一组吸
收峰,则F的结构简式为 。
(4) 关于上述示意图中的相关物质及转化,下列说法正确的有 (填字母序号)。
A. 由化合物 A到B的转化中,有π键的断裂与形成
B. 化合物 B、E分子中均含有手性碳原子
C. CO 属于含有非极性共价键的非极性分子
D. 反应②中,存在碳原子杂化方式的改变
₂
(5) 化合物E还有一种合成工艺:
①CH₂=CHCH₃发生加成反应生成化合物G;
②化合物G水解生成二元醇H;
③由 H与碳酸二甲酯 (CH OCOOCH ) 缩合聚合生成E。
写出步骤①、②的化学方程式 。
₃ ₃
2025 届韶关市高三调研考试
化学试题答案
一、 选择题答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 C D B C C A D D A B B C D C B D
17. (14分)
(1) ①100mL容量瓶、玻璃棒 (2分) ②抑制]Fe³⁺水解生成沉淀 (2分)(2) ①Fe²⁺ (2分) ②锌与H⁺反应, 平衡 Fe³⁺+3H₂O⇌Fe(OH)₃+3H⁺向右移动 (2分)
(3) ①0.500 (2分) ( 2˚3Zn+8H++2NO−=3Zn2++2NO+4H O(2分)
3 2
③常温下 , [ Fe(NO)]²⁺[比较稳定 , 难被 Zn还原; (2分)
18. (14分)
(1)Y(OH)₃+3H⁺=Y ³⁺+3H₂O (2分)
(2)一次沉淀(1分)
(3)5.0×10⁻²¹mol⋅L⁻¹(2分)
(4) Y (C O ) Y O +3CO↑+3CO ↑ (2分)
(5)加₂入几₂滴₄ K₃SCN₂溶液₃ ,振荡, 溶液₂变红色(2分); Y或钇(1分) ; Y(C O ) 3− (1分)
2 4 3
(6)体心(或体内) (1分); 1:5(2分)
19. (14分)
(1)2△H₁+2△H₂+△H₃(2分)
(2)① ② BD(2
分)
(3)①<(5分) ;温度升高,CO的平衡转化率降低,平衡左移(2分)
② a (2分)
③ CO(g)+2H₂(g)⇌CH₃OH(g)
1 2 ⊥
起始的浓度( mol/L ) 0.5 0.85 0
变化的浓度 ( mol/L ) 0.375 0.750.375
平衡的浓度( mol/L ) 0.125 0.10 0.37520. (14分)
(1)丙烯 ; 醚键 (各1分 , 共2分)
(2) (a)Cl 、 光照(或Cl 、500℃) ; (b)取代反应; (c)−[CH₂−CH(CH₃)]n−
₂ ₂
(各1分,共3分)
(3)C H₆O (1分); (CH CO) O (2分)
₄ ₃ ₃ ₂
(4)BD (2分)
(5)①CH₂=CHCH₃+Br₂→CH₂BrCHBrCH₃
②CH2BrCHBrCH3+2NaOH —→CH₂OHCHOHCH₃+2NaE}r
(各2分,共4分)