文档内容
德阳市高中2022级第一次诊断考试
化 学 试 卷
说明
:
1.本试卷分第I卷和第Ⅱ卷,共 8页 ,考生作答时,须将答案答在答题卡上,在本试卷、
车稿纸上答是无效。考试结束后,将答题卡交回。
2,本试卷满分100分,75分钟完巷
.
:H-lC-120-16
可能用到的相对原子质量
第 |卷 (选择题 共42分
)
-、选择题 (本题包括 14小题,每小题3分,共 42分 .每小题只有一个选项最符合题意
)
1.历史文物见证了中华民族的发展。下列义物的主要成分为天然高分子的是
|
C.金沙太阳神乌金饰 1) I -
II
`
'
曰
'
,
⒉
2,下列说法错误的是
A.亚硝酸钠用作食品防腐剂是利用其强氧化性
B.某些油脂兼有酯和烯烃的一些化学性质
C.新型陶瓷在组成上不限于传统的硅敌盐
D,新型储氢合金材料的研发利于氢能的利用
3.下列物质对应的描述中,正确的是
0
J●
A.so,的 VsEPR模 剧 :。
B,NH” H:0中心原子杂化`P方式相同
q:_Krq1日
C,用电子式表示KCI的形成过程:Kk+·
`
D 莶态F 的结构一不意图 ' h ` 一 0乙 ` N ν `0‘
\\8``
\\1//
·△
一/ /
.
`
化学一诊 第I页(共g页
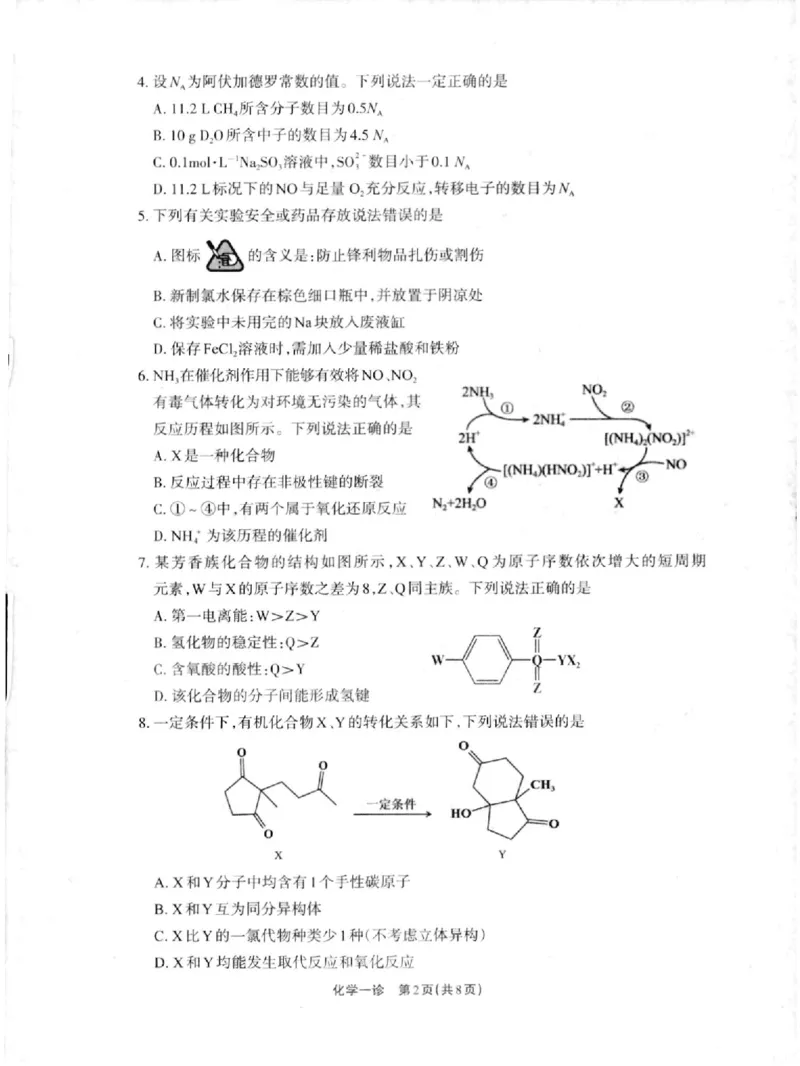
)4.设Ⅳ 阿伏加德罗常数的值。下列说法一定正确的是
^为
A.1⒈2 L CH4所含分子数目为0.5Ⅳ
^
B,108D20所 含中子的数目为4.5Ⅳ
^
C.0.lmo1·L^IN%sol溶液中,so:ˉ 数 目小 于0.1吨
D.l1.2L标况下的N0与足量02充分反应,转移电子的数目为几
5.下列有关实验安全或药品存放说法错误的是
‘ ▲
A.图标 的含义是:防止锋利物品扎伤或割伤
a■、
B.新制讯水保存在棕色细口瓶中,并放王于阴凉处
C.将实验中未用完的Na块放人废液缸
D.保存FeC12溶液时,需加人少量稀盐酸和铁粉
| 6.NH∶在催化剂作用下能够有效将No、No2
2NH,
有毒气体转化为对环境无污染的气体,其 k
^
o
—
厂 2NIII
反应历程如图所示。下列说法正确的是
A.X是一种化合物
法
((N"‘XH· No:)r+
B.反应过程中存在非极性键的断裂
~④ Na+2Hao X
C.① 中,有两个同于氧化还原反应
D.NHI为该历程的催化剂
7.某芳吞族化合物的结构如图所示,X、Y、z、 W、Q为原子序数依次增大的短周期
元素,W与X的原子序数之差为8,Z、Q同主族。下列说法正确的是
:W)z)Y
A,第一电离能
B.氢化物的稳定性:Q>z
`
C.禽氧酸的酸性 :Q>Y
|| 一、
`` `,
D.该化合物的分子间能形成氢键
`
·
8.·定朱件下,有机化个物X、 Y的转化关系】 ll卜 ,「列说法什议的
`t
0
0
C",
·ˉ
定级件
H
o
0
X
`·
A.X和Y分子中均含有1个手性碳原子
B.X和Y互为同分异构体
C.X比 Y的一氨代物种类少1种(不 考虑立体异构
)
D,X和 Y均能发生取代反应和氧化反应
化学一诊 第2页(共8页
)9.下列实验方案中,一定能达到相应日的的是
·
选项 实吮ll的 9(验 方案
向2mLO.I mo1·L】 AgNo3溶液中先滴加4滴0.lmd△ l
验11i K叩 (Agl)<κp(AgCl) KCl溶液,再滴加4滴 0.l mo1· L→ KI溶液,观察生成沉
` 淀的颜色变化
|
验证久置的Na2so) 取少墩样品溶于除氧蒸馏水中,加人足量的稀盐酸
,
I; 是否变质 冉滴加氛化钡溶液,观察是否有白色沉淀出现
将铁棒与碳棒分别连接到直流电源的负极和正极
(∶
探究牺牲阳极法
再插人稀硫酸中,观察气泡产生情况
,
探究浓度对水解程度 测定同体积、不同浓度的FcCI)溶液的pH,比较pH
I) 的影响 大小
10,NH4Fe(s04)2·12H20(铁铵矶)是分析化学中的重要试剂。下列有关lmoIL^INH‘Fe(so‘
)2
溶液的叙述正确的是
A.该溶液中
,H·
、AP和 I^可以大量共存
B,该溶液与0.5md· L^】 (NH)s04溶 液相 比,c(NHi):(NHO2so‘ >NH‘Fe(s04)2
C.可分别用NaOH浓溶液、KsCN溶液检验该溶液中的NH∶和Fcy
o.向 该溶液滴人Ba(0H`溶液恰好使soi·完全沉淀的离子方程式为
:
Fe”+2soi·+2Ba2·+30Hˉ ==2Bas04↓+Fe(0H),↓
11.下列装工或操作能达到实验目的的是 |
〃r晡
彬 画
J
和溆 △
上曲、
0 0
Φ Φ
A.图0:将硫酸铜溶液蒸干制胆矾
B.图②:制备碳酸氢钠
C.图③:检验装△气密性
D.图④:向容量瓶转移溶液
12.我国科学家房啸院士成功研发杯
I41吡
咯纳米膜(熔点:-2⒊5℃)的制备方法。杯【41
吡咯分子结构如下图所示,结构中含有四个吡咯单元(吡咯的结构简式为`I
·t
' ^
t
、
'
N
.
H
9丿
Δ
●
子中所有原子共平面,波浪线表示修饰基团 下列说法正确的是
)。
A.杯 [41吡咯纳米膜属于共价晶体
B.吡咯分子中N原子的杂化方式为spl
C,杯 I41吡咯分子结合卤紊离子形成的是超分子
D.溶于水的吡咯分子不能与水分子形成水合分子
化学一诊 第3页(共8页
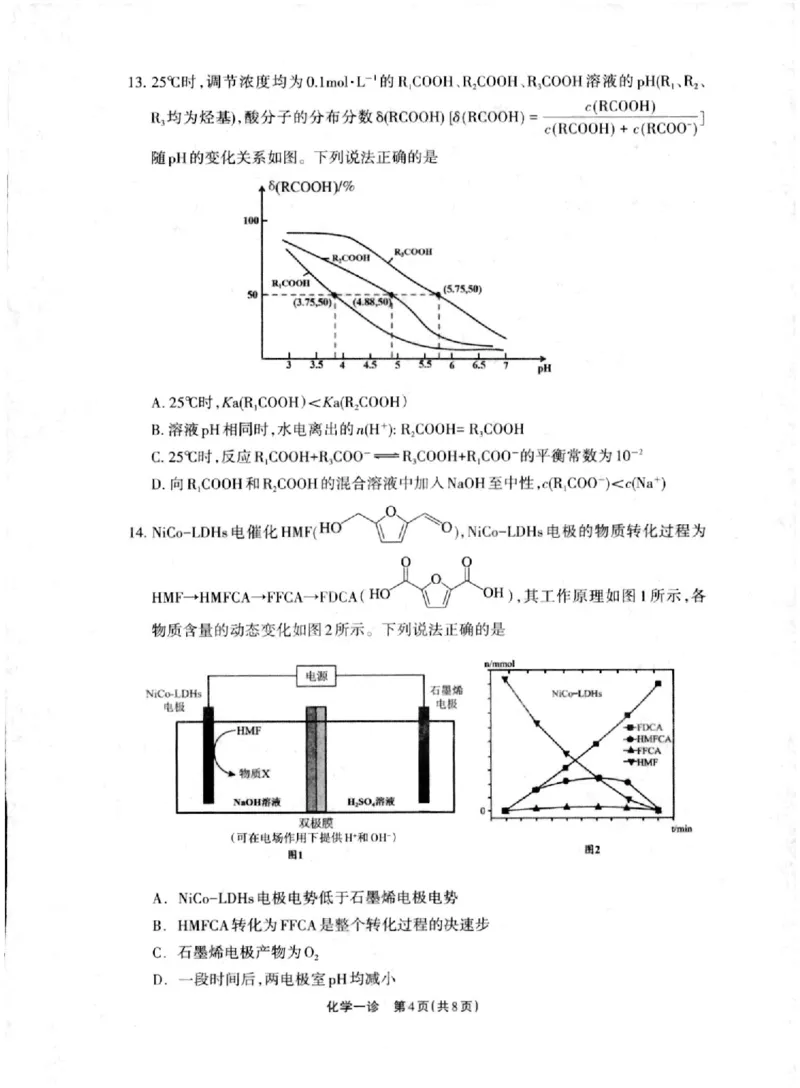
)13.25℃时 ,调 节浓度均 为 0,l mo1·Lˉ l的 RlC00H、 R2C00H、 R,C00H溶 液 的 pH(R” R2、
^`prnnu、
(RC00Hm(Rc00H)=面 ·
R,均为烃荃),酸分子的分布分数δ
面面清嵩 1号 嚣恧灭两 ]
随pH的变化关系如图。下列说法IE确的是
6(RCooHy%
I()0
R)(·(X)li
q,
kl(·(X)II
,s,sO)
(a,sJ“))
3 7
I,it
A.25℃时 ,Ka(RIC00H)(Ka(R,C00H)
B.溶液pH相同时,水电离出的以H十):R2c00H=RaC00H
C.25℃时,反应R1C00H+R=C00ˉ ==· R3C00H+R1C00^的 平衡常数为10-2
D.向 RIC00H和 R2C00H的混合溶液中加人NaOH至中性,c(RlC00^)(c(Na+)
14.NiCo-LDHs电 催 化 HM「(H ),NiCo-LDHs电 极的物质转化过程为
HM「-+HMFCA-→FFCA-·rl)cA(H ),其T作原理如图1所示,各
物质含蛩的动态变化如|图 2所示 ^F列 说法li确的Jl
电源
NiCo LDHs 石及讼
电极 电报
HMF △]IIIX·
◆ ~亠+ I】 rt`·(「A ^ (· ^
0△iMr
. ·
\
oI】济法 1Il“)(济浓
`●
双极饮
0mln
(可在电场作用下提供H·和oH-)
日1 田9
A.NiCo-LDHs电 极电势低于石垂烯电极电势
B.HMFCA转 化为FFCA是整个转化过程的决速步
C,石 墨烯电极产物为02
D,一段时间后,两电极室pH均减小
化学一诊 中4页(共8页
)第 ll卷 (选择题 共58分
)
二、坎空题(本题共4个小题,共58分
)
15.(14分 )常温下,A~J中
,C、
E和G为单质.其中C为黄色固体,E为常见的气体,其余
均为化合物。H和F在常温下均为液态且元素组成相同,G与 A的浓溶液在常温下作用无明
显现象,加热时有气体产生。它们存在如下的转化关系(图 中部分反应条件或产物略去 |
)。
′
衽 (
Ⅱ
加1热
回答下列问题
:
(1)B的 _;F的 _。
名称为 电子式为
(2)J分子的中心原子杂化方式为 _。
(3)若 I和G能发生化合反应,且反应前后溶液颜色有变化
:
_。
①G在元素周期表中的位王是
②向I溶液中通人D,发生反应的离子方程式为
(4)若组成G的元素的一种同位素,可用于考古时测定一些文物的年代
:
①A和G反应的的化学方程式为
②已知下列几种试剂
:
a.无水Cuso‘ b.品红溶液 c.酸性KMnO,溶液 d,澄清石灰水
为了检验A和G生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实
验方案,上述试剂使用顺序最合理的是 _→ NaOH溶液(坎标号
)。
16,(14分 )某 化学兴趣小组配制FeCla溶 液,并探究Mg和 FeClJ溶液的反应原理。
回答下列问题
:
(l)用 RClr6H20晶体配制0.5m。 L^IFeCla溶 液,下列说法正确的是 _(填 标号
1· )。
^
ˇ 一
.■
■
J1
ll
' `
`~'
化学一诊 第5页(共8页
)A.上图所示的仪器中,有三种是该实验不需要的
B.容 量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,若未用蒸馏水洗涤烧杯和玻璃棒,会导致所配溶液浓度偏低
(2)甲 同学猜想:Mg和 FcCl,溶液反应,会产生大量气体和红褐色沉淀。根据甲同学的
猜想,写 出Mg和 FeCll溶 液可能发生反应的化学方程式
:
′
从平衡移动的角度,解释产 l红褐色沉淀的原囚
:
(3)乙同学对甲的猜想提出质疑,认为沉淀颜色与Mg的用量有关,并设计实验方案进行
探究
:
Fe3+
在环境温度26℃左右,向烧杯中盛2()()mL
qF`+
I FeCll溶
0.5mo1·Lˉ 液,再进行某操作后,观察到
ˉ
镁条表面立即有大量气体产生,2():左右镁条表 Fc·
面变黑,… … ,4~5h后 ,得到棕黑色悬浊液,且 ˇ i ∶ / ' 力 +兰坌. Fe3+
fc)· F、 Fc
|
烧杯底部有少母棕黑色固体。
Mg
查阅资料 验中镁条表面变黑的微观变
||
:实
1●`
化过程如右图所示
: M 3内
“ ”
推测乙同学的 某操作 是
③对应的离子方程式为
(4)为了探究乙同学实验中棕黑色固体的成分,小组同学讨论后,设计方案并进行如下
实验
:
将一小磁铁放人上述棕黑色悬浊液中,发现磁铁吸附大且棕黑色固体。用蒸馏水洗涤
】
吸附的棕黑色固体2~3次 ,并溶于50mL 6mo1· Lˉ 盐酸中,未发现有气泡产生.棕黑色固体缓
慢溶解,30min后棕黑色固体完全消失得到黄色溶液。
~(填
小组同学们猜测该棕黑色固体的成分可能是 化学式
)。
(5)为了检验猜测,如果向黄色溶液中滴加 溶液(填化学式),发现有蓝
色沉淀产生,可证明猜测的合理性。
17.(14分 )亚硫酰戚(soClD和 硫酝宋(so2ClD均是重要的化工原料。以s0卜C1、sClz为原
料可以制备亚硫酰戚,所涉及的反应如下
:
反 应
△so2(g)+C12(g)=士 so2Cll(g) △HI=-471.7kJ/mOI KI
反应Ⅱ.so2C12(g)+sC12(g)=± 2soC12(g) △几=-5.6kJ/mol K2
回答下列问题
:
(1)反应so,(8)+C12(g)+sC12(8)亏 2sOC12(g)正 向自发进行的条件为 ~(填 “ 高温 ”
一
“ ” “ ”
低温 或 任何温度
)。
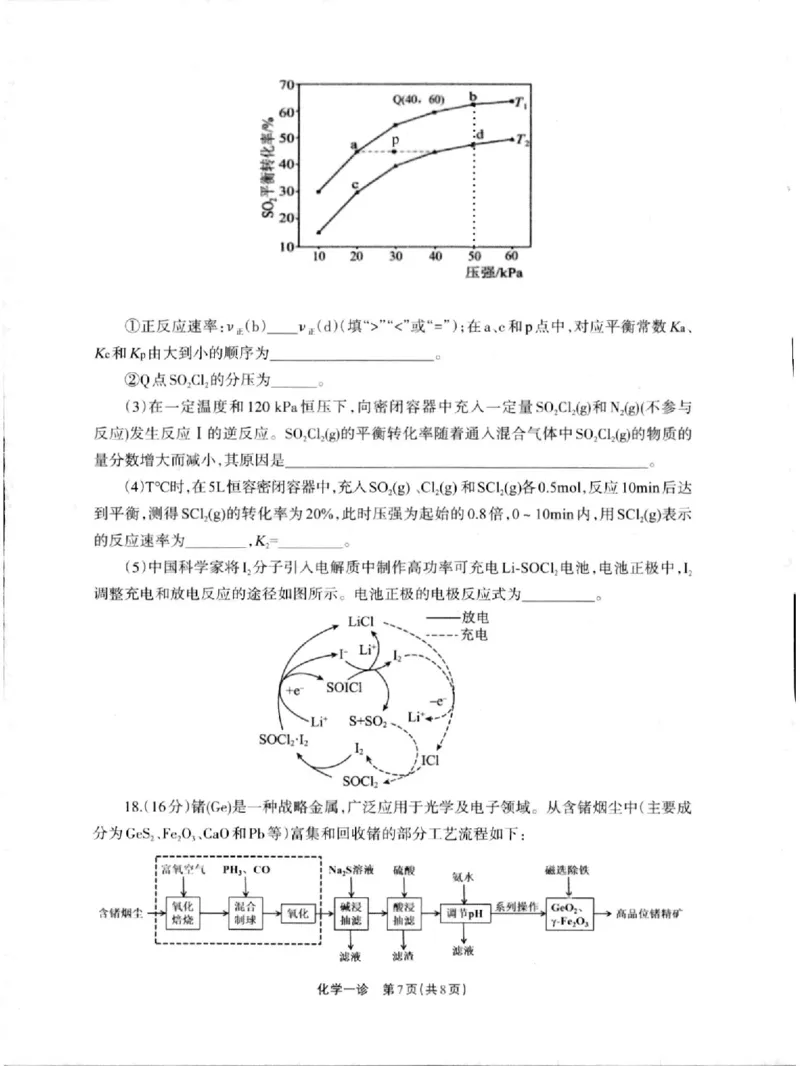
(2)在密闭反应器中充人lmolso2和 2.6moIC12发 生反应 I,测得体系内so2平衡转化率
与温度、压强关系如图所示。
化学一诊 中6页(共8页
)Q(o· 00)
·
"一
·
·
·
一
‘
·
一
`一
lo⒛ so
如 “ “
) )
压各
^po
“ “ “
(b)_vF(d)(填
①正反应速率 :v止 )” (”或 =");在a、 c和 p点中,对应平衡常效 Ka、
【和Kp由 大到小的顺序为 ‘
,
_。
②Q点so2C12的分压为
(3)在一定温度和120 kPa恒压下,向 密闭容器中充人一定I so2Cla(g)和 N2(g)(不 参与
反应
)发
生反应 I的逆反应。so2C12(8)的平衡转化率随着通人混合气体中so2C12(g)的物质的
△分数增大而减小,其原因是 。
(4)T℃时,在 5L恒容密闭容器中,充人so2(g)、C12(g)和 SC1(g)各 0.5mo1,反应10min后达
到平衡,浏得sC12(g)的 转化率为20%,此时压强为起始的0.8倍 ,0~IOmin内 ,用 sC12(g)表 示
_,K.=—
的反应速率为 °
(5)中国科学家将I2分子引人电解质中制作高功率可充电LisOC12电 池,电池正极中
,I2
调整充电和放电反应的途径如图所示。电池正极的电极反应式为
LiCl 放电
ˉˉˉ
充电
---..'\
Li· Ir
0
solCl
+eˉ
s+so2 Li·
Li·
soCl∶·I.
/
` ′/ C ′^ ' `
s oC12
′
.'彡 '
ICl
18.(16分 )锗(Ge)是一种战略金属,广泛应用于光学及电子领域。从含锗烟尘中(主要成
分为Gcs2、 Fc20卜Ca0和 Pb等 )富集和回收锗的部分△艺流程如下
:
t["i'/t PIIr, ( () ,s济澈 |论油
`‘ 么水
^ n '〓烟 (`i(姘化 汜 倒球 个 “化 0 抽 1汊 淹 1日lipi: 系列投们 ( y ; ~ c r O e z , 、 c)‘ 祝IIIdv铞h“J·
泷浓 泌漉
滥浓
化学一诊 第7页 (共 8页
)已知 :C)25°C时 ,Ksp【Fe(oH)jl=4× 10^犯.Ksp【GC(0H)J=4× I0^曲
;
“ ·’ ”
②锗元素 碱浸抽滤 后以Na2GcO,形式存在 酸浸过滤 后以Ge(so()2形式存在。
;“
回答下列问题
:
(1)基态锗原子的价层电子轨道表示式为 ;PH,的 空间构型为 。
(2)虚线框内转化流程的日的为 。
(3)滤渣的成分为 _和 _(填 化学式)r
(4)碱浸时GeO2发生反应会产生H2s,该过程的化学方程式为 。
|
(5)加氨水调节溶液pH“.4,锗和铁元素共沉淀.此时滤液中c(Ge4ˉ)以Fe· )=_。
(6)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图“
):
△
o(c·I⒈NHI)· o 一 0 ●
● (,t
oI `
(.
0该晶体中Ge的化合价为 _。
_(琰 “ “
②该锗化合物品胞的表示方式有多种,图 中 b (: 或 (l”)图 出能表 此化合
'J、
物的晶胞。
化学一诊 第8页(共8页
)