2024-2025 学年高二上学期 11 月检测
化 学
注意事项:
1.答卷前,考生务必将自己的姓名和座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净
后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡的相应位置上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:Na23 Zn65 O16 Cu64 K39 Cl 35.5
一.选择题(共15小题,每题3分,共45分)
1. 化学与社会、能源、环境等密切相关。下列说法错误的是( )
A. 生铁制作的铁锅比纯铁制作的铁锅更容易生锈
B. 太阳能、风能、水能、生物质能均为可再生能源
C. 工业上通过煤的干馏、气化等措施能提高煤的利用效率
D. 可将 反应设计成原电池,从而实现电能转化
2. 对于反应 而言,改变条件使平衡正向移动,则该条件的改变一定能使
( )
A. 增大 B. 反应释放的热量增多
C. 化学平衡常数K增大 D. 的平衡转化率增大
3. 下列说法正确的是( )
A. 铜制器皿在酸性环境中易发生析氢腐蚀
B. 可用勒夏特列原理解释用排饱和食盐水法收集氯气能减少氯气损失的原因
C. 金属锌与硫酸反应制氢气时,增大浓度一定可以加快生成 的速率
D. 对 平衡体系增大压强,平衡正向移动, 减小
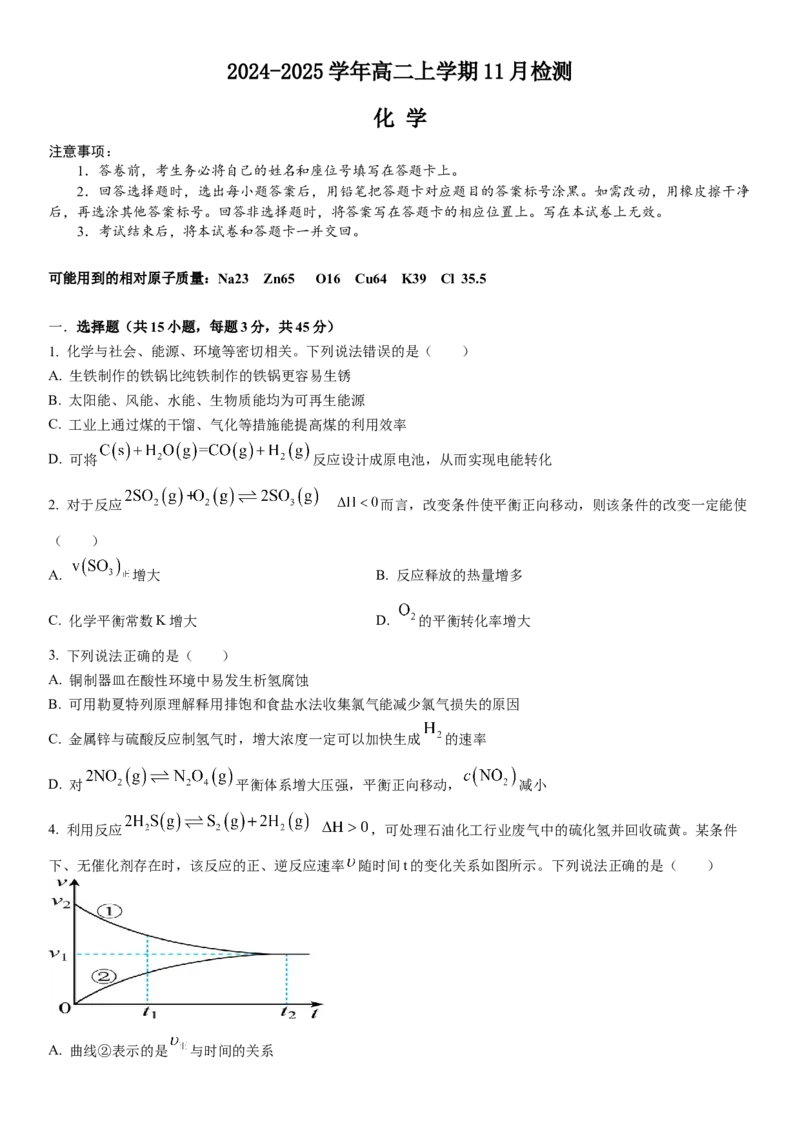
4. 利用反应 ,可处理石油化工行业废气中的硫化氢并回收硫黄。某条件
下、无催化剂存在时,该反应的正、逆反应速率 随时间t的变化关系如图所示。下列说法正确的是( )
A. 曲线②表示的是 与时间的关系B. 时刻混合气体的平均摩尔质量大于 时刻
C. 时刻体系中
D. 有催化剂存在时, 增大、 不变
5. 金属硫化物( )催化反应 ,既可以除去天然气中的
,又可以获得 。T℃时,该反应在某密闭容器中进行,下列有关说法正确的是( )
A. 平衡后通入Ne,反应速率增大
B. 当 时,反应达到平衡状态
C. 温度不变,压缩容器的容积,平衡逆向移动, 减小
D. 温度不变,改变条件使平衡常数 (浓度商),平衡正向移动
的
6. 类比和推理是重要 学习方法。下列类比或推理合理的是( )
选项 已知 方法 结论
A 工业电解熔融氯化镁制镁 类比 工业电解熔融氯化铝制铝
B 推理 氯的得电子能力大于溴
且
C 铁制品在潮湿空气中易生锈 类比 铝制品在潮湿空气中易生锈
D 由铝片、镁片与NaOH溶液组成的原电池中,铝片为负极 推理 铝的失电子能力大于镁
7. 某低成本储能电池的工作原理如图所示,下列说法正确的是( )
A. 放电过程中负极区电解液质量增加B. 充电时 通过质子交换膜移向右侧
C. 放电过程中 在多孔碳电极发生氧化反应
D. 充电时发生的总反应为
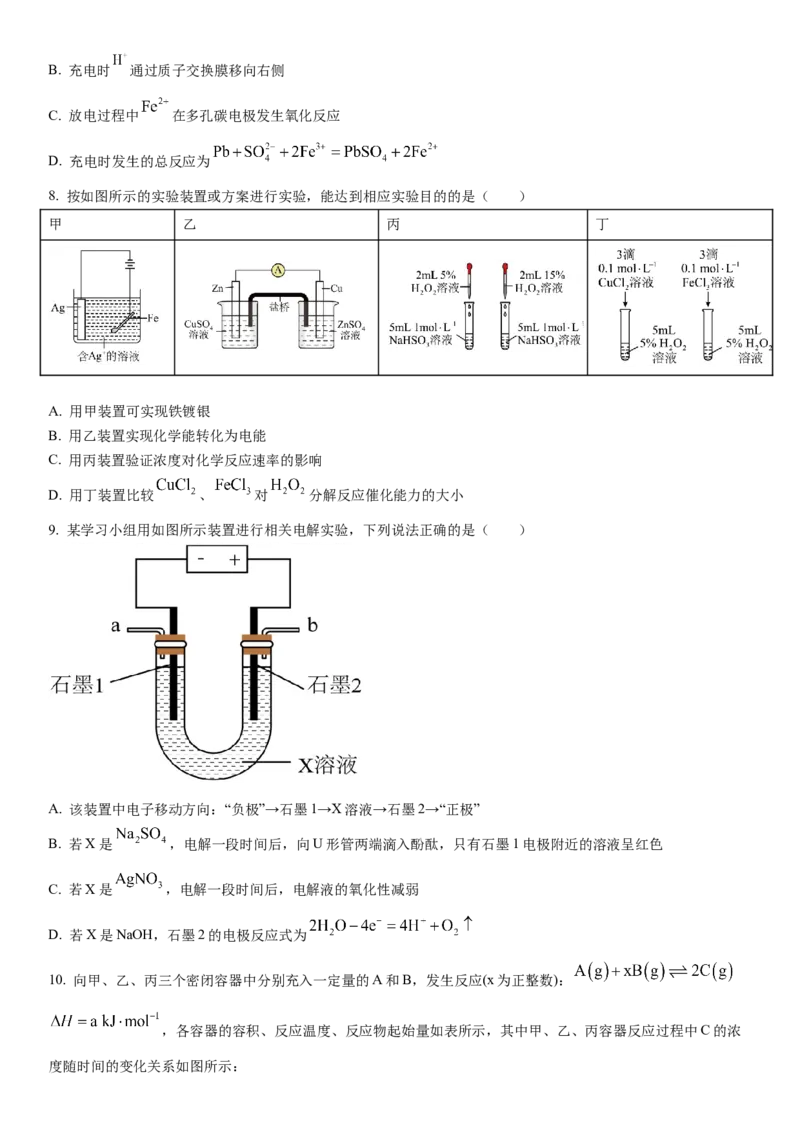
8. 按如图所示的实验装置或方案进行实验,能达到相应实验目的的是( )
甲 乙 丙 丁
A. 用甲装置可实现铁镀银
B. 用乙装置实现化学能转化为电能
C. 用丙装置验证浓度对化学反应速率的影响
D. 用丁装置比较 、 对 分解反应催化能力的大小
9. 某学习小组用如图所示装置进行相关电解实验,下列说法正确的是( )
A. 该装置中电子移动方向:“负极”→石墨1→X溶液→石墨2→“正极”
B. 若X是 ,电解一段时间后,向U形管两端滴入酚酞,只有石墨1电极附近的溶液呈红色
C. 若X是 ,电解一段时间后,电解液的氧化性减弱
D. 若X是NaOH,石墨2的电极反应式为
10. 向甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应(x为正整数):
,各容器的容积、反应温度、反应物起始量如表所示,其中甲、乙、丙容器反应过程中C的浓
度随时间的变化关系如图所示:容器 甲 乙 丙
容积 1L 1L 1L
温度/℃
3 mol A 3 mol A 6 mol A
反应物起始量
1 mol B 1 mol B 2 mol B
下列分析与推断错误的是( )
A. a<0
B. 丙容器达到平衡所需要的时间比乙短
C. 丙容器中A的平衡转化率小于16.7%
D. 0~10 min内甲容器中的平均反应速率
11.钠离子电池因其原材料丰富、资源成本低廉及安全环保等突出优点,在电化学规模储能领域和低速电动车领
域 中 具 有 广 阔 的 应 用 前 景 。 某 钠 离 子 电 池 结 构 如 图 所 示 , 钠 离 子 电 池 总 反 应 方 程 式 为
。下列说法不正确的是( )
A.充电时,电极B与外接直流电源的负极相连
B.充电时,Na+得电子成为Na嵌入硬碳中
C.放电时,电极A为正极,电极反应式:NaTMO +(1-x)Na+ + (1-x)e-=NaTMO
x 2 2
D.放电时,外电路中每转移0.2mole-,理论上硬碳质量增加4.6g
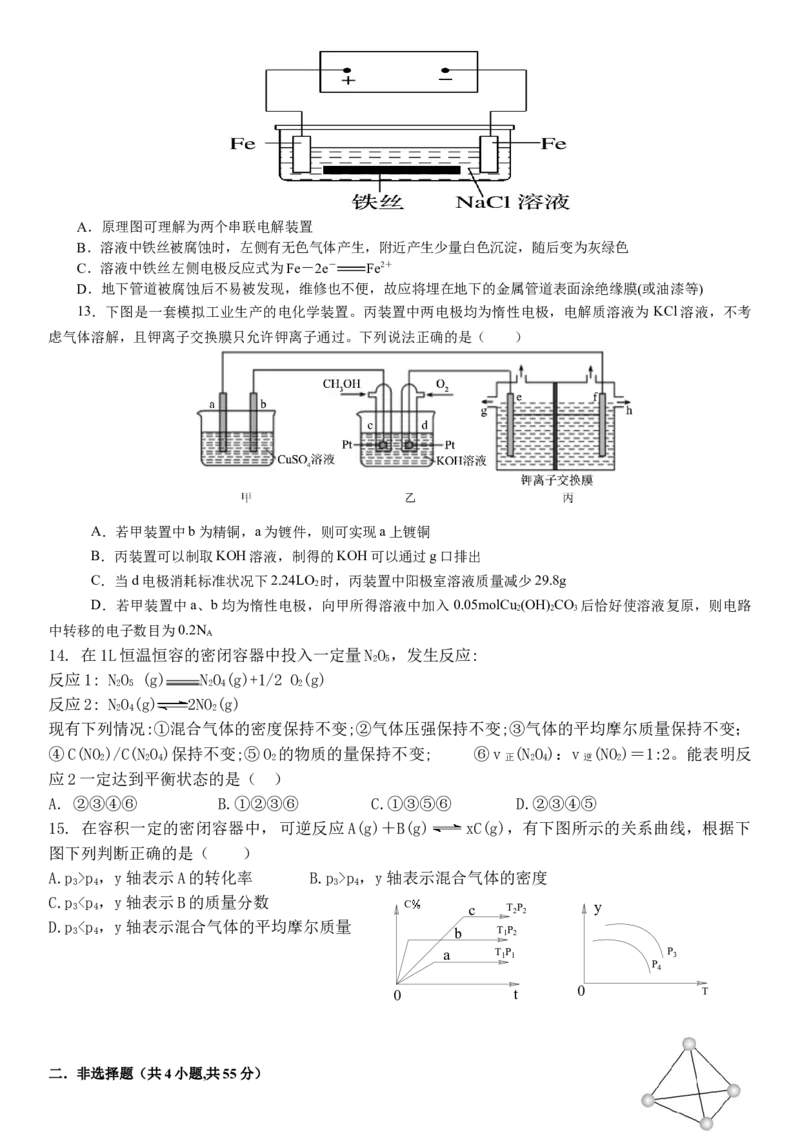
12.在城市地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁的铁轨,当有电流泄漏入潮湿的土壤
中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀,其腐蚀原理如图所示。则下列有关说法不正确
的是( )A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左侧电极反应式为Fe-2e- Fe2+
D.地下管道被腐蚀后不易被发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
13.下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为 KCl溶液,不考
虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是( )
A.若甲装置中b为精铜,a为镀件,则可实现a上镀铜
B.丙装置可以制取KOH溶液,制得的KOH可以通过g口排出
C.当d电极消耗标准状况下2.24LO 时,丙装置中阳极室溶液质量减少29.8g
2
D.若甲装置中a、b均为惰性电极,向甲所得溶液中加入0.05molCu (OH) CO 后恰好使溶液复原,则电路
2 2 3
中转移的电子数目为0.2N
A
14. 在1L恒温恒容的密闭容器中投入一定量N O ,发生反应:
2 5
反应1: N O (g) N O (g)+1/2 O (g)
2 5 2 4 2
反应2: N O (g) 2NO (g)
2 4 2
现有下列情况:①混合气体的密度保持不变;②气体压强保持不变;③气体的平均摩尔质量保持不变;
④C(NO )/C(N O )保持不变;⑤O 的物质的量保持不变; ⑥v (N O ):v (NO )=1:2。能表明反
2 2 4 2 正 2 4 逆 2
应2一定达到平衡状态的是( )
A. ②③④⑥ B.①②③⑥ C.①③⑤⑥ D.②③④⑤
15. 在容积一定的密闭容器中,可逆反应A(g)+B(g) xC(g),有下图所示的关系曲线,根据下
图下列判断正确的是( )
A.p >p ,y轴表示A的转化率 B.p >p ,y轴表示混合气体的密度
3 4 3 4
C.p
”“<”或“=”); ___________ (用含a、c的代数式表示)。
(2)已知298 K,101 kPa时, ,相关物质的摩尔燃烧
焓数据如表:
物质
摩尔燃烧焓
-285.8 -393.5 a
则表示C(石墨,s)摩尔燃烧焓的热化学方程式为___________,a=___________。
(16分)17. 工业上利用正丁烷(CHCHCHCH)的裂解反应制备乙烯、丙烯等化工基础原料,相关反应有:
3 2 2 3
ⅰ. △H=+80 kJ/mol
1
ⅱ. △H=+92 kJ/mol
2
请回答下列问题:
(1)反应ⅰ在___________下能自发进行(填字母)。
a.高温 b.低温 c.任意温度
(2)已知 △H=-9 kJ/mol,相对而言,___________较稳定(填“正丁烷”
3
或“异丁烷”);若异丁烷发生反应ⅰ,则其反应热△H ___________80 kJ/mol(填“>”或“<”)。
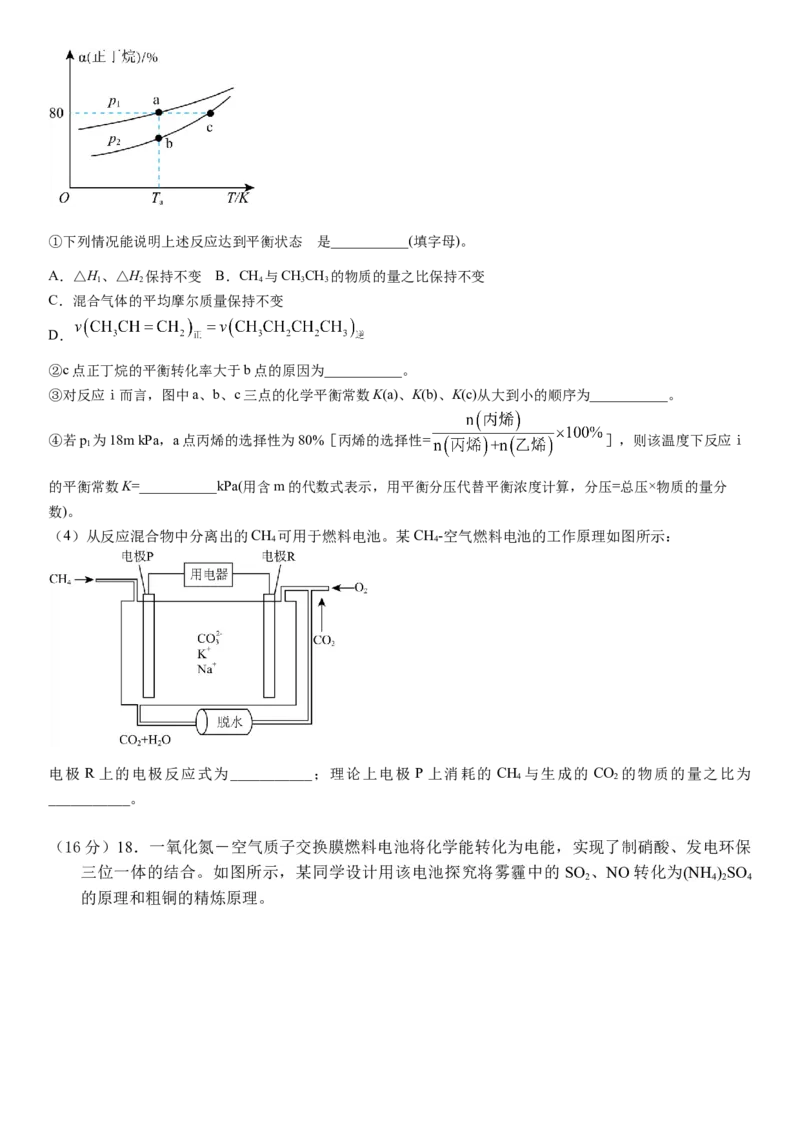
(3)将一定量的正丁烷通入某恒容密闭容器中,发生上述反应ⅰ和反应ⅱ,测得正丁烷的平衡转化率(a)与压强
(p)、温度(T)的关系如图所示。的
①下列情况能说明上述反应达到平衡状态 是___________(填字母)。
A.△H、△H 保持不变 B.CH 与CHCH 的物质的量之比保持不变
1 2 4 3 3
C.混合气体的平均摩尔质量保持不变
D.
②c点正丁烷的平衡转化率大于b点的原因为___________。
③对反应ⅰ而言,图中a、b、c三点的化学平衡常数K(a)、K(b)、K(c)从大到小的顺序为___________。
④若p 为18m kPa,a点丙烯的选择性为80%[丙烯的选择性= ],则该温度下反应ⅰ
1
的平衡常数K=___________kPa(用含m的代数式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分
数)。
(4)从反应混合物中分离出的CH 可用于燃料电池。某CH -空气燃料电池的工作原理如图所示:
4 4
电极 R 上的电极反应式为___________;理论上电极 P 上消耗的 CH 与生成的 CO 的物质的量之比为
4 2
___________。
(16分)18.一氧化氮-空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电环保
三位一体的结合。如图所示,某同学设计用该电池探究将雾霾中的 SO 、NO转化为(NH ) SO
2 4 2 4
的原理和粗铜的精炼原理。(1)燃料电池放电过程中负极的电极反应式 。
(2)乙装置中物质A是 (填化学式),理由是 ;电解过程
中阳极附近 pH (填“增大”“减小”或“不变”),阴极的电极反应式是
。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO 溶液的浓度将
4
(填“增大”、“减小”或“不变”)。
(4)若在标准状况下,甲装置有22.4 L O 参加反应,则乙装置中转化SO 和NO的物质的量共有
2 2
______mol;丙装置中阴极析出铜的质量为_____g。
(12分)19.I.(1) 设反应 ① Fe(s) + CO (g) FeO(s) + CO(g) 平衡常数为K ,反应②Fe(s)
2 1
+ H O(g) FeO(s) + H (g) 平衡常数为K ,在不同温度下,K 、K 的值如下:
2 2 2 1 2
T/K K K
1 2
973 1.47 2.38
1173 2.15 1.67
现有反应 ③ H (g) + CO (g) CO(g) + H O(g) 平衡常数为K
2 2 2 3
结合上表数据,根据反应①、②推导出 K 、K 、K 的关系式 K = _____________,反应③是
1 2 3 3
________(填“放”或“吸”)热反应。
II.将CO 转化为甲醇可以有效利用资源。原理为:CO +3H ⇌CH OH+H O
2 2 2 3 2
(1)一定温度下,若上述制备甲醇的反应在体积为2L的密闭容器中进行并保持温度不变,起始时投入
1 mol CO 、4mol H ,达到平衡时H 与CO 的物质的量之比为8:1,CO 的转化率是
2 2 2 2 2
(2)在其他条件不变的情况下,将体系体积压缩到原来的二分之一,下列有关该体系的说法不正确的是
a.甲醇的物质的量增加 b.重新平衡时n(H )/n(CH OH)增大
2 3
c.氢气的浓度减小 d.正反应速率增大,逆反应速率也增大
(3)若在温度为373K时,向体积为1L的密闭容器中,充入1 mol CO 和3molH ,反应过程中测得
2 2
CO 和CH OH(g)的浓度随时间的变化如图所示求此温度下该反应的平衡常数K= ,若开始时向该
2 3
容器中充1molCO ,2mo1H . 1.5molCH OH和1 molH O(g),则此时v(正) v(逆)(填“>”、“<”或
2 2 3 2
“=”)化学答案
1 2 3 4 5 6 7 8
D B B B D B B D
9 10 11 12 13 14 15
B C D C C A A
16 (11分)
I.(1)-882(2分)(2)KOH(aq)+1/2H SO (aq)=1/2K SO (aq)+H O(l) ΔH=-57.3kJ·mol-1(2
2 4 2 4 2
分)
II.(1) ①. > (1分) ②. (2分)
(2) ①. (2分) ②. -3267.5(2分)
17.(16分)
(1)a (1分) (2) ①. 异丁烷(1分) ②. > (2分)
(3)①. BD (2分) ②. 反应ⅰ和反应ⅱ均为吸热反应,升高温度,平衡正向移动,反应物的平衡转化率增
大(合理即可) (2分) ③. K(c)>K(a)=K(b)(2分) ④. 20.48m(2分)
(4) ①. O+4e-+2CO =2 (2分) ②. 1∶5(2分)
2 2
18.(16分)
(1)NO-3e-+2H O=NO -+4H+ (2分)
2 3
(2)H SO (2分);根据反应5SO +2NO+8H O (NH ) SO +4H SO ,产物中除有(NH ) SO 外还有H SO
2 4 2 2 4 2 4 2 4 4 2 4 2 4
(或阳极的电极反应为SO -2e-+2H O= SO 2-+4H+,故A为H SO )(2分);
2 2 4 2 4
减小(2分);NO+5e-+6H+=NH ++H O(2分)
4 2
(3)减小 (2分)
(4)2.8 (2分) 128(2分)
19.(12分) I.(1)K /K (2分) 吸 (2分)
1 2
II(1)80%(2分);(2) bc (2分);(3) (或5.3,不要求书写单位)(2分); >
(2分) ;