文档内容
2024—2025 学年度第一学期高二第一次月考试题
化 学
(考试时间:90分钟;满分:100分)
可能用到的相对原子质量:N—14 O—16 Cu—64
第Ⅰ卷 选择题(共40分)
一、单项选择题(本题包括8小题,每小题只有一个选项符合题意。每小题2分,共
16分)
1.按物质组成分类,KAl(SO ) •12H O属于( )
4 2 2
A.酸 B.碱 C.盐 D.混合物
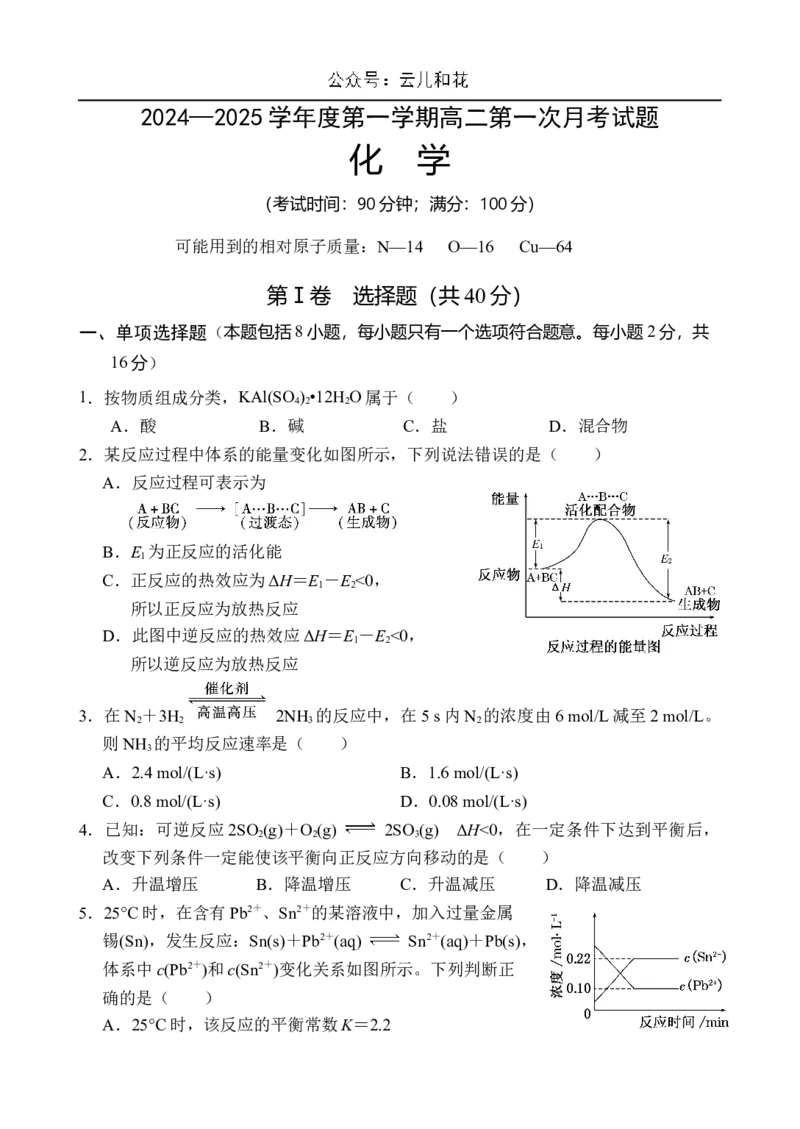
2.某反应过程中体系的能量变化如图所示,下列说法错误的是( )
A.反应过程可表示为
B.E 为正反应的活化能
1
C.正反应的热效应为ΔH=E -E <0,
1 2
所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E -E <0,
1 2
所以逆反应为放热反应
3.在N +3H 2NH 的反应中,在5 s内N 的浓度由6 mol/L减至2 mol/L。
2 2 3 2
则NH 的平均反应速率是( )
3
A.2.4 mol/(L·s) B.1.6 mol/(L·s)
C.0.8 mol/(L·s) D.0.08 mol/(L·s)
4.已知:可逆反应2SO (g)+O (g) 2SO (g) ΔH<0,在一定条件下达到平衡后,
2 2 3
改变下列条件一定能使该平衡向正反应方向移动的是( )
A.升温增压 B.降温增压 C.升温减压 D.降温减压
5.25°C时,在含有Pb2+、Sn2+的某溶液中,加入过量金属
锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),
体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正
确的是( )
A.25°C时,该反应的平衡常数K=2.2B.往平衡体系中加入金属铅后,c(Pb2+)增大
C.往平衡体系中加入少量Sn(NO ) 固体后,c(Pb2+)变小
3 2
D.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
6 . 已 知 : 2Zn(s) + O (g)===2ZnO(s) ΔH = - 701.0 kJ·mol - 1 ; 2Hg(l) +
2
O (g)===2HgO(s) ΔH=-181.6 kJ·mol-1。则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)
2
的ΔH为( )
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-519.4 kJ·mol-1 D.-259.7 kJ·mol-1
7.锂水电池以金属锂和钢板为电极材料,以 LiOH为电解质,使用时加入水即可放电。
关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成
C.放电时OH-向正极移动 D.总反应为:2Li+2H O===2LiOH+H ↑
2 2
8.常温时,下列叙述正确的是( )
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH Cl至溶液恰好无色,则此时溶液的pH<7
4
C.将pH=5的盐酸加水稀释1000倍,稀释后盐酸的pH=8.0
D.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶
液的pH=11
二、不定项选择题(本题包括6小题,每小题有1-2个选项符合题意。每小题4分,
共24分。若该小题有两个正确选项,只选一个且正确得2分,多选错选不得分。)
9.有关①100 mL 0.1 mol/L NaHCO 、②100 mL 0.1 mol/L Na CO 两种溶液的叙述不
3 2 3
正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO)>c(H CO )
2 3
D.②溶液中:c(HCO)>c(H CO )
2 3
10.根据下图,可判断出下列离子方程式中错误的是( )
A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s)
B.Co(s)+Cd2+(aq)===Co2+(aq)+Cd(s)
C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq)
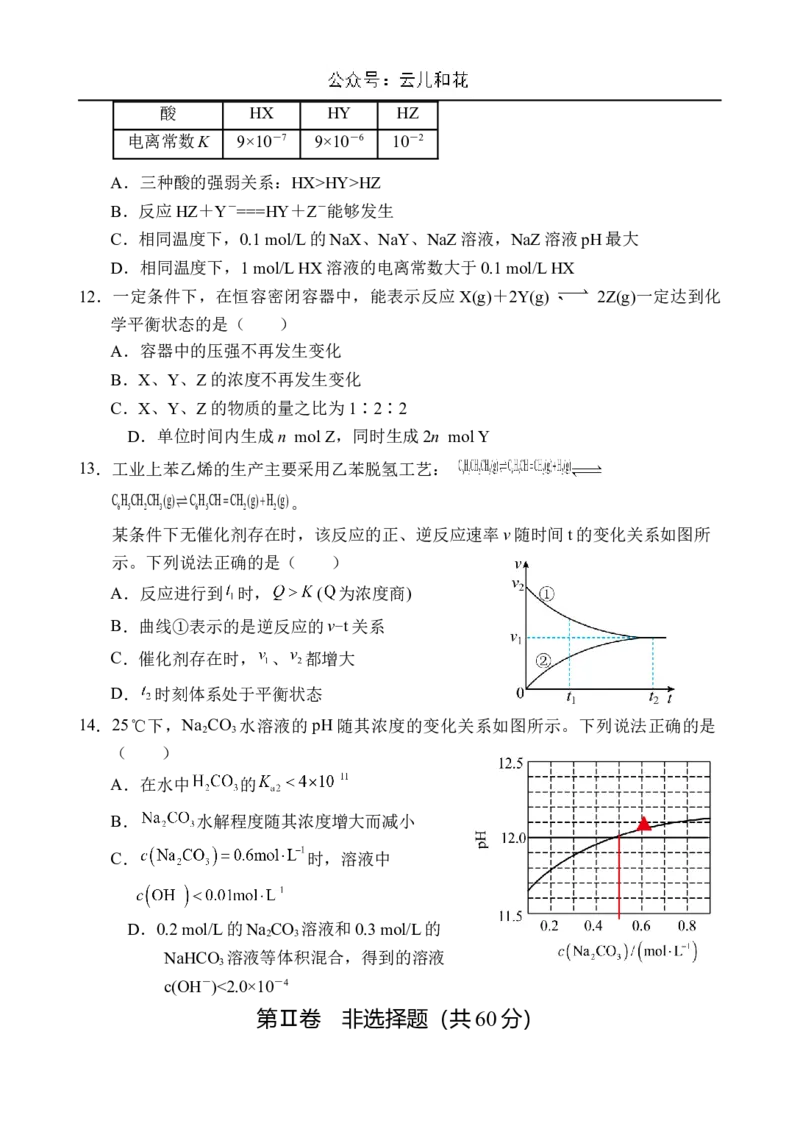
11.相同温度下,根据三种酸的电离常数,下列判断正确的是( )酸 HX HY HZ
电离常数K 9×10-7 9×10-6 10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX
12.一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化
学平衡状态的是( )
A.容器中的压强不再发生变化
B.X、Y、Z的浓度不再发生变化
C.X、Y、Z的物质的量之比为1∶2∶2
D.单位时间内生成n mol Z,同时生成2n mol Y
13.工业上苯乙烯的生产主要采用乙苯脱氢工艺:
C
6
H
5
CH
2
CH
3
(g)
C
6
H
5
CHCH
2
(g)H
2
(g)。
某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所
示。下列说法正确的是( )
A.反应进行到 时, ( 为浓度商)
B.曲线①表示的是逆反应的v-t关系
C.催化剂存在时, 、 都增大
D. 时刻体系处于平衡状态
14.25℃下,Na CO 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
2 3
( )
A.在水中 的
B. 水解程度随其浓度增大而减小
C. 时,溶液中
D.0.2 mol/L的Na CO 溶液和0.3 mol/L的
2 3
NaHCO 溶液等体积混合,得到的溶液
3
c(OH-)<2.0×10-4
第Ⅱ卷 非选择题(共60分)三、填空题。
15. (12分)无水FeCl 常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以
3
废铁屑(含有少量碳和SiO 杂质)为原料制备无水FeCl (s)。
2 3
已知:氯化亚砜( )熔点-101℃,沸点76℃,易水解。
回答问题:
(1)操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和 。
(2)为避免引入新的杂质,试剂B可以选用 (填编号)。
a. KMnO 溶液 b. Cl 水 c. Br 水 d. H O 溶液
4 2 2 2 2
(3)操作②是蒸发结晶,加热的同时通入HCl(g)的目的是 。
(4)取少量D晶体,溶于水并滴加KSCN溶液,现象是 。
(5)反应D→E的化学方程式为 。
(6)由D转化成E的过程中可能产生少量亚铁盐,可能的还原剂是 ,并
设计实验验证是该还原剂将Fe3+还原 。
16.(12分)碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知
25℃,100kPa时:
①1mol葡萄糖[C H O (s)]完全燃烧生成CO (g)和H O(1),放出2804kJ热量。
6 12 6 2 2
② CO(g)+ O (g)=CO (g) Δ H=-283 kJ•mol-1
2 2
回答问题
(1)25℃时,CO (g)与H O(l)经光合作用生成葡萄糖[C H O (s)]和O (g)的热化学方
2 2 6 12 6 2
程式为 。
(2)25℃,100kPa时,气态分子断开1mol化学键的焓变称为键焓。已知O=O、
C=O键的键焓分别为495 kJ•mol-1、799kJ•mol-1,CO(g)分子中碳氧键的键焓
为 kJ•mol-1。
(3)溶于水的CO 只有部分转化为H CO (aq),大部分以水合CO 的形式存在,水
2 2 3 2
合CO 可用CO (aq)表示。已知25℃时,H CO (aq) CO (aq)+H O(l)的平
2 2 2 3 2 2衡常数K=600,正反应的速率可表示为v(H CO )=k c(H CO ),逆反应的速率可
2 3 1• 2 3
表示为v(CO )=k c(CO ),则k = (用含k 的代数式表示)。
2 2• 2 2 1
(4)25℃时,潮湿的石膏雕像表面会发生反应:
CaSO (s)+CO 2-(aq) CaCO (s)+SO 2-(aq)
4 3 3 4
其平衡常数K= 。[已知 Ksp(CaSO )=9.1×10-6 ,Ksp(CaCO )=2.8×10-9]
4 3
(5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石
有破坏作用,从化学平衡的角度说明其原因 。
17. (13分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I−),实验过程包括准备标准溶
液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO 基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在
3
棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L−1 NH SCN标准溶液,备用。
4
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L−1 AgNO 溶液(过量),使I−完全转化为AgI沉淀。
3
c.加入NH Fe(SO ) 溶液作指示剂。
4 4 2
d.用0.1000 mol·L−1 NH SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN
4
沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 1 2 3
消耗NH SCN标准溶液体积/mL 10.24 10.02 9.98
4
f.数据处理。
回答下列问题:
(1)将称得的AgNO 配制成标准溶液,所使用的玻璃仪器除烧杯和玻璃棒外还有
3
________、________。
(2)AgNO 标准溶液放在棕色试剂瓶中避光保存的原因是___________________。
3
(3)滴定应在pH<0.5的条件下进行,其原因是___________________________。
(4)b和c两步操作是否可以颠倒___________,说明理由___________________。(5)所消耗的 NH SCN 标准溶液平均体积为_____mL,测得 c(I−)=_______
4
mol·L−1。
(6)在滴定管中装入NH SCN标准溶液的前一步,应进行的操作为_____________。
4
(7)若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____________。
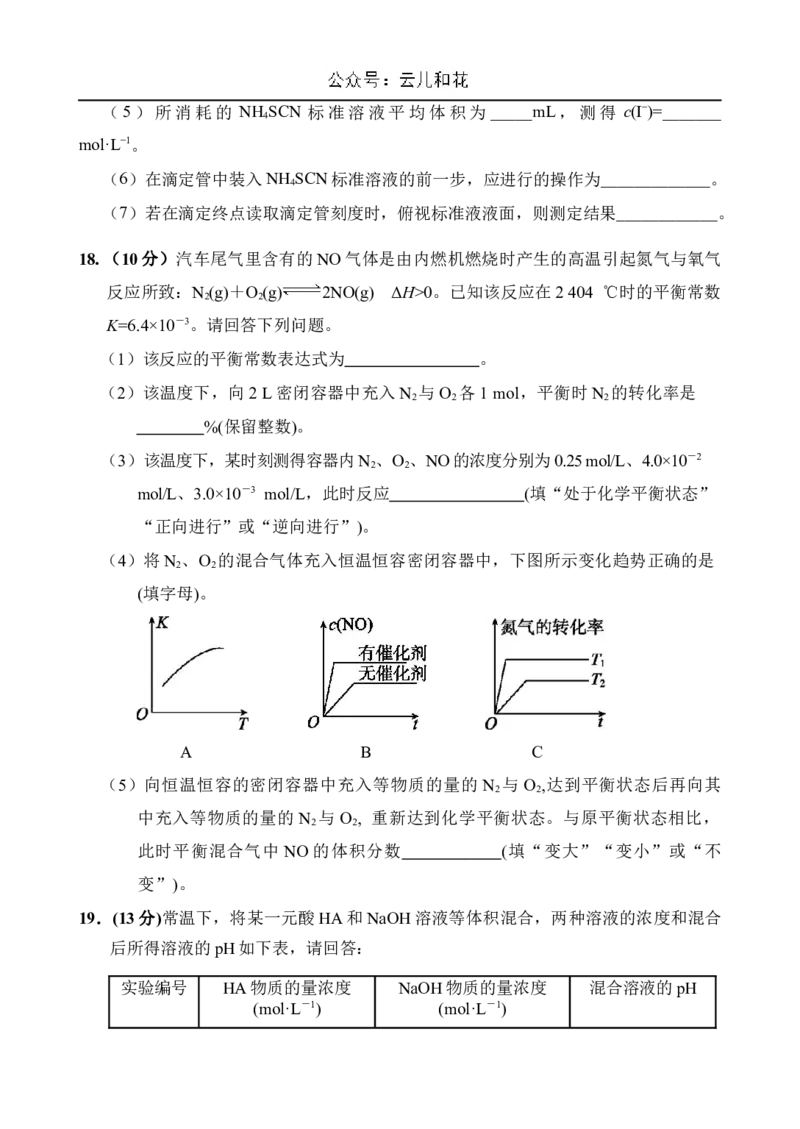
18.(10分)汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气与氧气
反应所致:N (g)+O (g) 高 2NO(g) ΔH>0。已知该反应在2 404 ℃时的平衡常数
2 2
K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2 L密闭容器中充入N 与O 各1 mol,平衡时N 的转化率是
2 2 2
%(保留整数)。
(3)该温度下,某时刻测得容器内N 、O 、NO的浓度分别为0.25 mol/L、4.0×10-2
2 2
mol/L、3.0×10-3 mol/L,此时反应 (填“处于化学平衡状态”
“正向进行”或“逆向进行”)。
(4)将N 、O 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
2 2
(填字母)。
A B C
(5)向恒温恒容的密闭容器中充入等物质的量的N 与O ,达到平衡状态后再向其
2 2
中充入等物质的量的 N 与O , 重新达到化学平衡状态。与原平衡状态相比,
2 2
此时平衡混合气中NO的体积分数 (填“变大”“变小”或“不
变”)。
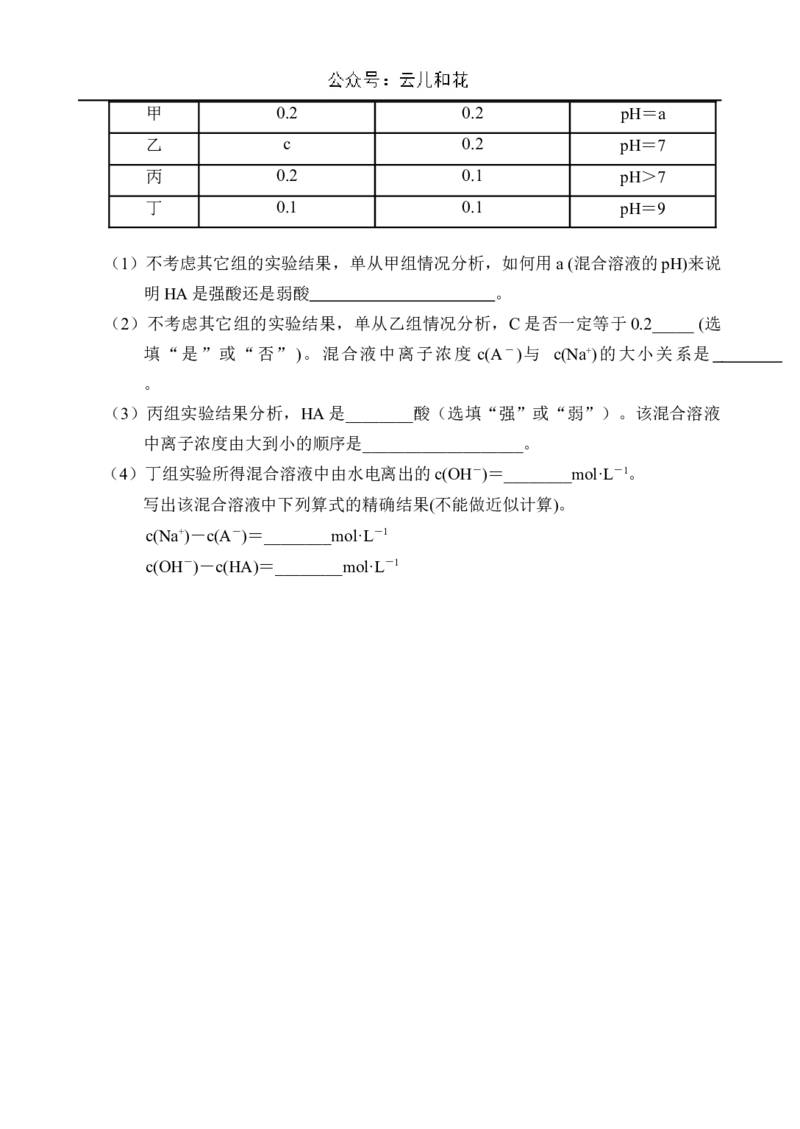
19.(13分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合
后所得溶液的pH如下表,请回答:
实验编号 HA物质的量浓度 NaOH物质的量浓度 混合溶液的pH
(mol·L-1) (mol·L-1)甲 0.2 0.2 pH=a
乙 c 0.2 pH=7
丙 0.2 0.1 pH>7
丁 0.1 0.1 pH=9
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说
明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2_____ (选
填“是”或“否”)。混合液中离子浓度 c(A-)与 c(Na+)的大小关系是
。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液
中离子浓度由大到小的顺序是___________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1
c(OH-)-c(HA)=________mol·L-12024—2025 学年度第一学期高二第一次月考答案
化 学
第Ⅰ卷 选择题(共40分)
一、单项选择题(本题包括8小题,每小题只有一个选项符合题意。每小题2分,共
16分)
题号 1 2 3 4 5 6 7 8
答案 C D B B A D C D
二、不定项选择题(本题包括6小题,每小题有1-2个选项符合题意。每小题4分,
共24分。若该小题有两个正确选项,只选一个且正确得2分,多选错选不得分。)
题号 9 10 11 12 13 14
答案 C AB B AB CD BD
第Ⅱ卷 非选择题(共60分)
三、填空题。
15.(除标注外,每空2分,共12分)
(1)漏斗(1分)
(2)bd
(3)抑制FeCl 的水解
3
(4)溶液变红(1分)
△
(5)FeCl ·6H O + 6SOCl ===FeCl + 6SO ↑+ 12HCl↑
3 2 2 3 2
(6)SO 向FeCl 溶液中通入足量的SO ,溶液由黄色变为浅绿色,再向溶液中
2 3 2
滴加1-2滴KSCN溶液,溶液不变红,证明Fe3+可被SO 还原成Fe2+。(合理
2
酌情给分)
16.(除标注外,每空2分,共12分)
(1)6CO (g) + 6H O(l) == C H O (s) + 6O (g) △H = +2804kJ/mol
2 2 6 12 6 2
(2)1067.5
(3)k = k /600
2 1
(4)3250(5)游客呼出的 CO 可与钟乳石主要成分 CaCO 发生可逆反应:CO + H O +
2 3 2 2
CaCO Ca(HCO ) ,CO 增加,平衡正向移动,CaCO 减少,钟乳石被坏
3 3 2 2 3
(各2分,共4分)
17.(除标注外,每空1分,共13分)
(1)250 mL(棕色)容量瓶 胶头滴管
(2)避免AgNO 见光分解
3
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能) 若颠倒,Fe3+与I−反应,指示剂耗尽,无法判断滴定终点
(5)10.00 0.0600(2分)
(6)用NH SCN标准溶液进行润洗(2分)
4
(7)偏高(2分)
18.(每空2分,共10分)
(1)K= (2)4
(3)正向进行 (4)AC
(5)不变
19.(除标注外,每空2分,共13分)
(1)若a=7,则HA是强酸;若a>7, 则HA是弱酸(酌情给分)
(2)否(1分) c(A-)=c(Na+)(1分)
(3)弱(1分)
c(Na+)>c(A-)>c(OH-)>c(H+) (如果离子写不完全且大小关系正确给1分)
(4)10-5 10-5-10-9 10-9