文档内容
2021 年北京市初中学业水平考试
化学试卷
可能用到的相对原子质量:C-12 O-16 Zn-65
第一部分
本部分共25题,每题1分,共25分。在每题列出的四个选项中,选出最符合题目要求的一
项。
1. 空气的成分中,体积分数约占78%的是
A. 氮气 B. 氧气 C. 二氧化碳 D. 稀有气体
【答案】A
2. 下列物质在O 中燃烧,火星四射,生成黑色固体的是
2
A. 木炭 B. 镁条 C. 蜡烛 D. 铁丝
【答案】D
3. 将CO 通入下列液体中,能产生白色沉淀的是
2
A. 水 B. 稀硫酸 C. 食盐水 D. 澄清石灰水
【答案】D
4. 下列物质能用作氮肥的是
A. KCl B. KCO C. NH Cl D. Ca (PO )
2 3 4 3 4 2
【答案】C
5. 下列物质属于氧化物的是
A. O B. CaO C. HSO D. KMnO
2 2 4 2
【答案】B
6. 下列仪器不能加热的是
A. 烧杯 B. 试管 C. 量筒 D. 燃烧匙
【答案】C
7. 下列物质含有氢分子的是
A. Ca(OH) B. HCO C. HO D. H
2 2 3 2 2 2
【答案】D
8. 下列物质能除铁锈的是
A. 盐酸 B. 植物油 C. NaOH溶液 D. 食盐水
【答案】A
9. 电解水实验如图,下列说法不正确的是A. 试管1中得到H B. 水由H、O 构成
2 2 2
C. 水发生了分解反应 D. 水由氢、氧元素组成
【答案】B
10. 下列元素中,人体摄入过低会引起贫血的是
A. 铁 B. 碘 C. 锌 D. 钙
【答案】A
11. 如图所示的图标表示
A. 禁止吸烟 B. 禁止燃放鞭炮
C. 禁止带火种 D. 禁止堆放易燃物
【答案】B
12. 下列H 的性质中,属于化学性质的是
2
A. 难溶于水 B. 无色气体 C. 能燃烧 D. 熔点低
【答案】C
13. 下表列出了某果仁的营养分,其中含量最高的营养素是
项目 每100g
蛋白质 13.2g
脂肪 70.1g
碳水化合物 13.0g
钠 216mg
A. 蛋白质 B. 糖类 C. 油脂 D. 无机盐
【答案】C14. 一些物质的pH范围如下,其中呈碱性的是
A. 柠檬汁(2-3) B. 酱油(4-5) C. 西瓜汁(5-6) D. 洗发水(8-9)
【答案】D
15. 下列物质属于有机化合物的是
A. NaCl B. NaOH C. HCl D. CH
4
【答案】D
我国冶炼金属的历史悠久、回答问题。
16. 远古时期火法炼铜的原料是孔雀石【主要成分为Cu (OH)CO】,组成Cu (OH)CO 的元素种类
2 2 3 2 2 3
为
A. 3种 B. 4种 C. 5种 D. 6种
17. 块炼铁以炭和铁矿石为原料,反应之一为 ,该反应中,化合价降低的元
素是
A. 铁元素 B. 碳元素 C. 氧元素 D. 铁元素和碳元素
18. 冶炼钛(Ti)的反应之一为 ,该反应属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
【答案】16. B 17. A 18. C
制作景泰蓝的釉料中常含钴元素。钴元素在元素周期表中的信息如下图。回答问题。
19. 下列有关钴元素的说法不正确的是
A. 原子序数是27 B. 属于非金属元素
C. 元素符号是Co D. 相对原子质量为58.93
20. 钴原子的核外电子数是
A. 27 B. 32 C. 59 D. 86
【答案】19. B 20. A用MgCl 溶液喷洒路面可融雪、防尘。20℃时,按下表数据配制溶液,回答问题。
2
序号 ① ② ③ ④
MgCl 的质量/g 30 40 50 60
2
水 的质量/g 100 100 100 100
(已知:20℃时,MgCl 的溶解度为54.6g)
2
21. 所得溶液中,溶质与溶剂的质量比为1:2的是
A. ① B. ② C. ③ D. ④
22. ①中溶质的质量分数约为
A. 23% B. 30% C. 35% D. 43%
23. 所得溶液中,属于饱和溶液的是
A. ① B. ② C. ③ D. ④
【答案】21. C 22. A 23. D
24. 用下图装置可验证空气中O 的含量。下列现象能表明O 含量的是
2 2
A. 集气瓶中产生大量白烟 B. 红磷燃烧一段时间后熄灭
C. 烧杯中的水倒吸进入集气瓶 D. 集气瓶中水面最终上升至1处
【答案】D
25. 实验研究铁锈蚀影响因素,记录如下、下列分析不正确的是
实验装置 序号 其他试剂 100s时O 的含量
2
① 干燥剂 21%
② 10滴水 15%
③ 10滴水和1.0g食盐 8%
A. ②③中O 含量减少表明铁已锈蚀 B. ①②证明水对铁锈蚀有影响
2
C. ②③证明食盐能加快铁锈蚀 D. ①②③证明炭粉对铁锈蚀有影响【答案】D
第二部分
本部分共14题,共45分。
【生活观象解释】
26. 从A或B两题中任选一个作答,若两题均作答,按A计分。
A NaHCO 的用途之一是______。 B NaHCO 的俗名是______。
3 3
【答案】 ①. 治疗胃酸过多 ②. 小苏打
27. 我国提出2060年前实现碳中和,彰显了负责任大国的作为与担当。
(1)现阶段的能源结构仍以化石燃料为主,化石燃料包括煤、______和天然气。
(2)下列燃料在O 中燃烧时,不会产生CO 的是______(填序号)。
2 2
A.天然气 B.氢气 C.肼(NH)
2 4
(3)捕集、利用和封存CO 是实现碳中和的一种途径。矿物质碳化封存的反应之一是氧化镁与CO 反应
2 2
生成碳酸镁,该反应的化学方程式为______。
【答案】 ①. 石油 ②. BC ③. MgO+CO =MgCO
2 3
28. HO 溶液常用作的消毒剂。
2 2
(1)HO 溶液属于______(填“混合物”或“纯净物”)。
2 2
(2)HO 不稳定,易分解。HO 分解的化学方程式为______。
2 2 2 2
(3)用3%的HO 溶液对不同金属进行腐蚀性实验,结果如下:
2 2
金属种类 不锈钢片 铝片 铜片
腐蚀速度(mg/h) 0.001 0.010 0.404
下列金属制品用该溶液浸泡消毒时,最易被腐蚀的是______(填序号)。
A.不锈钢锅 B.铝盆 C.铜火锅
【答案】 ①. 混合物 ②. ③. C
【科普阅读理解】
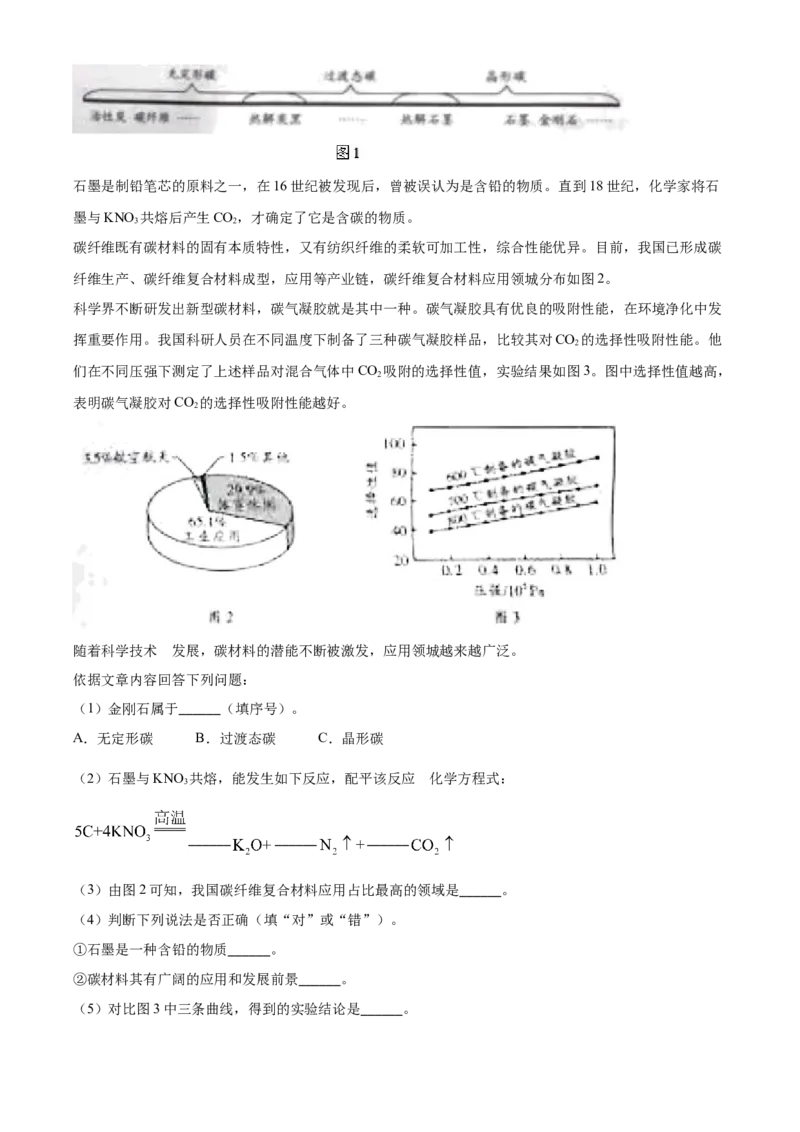
29. 阅读下面科普短文。
碳元素是人类接触和利用最早的元素之一。由碳元素组成的单质可分为无定形碳、过液态碳和晶形碳三大
类,如图1。石墨是制铅笔芯的原料之一,在16世纪被发现后,曾被误认为是含铅的物质。直到18世纪,化学家将石
墨与KNO 共熔后产生CO,才确定了它是含碳的物质。
3 2
碳纤维既有碳材料的固有本质特性,又有纺织纤维的柔软可加工性,综合性能优异。目前,我国已形成碳
纤维生产、碳纤维复合材料成型,应用等产业链,碳纤维复合材料应用领城分布如图2。
科学界不断研发出新型碳材料,碳气凝胶就是其中一种。碳气凝胶具有优良的吸附性能,在环境净化中发
挥重要作用。我国科研人员在不同温度下制备了三种碳气凝胶样品,比较其对CO 的选择性吸附性能。他
2
们在不同压强下测定了上述样品对混合气体中CO 吸附的选择性值,实验结果如图3。图中选择性值越高,
2
表明碳气凝胶对CO 的选择性吸附性能越好。
2
随着科学技术 的发展,碳材料的潜能不断被激发,应用领城越来越广泛。
依据文章内容回答下列问题:
(1)金刚石属于______(填序号)。
A.无定形碳 B.过渡态碳 C.晶形碳
的
(2)石墨与KNO 共熔,能发生如下反应,配平该反应 化学方程式:
3
。
______ ______ ______
(3)由图2可知,我国碳纤维复合材料应用占比最高的领域是______。
(4)判断下列说法是否正确(填“对”或“错”)。
①石墨是一种含铅的物质______。
②碳材料其有广阔的应用和发展前景______。
(5)对比图3中三条曲线,得到的实验结论是______。【答案】 ①. C ②. 2 ③. 2 ④. 5 ⑤. 工业应用 ⑥. 错 ⑦. 对 ⑧. 温度越低,压强越大,
碳气凝胶对CO 的选择性吸附性能越好
2
【生产实际分析】
30. 真空热还原法生产钙的主要转化过程如下:
(1)石灰石的主要成分是______。
(2)Ⅱ中反应有两种产物,固体X一定含有氧元素和铝元素,从元素守恒角度说明理由______。
(3)装置中发生的是______(填“物理”或“化学”)变化。
【答案】 ①. 碳酸钙 ②. 反应前有钙元素、氧元素和铝元素,产生了钙,所以固体X中一定有氧元
素和铝元素 ③. 物理
31. 高纯CO可用于半导体领域某些芯片的刻蚀,利用甲酸(HCOOH)制取高纯CO的主要流程如下:
(1)甲酸中碳元素和氧元素的质量比为______。
(2)反应塔中甲酸分解的微现示意图如下,在方框中补全另一种产物的微粒图示____。
(3)反应塔中发生副反应产生微量CO。洗涤器中加入NaOH溶液的目的是中和未反应的甲酸蒸气,并除
2
去CO,NaOH与CO 反应的化学方程式为______。
2 2
【答案】 ①. 3:8 ②. ③.
【基本实验及其原理分析】
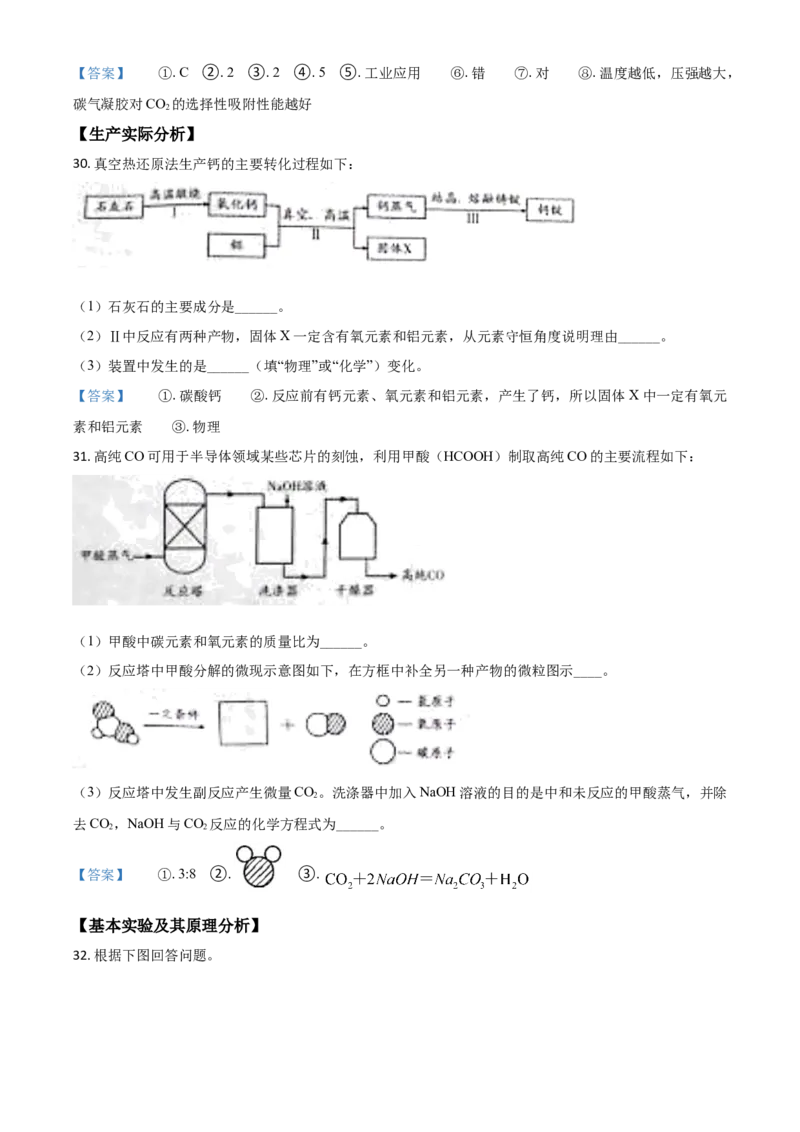
32. 根据下图回答问题。(1)仪器a的名称是______。
(2)加热KMnO 制取O 的化学方程式为______。
4 2
(3)收集O 的装置是______(填序号)。
2
的
(4)将带火星 木条放在瓶口,若观察到______,说明瓶中已充满O。
2
【答案】 ①. 酒精灯 ②. ③. B ④. 木条复燃
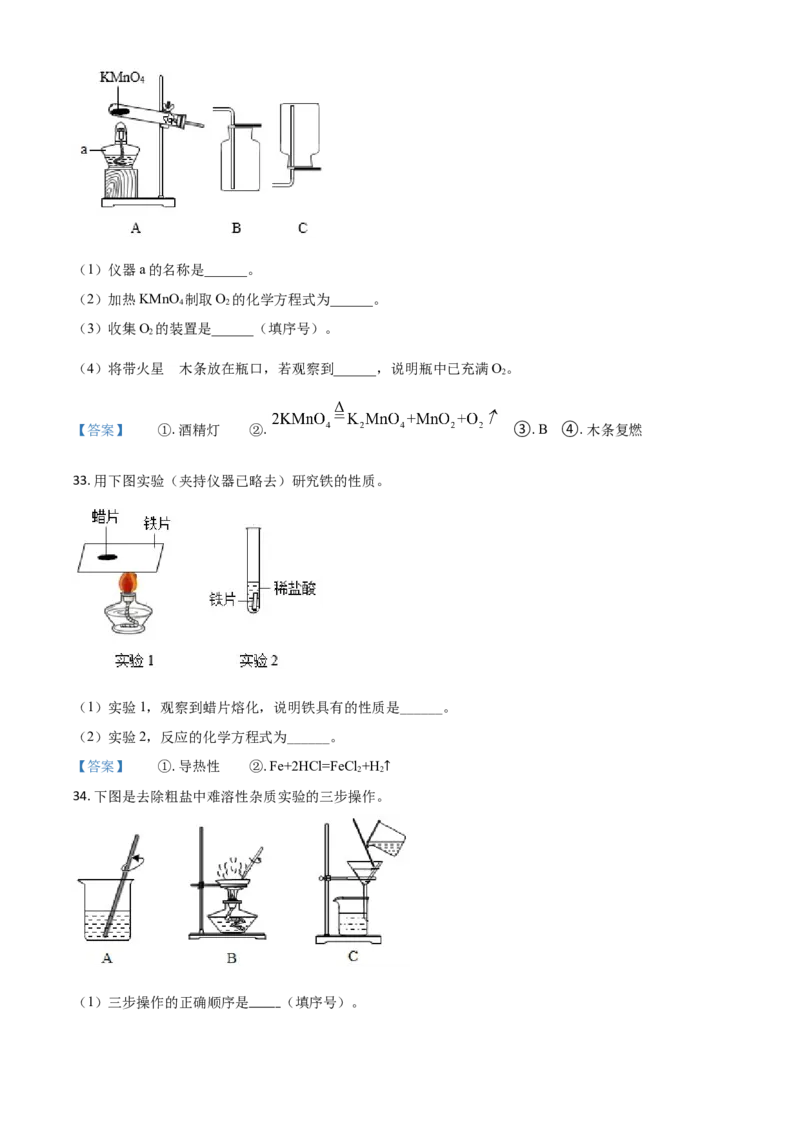
33. 用下图实验(夹持仪器已略去)研究铁的性质。
(1)实验1,观察到蜡片熔化,说明铁具有的性质是______。
(2)实验2,反应的化学方程式为______。
【答案】 ①. 导热性 ②. Fe+2HCl=FeCl +H
2 2
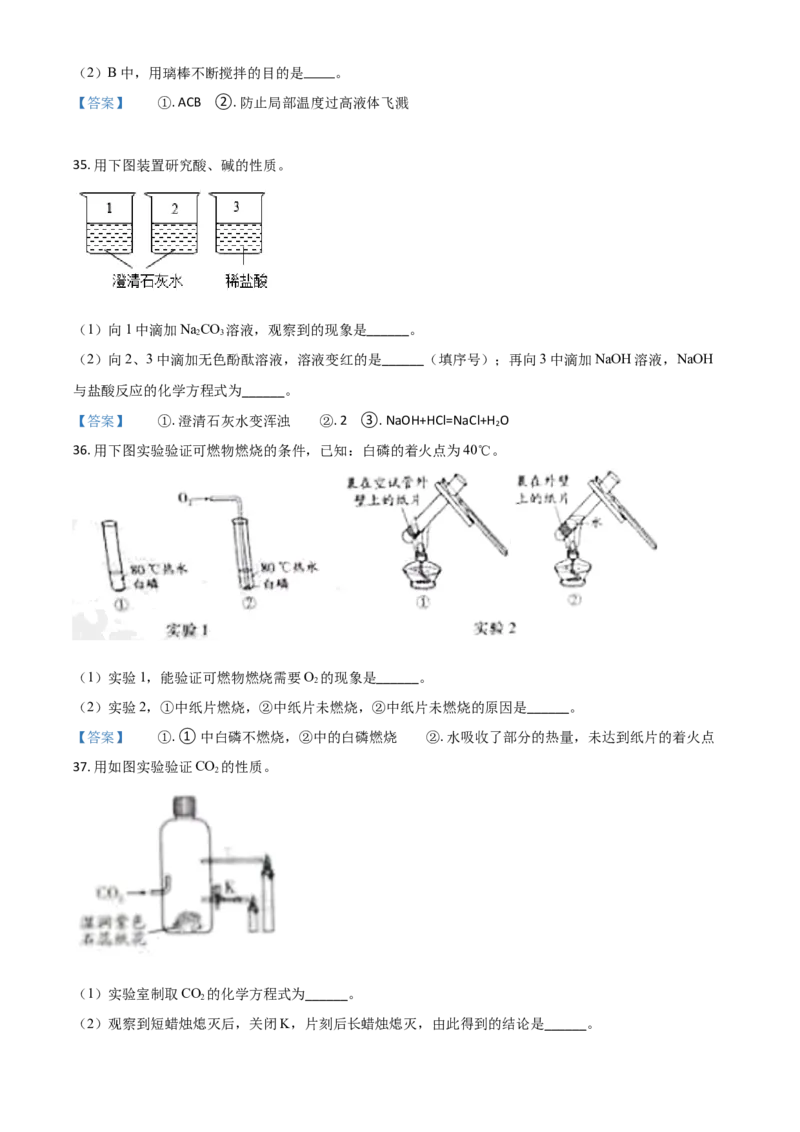
34. 下图是去除粗盐中难溶性杂质实验的三步操作。↑
(1)三步操作的正确顺序是 (填序号)。
______(2)B中,用璃棒不断搅拌的目的是 。
【答案】 ①. ACB ②. 防止局部温__度__过__高液体飞溅
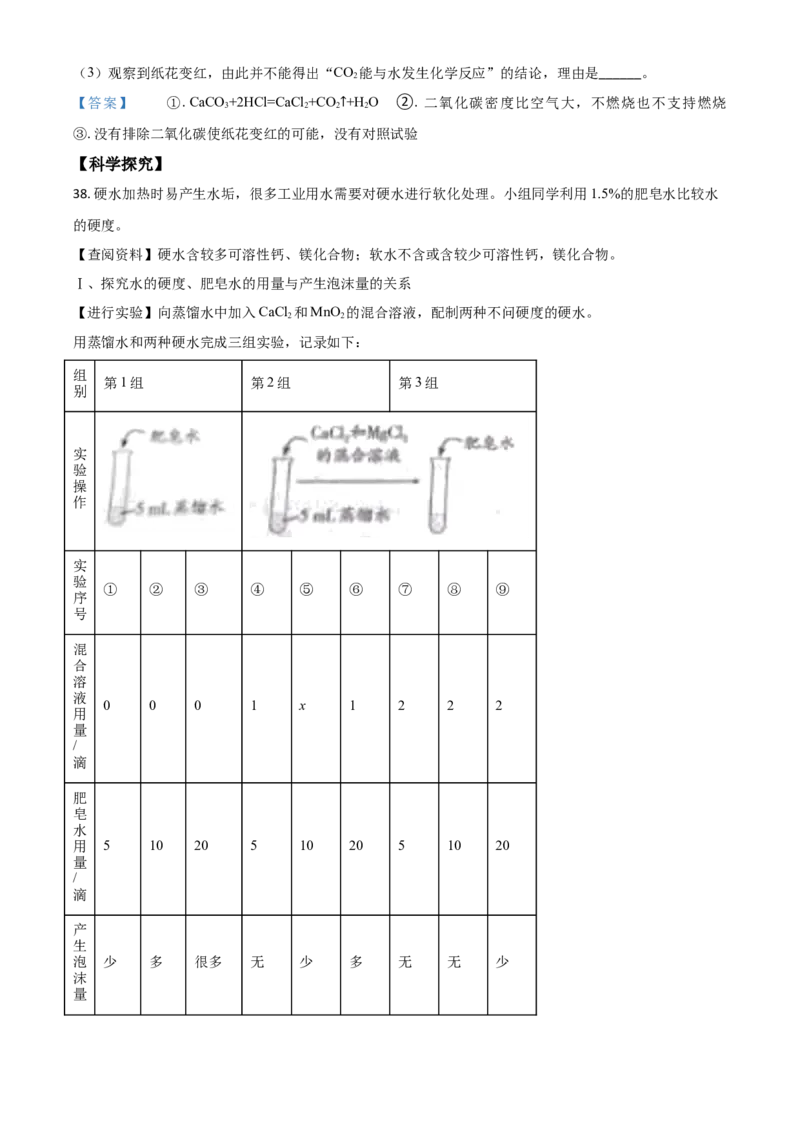
35. 用下图装置研究酸、碱的性质。
(1)向1中滴加NaCO 溶液,观察到的现象是______。
2 3
(2)向2、3中滴加无色酚酞溶液,溶液变红的是______(填序号);再向3中滴加NaOH溶液,NaOH
与盐酸反应的化学方程式为______。
【答案】 ①. 澄清石灰水变浑浊 ②. 2 ③. NaOH+HCl=NaCl+H O
2
36. 用下图实验验证可燃物燃烧的条件,已知:白磷的着火点为40℃。
(1)实验1,能验证可燃物燃烧需要O 的现象是______。
2
(2)实验2,①中纸片燃烧,②中纸片未燃烧,②中纸片未燃烧的原因是______。
【答案】 ①. ①中白磷不燃烧,②中的白磷燃烧 ②. 水吸收了部分的热量,未达到纸片的着火点
37. 用如图实验验证CO 的性质。
2
(1)实验室制取CO 的化学方程式为______。
2
(2)观察到短蜡烛熄灭后,关闭K,片刻后长蜡烛熄灭,由此得到的结论是______。(3)观察到纸花变红,由此并不能得出“CO 能与水发生化学反应”的结论,理由是______。
2
【答案】 ①. CaCO +2HCl=CaCl +CO +H O ②. 二氧化碳密度比空气大,不燃烧也不支持燃烧
3 2 2 2
③. 没有排除二氧化碳使纸花变红的可能,没↑有对照试验
【科学探究】
38. 硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。小组同学利用1.5%的肥皂水比较水
的硬度。
【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙,镁化合物。
Ⅰ、探究水的硬度、肥皂水的用量与产生泡沫量的关系
【进行实验】向蒸馏水中加入CaCl 和MnO 的混合溶液,配制两种不问硬度的硬水。
2 2
用蒸馏水和两种硬水完成三组实验,记录如下:
组
第1组 第2组 第3组
别
实
验
操
作
实
验
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
序
号
混
合
溶
液
0 0 0 1 x 1 2 2 2
用
量
/
滴
肥
皂
水
用 5 10 20 5 10 20 5 10 20
量
/
滴
产
生
泡 少 多 很多 无 少 多 无 无 少
沫
量【解释与结论】
(1)对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是______。
(2)设计第2组实验时,为控制水的硬度相同,⑤中x应为______。
(3)第2组实验的目的是______。
(4)由上述三组实验得到的结论是______。
Ⅱ、比较不同水样的硬度
【进行实验】用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量。
实验操作 水样 肥皂水用量/滴
市售纯净水 2
煮沸后的自来水 6
自来水 9
湖水 14
【解释与结论】
(5)硬度最大的水样是______。
(6)由上述实验可知,能将自来水硬度降低的方法有______。
(7)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为______。
【答案】 ①. 产生泡沫多少 ②. 1 ③. 第2组实验以肥皂水为变量,探究肥皂水多少与产生泡沫量
的关系 ④. 硬水中加肥皂水泡沫少,软水中加肥皂水泡沫多 ⑤. 湖水 ⑥. 煮沸 ⑦. 另取相同
量山泉水,滴加肥皂水记录产生泡沫所需肥皂水量,大于自来水所需肥皂水量,说明山泉水硬度大于自来
水
【实际应用定量计算】
39. 《天工开物》中记载了金属的冶炼技术。在锌的冶炼方法中,主要反应之一为
。若制得65kgZn,计算参加反应的ZnO的质量(写出计算过程及结果)。
【答案】81kg
解:设参加反应氧化锌质量为x。x=81kg
答:参加反应的ZnO的质量81kg。