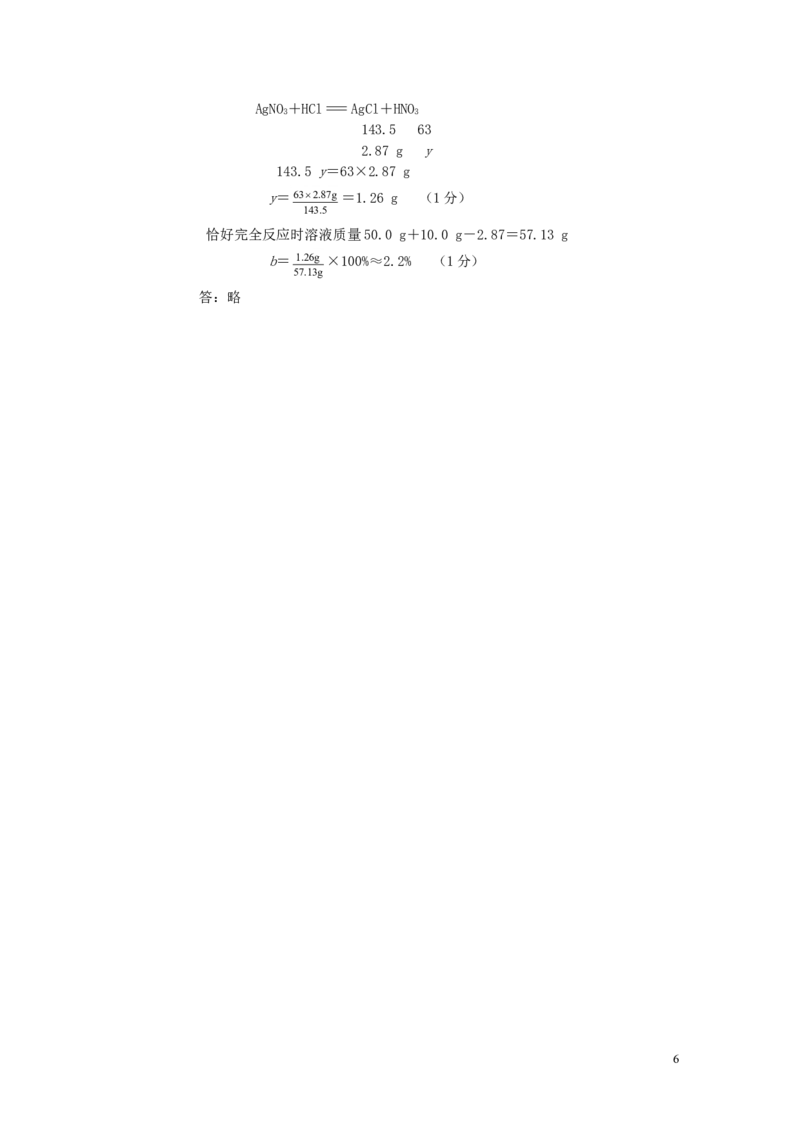文档内容
化学部分
一、选择题(本大题包括7小题,每小题3分,共21分;每小题只有一个选项符合题意)
1.化学与生活密切相关,从化学的角度认识生活中的问题,下列说法正确的是
A.地沟油经化学方法处理制成航空燃油,实现变废为宝
B.食品添加剂符合国家许可,制作食品过程中可随意添加
C.脂肪、糖类、动物蛋白都是人体必须的营养素,吃得越多越好
D.生活污水不是化工废水,可向江河湖泊里任意排放
2.下列有关概念应用的判断正确的是
A.CO 、Fe O、HSO 、O 等都含氧元素,都属于氧化物
2 2 3 2 3 2
B.可燃物与氧气发生的氧化反应都属于燃烧反应
C.生铁和钢都与铁的性质有所不同,都属含碳量不同的铁合金
D.凡是生成盐和水的化学反应都是中和反应
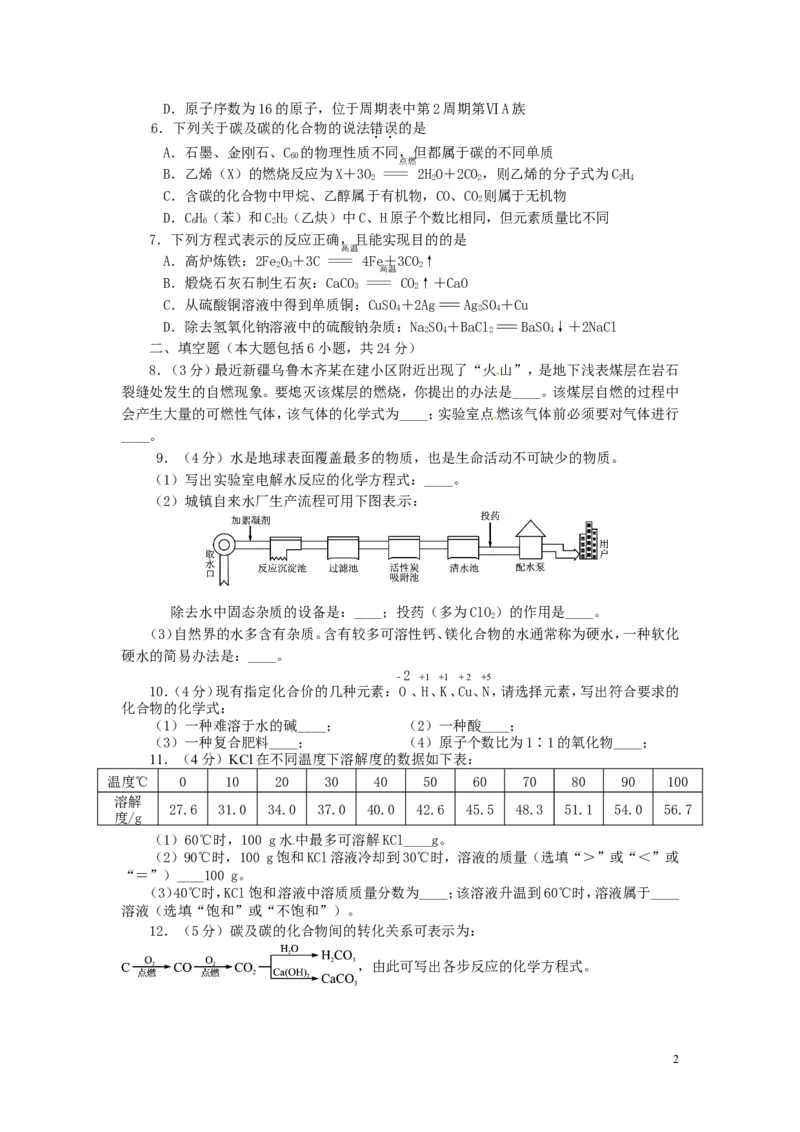
3.下列化学实验不能实现实验目的的是
检验CO 2 是否收集满 测试某溶液的酸碱度 分离溶液中的固态物质
A B C D
4.下列现象的结论正确的是
A.经检测某干燥的空气主要成分有:N、O、CO、SO、NO 和PM2.5,该空气为清洁空气
2 2 2 2 2
B.质量为a的某固体物质放入质量为b的水中,振荡,得到的溶液质量一定为(a+b)
C.家用菜刀放置几天后出现砖红色斑点,说明菜刀开始生锈了
D.用老面发酵制作馒头,可加少量纯碱溶液中和发面的酸味,纯碱属于碱类物质
5.下列有关物质构成的说法不正确的是
A.物质可由分子、原子或离子构成
B.结构示意图为 、 的粒子,表示了同种元素不同的粒子
C.相对原子质量为m的原子M,核外有n个电子,则核内中子数为:m-n
1D.原子序数为16的原子,位于周期表中第2周期第ⅥA族
6.下列关于碳及碳的化合物的说法错误的是
A.石墨、金刚石、C 的物理性质不同,但都属于碳的不同单质
60
点燃
B.乙烯(X)的燃烧反应为X+3O = 2HO+2CO,则乙烯的分子式为CH
2 2 2 2 4
C.含碳的化合物中甲烷、乙醇属于有机物,CO、CO 则属于无机物
2
D.CH(苯)和CH(乙炔)中C、H原子个数比相同,但元素质量比不同
6 6 2 2
7.下列方程式表示的反应正确,且能实现目的的是
高温
A.高炉炼铁:2FeO+3C = 4Fe+3CO↑
2 3 2
高温
B.煅烧石灰石制生石灰:CaCO = CO↑+CaO
3 2
C.从硫酸铜溶液中得到单质铜:CuSO+2Ag=AgSO+Cu
4 2 4
D.除去氢氧化钠溶液中的硫酸钠杂质:NaSO+BaCl=BaSO↓+2NaCl
2 4 2 4
二、填空题(本大题包括6小题,共24分)
8.(3分)最近新疆乌鲁木齐某在建小区附近出现了“火山”,是地下浅表煤层在岩石
裂缝处发生的自燃现象。要熄灭该煤层的燃烧,你提出的办法是____。该煤层自燃的过程中
会产生大量的可燃性气体,该气体的化学式为____;实验室点燃该气体前必须要对气体进行
____。
9.(4分)水是地球表面覆盖最多的物质,也是生命活动不可缺少的物质。
(1)写出实验室电解水反应的化学方程式:____。
(2)城镇自来水厂生产流程可用下图表示:
除去水中固态杂质的设备是:____;投药(多为ClO)的作用是____。
2
(3)自然界的水多含有杂质。含有较多可溶性钙、镁化合物的水通常称为硬水,一种软化
硬水的简易办法是:____。
2
- +1 +1 +2 +5
10.(4分)现有指定化合价的几种元素:O 、H、K、Cu、N,请选择元素,写出符合要求的
化合物的化学式:
(1)一种难溶于水的碱____; (2)一种酸____;
(3)一种复合肥料____; (4)原子个数比为1∶1的氧化物____;
11.(4分)KCl在不同温度下溶解度的数据如下表:
温度℃ 0 10 20 30 40 50 60 70 80 90 100
溶解
27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
度/g
(1)60℃时,100 g水中最多可溶解KCl____g。
(2)90℃时,100 g饱和KCl溶液冷却到30℃时,溶液的质量(选填“>”或“<”或
“=”)____100 g。
(3)40℃时,KCl饱和溶液中溶质质量分数为____;该溶液升温到60℃时,溶液属于____
溶液(选填“饱和”或“不饱和”)。
12.(5分)碳及碳的化合物间的转化关系可表示为:
,由此可写出各步反应的化学方程式。
2硫及硫的化合物间的转化关系可表示为: 。
(1)模仿碳及碳的化合物间转化反应方程式的书写,写出硫及硫的化合物转化反应中指
定反应的化学方程式:反应①:____;反应③:____。
(2)反应②中,VO 在反应前后的质量均为m,则VO 在该反应中起____作用。
2 5 2 5
(3)上述反应中,属于化合反应的有:____(填反应序号)。
(4)实验室因操作不当,将浓硫酸滴在书页上,一会书页出现了黑色,且由糊状至烂洞状。
这是因为浓硫酸具有____。
13.(4分)某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如下:
请认真分析流程中各步骤的信息作答:
(1)溶剂X是____;Y溶液中溶质的化学式为:____。
(2)蒸发操作的目的是除去(填物质的化学式)____。
(3)写出加入过量KOH溶液反应的化学方程式:____。
三、实验与探究题(本大题包括2小题,共10分)
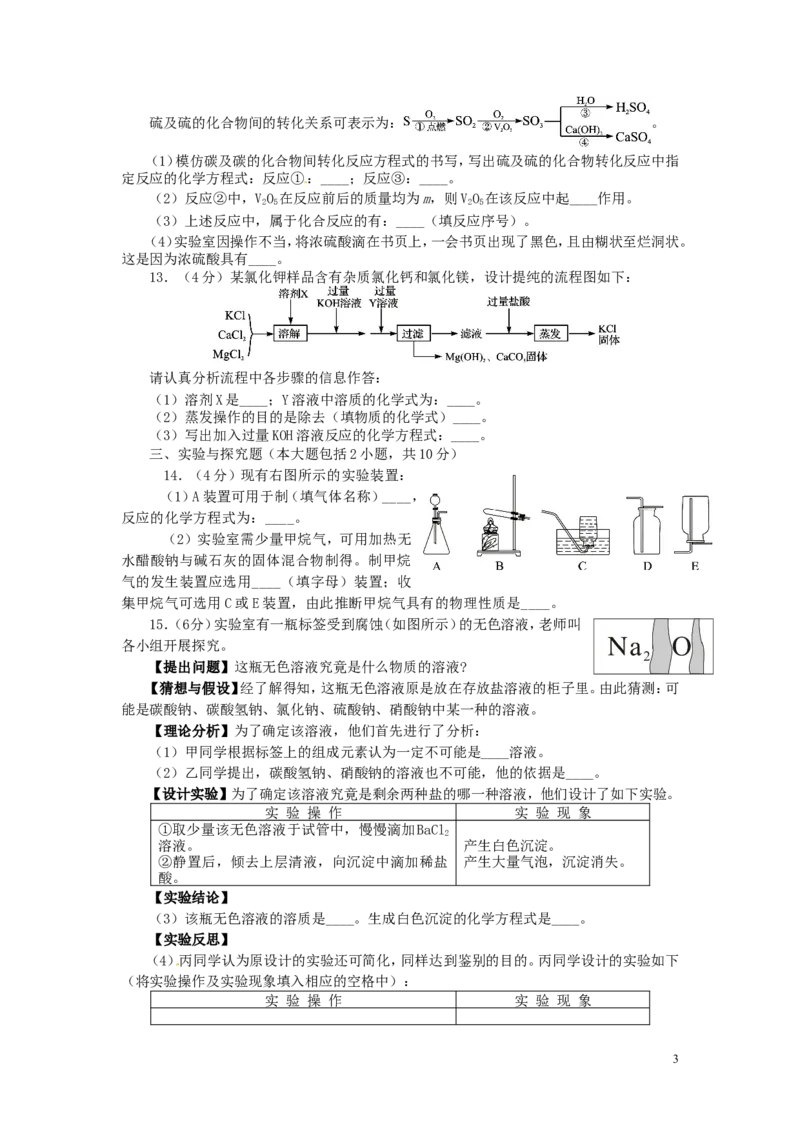
14.(4分)现有右图所示的实验装置:
(1)A装置可用于制(填气体名称)____,
反应的化学方程式为:____。
(2)实验室需少量甲烷气,可用加热无
水醋酸钠与碱石灰的固体混合物制得。制甲烷
气的发生装置应选用____(填字母)装置;收
集甲烷气可选用C或E装置,由此推断甲烷气具有的物理性质是____。
15.(6分)实验室有一瓶标签受到腐蚀(如图所示)的无色溶液,老师叫
各小组开展探究。
【提出问题】这瓶无色溶液究竟是什么物质的溶液?
【猜想与假设】经了解得知,这瓶无色溶液原是放在存放盐溶液的柜子里。由此猜测:可
能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液。
【理论分析】为了确定该溶液,他们首先进行了分析:
(1)甲同学根据标签上的组成元素认为一定不可能是____溶液。
(2)乙同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是____。
【设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验。
实 验 操 作 实 验 现 象
①取少量该无色溶液于试管中,慢慢滴加BaCl
2
溶液。 产生白色沉淀。
②静置后,倾去上层清液,向沉淀中滴加稀盐 产生大量气泡,沉淀消失。
酸。
【实验结论】
(3)该瓶无色溶液的溶质是____。生成白色沉淀的化学方程式是____。
【实验反思】
(4)丙同学认为原设计的实验还可简化,同样达到鉴别的目的。丙同学设计的实验如下
(将实验操作及实验现象填入相应的空格中):
实 验 操 作 实 验 现 象
3四、计算题(本大题包括1小题,共5分)
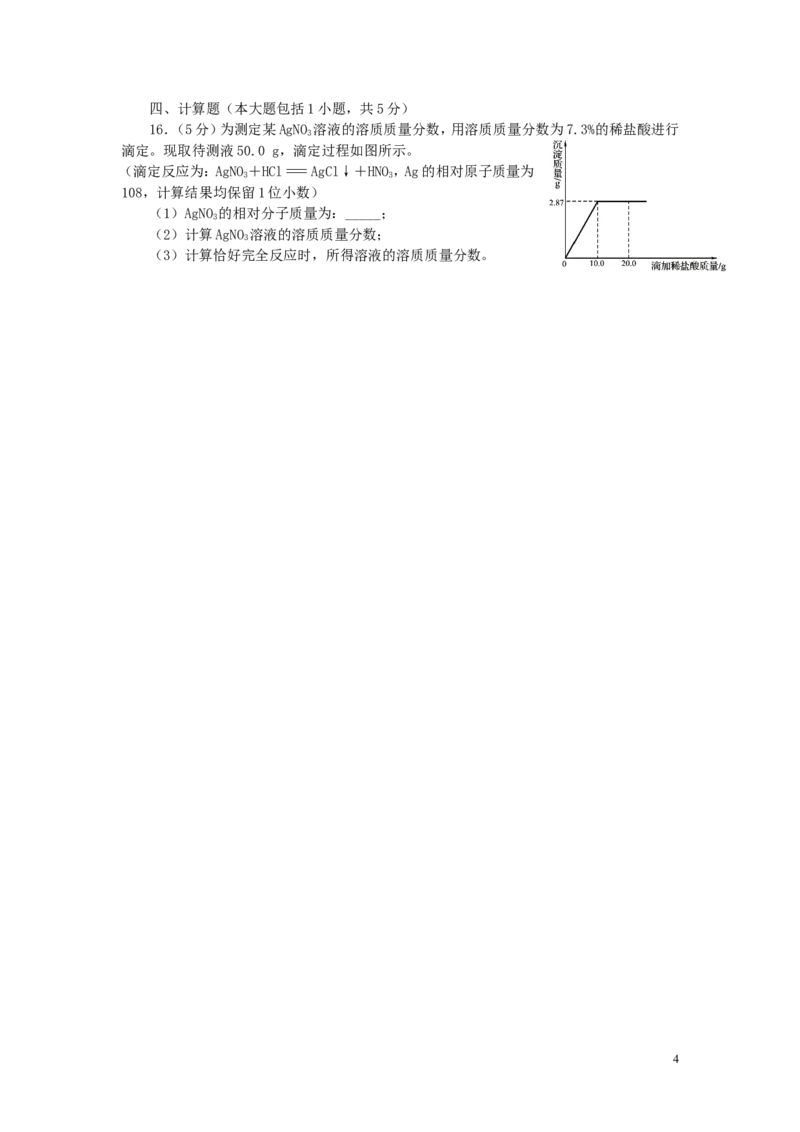
16.(5分)为测定某AgNO 溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行
3
滴定。现取待测液50.0 g,滴定过程如图所示。
(滴定反应为:AgNO+HCl=AgCl↓+HNO,Ag的相对原子质量为
3 3
108,计算结果均保留1位小数)
(1)AgNO 的相对分子质量为:_____;
3
(2)计算AgNO 溶液的溶质质量分数;
3
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
4资阳市2015年高中阶段教育学校招生统一考试
理科综合参考答案及评分意见
化学部分(共60分)
一、选择题(每题3分,共21分)
题 号 1 2 3 4 5 6 7
答 案 A C B C D D B
(8~15题每空1分)
二、填空题(共24分)
8.(3分)用水浇灭或用土掩埋(答到一点即可);CO;验纯(或纯度检验);
通电
9.(4分)(1)2HO = 2H↑+O↑;(2)过滤池;消毒杀菌;(3)将水煮沸;
2 2 2
10.(4分)(1)Cu(OH);(2)HNO;(3)KNO;(4)CuO;
2 3 3
11.(4分)(1)45.5;(2)<;(3)28.6%(0.286或 40 或2,没规定保留小数位数,28%~29%
140 7
点燃
可);不饱和;
12.(5分)(1)S+O = SO;SO+HO=HSO;
2 2 3 2 2 4
(2)催化(或催化剂的);(3)①②③(不得有缺);(4)较强的腐蚀性(或较强
的脱水性);
13.(4分)(1)水(或HO);KCO;(2)HO、HCl(不得有缺);(3)MgCl+2KOH=
2 2 3 2 2
Mg(OH)↓+2KCl;
2
三、实验与探究题(共10分)
14.(4分)(1)二氧化碳;CaCO+2HCl=CaCl+CO↑+HO;
3 2 2 2
(或氧气;2HMOnO 2= 2HO+O↑;或氢气;HSO+Zn=ZnSO+H↑)
2 2 2 2 2 4 4 2
(2)B;难溶于水、密度小于空气(不得有缺);
15.(6分)
【理论分析】(1)氯化钠(或NaCl);(2)碳酸氢钠和硝酸钠的化学式中钠的原子个数
为 1,而标签中为2;(或碳酸氢根和硝酸根化合价为-1价,而标签中显示推断酸根为-2
价)
【实验结论】(3)碳酸钠(或NaCO);NaCO+BaCl=BaCO↓+2NaCl;
2 3 2 3 2 3
【实验反 思】
实 验 操 作 实 验 现 象
(4)
取少量无色溶液于试管中,向其中滴加
有大量气泡产生
稀盐酸
四、计算题(5分)
16.(5分)(1)170(1分);
(2)设50.0 g待测液中AgNO 的质量为x,质量分数为a
3
AgNO+HCl=AgCl+HNO
3 3
170 143.5
x 2.87 g
143.5 x=170×2.87 g
x=1702.87g=3.4 g (1分)
143.5
a= 3.4g ×100%=6.8% (1分)
50.0g
(3)设恰好完全反应时,所得溶液中溶质HNO 的质量为y,质量分数为b。
3
5AgNO+HCl=AgCl+HNO
3 3
143.5 63
2.87 g y
143.5 y=63×2.87 g
y=632.87g =1.26 g (1分)
143.5
恰好完全反应时溶液质量50.0 g+10.0 g-2.87=57.13 g
b= 1.26g ×100%≈2.2% (1分)
57.13g
答:略
6