文档内容
内蒙古包头市2015年中考化学试卷
一、选择题(每题2分,共12分.每小题只有一个正确选项,请将答题卡上对应题目的答案
标号涂黑)
1.物质的下列用途主要利用其物理性质的是( )
A.白醋用于清除水壶中的水垢 B.干冰用于人工降雨
C.稀盐酸用于金属表面除锈 D.苏打水用于缓解胃酸过多
2.下列说法中错误的是( )
A.同种分子构成的物质是纯净物
B.原子是化学变化中的最小粒子
C.同种元素组成的物质是单质
D.元素的化学性质与该元素的原子的最外层电子数关系最密切
3.(2分)(2015•包头)下列有关物质除杂、鉴别所用试剂或方法正确的是( )
A.除去铁粉中混有的锌粉,可加入过量的硫酸亚铁溶液并过滤
B.用酚酞溶液可一次性鉴别稀硫酸、澄清石灰水、和氯化钠溶液
C.要除去CO 气体中的少量HCl气体,可将其通过足量的NaOH溶液
2
D.不加任何试剂即可鉴别KCl溶液、NaOH溶液、KSO 溶液、CuSO 溶液
2 4 4
4.(2分)(2015•包头)质量为50g溶质质量分数为20%的氢氧化钾溶液和质量为50g溶质质
量分数为20%的稀硫酸混合,所得溶液的PH( )
A.小于7 B.等于7 C.大于7 D.不确定
5.(2分)(2015•包头)天平两边各放质量相等的烧杯,分别装入等质量,等溶质质量分数的
稀硫酸,此时天平平衡,将等质量的MgCO 和NaCO 分别加入两烧杯中,充分反应后,下列说
3 2 3
法错误的是( )
A.若天平不平衡,指针一定偏向加NaCO 的一边
2 3
B.若天平平衡,两烧杯中的酸一定完全反应
C.若反应后Na CO 有剩余,天平一定平衡
2 3
D.若天平不平衡,两种碳酸盐一定都没有剩余
6.(2分)(2015•包头)下列有关量的变化图象与其对应叙述相符的是( )
A B C D
常温下,向一定量的饱t℃时,向等质量的甲、向一定质量的过氧化氢向等质量的铁和镁
和石灰水中加入氧化 乙、丙三种物质中分别加的水溶液中加入二氧化中分别加入足量的
钙 水配成饱和溶液,所得溶锰 稀盐酸
液质量最小的是丙
A.A B.B C.C D.D
二、填空题(每空1分,化学方程式2分,共21分.请将答案写在答题卡的对应位置)
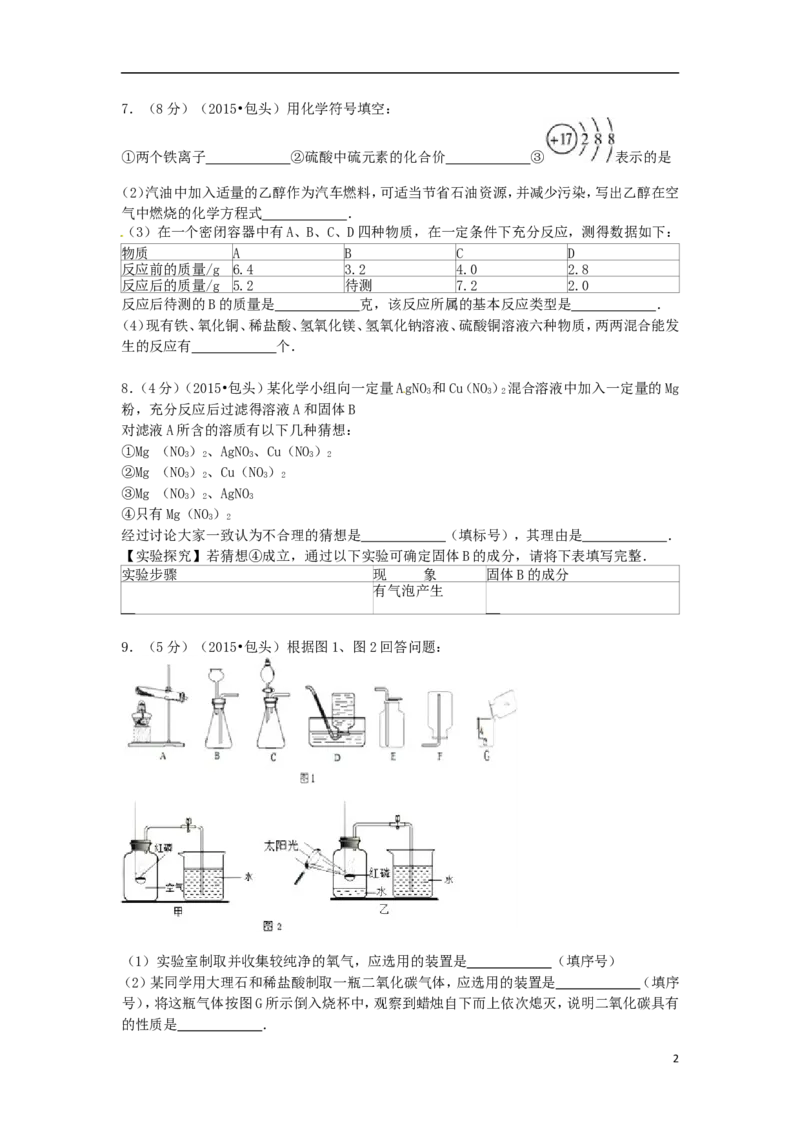
17.(8分)(2015•包头)用化学符号填空:
①两个铁离子 ②硫酸中硫元素的化合价 ③ 表示的是
(2)汽油中加入适量的乙醇作为汽车燃料,可适当节省石油资源,并减少污染,写出乙醇在空
气中燃烧的化学方程式 .
(3)在一个密闭容器中有A、B、C、D四种物质,在一定条件下充分反应,测得数据如下:
物质 A B C D
反应前的质量/g 6.4 3.2 4.0 2.8
反应后的质量/g 5.2 待测 7.2 2.0
反应后待测的B的质量是 克,该反应所属的基本反应类型是 .
(4)现有铁、氧化铜、稀盐酸、氢氧化镁、氢氧化钠溶液、硫酸铜溶液六种物质,两两混合能发
生的反应有 个.
8.(4分)(2015•包头)某化学小组向一定量AgNO 和Cu(NO)混合溶液中加入一定量的Mg
3 3 2
粉,充分反应后过滤得溶液A和固体B
对滤液A所含的溶质有以下几种猜想:
①Mg (NO)、AgNO、Cu(NO)
3 2 3 3 2
②Mg (NO)、Cu(NO)
3 2 3 2
③Mg (NO)、AgNO
3 2 3
④只有Mg(NO)
3 2
经过讨论大家一致认为不合理的猜想是 (填标号),其理由是 .
【实验探究】若猜想④成立,通过以下实验可确定固体B的成分,请将下表填写完整.
实验步骤 现 象 固体B的成分
有气泡产生
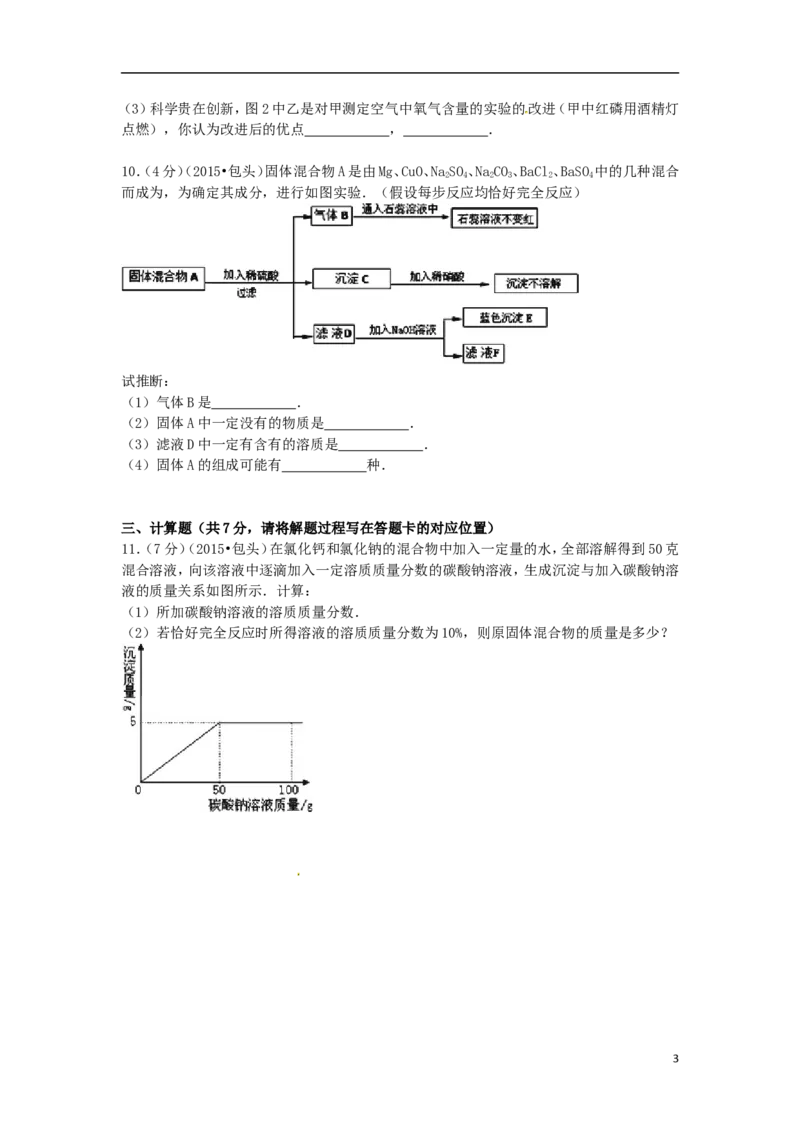
9.(5分)(2015•包头)根据图1、图2回答问题:
(1)实验室制取并收集较纯净的氧气,应选用的装置是 (填序号)
(2)某同学用大理石和稀盐酸制取一瓶二氧化碳气体,应选用的装置是 (填序
号),将这瓶气体按图G所示倒入烧杯中,观察到蜡烛自下而上依次熄灭,说明二氧化碳具有
的性质是 .
2(3)科学贵在创新,图2中乙是对甲测定空气中氧气含量的实验的改进(甲中红磷用酒精灯
点燃),你认为改进后的优点 , .
10.(4分)(2015•包头)固体混合物A是由Mg、CuO、NaSO、NaCO、BaCl、BaSO 中的几种混合
2 4 2 3 2 4
而成为,为确定其成分,进行如图实验.(假设每步反应均恰好完全反应)
试推断:
(1)气体B是 .
(2)固体A中一定没有的物质是 .
(3)滤液D中一定有含有的溶质是 .
(4)固体A的组成可能有 种.
三、计算题(共7分,请将解题过程写在答题卡的对应位置)
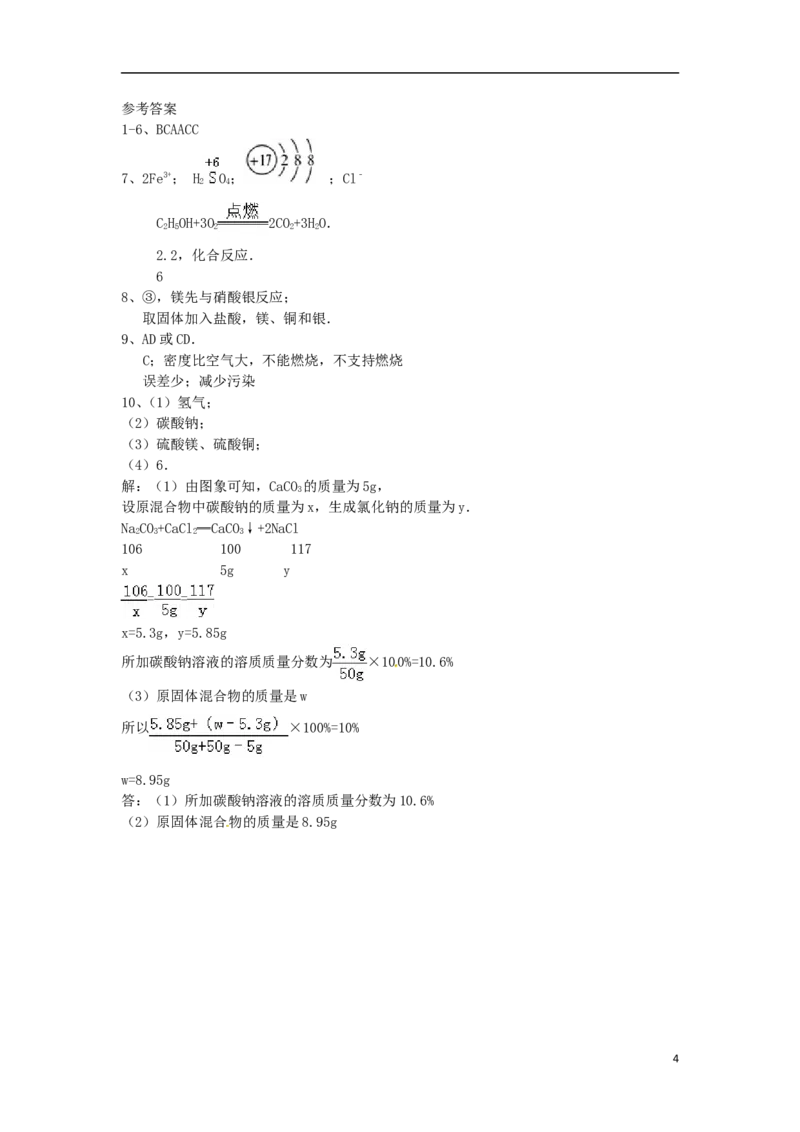
11.(7分)(2015•包头)在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克
混合溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠溶液,生成沉淀与加入碳酸钠溶
液的质量关系如图所示.计算:
(1)所加碳酸钠溶液的溶质质量分数.
(2)若恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?
3参考答案
1-6、BCAACC
7、2Fe3+; H O; ;Cl﹣
2 4
CHOH+3O 2CO+3HO.
2 5 2 2 2
2.2,化合反应.
6
8、③,镁先与硝酸银反应;
取固体加入盐酸,镁、铜和银.
9、AD或CD.
C;密度比空气大,不能燃烧,不支持燃烧
误差少;减少污染
10、(1)氢气;
(2)碳酸钠;
(3)硫酸镁、硫酸铜;
(4)6.
解:(1)由图象可知,CaCO 的质量为5g,
3
设原混合物中碳酸钠的质量为x,生成氯化钠的质量为y.
NaCO+CaCl═CaCO↓+2NaCl
2 3 2 3
106 100 117
x 5g y
= =
x=5.3g,y=5.85g
所加碳酸钠溶液的溶质质量分数为 ×100%=10.6%
(3)原固体混合物的质量是w
所以 ×100%=10%
w=8.95g
答:(1)所加碳酸钠溶液的溶质质量分数为10.6%
(2)原固体混合物的质量是8.95g
4