文档内容
2007年北京市高级中等学校招生统一考试(课标卷)
化 学 试 卷
1.本试卷分为第I卷、第II卷,共11页,共四道大题,40个小题,满
考 分80分。考试时间100分钟。
生 2.在试卷密封线内认真填写区(县)名称、毕业学校、姓名、报名
须 号、准考证号。
知 3.考试结束,请将本试卷和机读答题卡一并交回。
4.本试卷化学方程式中的“==”和“→”含义相同。
可能用到的相对原子质量
H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Ca 40 Cr 52 Fe 56 Cu 64
部分碱和盐的溶解性表(20 ℃)
阳离子 Ba2+
Ca2+ Mg2+ Zn2+ Fe2+ Cu2+
阴离子
OH– 溶 微 不 不 不 不
SO 2- 不 微 溶 溶 溶 溶
4
CO2- 不 不 微 不 不 不
3
第I卷
(机读卷 共30分)
考生 1.第I卷共4页,共一道大题,30个小题。
须知 2.试题答案一律填涂在机读答题卡上,在试卷上做答无效。
一、选择题(每小题只有一个选项符合题意。共30个小题,每小题1分,共30分。)
1.空气的成分中,体积分数约占21%的是
A.氮气 B.氧气 C.二氧化碳 D.稀有气体
2.下列变化中,属于化学变化的是
A.酒精燃烧 B.玻璃破碎 C.冰块融化 D.铁丝弯曲
3.下列元素中,属于金属元素的是
A.氖 B.氧 C.锌 D.磷
4.能引起温室效应的主要气体是
A.CO B.CO
2
C.SO D.NO
2 2
5.饰品中的红宝石(见右图)主要成分是Al O。Al O 属于
2 3 2 3
A.氧化物 B.酸
C.碱 D.盐
6.碳酸钠是重要的化工原料,其俗称为
A.纯碱 B.苛性钠 C. 食盐 D.消石灰
7.食品包装中经常用到铝箔。铝能制成铝箔是因为铝具有良好的
A.导电性 B.延展性 C.导热性 D.抗腐蚀性
18.在缺氮的情况下,植物的生长发育迟缓或停滞。这时应施用的化肥是
A.KCl B.NHCl C.KCO D. Ca(HPO )
4 2 3 2 4 2
9.下列清洗方法中,利用乳化原理的是
A.用自来水洗手 B.用汽油清洗油污
C.用洗涤剂清洗餐具 D.用盐酸清除铁锈
10.每年的6月1日为“世界牛奶日”。牛奶(见右图)中富含的维
生素D有助于人体对钙的吸收,这里说的钙是指
A.分子 B.原子
C.元素 D.单质
11.下列有关物质用途的叙述中,不正确的是
A.食盐作调味品 B.氧气用于急救病人
C.碳酸氢钠作发酵剂 D.氢氧化钠用于泡发鱿鱼等水产品
12.锂电池可用作心脏起搏器的电源。已知一种锂原子核内含有3个质子和4个中子,则
该锂原子的核外电子数为
A.1 B.3 C.4 D.7
13.下列符号中,表示两个氢原子的是
A.H B.2H C.2H+ D.2H
2 2
14.洋葱(见右图)被誉为“蔬菜皇后”。切洋葱时可闻到刺激性气味,
这说明
A.分子在不停地运动 B.分子体积很小
C.分子间有间隔 D.分子质量很小
15.二氧化碳是由碳、氧两种元素组成,这两种元素的本质区别是
A.质子数不同 B.中子数不同
C.电子数不同 D.最外层电子数不同
16.下列叙述中,属于氧气化学性质的是
A.无色无气味 B.常温下为气态
C.能支持燃烧 D.液氧为淡蓝色
17.从古至今,铁都被广泛使用。下列叙述中,不正确的是
A.生铁属于合金 B.铁可以在氧气中燃烧
C.铁能跟硝酸银溶液反应 D.铁在潮湿的环境中不易生锈
18.下列实验操作中,正确的是
点燃酒精灯 检查气密性 读取液体体积 加热液体
A. B. 检 验气 C 密.性 D.
19.下列操作中,可以鉴别空气、氧气和二氧化碳三瓶气体的是
A.观察气体颜色 B.闻气体的气味
C.插入燃着的木条 D.倒入澄清的石灰水
20.除去氯化钠溶液中含有少量的氢氧化钠,选用试剂正确的是
2A.盐酸 B.酚酞 C.二氧化碳 D.碳酸钠
21.下列物质的化学式中,书写正确的是
A.氮气N B.氯化铁FeCl
2 2
C.氧化镁MgO D.氯化钙CaCl
2
22.下列化学方程式中,书写正确的是
点燃 点燃
A.P + O ==== PO B.2P + 5O ==== PO
2 2 2 2 5
点燃
C.4P + 5O ==== PO D.4P + 5O ==== 2PO
2 2 5 2 2 5
23.小红观察在不同酸碱度下紫甘蓝(见右图)汁液所显示的颜色,记录如下。
pH 1 2~3 4~6 7~9 10 11 12~14
颜色 深红 紫红 浅紫 蓝 绿 黄绿 黄
下列物质中,能使紫甘蓝汁液变黄的是
A.水 B.食盐溶液 C.硫酸溶液 D.氢氧化钠溶液
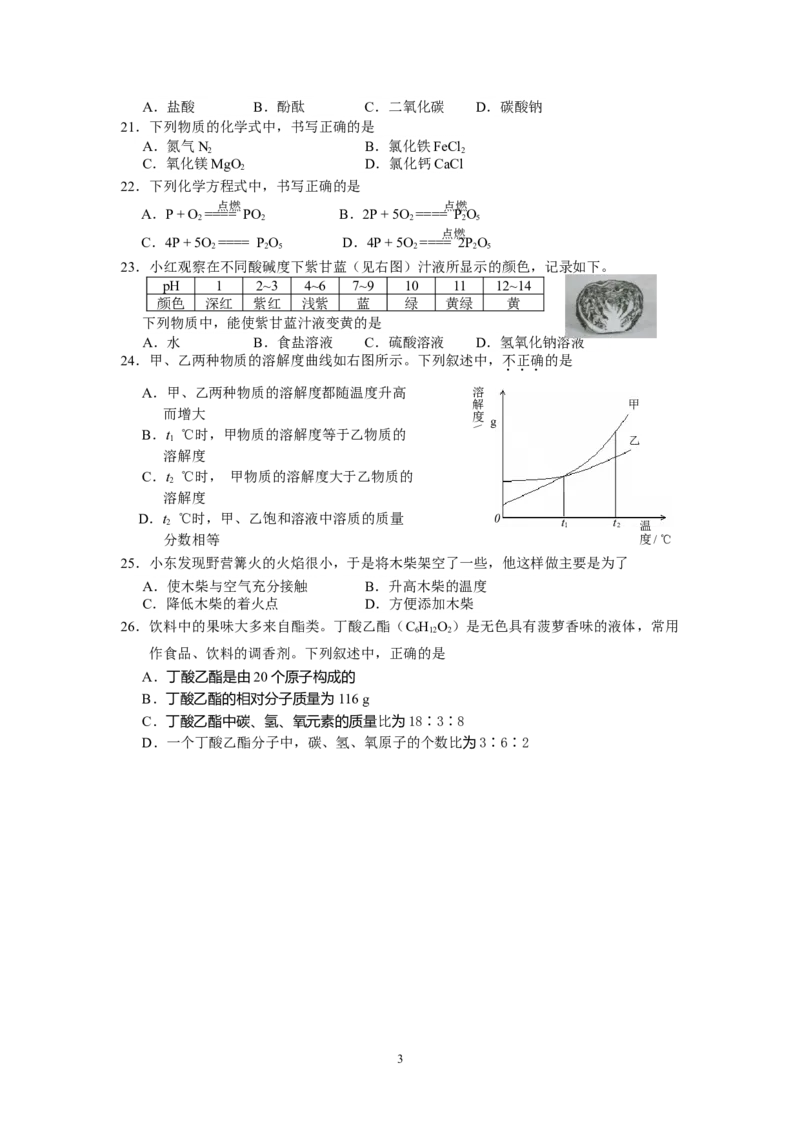
24.甲、乙两种物质的溶解度曲线如右图所示。下列叙述中,不正确的是
A.甲、乙两种物质的溶解度都随温度升高 溶
解 甲
而增大 度
B.t ℃时,甲物质的溶解度等于乙物质的
1 乙
溶解度
C.t ℃时, 甲物质的溶解度大于乙物质的
2
溶解度
D.t ℃时,甲、乙饱和溶液中溶质的质量 2
分数相等
25.小东发现野营篝火的火焰很小,于是将木柴架空了一些,他这样做主要是为了
A.使木柴与空气充分接触 B.升高木柴的温度
C.降低木柴的着火点 D.方便添加木柴
26.饮料中的果味大多来自酯类。丁酸乙酯(C H O )是无色具有菠萝香味的液体,常用
6 12 2
作食品、饮料的调香剂。下列叙述中,正确的是
A.丁酸乙酯是由20个原子构成的
B.丁酸乙酯的相对分子质量为116 g
C.丁酸乙酯中碳、氢、氧元素的质量比为18∶3∶8
D.一个丁酸乙酯分子中,碳、氢、氧原子的个数比为3∶6∶2
3
\
g
0 t 1 t 2 温
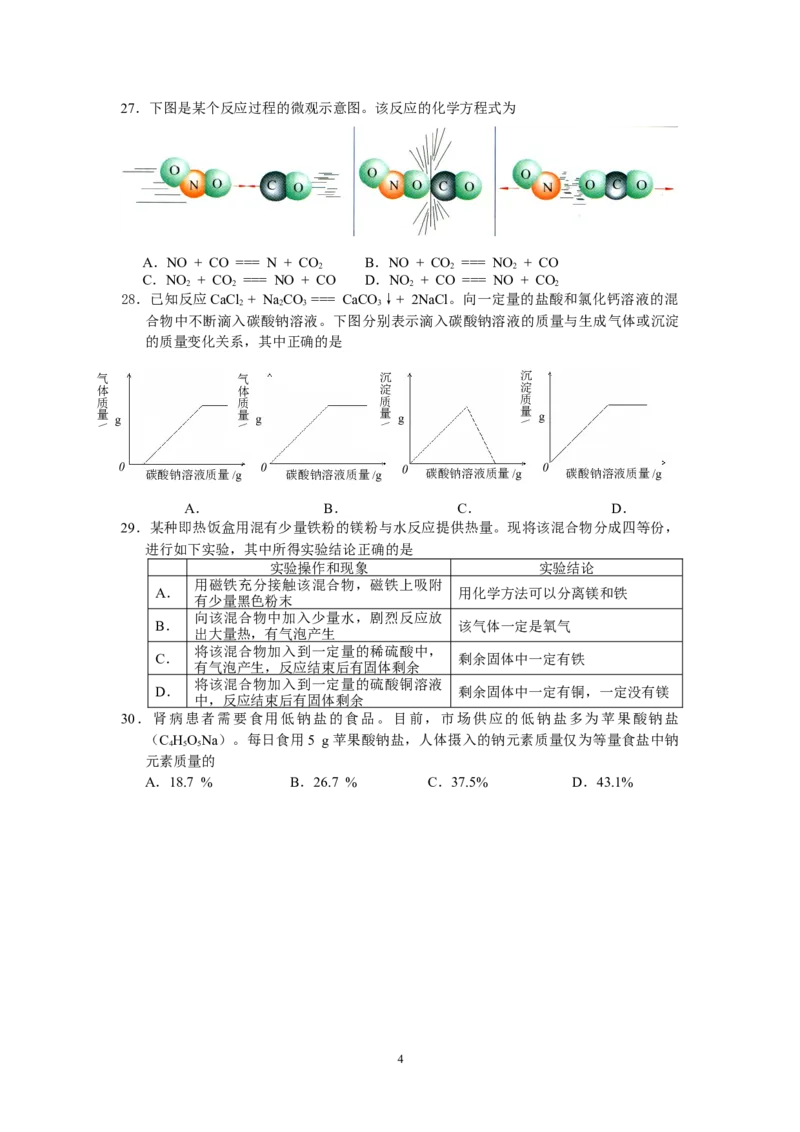
度/℃27.下图是某个反应过程的微观示意图。该反应的化学方程式为
A.NO + CO === N + CO B.NO + CO === NO + CO
2 2 2
C.NO + CO === NO + CO D.NO + CO === NO + CO
2 2 2 2
28.已知反应CaCl + NaCO === CaCO ↓+ 2NaCl。向一定量的盐酸和氯化钙溶液的混
2 2 3 3
合物中不断滴入碳酸钠溶液。下图分别表示滴入碳酸钠溶液的质量与生成气体或沉淀
的质量变化关系,其中正确的是
气
体
质
量
碳酸钠溶液质量/g 碳酸钠溶液质量/g 碳酸钠溶液质量/g 碳酸钠溶液质量/g
A. B. C. D.
29.某种即热饭盒用混有少量铁粉的镁粉与水反应提供热量。现将该混合物分成四等份,
进行如下实验,其中所得实验结论正确的是
实验操作和现象 实验结论
用磁铁充分接触该混合物,磁铁上吸附
A. 用化学方法可以分离镁和铁
有少量黑色粉末
向该混合物中加入少量水,剧烈反应放
B. 该气体一定是氧气
出大量热,有气泡产生
将该混合物加入到一定量的稀硫酸中,
C. 剩余固体中一定有铁
有气泡产生,反应结束后有固体剩余
将该混合物加入到一定量的硫酸铜溶液
D. 剩余固体中一定有铜,一定没有镁
中,反应结束后有固体剩余
30.肾病患者需要食用低钠盐的食品。目前,市场供应的低钠盐多为苹果酸钠盐
(C HONa)。每日食用5 g苹果酸钠盐,人体摄入的钠元素质量仅为等量食盐中钠
4 5 5
元素质量的
A.18.7 % B.26.7 % C.37.5% D.43.1%
4
\
气
体
质
量
\
沉
淀
质
量
\
沉
淀
质
量
\
g g g g
0 0 0 02007年北京市高级中等学校招生统一考试(课标卷)
化 学 试 卷
第II卷
(非机读卷 共50分)
考生 1.第II卷共7页,共三道大题,10个小题。
须知 2.答题必须用黑色或蓝色钢笔、圆珠笔。
题 号 二 三 四 总 分
得 分
阅卷人
复查人
二、填空题(共5个小题,每空1分,共26分。)
31.(5分)青少年正处在生长发育期,应注意营养均衡,膳食合理。
(1)有些青少年不爱吃蔬菜、水果,影响生长发育,这主要是由于摄入
(填序号)不足而引起的。
××糕点
①维生素 ②油脂 ③蛋白质
营养素 每100 g含有
(2)“××糕点”主要营养成分如右表所示。
蛋白质 4.8 g
请根据该表回答。
①所含营养素中属于无机盐的是 , 油 脂 20 g
没有列出的一类营养素是 。 糖 类 40 g
②正常情况下,人每日摄入的油脂不超过60 g,
β—胡萝卜素 1.8 mg
由此计算,每日食用该糕点最多不应超过 g。 (维生素类)
③糖类是人体所需 的主要来源。
碳酸钙 400 mg
32.(6分)化学在2008年北京奥运会的各个方面发挥重要作用。
(1)北京奥运会需要大量材料。下列应用中使用金属材料的是 (填序号,
下同),使用有机合成材料的是 。
①使用金、银 ②使用铝合金 ③使用钢铁建造 ④使用涤纶(的
确良)
和铜等制作奖牌 制作奥运火炬 主体育场——“鸟巢” 制作运动
服装
(2)北京奥运会对能量的需求很大。人类通过化学反应获得的能量,
大多来自于天然气、 和煤等化石燃料。北京市在
开发和使用新能源上进行了很多尝试,小芳在街头发现一种不
用外接电源的路灯(见右图),只要每天有短时间的光照就能
5使用,这种路灯使用的新能源是 。
(3)为体现绿色奥运的理念,北京奥运会采用丙烷(C H)作火炬燃料。丙烷燃烧时
3 8
发出亮黄色火焰,反应生成水和二氧化碳,该反应的化学方程式为 。
(4)北京奥运会将有数以万计的观众。针对观看比赛时产生的垃圾,下列说法正确的
是 。
①这些垃圾应随身带出赛场,分类回收
②这些垃圾可送到垃圾焚烧发电厂,焚烧发电
③这些垃圾中的塑料制品不要随意丢弃,避免“白色污染”
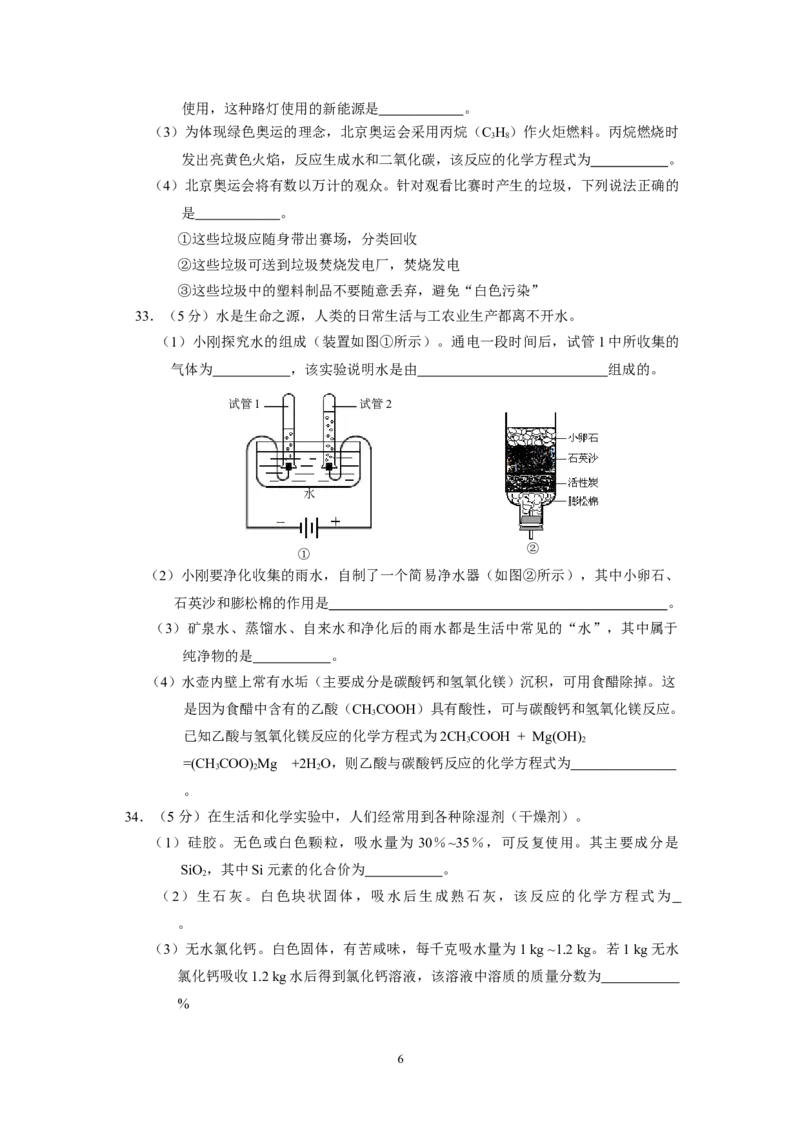
33.(5分)水是生命之源,人类的日常生活与工农业生产都离不开水。
(1)小刚探究水的组成(装置如图①所示)。通电一段时间后,试管1中所收集的
气体为 ,该实验说明水是由 组成的。
试管1 试管2
水
②
①
(2)小刚要净化收集的雨水,自制了一个简易净水器(如图②所示),其中小卵石、
石英沙和膨松棉的作用是 。
(3)矿泉水、蒸馏水、自来水和净化后的雨水都是生活中常见的“水”,其中属于
纯净物的是 。
(4)水壶内壁上常有水垢(主要成分是碳酸钙和氢氧化镁)沉积,可用食醋除掉。这
是因为食醋中含有的乙酸(CHCOOH)具有酸性,可与碳酸钙和氢氧化镁反应。
3
已知乙酸与氢氧化镁反应的化学方程式为2CHCOOH + Mg(OH)
3 2
=(CHCOO)Mg +2H O,则乙酸与碳酸钙反应的化学方程式为
3 2 2
。
34.(5分)在生活和化学实验中,人们经常用到各种除湿剂(干燥剂)。
(1)硅胶。无色或白色颗粒,吸水量为 30%~35%,可反复使用。其主要成分是
SiO,其中Si元素的化合价为 。
2
(2)生石灰。白色块状固体,吸水后生成熟石灰,该反应的化学方程式为
。
(3)无水氯化钙。白色固体,有苦咸味,每千克吸水量为1 kg ~1.2 kg。若1 kg无水
氯化钙吸收1.2 kg水后得到氯化钙溶液,该溶液中溶质的质量分数为
%
6(计算结果保留小数点后一位数字)。
(4)浓硫酸。无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂,但日常生活
中却很少用它作除湿剂。其原因是 (写出一条即可)。
(5)还原铁粉。灰色或黑色粉末,又称“双吸剂”,能够吸收空气中的水分和氧气,
常用于食品保鲜。检验使用一段时间后的“双吸剂”是否仍有效的化学方法为
。
35.(5分)A、B、C、D、E、F都是初中化学常见的物质,其中B是常用于光合作用和
灭火的气体。它们之间的关系如下图所示。(图中“—”表示两端的物质能发生化学
反应;“→”表示物质间存在转化关系。)
(1)B的化学式为 。
(2)已知反应①、②、③的基本反应类型相同。反应①的
化学方程式为 ,
基本反应类型为 。
(3)已知反应④、⑤、⑥中,一个有沉淀生成,另一个有
气体生成,还有一个没有明显现象。B、E不含相同元素,
D、F 只含一种相同元素。反应④的化学方程式为
,反应⑤的化学方程式为
。
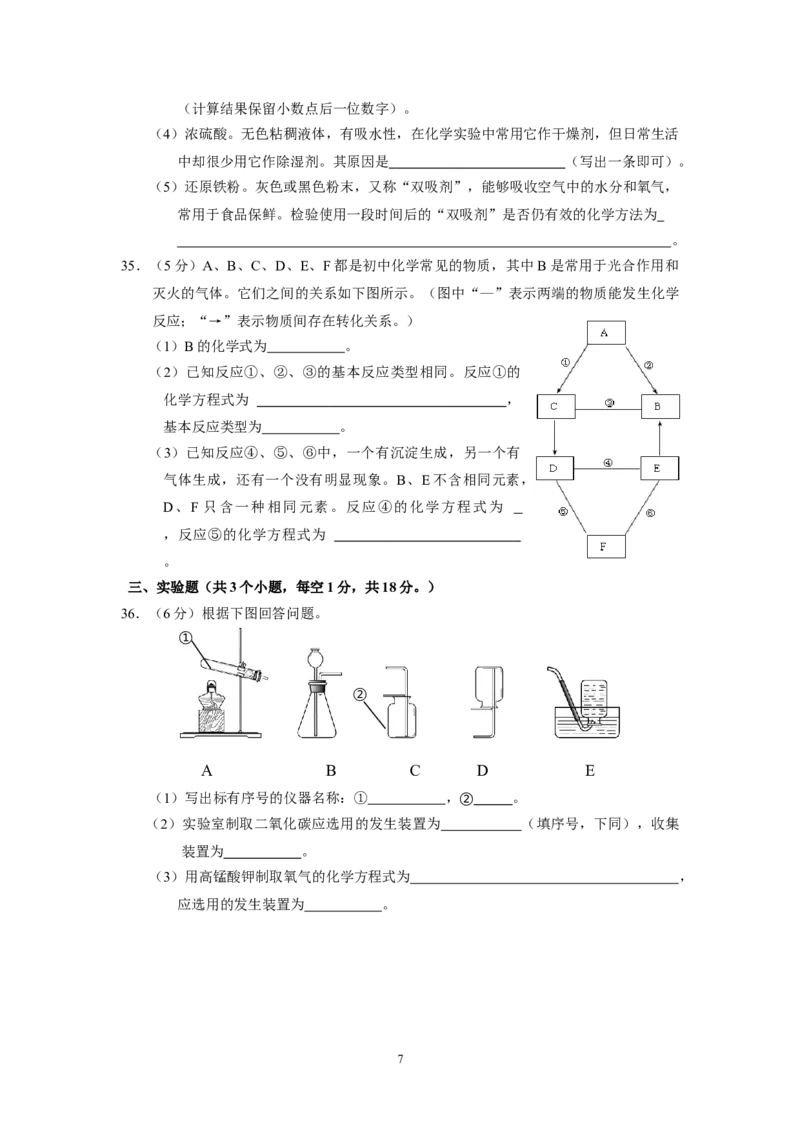
三、实验题(共3个小题,每空1分,共18分。)
36.(6分)根据下图回答问题。
①
②
A B C D E
(1)写出标有序号的仪器名称:① ,② 。
(2)实验室制取二氧化碳应选用的发生装置为 (填序号,下同),收集
装置为 。
(3)用高锰酸钾制取氧气的化学方程式为 ,
应选用的发生装置为 。
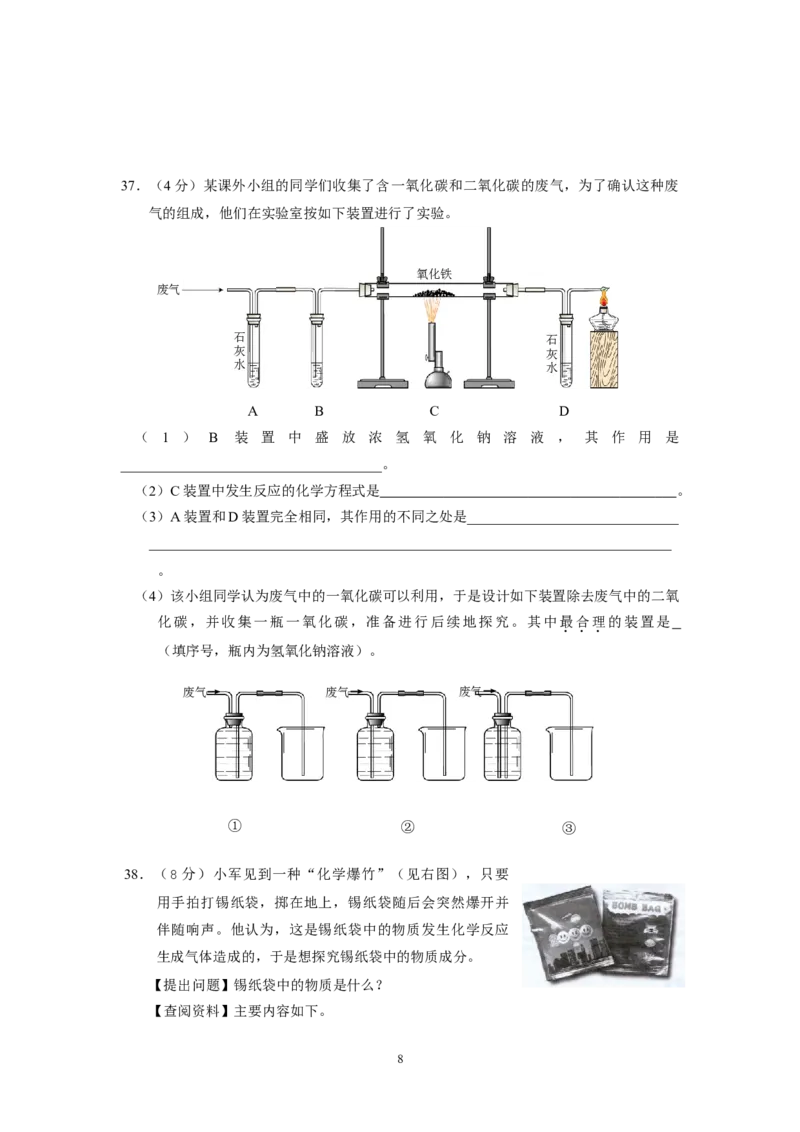
737.(4分)某课外小组的同学们收集了含一氧化碳和二氧化碳的废气,为了确认这种废
气的组成,他们在实验室按如下装置进行了实验。
氧化铁
废气
石 石
灰 灰
水 水
A B C D
( 1 ) B 装 置 中 盛 放 浓 氢 氧 化 钠 溶 液 , 其 作 用 是
_____________________________________。
(2)C装置中发生反应的化学方程式是 。
(3)A装置和D装置完全相同,其作用的不同之处是______________________________
__________________________________________________________________________
。
(4)该小组同学认为废气中的一氧化碳可以利用,于是设计如下装置除去废气中的二氧
化碳,并收集一瓶一氧化碳,准备进行后续地探究。其中最合理的装置是
(填序号,瓶内为氢氧化钠溶液)。
废气→ 废气→ 废气→
① ② ③
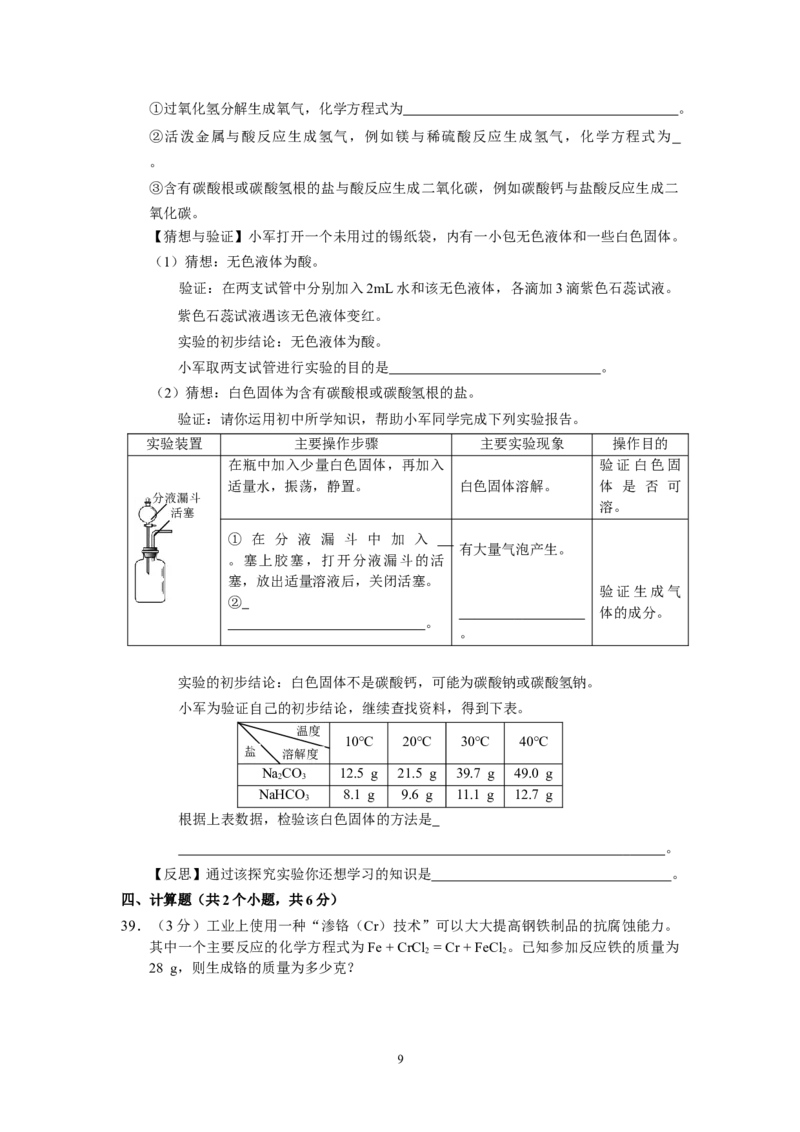
38.(8分)小军见到一种“化学爆竹”(见右图),只要
用手拍打锡纸袋,掷在地上,锡纸袋随后会突然爆开并
伴随响声。他认为,这是锡纸袋中的物质发生化学反应
生成气体造成的,于是想探究锡纸袋中的物质成分。
【提出问题】锡纸袋中的物质是什么?
【查阅资料】主要内容如下。
8①过氧化氢分解生成氧气,化学方程式为 。
②活泼金属与酸反应生成氢气,例如镁与稀硫酸反应生成氢气,化学方程式为
。
③含有碳酸根或碳酸氢根的盐与酸反应生成二氧化碳,例如碳酸钙与盐酸反应生成二
氧化碳。
【猜想与验证】小军打开一个未用过的锡纸袋,内有一小包无色液体和一些白色固体。
(1)猜想:无色液体为酸。
验证:在两支试管中分别加入2mL水和该无色液体,各滴加3滴紫色石蕊试液。
紫色石蕊试液遇该无色液体变红。
实验的初步结论:无色液体为酸。
小军取两支试管进行实验的目的是 。
(2)猜想:白色固体为含有碳酸根或碳酸氢根的盐。
验证:请你运用初中所学知识,帮助小军同学完成下列实验报告。
实验装置 主要操作步骤 主要实验现象 操作目的
在瓶中加入少量白色固体,再加入 验证白色固
适量水,振荡,静置。 白色固体溶解。 体 是 否 可
分液漏斗
溶。
活塞
① 在 分 液 漏 斗 中 加 入
有大量气泡产生。
。塞上胶塞,打开分液漏斗的活
塞,放出适量溶液后,关闭活塞。
验证生成气
②
体的成分。
。
。
实验的初步结论:白色固体不是碳酸钙,可能为碳酸钠或碳酸氢钠。
小军为验证自己的初步结论,继续查找资料,得到下表。
温度
10℃ 20℃ 30℃ 40℃
盐 溶解度
NaCO 12.5 g 21.5 g 39.7 g 49.0 g
2 3
NaHCO 8.1 g 9.6 g 11.1 g 12.7 g
3
根据上表数据,检验该白色固体的方法是
。
【反思】通过该探究实验你还想学习的知识是 。
四、计算题(共2个小题,共6分)
39.(3分)工业上使用一种“渗铬(Cr)技术”可以大大提高钢铁制品的抗腐蚀能力。
其中一个主要反应的化学方程式为Fe + CrCl = Cr + FeCl 。已知参加反应铁的质量为
2 2
28 g,则生成铬的质量为多少克?
940.(3分)在电缆生产过程中会产生一定量的含铜废料。据报道,在通入空气并加热的
条件下,铜与稀硫酸反应转化为硫酸铜。
(1)请完成该反应的化学方程式:
△
2Cu + 2H SO + O 2CuSO +
2 4 2 4
(2)若选用的稀硫酸溶质的质量分数为12%,则用100 mL98%的浓硫酸(密度为1.8
g/cm3)配制该稀硫酸,需加水 g。
(3)取一定量上述稀释后的硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不
和其他杂质反应,则反应后硫酸铜溶液的质量为(写出计算式即可)
g。
102007年北京市高级中等学校招生统一考试(课标卷)
化学试卷答案及评分参考
说明:考生答案如与本答案不同,若答得合理,可酌情给分,但不得超过原题所规定的分
数。
本试卷化学方程式中的“==”和“→”含义相同。
一、选择题(每小题1分,共30分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B A C B A A B B C C D B B A A
题号 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
答案 C D B C A A D D D A C D B C C
二、填空题(每空1分,共26分。)
31.(5分)
(1)①
(2)①碳酸钙 水 ②300 ③能量
32.(6分)
(1)①②③ ④
(2)石油 太阳能
点燃
(3)C H + 5O ==== 3CO + 4HO
3 8 2 2 2
(4)①②③
33.(5分)
(1)氢气 氢、氧两种元素
(2)过滤雨水中的固体杂质
(3)蒸馏水
(4)2CHCOOH + CaCO = (CHCOO)Ca + HO + CO↑
3 3 3 2 2 2
34.(5分)
(1)+4
(2)CaO + HO == Ca(OH)
2 2
(3)45.5
(4)浓硫酸具有很强的腐蚀性
(5)取少量该“双吸剂”于试管中,滴加稀盐酸,若有气泡产生,则“双吸剂”还有
效;否则无效。
35.(5分)
11(1)CO
2
点燃
(2)2H + O ==== 2HO 化合反应
2 2 2
(3)Ca(OH) + 2HCl === CaCl + 2H O NaCO + Ca(OH) == 2NaOH + CaCO ↓
2 2 2 2 3 2 3
三、实验题(每空1分,共18分。)
36.(6分)
(1)①试管 ②集气瓶
(2)B C
(3)2KMnO === KMnO + MnO + O↑ A
4 2 4 2 2
37.(4分)
(1)充分吸收废气中的二氧化碳
高温
(2)Fe O + 3CO ===== 2Fe +3CO
2 3 2
(3)A装置用来检验废气中是否含有二氧化碳;D装置用来检验反应中是否有二氧化
碳生成,进而推断出废气中是否含有一氧化碳。
(4)③
38.(8分)
MnO
2
【查阅资料】 ① 2HO ==== 2HO + O ②Mg + HSO === MgSO + H↑
2 2 2 2 2 4 4 2
【猜想与验证】(1)作空白实验,进行对比
(2)①稀盐酸 ②将气体通入澄清石灰水 澄清石灰水变浑浊
方法:20 ℃时,在100 g水中加入11 g该白色固体,充分溶解后,若有白色固
体剩余,为碳酸氢钠;否则为碳酸钠。
【反思】碳酸钠和碳酸氢钠化学性质上有哪些差异
四、计算题(共6分。)
39.(3分)解:生成铬的质量为x
Fe + CrCl === Cr + FeCl
2 2
56 52
28 g x ………………………………………(1分)
= 或 = ………………………………………(1分)
x= = 26 g ………………………………………(1分)
答:生成铬的质量为26 g。
40.(3分,每空1分)
(1)2HO
2
(2)1290
(3)解法一:64 + 16 + 98÷12%
解法二:160 + 18 + 98÷12% -98
12