文档内容
北京市2018年中考化学真题试题
第一部分 选择题(12分)
1、下列物质能使紫色石蕊试液变红的是( )
A.CO B.O C.NaCl D.NaOH
2 2
【答案】A
【解析】CO 溶于水,且与水反应生成碳酸,能紫色石蕊试液变红。故选A。
2
2、下列含金属元素的物质是( )
A.HSO B.AlO C.NO D.PO
2 4 2 3 2 2 5
【答案】B
【解析】AlO 含有金属铝元素。故选B。
2 3
3、一些物质的pH范围如下,其中呈碱性的是( )
A.油污净(12~13) B.西瓜汁(5~6) C.洁厕灵(1~2) D.橘子汁(3~4)
【答案】A
【解析】溶液pH>7,显碱性。故选A。
4、下列金属不能与CuSO 溶液反应的是( )
4
A.Ag B.Fe C.Zn D.Al
【答案】A
【解析】Fe、Zn 和Al都比Cu活泼,都可以与CuSO 溶液发生置换反应;Cu比Ag活泼,Ag不能
4
与CuSO 溶液发生置换反应。故选A。
4
5、下列操作不正确的是( )
【答案】D
【解析】过滤需要玻璃棒引流。故选D。
6、下列符号能表示2个氯分子的是( )
A.Cl B.2Cl C.2Cl D.2Cl-
2 2
【答案】B
【解析】Cl 表示一个氯分子、氯气;2Cl 表示两个氯分子;2Cl表示两个氯原子;2Cl-表示两个
2 2
1氯离子。故选B。
7、下列物质能与NaOH反应的是( )
A.Fe B.CO C.FeO D.NaCl
2 2 3
【答案】B
【解析】二氧化碳与氢氧化钠反应:CO+2NaOH= NaCO+HO。故选B。
2 2 3 2
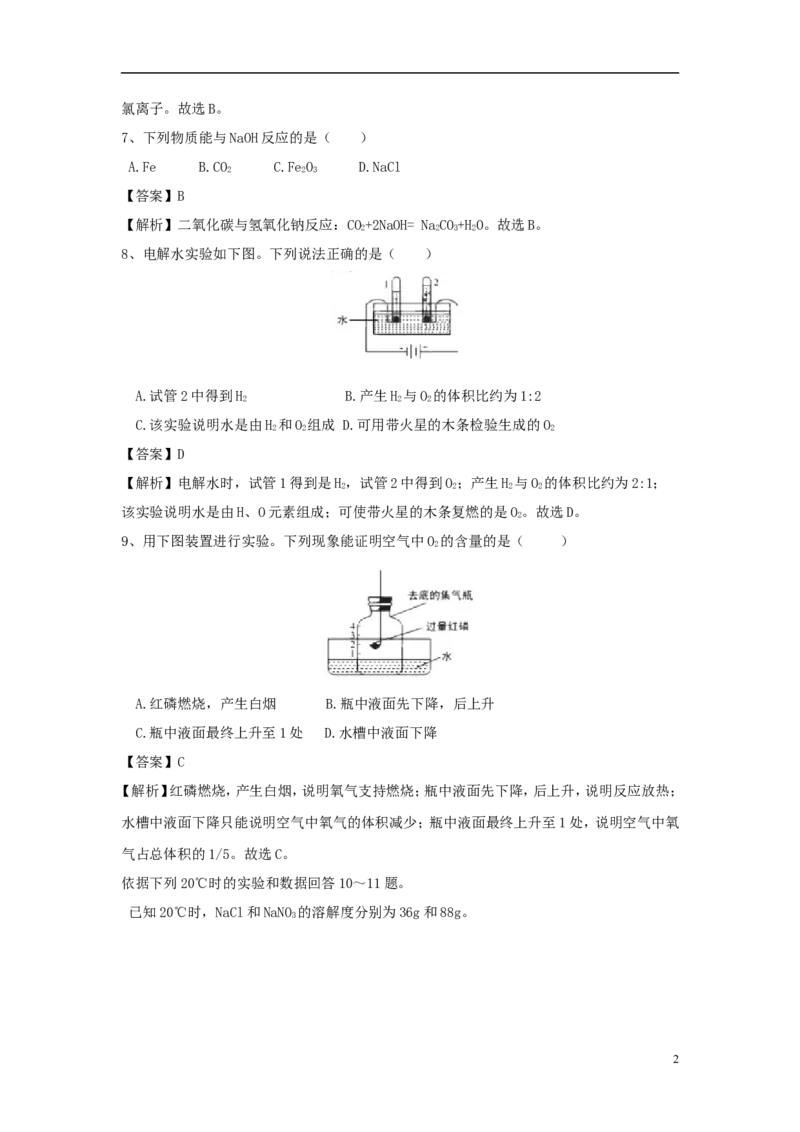
8、电解水实验如下图。下列说法正确的是( )
A.试管2中得到H B.产生H 与O 的体积比约为1:2
2 2 2
C.该实验说明水是由H 和O 组成 D.可用带火星的木条检验生成的O
2 2 2
【答案】D
【解析】电解水时,试管1得到是H,试管2中得到O;产生H 与O 的体积比约为2:1;
2 2 2 2
该实验说明水是由H、O元素组成;可使带火星的木条复燃的是O。故选D。
2
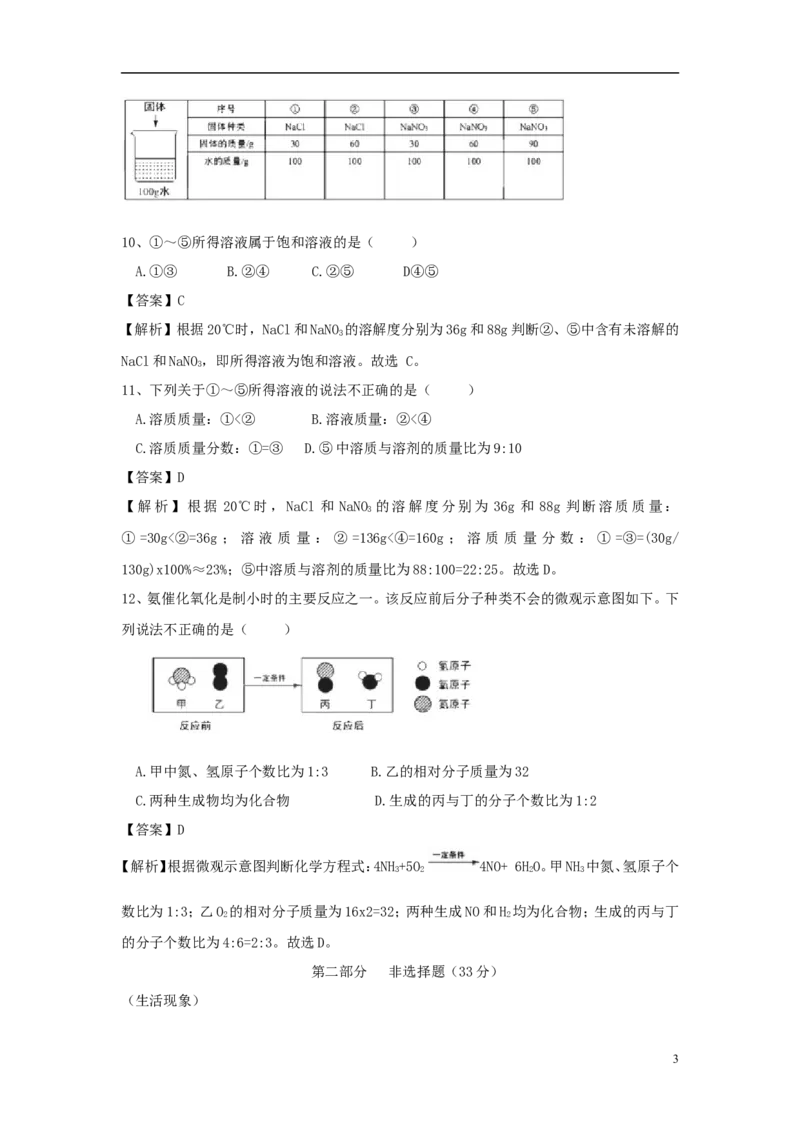
9、用下图装置进行实验。下列现象能证明空气中O 的含量的是( )
2
A.红磷燃烧,产生白烟 B.瓶中液面先下降,后上升
C.瓶中液面最终上升至1处 D.水槽中液面下降
【答案】C
【解析】红磷燃烧,产生白烟,说明氧气支持燃烧;瓶中液面先下降,后上升,说明反应放热;
水槽中液面下降只能说明空气中氧气的体积减少;瓶中液面最终上升至1处,说明空气中氧
气占总体积的1/5。故选C。
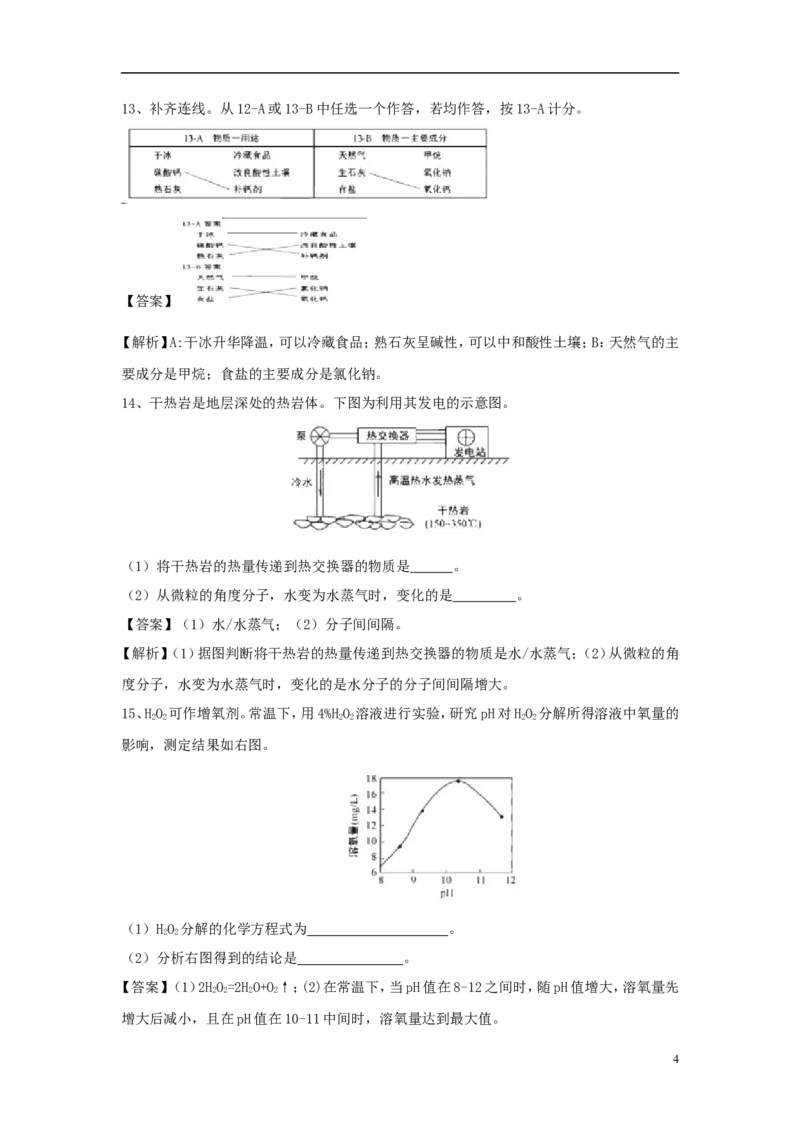
依据下列20℃时的实验和数据回答10~11题。
已知20℃时,NaCl和NaNO 的溶解度分别为36g和88g。
3
210、①~⑤所得溶液属于饱和溶液的是( )
A.①③ B.②④ C.②⑤ D④⑤
【答案】C
【解析】根据20℃时,NaCl和NaNO 的溶解度分别为36g和88g判断②、⑤中含有未溶解的
3
NaCl和NaNO,即所得溶液为饱和溶液。故选 C。
3
11、下列关于①~⑤所得溶液的说法不正确的是( )
A.溶质质量:①<② B.溶液质量:②<④
C.溶质质量分数:①=③ D.⑤中溶质与溶剂的质量比为9:10
【答案】D
【解析】根据 20℃时,NaCl 和 NaNO 的溶解度分别为 36g 和 88g 判断溶质质量:
3
① =30g<②=36g ; 溶 液 质 量 : ② =136g<④=160g ; 溶 质 质 量 分 数 : ① =③=(30g/
130g)x100%≈23%;⑤中溶质与溶剂的质量比为88:100=22:25。故选D。
12、氨催化氧化是制小时的主要反应之一。该反应前后分子种类不会的微观示意图如下。下
列说法不正确的是( )
A.甲中氮、氢原子个数比为1:3 B.乙的相对分子质量为32
C.两种生成物均为化合物 D.生成的丙与丁的分子个数比为1:2
【答案】D
【解析】根据微观示意图判断化学方程式:4NH+5O 4NO+ 6HO。甲NH 中氮、氢原子个
3 2 2 3
数比为1:3;乙O 的相对分子质量为16x2=32;两种生成NO和H 均为化合物;生成的丙与丁
2 2
的分子个数比为4:6=2:3。故选D。
第二部分 非选择题(33分)
(生活现象)
313、补齐连线。从12-A或13-B中任选一个作答,若均作答,按13-A计分。
【答案】
【解析】A:干冰升华降温,可以冷藏食品;熟石灰呈碱性,可以中和酸性土壤;B:天然气的主
要成分是甲烷;食盐的主要成分是氯化钠。
14、干热岩是地层深处的热岩体。下图为利用其发电的示意图。
(1)将干热岩的热量传递到热交换器的物质是 。
(2)从微粒的角度分子,水变为水蒸气时,变化的是 。
【答案】(1)水/水蒸气;(2)分子间间隔。
【解析】(1)据图判断将干热岩的热量传递到热交换器的物质是水/水蒸气;(2)从微粒的角
度分子,水变为水蒸气时,变化的是水分子的分子间间隔增大。
15、HO 可作增氧剂。常温下,用4%HO 溶液进行实验,研究pH对HO 分解所得溶液中氧量的
2 2 2 2 2 2
影响,测定结果如右图。
(1)HO 分解的化学方程式为 。
2 2
(2)分析右图得到的结论是 。
【答案】(1)2HO=2HO+O↑;(2)在常温下,当pH值在8-12之间时,随pH值增大,溶氧量先
2 2 2 2
增大后减小,且在pH值在10-11中间时,溶氧量达到最大值。
4【解析】(1)HO 分解的化学方程式为2HO=2HO+O↑;(2)根据图中信息判断在常温下,当pH
2 2 2 2 2 2
值在8-12之间时,随pH值增大,溶氧量先增大后减小,且在pH值在10-11中间时,溶氧量达
到最大值。
(科普阅读理解)
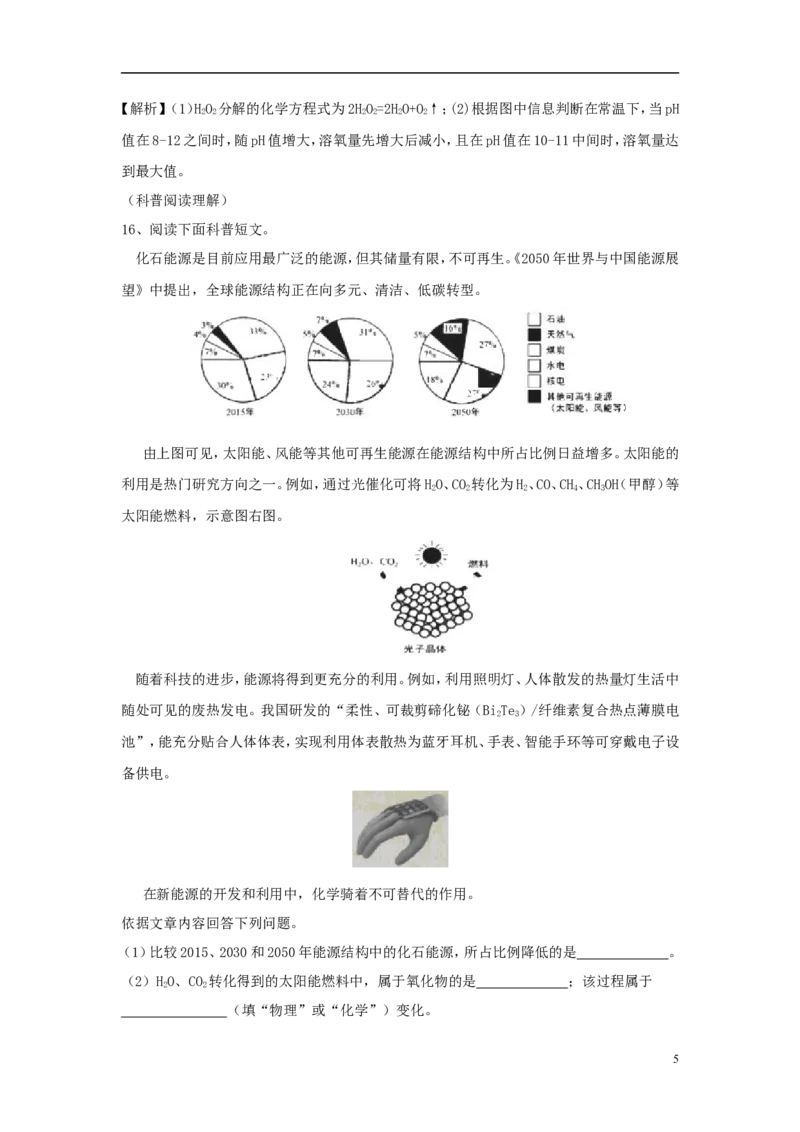
16、阅读下面科普短文。
化石能源是目前应用最广泛的能源,但其储量有限,不可再生。《2050年世界与中国能源展
望》中提出,全球能源结构正在向多元、清洁、低碳转型。
由上图可见,太阳能、风能等其他可再生能源在能源结构中所占比例日益增多。太阳能的
利用是热门研究方向之一。例如,通过光催化可将HO、CO 转化为H、CO、CH、CHOH(甲醇)等
2 2 2 4 3
太阳能燃料,示意图右图。
随着科技的进步,能源将得到更充分的利用。例如,利用照明灯、人体散发的热量灯生活中
随处可见的废热发电。我国研发的“柔性、可裁剪碲化铋(BiTe)/纤维素复合热点薄膜电
2 3
池”,能充分贴合人体体表,实现利用体表散热为蓝牙耳机、手表、智能手环等可穿戴电子设
备供电。
在新能源的开发和利用中,化学骑着不可替代的作用。
依据文章内容回答下列问题。
(1)比较2015、2030和2050年能源结构中的化石能源,所占比例降低的是 。
(2)HO、CO 转化得到的太阳能燃料中,属于氧化物的是 ;该过程属于
2 2
(填“物理”或“化学”)变化。
5(3)复合热点薄膜电池中BiTe 由 种元素组成。
2 3
(4)下列说法正确的是 (填序号)。
A.能源结构向多元、清洁、低碳转型 B.科技进步会促进能源的利用
C.石油和太阳能属于可再生能源 D.生活中的废热可转化为电能
【答案】(1)常规能源煤炭、石油等比例降低;(2)CO化学;(3)两(或2);(4)ABD。
【解析】(1)据图判断太阳能、风能等其他可再生能源在能源结构中所占比例日益增多,常
规能源煤炭、石油等比例降低;(2)根据光催化可将HO、CO 转化为H、CO、CH、CHOH(甲醇)
2 2 2 4 3
中CO属于氧化物;该过程是化学变化;(3)BiTe 由Bi、Te两种元素组成;(4)根据材料和图
2 3
判断能源结构向多元、清洁、低碳转型;科技进步会促进能源的利用;石油属于不可再生资源,
太阳能属于可再生能源;生活中的废热可转化为电能。故选ABD。
(生产实际分析)
17、炼铁的主要原料是赤铁矿(主要成分是FeO)、焦炭、空气等,转化过程如下:
2 3
(1)②中,反应为CO+C 高温 2CO,其中化合价发生改变的元素是 。
2
(2)③中,CO与FeO 反应的化学方程式为 。
2 3
【答案】(1)C或碳元素;(2) 。
【解析】(1)CO 中C的化合价为+4,O的化合价为-2,C单质的化合价为0,CO中C的化合价为
2
+2,O的化合价为-2,即该反应中碳元素化合价发生改变;(2)工业炼铁的反应方程式:
。
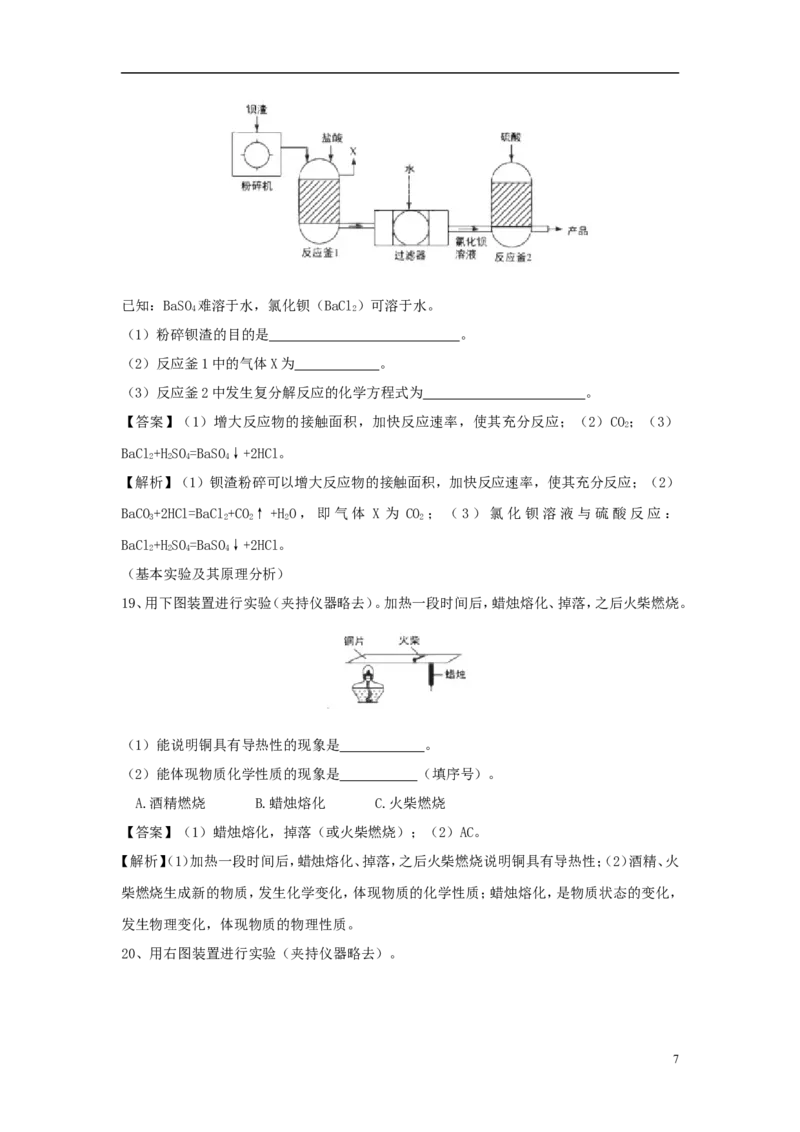
18、为保护绿水青山,可将工业残留的钡渣(主要成分为碳酸钡(BaCO))进行无害化处理,制
3
取化工原料;硫酸钡(BaSO)。主要流程如下:
4
6已知:BaSO 难溶于水,氯化钡(BaCl)可溶于水。
4 2
(1)粉碎钡渣的目的是 。
(2)反应釜1中的气体X为 。
(3)反应釜2中发生复分解反应的化学方程式为 。
【答案】(1)增大反应物的接触面积,加快反应速率,使其充分反应;(2)CO ;(3)
2
BaCl+HSO=BaSO↓+2HCl。
2 2 4 4
【解析】(1)钡渣粉碎可以增大反应物的接触面积,加快反应速率,使其充分反应;(2)
BaCO+2HCl=BaCl+CO↑+HO,即气体 X 为 CO ;(3)氯化钡溶液与硫酸反应:
3 2 2 2 2
BaCl+HSO=BaSO↓+2HCl。
2 2 4 4
(基本实验及其原理分析)
19、用下图装置进行实验(夹持仪器略去)。加热一段时间后,蜡烛熔化、掉落,之后火柴燃烧。
(1)能说明铜具有导热性的现象是 。
(2)能体现物质化学性质的现象是 (填序号)。
A.酒精燃烧 B.蜡烛熔化 C.火柴燃烧
【答案】(1)蜡烛熔化,掉落(或火柴燃烧);(2)AC。
【解析】(1)加热一段时间后,蜡烛熔化、掉落,之后火柴燃烧说明铜具有导热性;(2)酒精、火
柴燃烧生成新的物质,发生化学变化,体现物质的化学性质;蜡烛熔化,是物质状态的变化,
发生物理变化,体现物质的物理性质。
20、用右图装置进行实验(夹持仪器略去)。
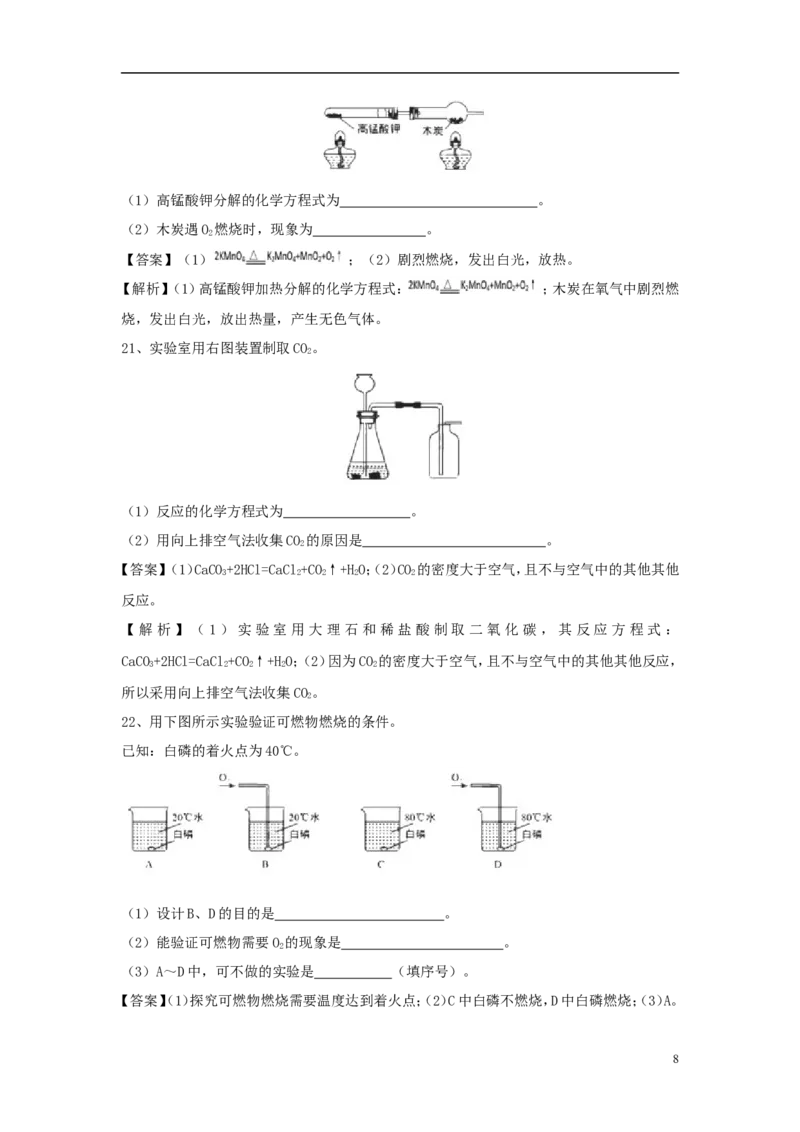
7(1)高锰酸钾分解的化学方程式为 。
(2)木炭遇O 燃烧时,现象为 。
2
【答案】(1) ;(2)剧烈燃烧,发出白光,放热。
【解析】(1)高锰酸钾加热分解的化学方程式: ;木炭在氧气中剧烈燃
烧,发出白光,放出热量,产生无色气体。
21、实验室用右图装置制取CO。
2
(1)反应的化学方程式为 。
(2)用向上排空气法收集CO 的原因是 。
2
【答案】(1)CaCO+2HCl=CaCl+CO↑+HO;(2)CO 的密度大于空气,且不与空气中的其他其他
3 2 2 2 2
反应。
【解析】(1)实验室用大理石和稀盐酸制取二氧化碳,其反应方程式:
CaCO+2HCl=CaCl+CO↑+HO;(2)因为CO 的密度大于空气,且不与空气中的其他其他反应,
3 2 2 2 2
所以采用向上排空气法收集CO。
2
22、用下图所示实验验证可燃物燃烧的条件。
已知:白磷的着火点为40℃。
(1)设计B、D的目的是 。
(2)能验证可燃物需要O 的现象是 。
2
(3)A~D中,可不做的实验是 (填序号)。
【答案】(1)探究可燃物燃烧需要温度达到着火点;(2)C中白磷不燃烧,D中白磷燃烧;(3)A。
8【解析】(1)白磷是可燃物,B图温度为20℃,通入氧气,白磷不燃烧,温度未达到着火点,探
究可燃物燃烧需要温度达到着火点;D图温度为80℃,通入氧气,白磷燃烧,温度达到着火点,
设计B、D的目的是探究可燃物燃烧需要温度达到着火点;(2)C中温度达到80℃,达到白磷
的着火点,由于没有氧气,白磷不燃烧,而D中,通入氧气,白磷燃烧,说明可燃物燃烧需要氧
气;(3)B、D验证可燃物燃烧需要达到着火点,C、D验证可燃物燃烧需要氧气,A不需要做。
23、进行如下微型实验,研究物质的性质。
(1)能产生气泡的是 (填序号)。
(2)能证明C中发生反应的现象是 。
(3)有一只烧杯中的物质不与稀盐酸反应,原因是 。
【答案】(1)BD;(2)红色溶液变为无色;(3)Cu的活动性排在氢后,所以不与稀盐酸反应。
【解析】(1)Mg、NaHCO 都与稀盐酸反应生成气体。故填BD;(2)滴有酚酞的澄清石灰水的溶
3
液为红色溶,稀盐酸能与氢氧化钙发生中和反应,当溶液由红色变为无色时,说明发生反应;
(3)Cu的活动性排在氢后,所以不与稀盐酸反应,A烧杯中物质不与稀盐酸反应。
(科学探究)
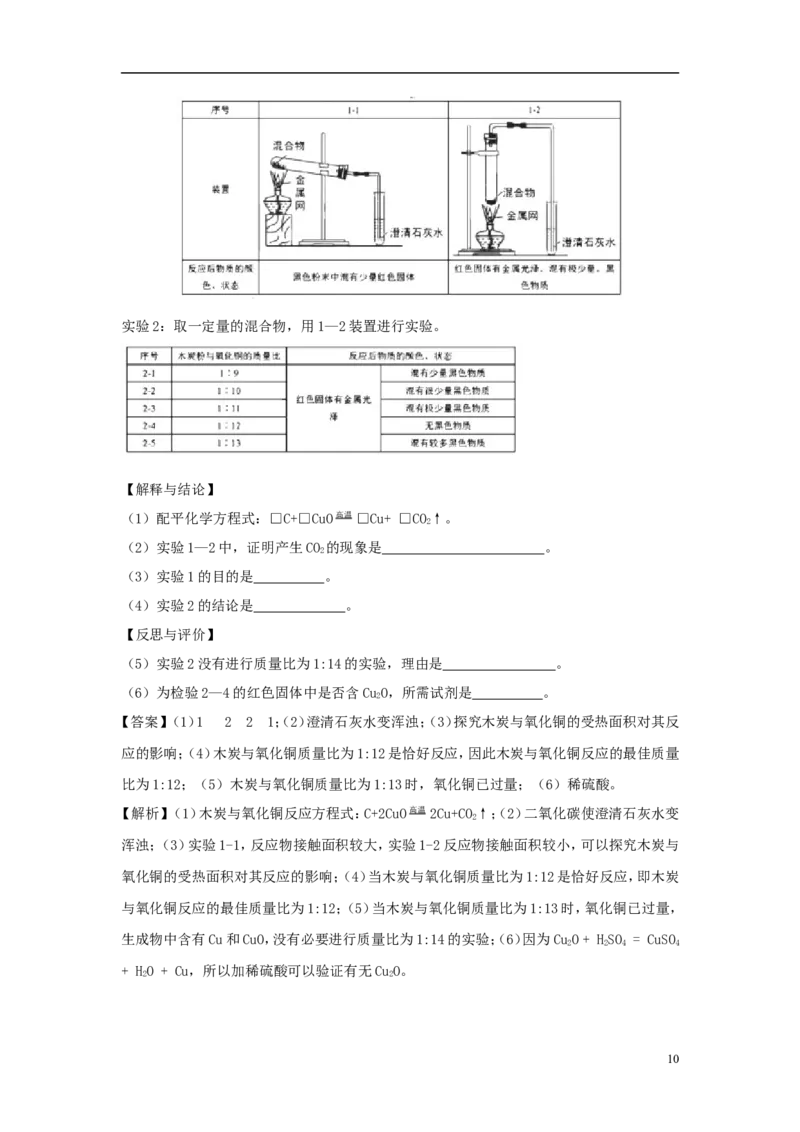
24、为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系
列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,
能与稀硫酸反应:CuO+ HSO = CuSO + HO + Cu
2 2 4 4 2
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
9实验2:取一定量的混合物,用1—2装置进行实验。
【解释与结论】
(1)配平化学方程式:□C+□CuO高温 □Cu+ □CO↑。
2
(2)实验1—2中,证明产生CO 的现象是 。
2
(3)实验1的目的是 。
(4)实验2的结论是 。
【反思与评价】
(5)实验2没有进行质量比为1:14的实验,理由是 。
(6)为检验2—4的红色固体中是否含CuO,所需试剂是 。
2
【答案】(1)1 2 2 1;(2)澄清石灰水变浑浊;(3)探究木炭与氧化铜的受热面积对其反
应的影响;(4)木炭与氧化铜质量比为1:12是恰好反应,因此木炭与氧化铜反应的最佳质量
比为1:12;(5)木炭与氧化铜质量比为1:13时,氧化铜已过量;(6)稀硫酸。
【解析】(1)木炭与氧化铜反应方程式:C+2CuO高温 2Cu+CO↑;(2)二氧化碳使澄清石灰水变
2
浑浊;(3)实验1-1,反应物接触面积较大,实验1-2反应物接触面积较小,可以探究木炭与
氧化铜的受热面积对其反应的影响;(4)当木炭与氧化铜质量比为1:12是恰好反应,即木炭
与氧化铜反应的最佳质量比为1:12;(5)当木炭与氧化铜质量比为1:13时,氧化铜已过量,
生成物中含有Cu和CuO,没有必要进行质量比为1:14的实验;(6)因为CuO+ HSO = CuSO
2 2 4 4
+ HO + Cu,所以加稀硫酸可以验证有无CuO。
2 2
10