文档内容
2025 年普通高中学业水平选择性考试(江苏卷)
化学
本试卷满分 100分,考试时间 75分钟。
可能用到的相对原子质量:
H—1 C—12 O—16 S—32 Cl—35.5 K—39
Fe—56 Zn—65 As—75 Cd—112 Ce—140
一、单项选择题:共 13题,每题 3分,共 39分。每题只有一个选项最符合题
意。
1.大气中的氮是取之不尽的天然资源。下列工业生产中以氮气作反应物的是
A.工业合成氨 B.湿法炼铜 C.高炉炼铁 D.接触法制硫酸
2.科学家通过核反应1n6Li3 H4He发现氚 3H 。下列说法正确的是
0 3 1 2 1
A.1n表示一个质子
0
B.6Li的基态原子核外电子排布式为1s12s2
3
C.3H与2H互为同位素
1 1
D.4He的原子结构示意图为
2
3.用0.05000molL1草酸H C O 溶液滴定未知浓度的NaOH溶液。下列实验操作规范的是
2 2 4
A.配制草酸溶 B.润洗滴定
C.滴定 D.读数
液 管
A.A B.B C.C D.D
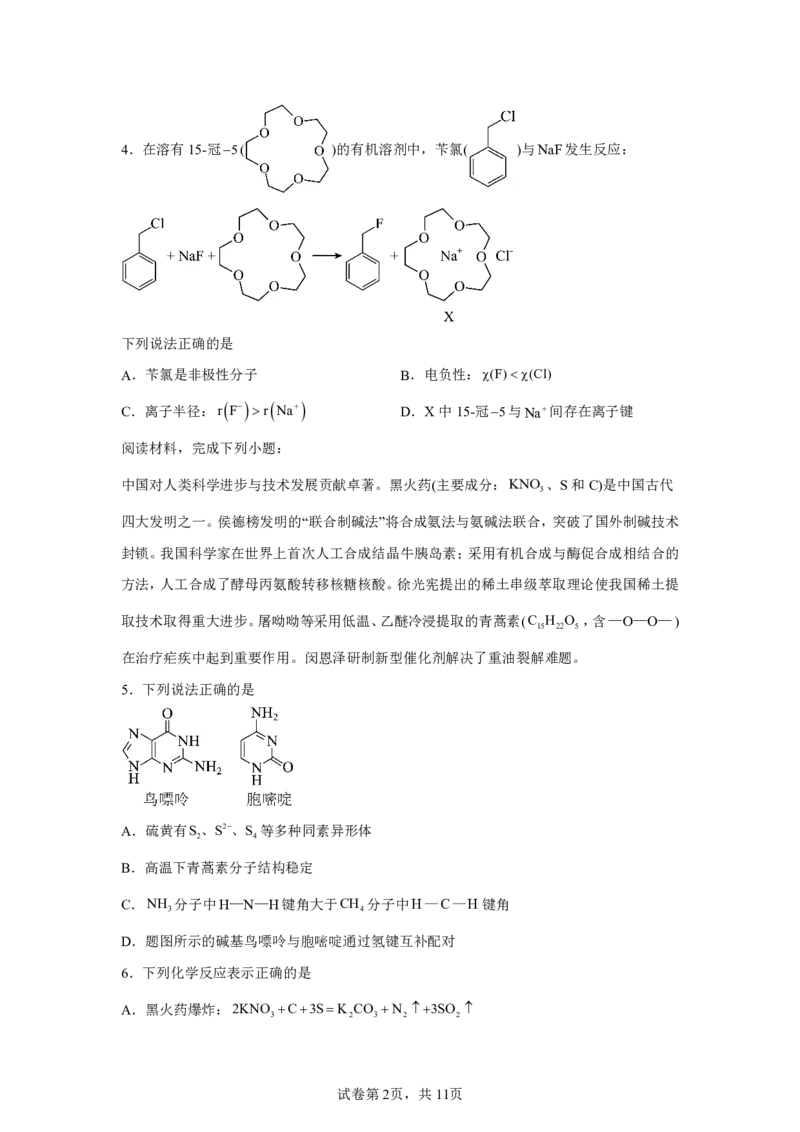
试卷第1页,共11页4.在溶有15-冠5( )的有机溶剂中,苄氯( )与NaF发生反应:
下列说法正确的是
A.苄氯是非极性分子 B.电负性:χ(F)χ(Cl)
C.离子半径:r
F
r
Na
D.X中15-冠5与Na间存在离子键
阅读材料,完成下列小题:
中国对人类科学进步与技术发展贡献卓著。黑火药(主要成分:KNO 、S和C)是中国古代
3
四大发明之一。侯德榜发明的“联合制碱法”将合成氨法与氨碱法联合,突破了国外制碱技术
封锁。我国科学家在世界上首次人工合成结晶牛胰岛素;采用有机合成与酶促合成相结合的
方法,人工合成了酵母丙氨酸转移核糖核酸。徐光宪提出的稀土串级萃取理论使我国稀土提
取技术取得重大进步。屠呦呦等采用低温、乙醚冷浸提取的青蒿素(C H O ,含—O—O—)
15 22 5
在治疗疟疾中起到重要作用。闵恩泽研制新型催化剂解决了重油裂解难题。
5.下列说法正确的是
A.硫黄有S、S2、S 等多种同素异形体
2 4
B.高温下青蒿素分子结构稳定
C.NH 分子中H—N—H键角大于CH 分子中H—C—H键角
3 4
D.题图所示的碱基鸟嘌呤与胞嘧啶通过氢键互补配对
6.下列化学反应表示正确的是
A.黑火药爆炸:2KNO C3SK CO N 3SO
3 2 3 2 2
试卷第2页,共11页通电
B.电解饱和NaCl溶液制NaOH:Cl2H O 2OHH ClO
2 2
C.重油裂解获得的丙烯制聚丙烯:nCH CHCH 催化剂
2 3
D.向饱和氨盐水中通入过量CO :NaClNH H OCO NaHCO NH Cl
2 3 2 2 3 4
7.下列物质组成或性质与分离提纯方法对应关系正确的是
A.蛋白质能水解,可用饱和NH SO 溶液提纯蛋白质
4 2 4
B.乙醚与青蒿素组成元素相同,可用乙醚提取青蒿素
C.CCl 难溶于水、比水易溶解I ,可用CCl 萃取碘水中的I
4 2 4 2
D.不同的烃密度不同,可通过分馏从石油中获得汽油、柴油
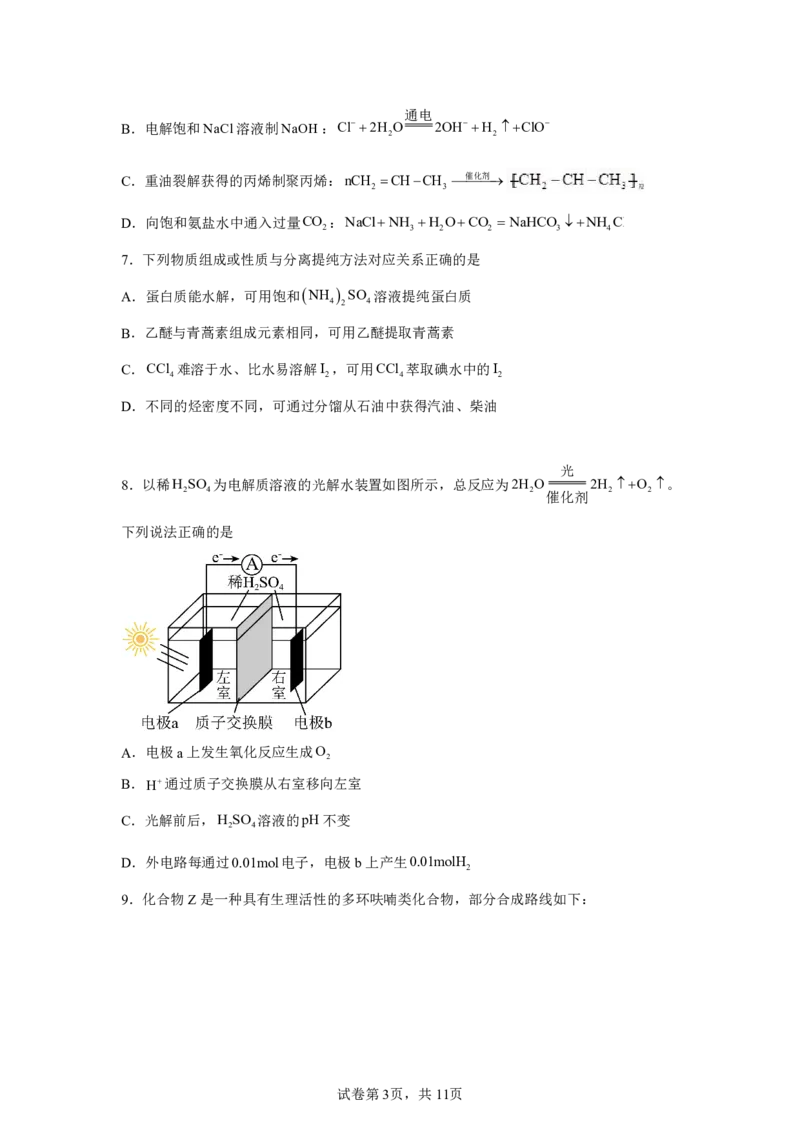
光
8.以稀H SO 为电解质溶液的光解水装置如图所示,总反应为2H O 2H O 。
2 4 2 催化剂 2 2
下列说法正确的是
A.电极a上发生氧化反应生成O
2
B.H通过质子交换膜从右室移向左室
C.光解前后,H SO 溶液的pH不变
2 4
D.外电路每通过0.01mol电子,电极b上产生0.01molH
2
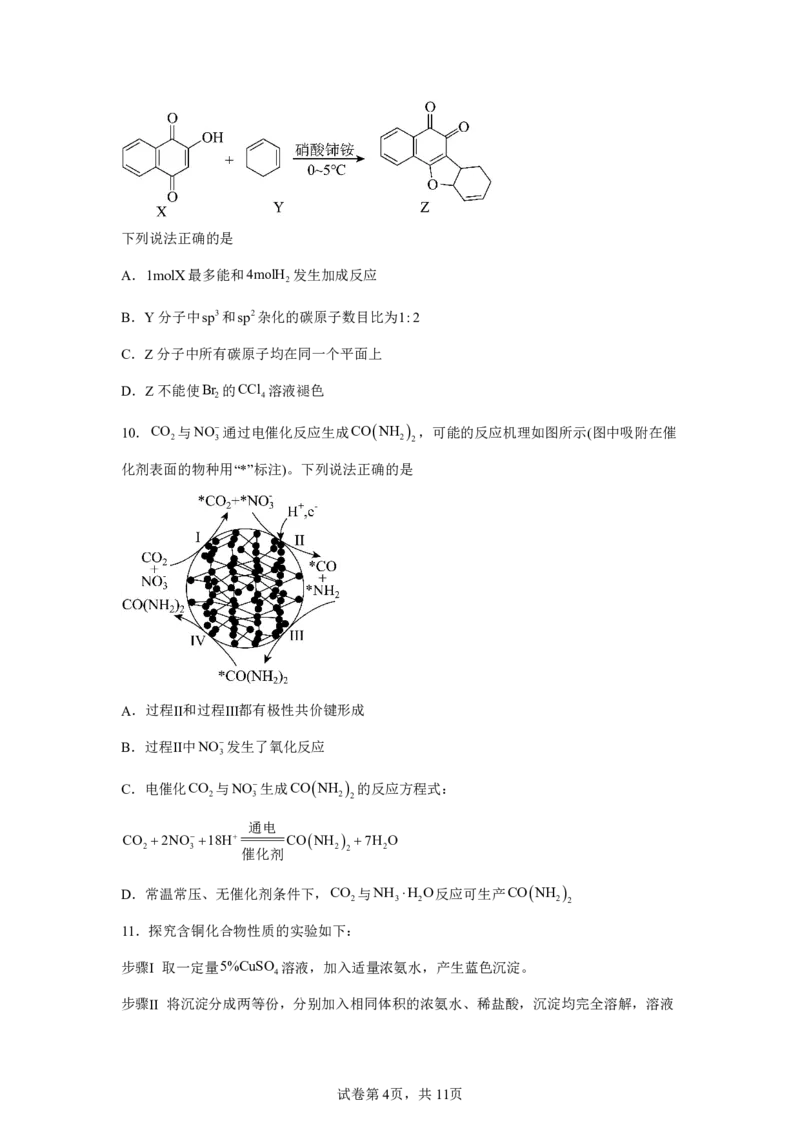
9.化合物Z是一种具有生理活性的多环呋喃类化合物,部分合成路线如下:
试卷第3页,共11页下列说法正确的是
A.1molX最多能和4molH 发生加成反应
2
B.Y分子中sp3和sp2杂化的碳原子数目比为1:2
C.Z分子中所有碳原子均在同一个平面上
D.Z不能使Br 的CCl 溶液褪色
2 4
10.CO 与NO通过电催化反应生成CONH ,可能的反应机理如图所示(图中吸附在催
2 3 2 2
化剂表面的物种用“*”标注)。下列说法正确的是
A.过程Ⅱ和过程Ⅲ都有极性共价键形成
B.过程Ⅱ中NO发生了氧化反应
3
C.电催化CO 与NO生成CONH 的反应方程式:
2 3 2 2
通电
CO 2NO18H CONH 7H O
2 3 催化剂 2 2 2
D.常温常压、无催化剂条件下,CO 与NH H O反应可生产CONH
2 3 2 2 2
11.探究含铜化合物性质的实验如下:
步骤Ⅰ 取一定量5%CuSO 溶液,加入适量浓氨水,产生蓝色沉淀。
4
步骤Ⅱ 将沉淀分成两等份,分别加入相同体积的浓氨水、稀盐酸,沉淀均完全溶解,溶液
试卷第4页,共11页分别呈现深蓝色、蓝色。
步骤Ⅲ 向步骤Ⅱ所得的深蓝色溶液中插入一根打磨过的铁钉,无明显现象;继续加入稀盐
酸,振荡后静置,产生少量气泡,铁钉表面出现红色物质。
下列说法正确的是
A.步骤Ⅰ产生的蓝色沉淀为
CuNH
3
4
SO
4
B.步骤Ⅱ的两份溶液中:c
Cu2
c
Cu2
深蓝色 蓝色
C.步骤Ⅲ中无明显现象是由于铁钉遇深蓝色溶液迅速钝化
D.步骤Ⅲ中产生气体、析出红色物质的反应为
CuNH
3
4
2 FeCuFe24NH
3
12.室温下,有色金属冶炼废渣(含Cu、Ni、Si 等的氧化物)用过量的较浓H SO 溶液酸浸后,
2 4
提取铜和镍的过程如下所示。
已知:K HSO 1.2102,K H SO 1.2102,K H SO 6.0108。下列说法正确
a 4 al 2 3 a2 2 3
的是
A.较浓H SO 溶液中:c
H
2c
SO2
c
OH
2 4 4
B.NaHSO 溶液中:2HSO SO2H SO 的平衡常数K5.0106
3 3 3 2 3
C.NH C O 溶液中:cNH H Oc OH cH C O c HC O c H
4 2 2 4 3 2 2 2 4 2 4
D.“提铜”和“沉镍”后的两份滤液中:c
Na
c
Na
提铜 沉镍
13.甘油C H O 水蒸气重整获得H 过程中的主要反应:
3 8 3 2
反应Ⅰ C H O (g)3CO(g)4H (g) H0
3 8 3 2
反应Ⅱ CO(g)H O(g)CO (g)H (g) H0
2 2 2
反应Ⅲ CO (g)4H (g)CH (g)2H O(g) H0
2 2 4 2
1.0105Pa条件下,1molC H O 和9molH O发生上述反应达平衡状态时,体系中
3 8 3 2
试卷第5页,共11页CO、H 、CO 和CH 的物质的量随温度变化的理论计算结果如图所示。下列说法正确的是
2 2 4
A.550℃时,H O的平衡转化率为20%
2
B.550℃反应达平衡状态时,nCO :n(CO)11:25
2
C.其他条件不变,在400~550℃范围,平衡时H O的物质的量随温度升高而增大
2
D.其他条件不变,加压有利于增大平衡时H 的物质的量
2
二、非选择题:共 4题,共 61分。
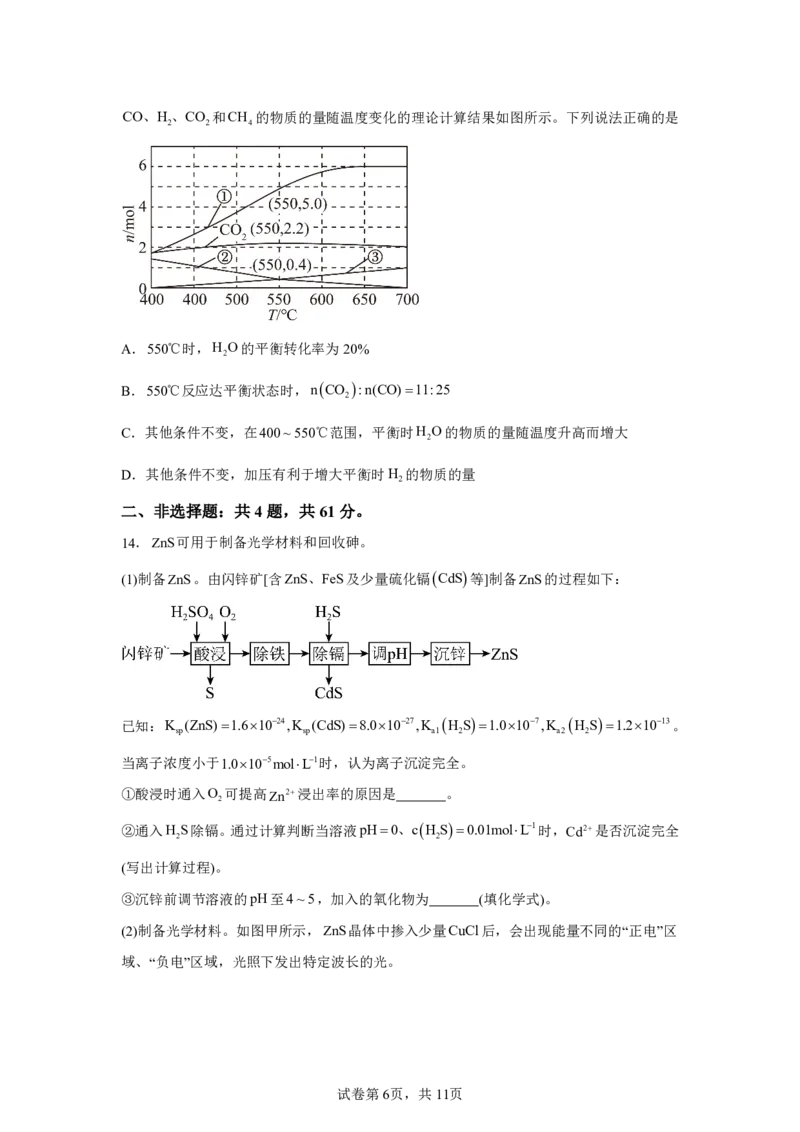
14.ZnS可用于制备光学材料和回收砷。
(1)制备ZnS。由闪锌矿[含ZnS、FeS及少量硫化镉CdS等]制备ZnS的过程如下:
已知:K (ZnS)1.61024,K (CdS)8.01027,K H S1.0107,K H S1.21013。
sp sp a1 2 a2 2
当离子浓度小于1.0105molL1时,认为离子沉淀完全。
①酸浸时通入O 可提高Zn2浸出率的原因是 。
2
②通入H S除镉。通过计算判断当溶液pH0、cH S0.01molL1时,Cd2是否沉淀完全
2 2
(写出计算过程)。
③沉锌前调节溶液的pH至4~5,加入的氧化物为 (填化学式)。
(2)制备光学材料。如图甲所示,ZnS晶体中掺入少量CuCl后,会出现能量不同的“正电”区
域、“负电”区域,光照下发出特定波长的光。
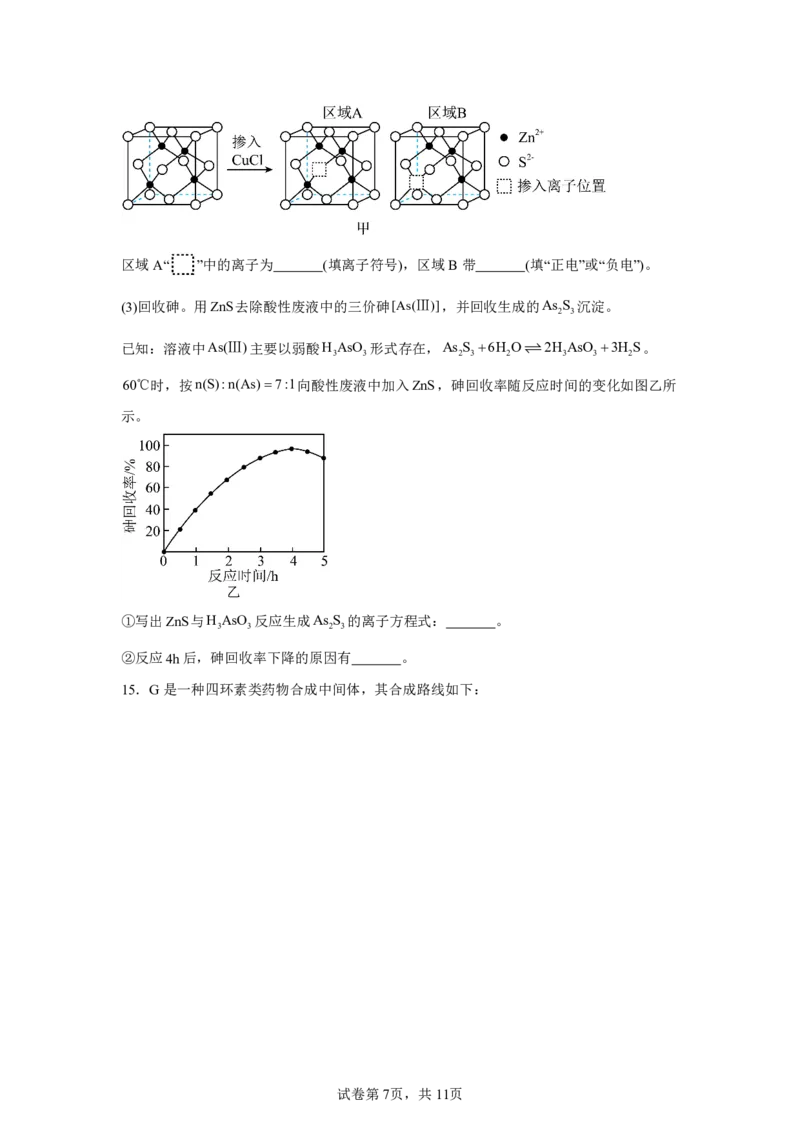
试卷第6页,共11页区域A“ ”中的离子为 (填离子符号),区域B带 (填“正电”或“负电”)。
(3)回收砷。用ZnS去除酸性废液中的三价砷[As(Ⅲ)],并回收生成的As S 沉淀。
2 3
已知:溶液中As(Ⅲ)主要以弱酸H AsO 形式存在,As S 6H O2H AsO 3H S。
3 3 2 3 2 3 3 2
60℃时,按n(S):n(As)7:1向酸性废液中加入ZnS,砷回收率随反应时间的变化如图乙所
示。
①写出ZnS与H AsO 反应生成As S 的离子方程式: 。
3 3 2 3
②反应4h后,砷回收率下降的原因有 。
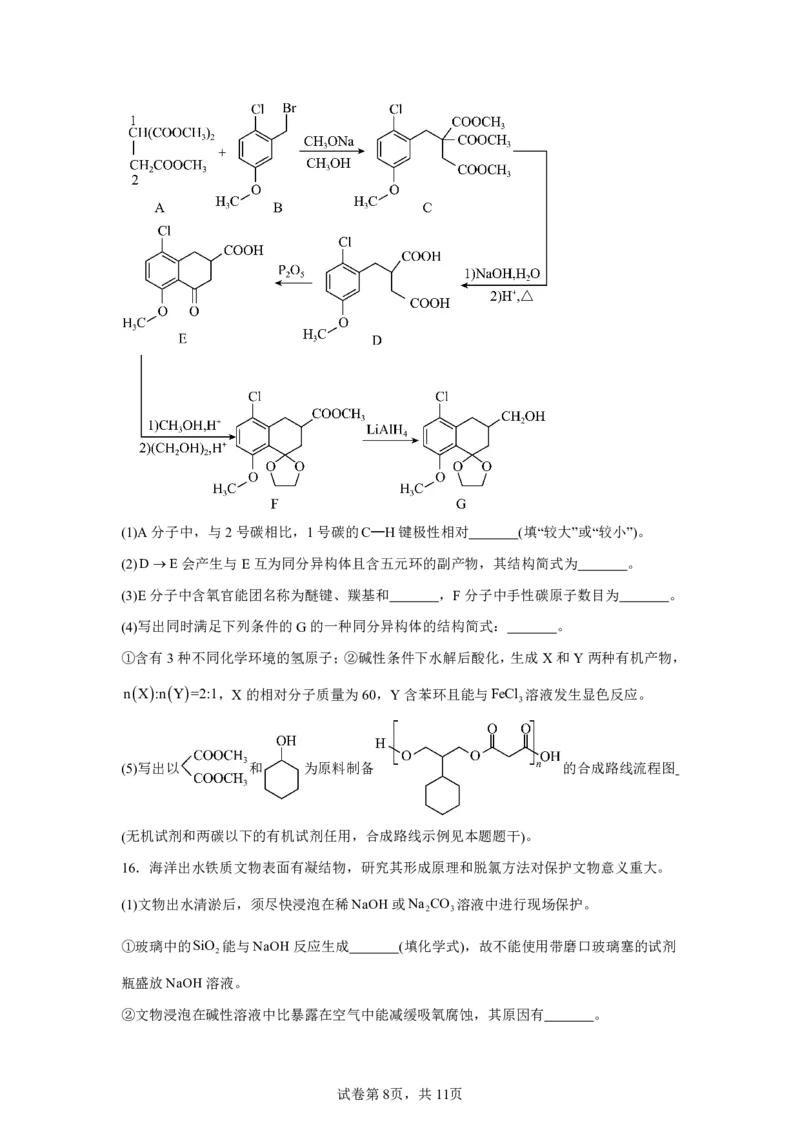
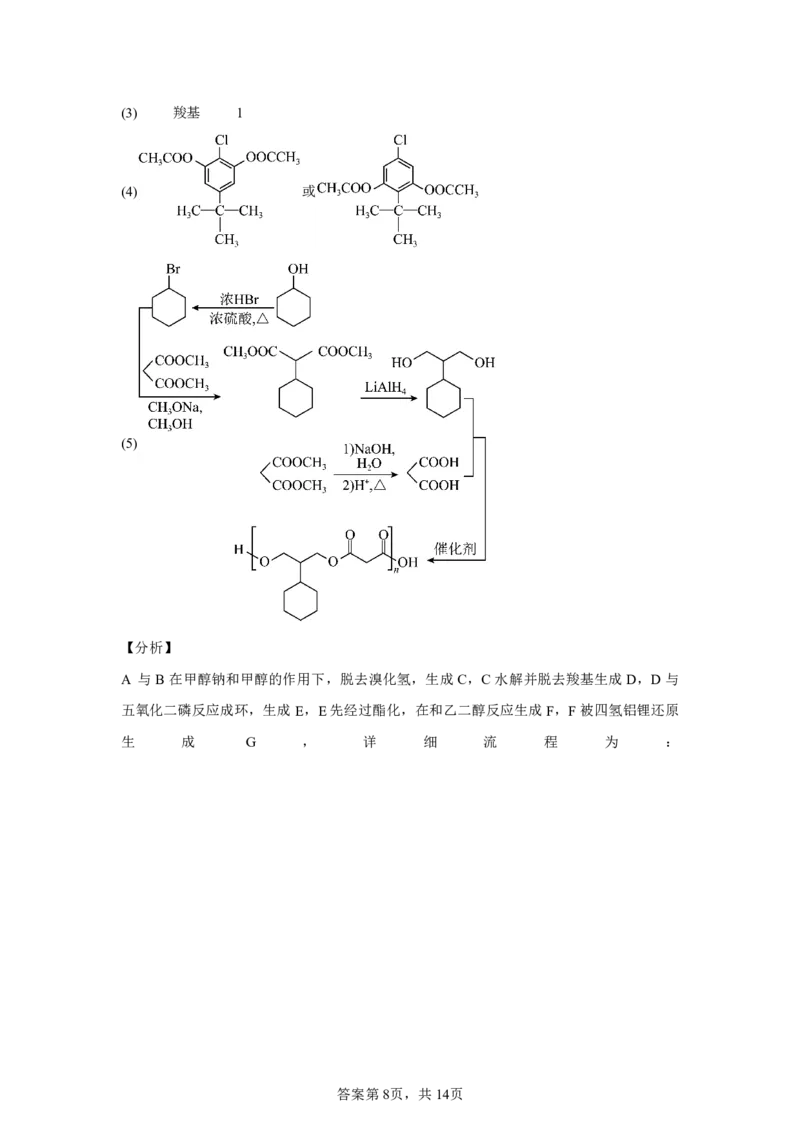
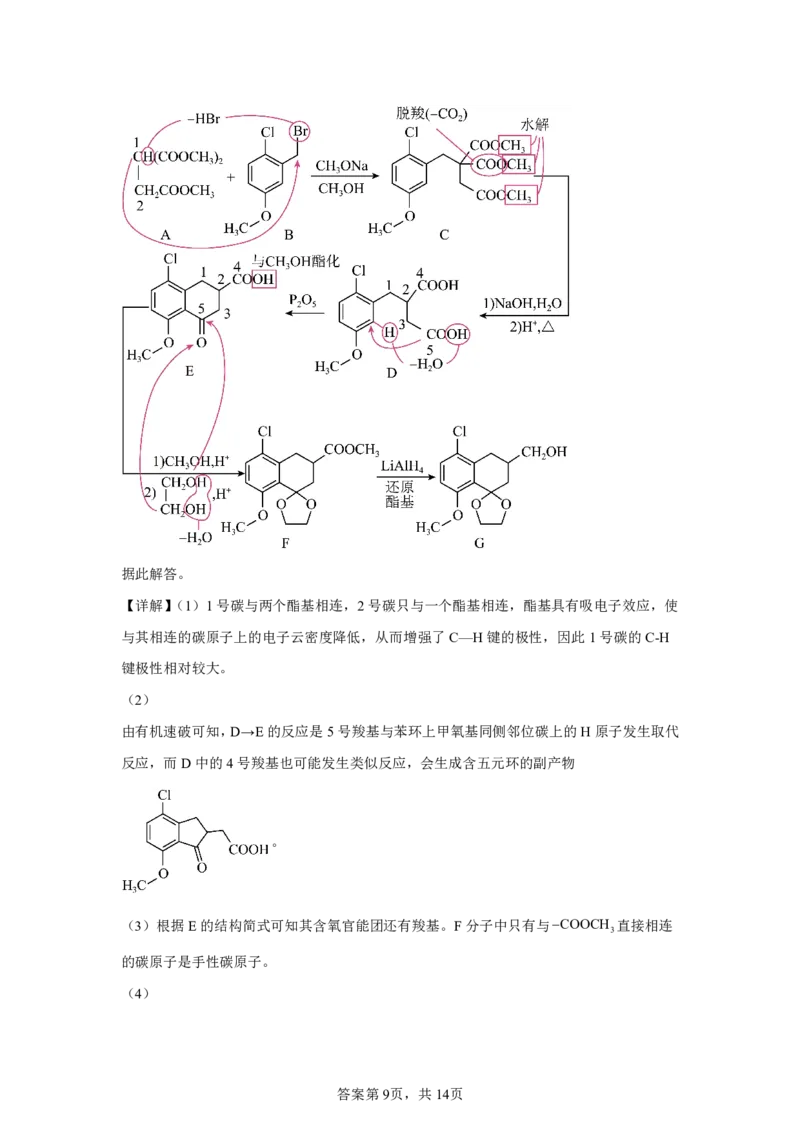
15.G是一种四环素类药物合成中间体,其合成路线如下:
试卷第7页,共11页(1)A分子中,与2号碳相比,1号碳的C—H键极性相对 (填“较大”或“较小”)。
(2)DE会产生与E互为同分异构体且含五元环的副产物,其结构简式为 。
(3)E分子中含氧官能团名称为醚键、羰基和 ,F分子中手性碳原子数目为 。
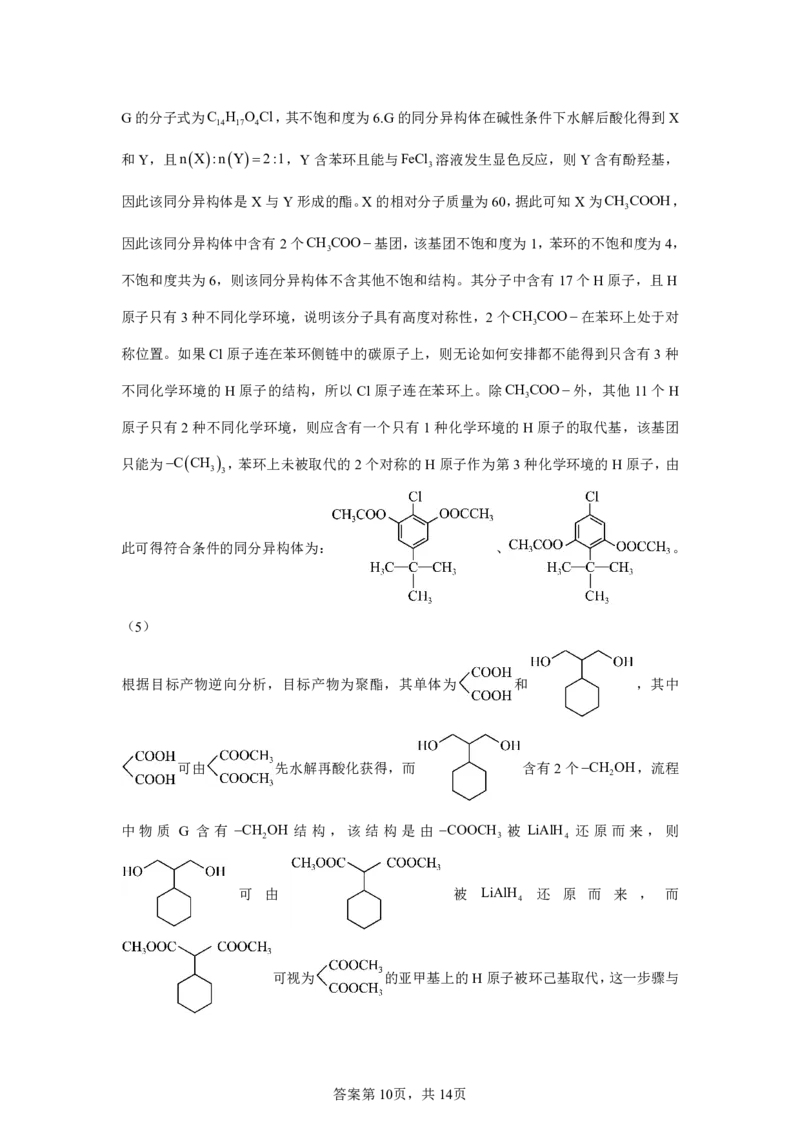
(4)写出同时满足下列条件的G的一种同分异构体的结构简式: 。
①含有3种不同化学环境的氢原子;②碱性条件下水解后酸化,生成X和Y两种有机产物,
nX:nY=2:1,X的相对分子质量为60,Y含苯环且能与FeCl 溶液发生显色反应。
3
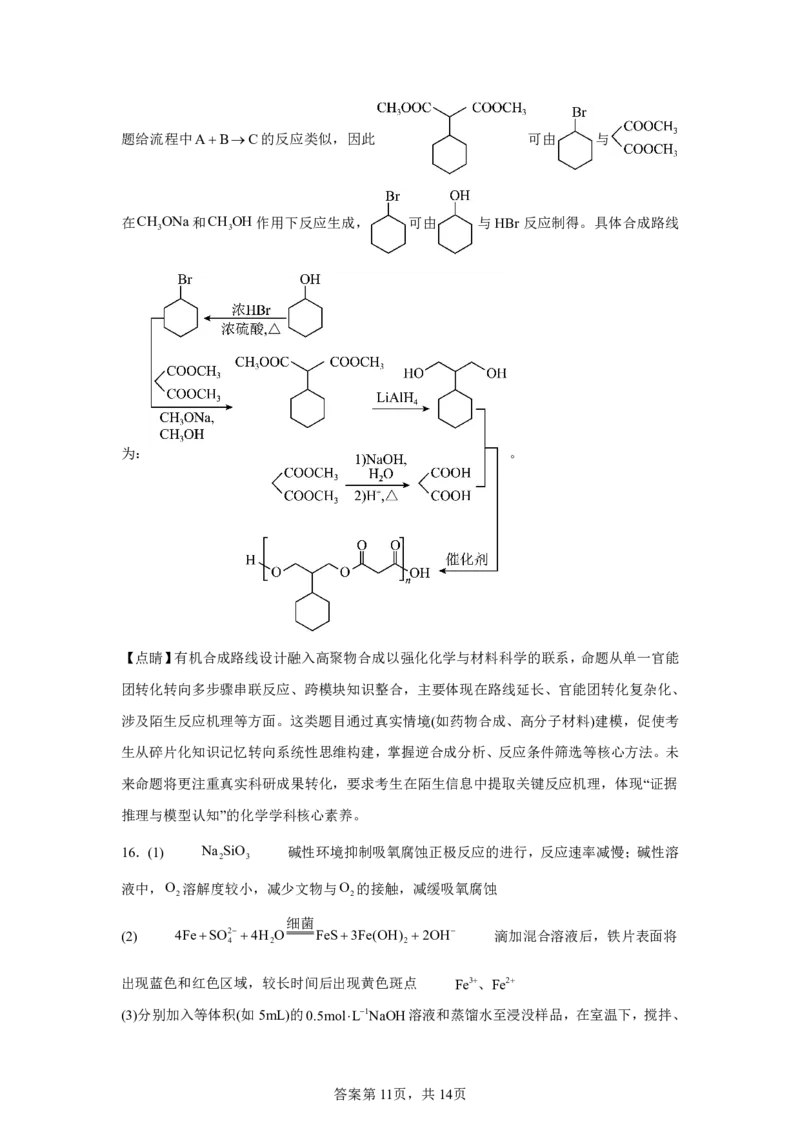
(5)写出以 和 为原料制备 的合成路线流程图
(无机试剂和两碳以下的有机试剂任用,合成路线示例见本题题干)。
16.海洋出水铁质文物表面有凝结物,研究其形成原理和脱氯方法对保护文物意义重大。
(1)文物出水清淤后,须尽快浸泡在稀NaOH或Na CO 溶液中进行现场保护。
2 3
①玻璃中的SiO 能与NaOH反应生成 (填化学式),故不能使用带磨口玻璃塞的试剂
2
瓶盛放NaOH溶液。
②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有 。
试卷第8页,共11页(2)文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的Fe与海水中的SO2在细菌作用下形成FeS等含铁凝结物。写出Fe
4
与SO2反应生成FeS和Fe(OH) 的离子方程式: 。
4 2
②有氧环境中,海水中的铁质文物表面形成FeOOH等凝结物。
(i)铁在盐水中腐蚀的可能原理如图所示。依据原理设计如下实验:向NaCl溶液中加入
K
Fe(CN)
溶液(能与Fe2形成蓝色沉淀)和酚酞,将混合液滴到生铁片上。预测该实验的
3 6
现象为 。
(ii)铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集Cl的可能原因。该胶粒
的形成过程中,参与的主要阳离子有 (填离子符号)。
(3)为比较含氯FeOOH在NaOH溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定
量含氯FeOOH模拟样品,将其分为两等份, ,比较滴加AgNO 溶液体积
3
[K (AgCl)1.81010。实验须遵循节约试剂用量的原则,必须使用的试剂:蒸馏水、
sp
0.5molL1NaOH溶液、0.5molL1HNO 溶液、0.05molL1AgNO 溶液]。
3 3
17.合成气(CO和H )是重要的工业原料气。
2
(1)合成气制备甲醇:CO(g)2H (g)CH OH(g)。CO的结构式为CO,估算该反应的H
2 3
需要 (填数字)种化学键的键能数据。
(2)合成气经“变换”“脱碳”获得纯H 。
2
①合成气变换。向绝热反应器中通入CO、H 和过量的H O(g):
2 2
低温型催化剂
CO(g)H O(g) CO (g)H (g) H0。催化作用受接触面积和温度等因素
2 约230C、3MPa 2 2
影响,H Og的比热容较大。H Og过量能有效防止催化剂活性下降,其原因有 。
2 2
②脱碳在钢制吸收塔中进行,吸收液成分:质量分数30%的K CO 吸收剂、K CrO (Cr正
2 3 2 4
试卷第9页,共11页价有3、6)缓蚀剂等。K CO 溶液浓度偏高会堵塞设备,导致堵塞的物质是 (填化
2 3
学式)。K CrO 减缓设备腐蚀的原理是 。
2 4
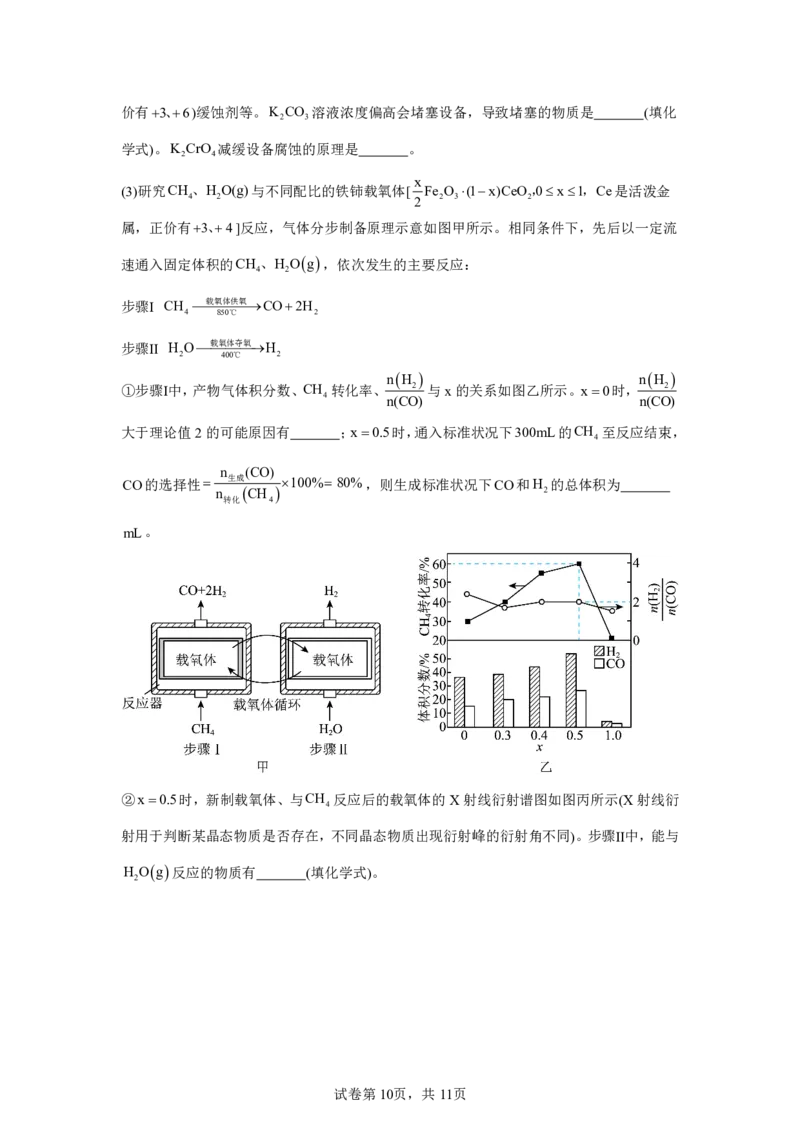
x
(3)研究CH、H O(g)与不同配比的铁铈载氧体[ Fe O (1x)CeO,0x1,Ce是活泼金
4 2 2 2 3 2
属,正价有3、4]反应,气体分步制备原理示意如图甲所示。相同条件下,先后以一定流
速通入固定体积的CH 、H Og,依次发生的主要反应:
4 2
步骤Ⅰ CH 载氧体供氧CO2H
4 850℃ 2
步骤Ⅱ H O载氧体夺氧H
2 400℃ 2
nH nH
①步骤Ⅰ中,产物气体积分数、CH 转化率、 2 与x的关系如图乙所示。x0时, 2
4 n(CO) n(CO)
大于理论值2的可能原因有 ;x0.5时,通入标准状况下300mL的CH 至反应结束,
4
n (CO)
CO的选择性 生成 100% 80%,则生成标准状况下CO和H 的总体积为
n CH 2
转化 4
mL。
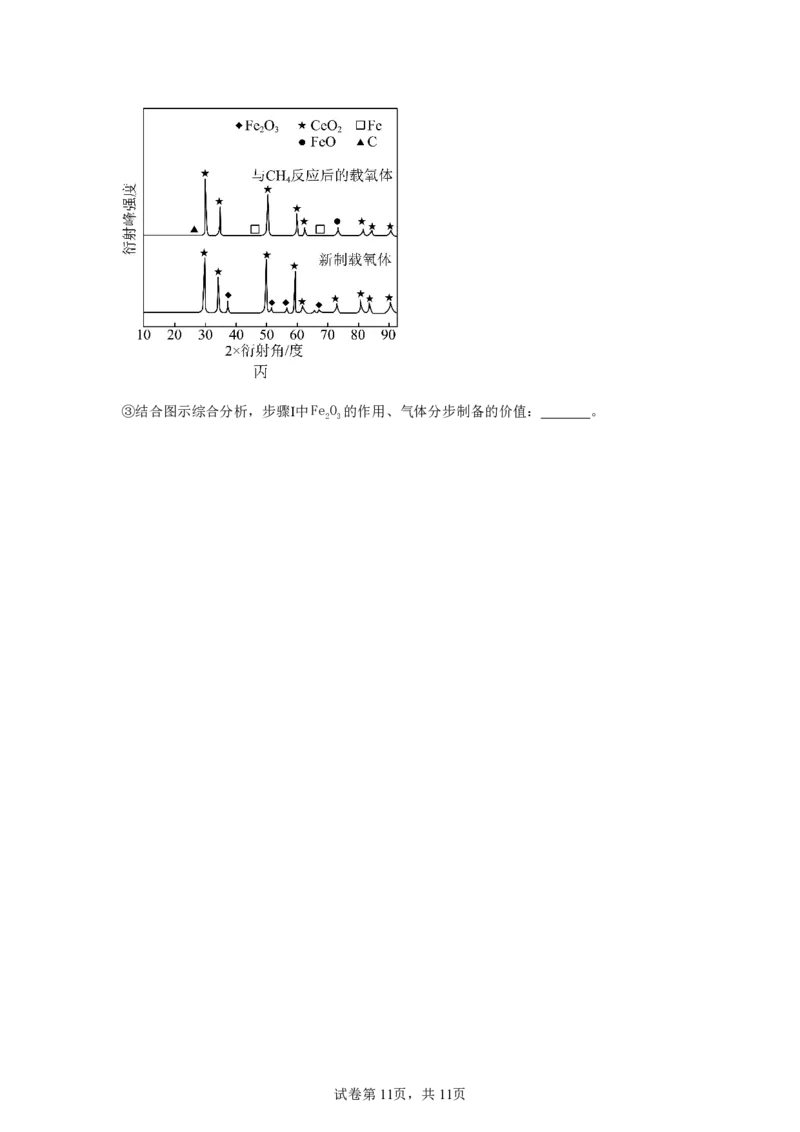
②x0.5时,新制载氧体、与CH 反应后的载氧体的X射线衍射谱图如图丙所示(X射线衍
4
射用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。步骤Ⅱ中,能与
H Og反应的物质有 (填化学式)。
2
试卷第10页,共11页③结合图示综合分析,步骤Ⅰ中Fe O 的作用、气体分步制备的价值: 。
2 3
试卷第11页,共11页1.A
【详解】A.工业合成氨的反应为N 和H 反应生成NH ,氮气是直接反应物,A正确;
2 2 3
B.湿法炼铜通过Fe置换CuSO 中的Cu,反应不涉及氮气,B错误;
4
C.高炉炼铁中氮气作为空气成分进入高炉,但未参与还原铁矿石的主要反应,C错误;
D.接触法制硫酸涉及硫或硫化物的氧化,氮气未参与反应,D错误;
故选A。
2.C
【详解】A.1n质量数为1,质子数为0,中子数为1,因此其表示一个中子,A错误;
0
B.6Li的基态原子核外电子排布式为1s22s1,B错误;
3
C.质子数相同而中子数不同的同一元素的不同原子互称为同位素,3H与2H质子数相同、
1 1
中子数不同,二者互为同位素,C正确;
D.4He原子核外只有2个电子,原子结构示意图为 ,D错误。
2
故选C。
3.D
【详解】A.定容时需要用玻璃棒引流,A错误;
B.润洗滴定管时应取少量标准液于滴定管中,倾斜着转动滴定管进行润洗,B错误;
C.滴定时,应手持锥形瓶上端轻微地摇动锥形瓶,不能手持锥形瓶底端摇动,C错误;
D.读数时,眼睛平视滴定管凹液面最低点,D正确;
答案选D。
4.C
【详解】A.苄氯分子含有饱和C原子,且饱和碳原子连有三种不同的基团,分子空间结构
不对称,故苄氯为极性分子,A错误;
B.同主族元素从上到下电负性逐渐减小,故电负性:χFχCl,B错误;
C.电子层结构相同时,离子半径随原子序数增大而减小,故离子半径:r
F
r
Na
,C
正确;
D.15-冠-5是分子,与阳离子Na之间不存在离子键,二者通过非共价键形成超分子,D错
误;
答案第1页,共14页故选C。
5.D 6.D 7.C
【解析】5.A.同素异形体是同种元素形成的不同单质间的互称,S2是离子不是单质,A
错误;
B.根据信息可知青蒿素中含有—O—O—,类比双氧水的分子结构可知其不稳定,高温条
件下易分解,B错误;
1
C.NH 中心原子N原子价层电子对数为3 5134,采用sp3杂化,孤电子对数为
3
2
1
1,CH 中心原子C原子价层电子对数为4 4144,采用sp3杂化,孤电子对数为
4 2
0,中心原子杂化方式相同时,孤电子对数越多,孤电子对对成键电子对的排斥力越大,键
角越小,则NH 分子中H—N—H键角小于CH 分子中H—C—H键角,C错误;
3 4
D.鸟嘌呤、胞嘧啶中含有NH、NH 、O原子、N原子,可形成氢键,从而实现互补
2
配对,如图所示: ,D正确。
故选D。
6.A.黑火药爆炸时,KNO 、C和S反应生成K S、N 和CO ,该反应的化学方程式为
3 2 2 2
2KNO 3CSK SN 3CO ,A错误;
3 2 2 2
B.电解饱和NaCl溶液生成Cl、H 和NaOH,该反应的离子方程式为
2 2
通电
2Cl2H O H Cl 2OH,B错误;
2 2 2
催化剂
nCH CHCH [CH CH]
C.丙烯生成聚丙烯的反应为 2 3 2 | n ,C错误;
CH
3
D.向饱和氨盐水中通入过量CO 生成NH Cl和溶解度较小的NaHCO ,NaHCO 结晶析出,
2 4 3 3
D正确。
故选D。
答案第2页,共14页7.A.蛋白质在饱和NH SO 溶液中会发生盐析,故可用饱和NH SO 溶液分离提纯
4 2 4 4 2 4
蛋白质,与蛋白质能发生水解反应无关,A错误;
B.青蒿素在乙醚中的溶解度较大,故可用乙醚提取青蒿素,与二者的组成元素无关,B错
误;
C.I 在CCl 中的溶解度大于在水中的溶解度,且CCl 与水不互溶,故可用CCl 萃取碘水
2 4 4 4
中的I ,C正确;
2
D.不同烃的沸点不同,故可用分馏法从石油中获得汽油、柴油,与烃的密度无关,D错误。
故选C。
8.A
【分析】光解过程中,电极a上电子流出,发生氧化反应,a为负极,电极反应式为:
2H O4e O 4H;电极b上电子流入,发生还原反应,b为正极,电极反应式为:
2 2
2H 2e H 。
2
【详解】A.根据分析,电极a为负极,发生氧化反应,电极反应式为:2H O4e O 4H,
2 2
生成物有O ,A正确;
2
B.原电池中阳离子向正极移动,电极a上生成H,电极b上消耗H,H通过质子交换膜
从左室移向右室,B错误;
C.在探究溶液浓度变化时,不仅要关注溶质的变化,也要关注溶剂的变化,在光解总反应
是电解水,H SO 溶液中H O减少,H SO 溶液浓度增大,pH减小,C错误;
2 4 2 2 4
D.生成1molH ,转移2mol电子,外电路通过0.01mol电子时,电极b上生成0.005molH ,
2 2
D错误;
答案选A。
9.B
【详解】A.X中不饱和键均可以与H 发生加成反应,1molX中苯环与3molH 发生加成反
2 2
应、碳碳双键与1molH 发生加成反应、酮羰基与2molH 发生加成反应,则1molX最多能
2 2
和6molH 发生加成反应,A错误;
2
B.饱和碳原子采用sp3杂化,碳碳双键的碳原子采用sp2杂化,1个Y分子中,采用sp3杂
答案第3页,共14页化的碳原子有2个,采用sp2杂化的碳原子有4个,数目比为1:2,B正确;
C. 中1号碳原子为饱和碳原子,与2、3、4号碳原子直接相连,这4个
碳原子不可能全部共面,C错误;
D.Z分子中含有碳碳双键,能使Br 的CCl 溶液褪色,D错误;
2 4
答案选B。
10.A
【详解】A.过程Ⅱ为:*CO 和*NO在酸性条件下被还原为*CO和*NH 的反应,生成了
2 3 2
N—H等极性共价键;过程Ⅲ为*CO与*NH 生成*CONH 的反应,生成了C—N极性共
2 2 2
价键,A正确;
B.过程Ⅱ是得电子的还原反应,N元素的化合价由5降为2,C元素的化合价由4降为2,
B错误;
C.所给离子方程式电荷不守恒,根据反应机理图可知,过程Ⅱ需要外界提供电子,则正确
通电
的反应方程式为CO 2NO18H16e CO(NH ) 7H O,C错误;
2 3 催化剂 2 2 2
D.常温常压、无催化剂条件下,CO 与NH H O反应生成NH CO 或NH HCO ,D
2 3 2 4 2 3 4 3
错误;
故选A。
11.B
【详解】A.步骤Ⅰ中产生的蓝色沉淀是Cu(OH) ,而非[Cu(NH ) ]SO 。因为适量浓氨水与
2 3 4 4
CuSO 溶液反应首先生成Cu(OH) 沉淀,过量氨水才会溶解沉淀形成络合物,A错误;
4 2
B.步骤Ⅱ中,深蓝色溶液(加入浓氨水)中的Cu2+因形成[Cu(NH ) ]2+络离子而浓度降低,
3 4
而蓝色溶液(加入稀盐酸)中Cu2+可以自由移动,浓度较高。因此c (Cu2+)