文档内容
2019年北京市高级中等学校招生考试(中考)化学试卷
考生须知
1.本试卷共6页,共两部分,24道小题,满分45分,考试时间:与生物合计90分钟。
2.在试卷和草稿纸上准确填写姓名、准考证号、考场号和座位号。
3.试题答案一律填涂或书写在答题卡上,在试卷上作答无效。
4.在答题卡上,选择题用2B铅笔作答,其他试题用黑色字迹签字笔作答。
5.考试结束,请将本试卷、答题卡和草稿纸一并交回。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分选择题(共12分)
每小题1分。在每小题列出的四个选项中,选出符合题目要求的一项。
1.空气成分中,体积分数最大的是( )
A.氧气 B.氮气 C.稀有气体 D.二氧化碳
【答案】B
【解析】空气成分中,体积分数:氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%和其他
气体0.03%。故选B。
2.下列属于非金属元素的是( )
A.Mg B.Zn C.Cl D.Ag
【答案】C
【解析】Mg、Zn和Ag都属于金属元素,Cl属于非金属元素。故选C。
3.一些食物的pH范围如下,其中呈碱性的是( )
A.柠檬汁(2.0~3.0) B.番茄汁(4.0~4.4) C.牛奶(6.3~6.6) D.鸡蛋清(7.6~8.0)
【答案】D
【解析】溶液pH<7,显酸性;pH=7,显中性;pH>7,显碱性;鸡蛋清(7.6~8.0)的pH>7,显碱性。
故选D。
4.下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )
A.铁丝 B.红磷 C.甲烷 D.氢气
【答案】A
【解析】铁丝在氧气中剧烈燃烧,火星四射、生成黑色固体。故选A。
5.下列操作不正确的是( )
1A. 加热液体 B. 稀释浓硫酸 C. 取固体粉末 D. 检查气密性
【答案】B
【解析】稀释浓硫酸时,一定要把浓硫酸注入水中,并且不断用玻璃棒搅拌,防止局部受热,液体
沸腾。故选B。
6.下列物质含有氢分子的是( )
A.H B.HO C.HCO D.HO
2 2 2 2 3 2
【答案】A
【解析】H 含有氢元素、氢原子和氢分子;HO 含有氢元素和氢原子;HCO 含有氢元素和氢原子;HO含
2 2 2 2 3 2
有氢元素和氢原子。故选A。
7.下列物质的用途中,利用其物理性质的是( )
A.铜用于制作导线 B.一氧化碳用于炼铁 C.天然气用作燃料 D.氧气用于气焊
【答案】A
【解析】铜具有导电性,可用于制作导线,属于物理性质;一氧化碳具有还原性,可用于炼铁,属
于化学性质;天然气具有可燃性,可用作燃料,属于化学性质;氧气具有氧化性和助燃性,可用于
气焊,属于化学性质。故选A。
8.下列说法不正确的是( )
A.NaOH有腐蚀性B.HO 能分解C.HO是常用的溶剂D.Al在常温下不能与O 反应
2 2 2 2
【答案】D
【解析】NaOH属于强碱,具有较强腐蚀性;HO 能分解生成水和氧气;HO是常用的溶剂;Al在
2 2 2
常温下可以与O 反应,生成一层致密的氧化铝薄膜,阻止铝进一步氧化,起到保护作用。故选D。
2
9.下列物质的化学式不正确的是( )
A.干冰—CO B.消石灰—Ca(OH) C.纯碱一NaOH D.小苏打一NaHCO
2 2 3
【答案】C
【解析】干冰是固体二氧化碳其化学式为CO;消石灰是熟石灰的别称,其化学式为Ca(OH) ;纯
2 2
碱是碳酸钠的俗称,其化学式为NaOH;小苏打是碳酸氢钠的俗称,其化学式为NaHCO。故选C。
3
10.下列关于CO 的实验室制法及性质实验的说法不正确的是( )
2
A. 制CO 的药品 B.发生装置 C.收集装置 D.比较CO 与空气的密度
2 2
【答案】A
2【解析】大理石与稀硫酸反应生成微溶的硫酸钙覆盖在大理石上,阻止反应进一步发生,该实验方
案不合理。故选A。
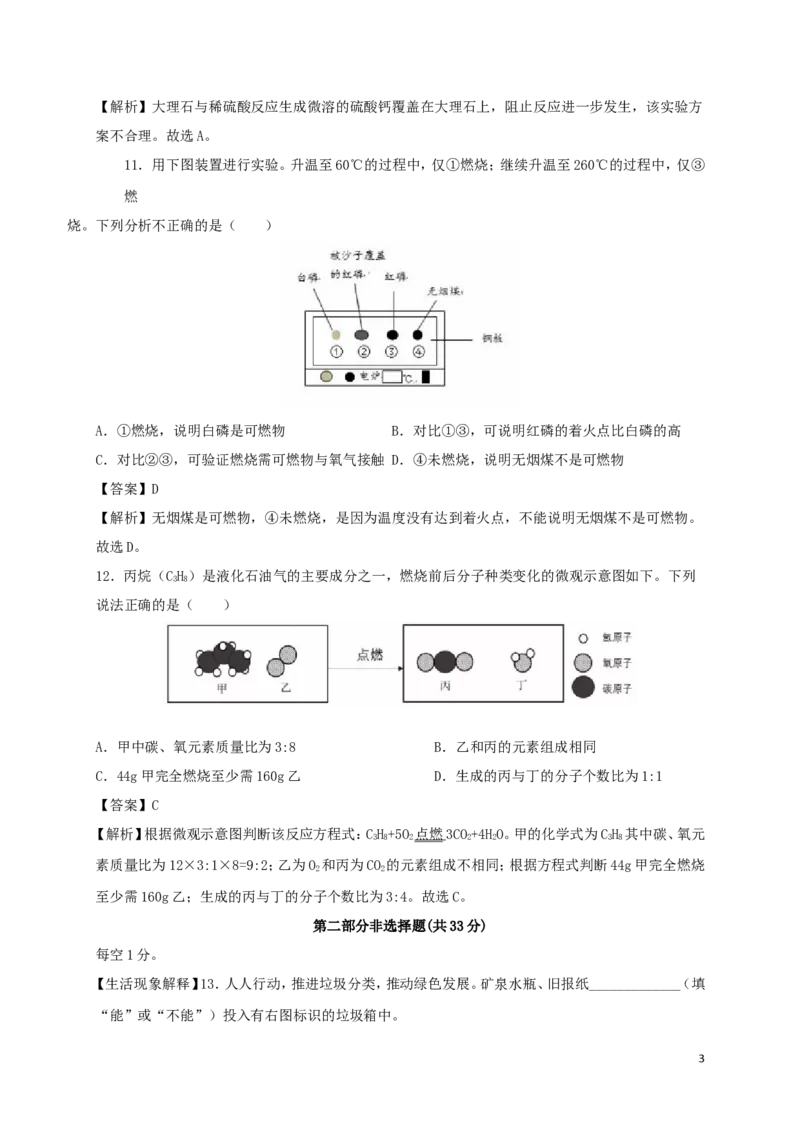
11.用下图装置进行实验。升温至60℃的过程中,仅①燃烧;继续升温至260℃的过程中,仅③
燃
烧。下列分析不正确的是( )
A.①燃烧,说明白磷是可燃物 B.对比①③,可说明红磷的着火点比白磷的高
C.对比②③,可验证燃烧需可燃物与氧气接触 D.④未燃烧,说明无烟煤不是可燃物
【答案】D
【解析】无烟煤是可燃物,④未燃烧,是因为温度没有达到着火点,不能说明无烟煤不是可燃物。
故选D。
12.丙烷(CH)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如下。下列
3 8
说法正确的是( )
A.甲中碳、氧元素质量比为3:8 B.乙和丙的元素组成相同
C.44g甲完全燃烧至少需160g乙 D.生成的丙与丁的分子个数比为1:1
【答案】C
【解析】根据微观示意图判断该反应方程式:CH+5O 点燃 3CO+4HO。甲的化学式为CH 其中碳、氧元
3 8 2 2 2 3 8
素质量比为12×3:1×8=9:2;乙为O 和丙为CO 的元素组成不相同;根据方程式判断44g甲完全燃烧
2 2
至少需160g乙;生成的丙与丁的分子个数比为3:4。故选C。
第二部分非选择题(共33分)
每空1分。
【生活现象解释】13.人人行动,推进垃圾分类,推动绿色发展。矿泉水瓶、旧报纸_____________(填
“能”或“不能”)投入有右图标识的垃圾箱中。
3【答案】能。
【解析】矿泉水瓶、旧报纸属于可回收物品。
14.84消毒液[有效成分为次氯酸钠(NaClO)]和二氧化氯(ClO)是常用消毒剂。
2
(1)NaClO中氯元素的化合价为_____。
(2)ClO 属于____________(填序号)。A.混合物B.化合物 C.氧化物
2
【答案】(1)+1;(2)BC。
【解析】(1)Na在化合物中显+1价,O显-2价,根据化合物中元素化合价代数和为0计算NaClO
中氯元素的化合价为+1;(2)ClO 属于纯净物和化合物中的氧化物。故选BC。
2
15.氢气是理想的清洁、高能燃料。水分解可获得氢气和氧气。
(1)右图中,产生氢气的试管是______(填“1”或“2”)。
(2)我国开发出一种新型催化剂,实现了在光照下分解水,反应的化学方程式为_________________。
催化剂
【答案】(1)1;(2)2HO 2H +O↑。
2 2 光照 2↑ 2
【解析】(1)电解水时正极产生的是氧气,负极产生的气体是氢气,它们的体积比为1:2,即1产生
催化剂
的是氢气;(2)在催化剂和光照下分解水的反应的化学方程式:2HO 光照 2H +O↑。
2 2 2↑ 2
【科普阅读理解】16.(5分)阅读下面科普短文。
土豆是继水稻、小麦、玉米之后的第四大粮食作物,含淀粉、蛋白质、维生素C等多种营养物质,
是餐桌上的美味食材。
表1鲜土豆中主要营养物质的含量(每100g)
4蛋白质/g 脂肪/g 淀粉/g 钙/mg 磷/mg 维生素C/mg
1.5-2.3 0.4-0.94 17.5-28.0 11-60 15-68 20-40
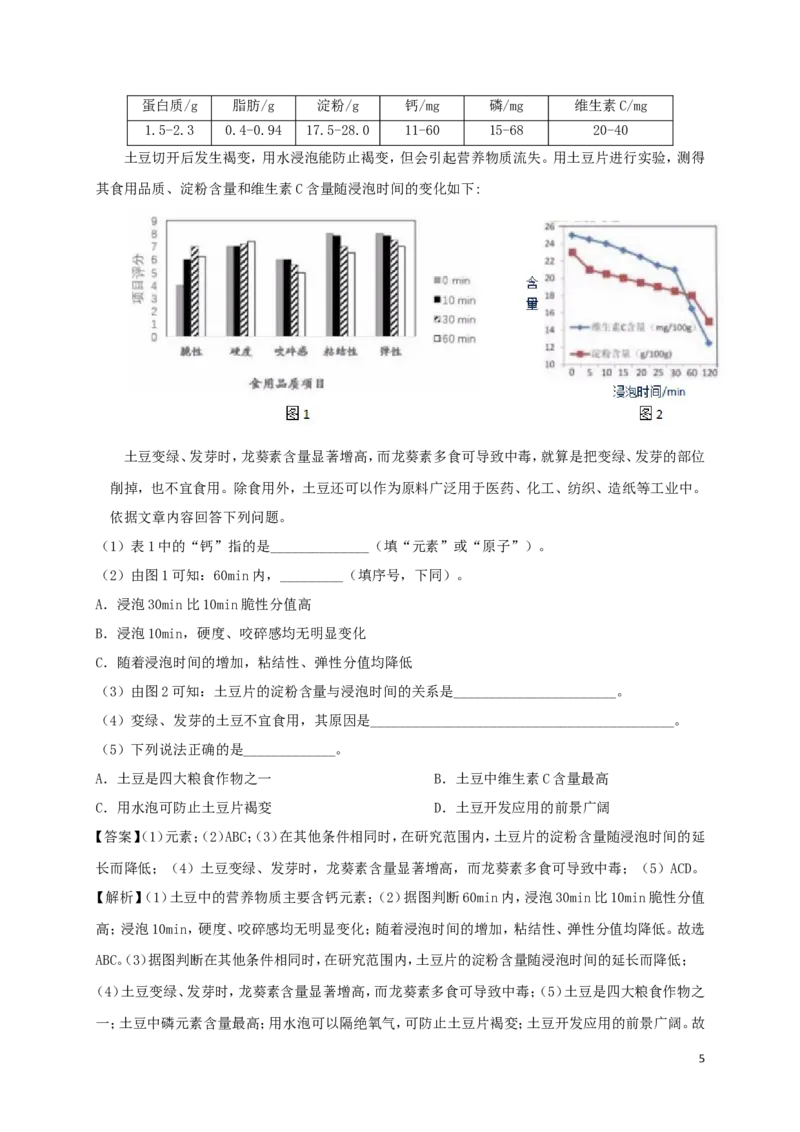
土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。用土豆片进行实验,测得
其食用品质、淀粉含量和维生素C含量随浸泡时间的变化如下:
土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒,就算是把变绿、发芽的部位
削掉,也不宜食用。除食用外,土豆还可以作为原料广泛用于医药、化工、纺织、造纸等工业中。
依据文章内容回答下列问题。
(1)表1中的“钙”指的是______________(填“元素”或“原子”)。
(2)由图1可知:60min内,_________(填序号,下同)。
A.浸泡30min比10min脆性分值高
B.浸泡10min,硬度、咬碎感均无明显变化
C.随着浸泡时间的增加,粘结性、弹性分值均降低
(3)由图2可知:土豆片的淀粉含量与浸泡时间的关系是_______________________。
(4)変绿、发芽的土豆不宜食用,其原因是___________________________________________。
(5)下列说法正确的是_____________。
A.土豆是四大粮食作物之一 B.土豆中维生素C含量最高
C.用水泡可防止土豆片褐変 D.土豆开发应用的前景广阔
【答案】(1)元素;(2)ABC;(3)在其他条件相同时,在研究范围内,土豆片的淀粉含量随浸泡时间的延
长而降低;(4)土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒;(5)ACD。
【解析】(1)土豆中的营养物质主要含钙元素;(2)据图判断60min内,浸泡30min比10min脆性分值
高;浸泡10min,硬度、咬碎感均无明显变化;随着浸泡时间的增加,粘结性、弹性分值均降低。故选
ABC。(3)据图判断在其他条件相同时,在研究范围内,土豆片的淀粉含量随浸泡时间的延长而降低;
(4)土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒;(5)土豆是四大粮食作物之
一;土豆中磷元素含量最高;用水泡可以隔绝氧气,可防止土豆片褐変;土豆开发应用的前景广阔。故
5选ACD。
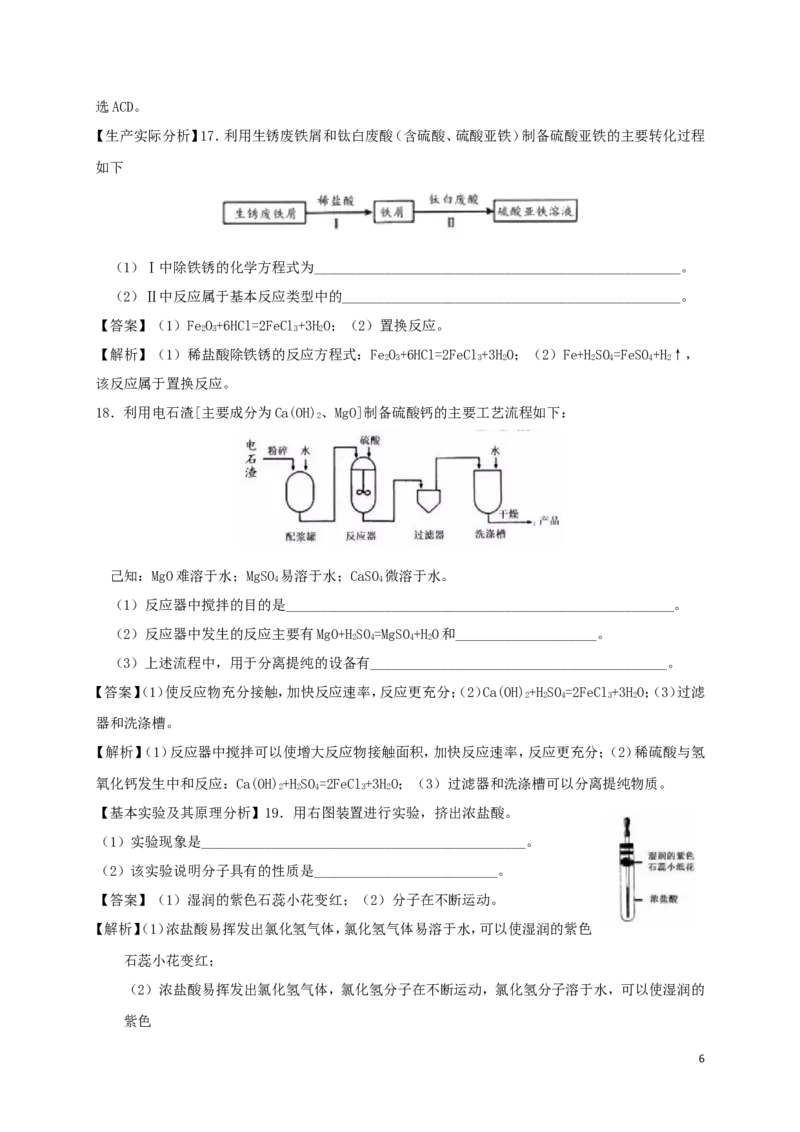
【生产实际分析】17.利用生锈废铁屑和钛白废酸(含硫酸、硫酸亚铁)制备硫酸亚铁的主要转化过程
如下
(1)Ⅰ中除铁锈的化学方程式为____________________________________________________。
(2)Ⅱ中反应属于基本反应类型中的________________________________________________。
【答案】(1)FeO+6HCl=2FeCl+3HO;(2)置换反应。
2 3 3 2
【解析】(1)稀盐酸除铁锈的反应方程式:FeO+6HCl=2FeCl+3HO;(2)Fe+HSO=FeSO+H↑,
2 3 3 2 2 4 4 2
该反应属于置换反应。
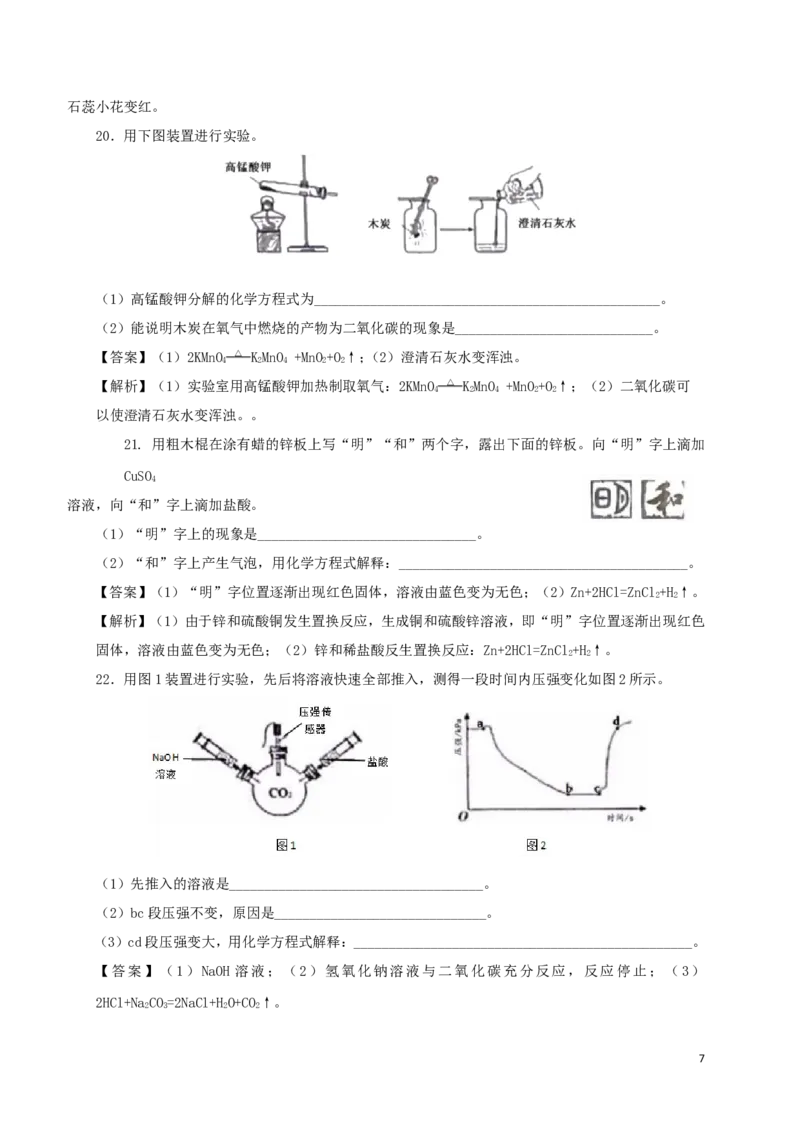
18.利用电石渣[主要成分为Ca(OH)、MgO]制备硫酸钙的主要工艺流程如下:
2
己知:MgO难溶于水;MgSO 易溶于水;CaSO 微溶于水。
4 4
(1)反应器中搅拌的目的是_______________________________________________________。
(2)反应器中发生的反应主要有MgO+HSO=MgSO+HO和____________________。
2 4 4 2
(3)上述流程中,用于分离提纯的设备有__________________________________________。
【答案】(1)使反应物充分接触,加快反应速率,反应更充分;(2)Ca(OH)+HSO=2FeCl+3HO;(3)过滤
2 2 4 3 2
器和洗涤槽。
【解析】(1)反应器中搅拌可以使增大反应物接触面积,加快反应速率,反应更充分;(2)稀硫酸与氢
氧化钙发生中和反应:Ca(OH)+HSO=2FeCl+3HO;(3)过滤器和洗涤槽可以分离提纯物质。
2 2 4 3 2
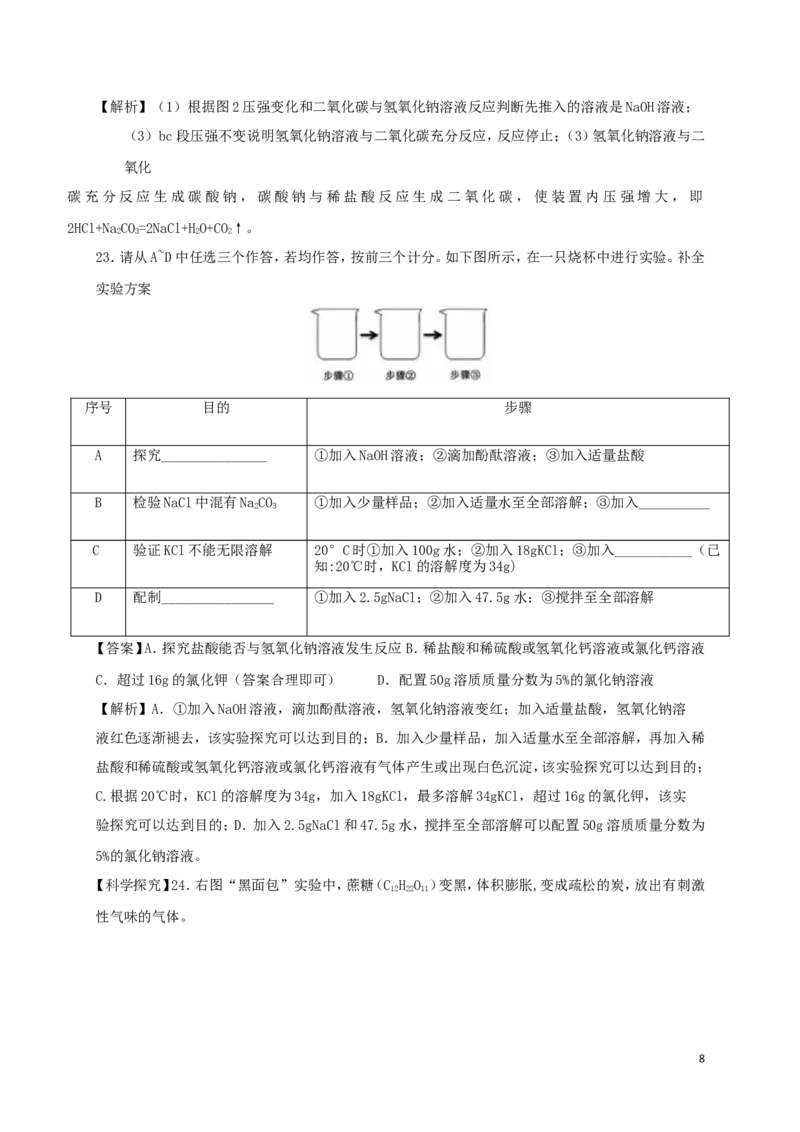
【基本实验及其原理分析】19.用右图装置进行实验,挤出浓盐酸。
(1)实验现象是______________________________________________。
(2)该实验说明分子具有的性质是__________________________。
【答案】(1)湿润的紫色石蕊小花变红;(2)分子在不断运动。
【解析】(1)浓盐酸易挥发出氯化氢气体,氯化氢气体易溶于水,可以使湿润的紫色
石蕊小花变红;
(2)浓盐酸易挥发出氯化氢气体,氯化氢分子在不断运动,氯化氢分子溶于水,可以使湿润的
紫色
6石蕊小花变红。
20.用下图装置进行实验。
(1)高锰酸钾分解的化学方程式为_________________________________________________。
(2)能说明木炭在氧气中燃烧的产物为二氧化碳的现象是____________________________。
【答案】(1)2KMnO △ KMnO +MnO+O↑;(2)澄清石灰水变浑浊。
4 2 4 2 2
【解析】(1)实验室用高锰酸钾加热制取氧气:2KMnO △ KMnO +MnO+O↑;(2)二氧化碳可
4 2 4 2 2
以使澄清石灰水变浑浊。。
21. 用粗木棍在涂有蜡的锌板上写“明”“和”两个字,露出下面的锌板。向“明”字上滴加
CuSO
4
溶液,向“和”字上滴加盐酸。
(1)“明”字上的现象是_______________________________。
(2)“和”字上产生气泡,用化学方程式解释:_________________________________________。
【答案】(1)“明”字位置逐渐出现红色固体,溶液由蓝色变为无色;(2)Zn+2HCl=ZnCl+H↑。
2 2
【解析】(1)由于锌和硫酸铜发生置换反应,生成铜和硫酸锌溶液,即“明”字位置逐渐出现红色
固体,溶液由蓝色变为无色;(2)锌和稀盐酸反生置换反应:Zn+2HCl=ZnCl+H↑。
2 2
22.用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。
(1)先推入的溶液是____________________________________。
(2)bc段压强不变,原因是______________________________。
(3)cd段压强变大,用化学方程式解释:________________________________________________。
【答案】(1)NaOH 溶液;(2)氢氧化钠溶液与二氧化碳充分反应,反应停止;(3)
2HCl+NaCO=2NaCl+HO+CO↑。
2 3 2 2
7【解析】(1)根据图2压强变化和二氧化碳与氢氧化钠溶液反应判断先推入的溶液是NaOH溶液;
(3)bc段压强不变说明氢氧化钠溶液与二氧化碳充分反应,反应停止;(3)氢氧化钠溶液与二
氧化
碳充分反应生成碳酸钠,碳酸钠与稀盐酸反应生成二氧化碳,使装置内压强增大,即
2HCl+NaCO=2NaCl+HO+CO↑。
2 3 2 2
23.请从A~D中任选三个作答,若均作答,按前三个计分。如下图所示,在一只烧杯中进行实验。补全
实验方案
序号 目的 步骤
A 探究_______________ ①加入NaOH溶液;②滴加酚酞溶液;③加入适量盐酸
B 检验NaCl中混有NaCO ①加入少量样品;②加入适量水至全部溶解;③加入__________
2 3
C 验证KCl不能无限溶解 20°C时①加入100g水;②加入18gKCl;③加入___________(已
知:20℃时,KCl的溶解度为34g)
D 配制________________ ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解
【答案】A.探究盐酸能否与氢氧化钠溶液发生反应B.稀盐酸和稀硫酸或氢氧化钙溶液或氯化钙溶液
C.超过16g的氯化钾(答案合理即可) D.配置50g溶质质量分数为5%的氯化钠溶液
【解析】A.①加入NaOH溶液,滴加酚酞溶液,氢氧化钠溶液变红;加入适量盐酸,氢氧化钠溶
液红色逐渐褪去,该实验探究可以达到目的;B.加入少量样品,加入适量水至全部溶解,再加入稀
盐酸和稀硫酸或氢氧化钙溶液或氯化钙溶液有气体产生或出现白色沉淀,该实验探究可以达到目的;
C.根据20℃时,KCl的溶解度为34g,加入18gKCl,最多溶解34gKCl,超过16g的氯化钾,该实
验探究可以达到目的;D.加入2.5gNaCl和47.5g水,搅拌至全部溶解可以配置50g溶质质量分数为
5%的氯化钠溶液。
【科学探究】24.右图“黑面包”实验中,蔗糖(C H O )变黑,体积膨胀,变成疏松的炭,放出有刺激
12 22 11
性气味的气体。
8【提出问题】改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢?
【进行实验】分别取5g糖粉进行实验,根据前2min的现象对实验效果进行评分,
记录如下:
表1实验记录
实验 糖 浓硫酸体积/mL 水的滴数 温度/℃ 效果得分
1 蔗糖 4 5 22 65
2 蔗糖 5 10 30 81
3 蔗糖 6 15 50 93
4 冰糖 4 10 50 91
5 冰糖 5 15 22 88
6 冰糖 a 5 30 75
7 葡萄糖 4 15 30 0
8 葡萄糖 5 5 50 0
9 葡萄糖 6 10 22 0
【处理数据】分析表1,计算效果得分均值,结果如下:
表2 效果得分均值
因素 糖 浓硫酸体积/mL 水的滴数 温度/℃
蔗糖 冰糖 葡萄糖 4 5 6 5 10 15 22 30 50
均值 79.7 84.7 0 52.0 56.3 56.0 46.7 57.3 60.3 51.0 52.0 61.3
依据均值推断最佳实验方案,均值越高,效果越好。
【解释与结论】(1)蔗糖变成黑色的炭,发生了_____________(填“物理”或“化学”)变化。
(2)推测放出的气体含SO,从元素守恒角度说明理由:________________________________。
2
(3)实验6中,a为_____________mL。
(4)根据表2推断,“黑面包”实验最好选择5g冰糖、5mL浓硫酸、_____滴水和50℃
【反思与评价】
9( 5 ) 表 2 中 , 22℃ 对 应 的 均 值 为 51.0, , 计 算 该 值 所 依 据 的 3 个 数 据 分 别 是
________________________________。
(6)综合分析,使实验3的效果得分高于实验4的因素有________________________________。
【答案】(1)化学;(2)浓硫酸中有硫元素和氧元素,蔗糖中含有氧元素,则生成物中也会有硫元素和
氧元素;(3)6;(4)15;(5)65:88:0;(6)浓硫酸的体积和水的滴数。
【解析】(1)蔗糖C H O 变成黑色的炭C,发生了化学变化;(2)根据质量守恒定律中元素质量不变和
12 22 11
反应生成刺激性气体可以判断为二氧化硫SO,即浓硫酸中有硫元素和氧元素,蔗糖中含有氧元素,
2
则生成物中也会有硫元素和氧元素;(3)根据表格数据排布规律判断a=6;(4)根据效果得分可以“黑
面包”实验最好选择5g冰糖、5mL浓硫酸、15滴水和50℃;(5)根据表格判断22℃对应的均值为
51.0,,计算该值所依据的3个数据分别是65、88和0;(6)实验3和4,温度均为50℃,使实验3的效
果得分高于实验4的因素有浓硫酸的体积和水的滴数。,
10