文档内容
四川省宜宾市2015年中考化学真题试题(含解析)
第Ⅰ卷
(选择题 共20分)
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5
K—39 Cu—64 Zn—65 Ag—108
一、选择题(本题共10个小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.空气是一种宝贵的自然资源,下列措施中,不利于提高空气质量的是( )
A.开发新能源代替化石燃料 B.改进汽车尾气的净化技术
C.节假日燃放烟花爆竹 D.控制PM 的排放以减少雾霾天气
2.5
【答案】C
考点:空气污染及其防治
2.下列有关金属材料的说法正确的是 ( )
A.硬铝片比纯铝片硬度小 B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快 D.为防止钢铁生锈,可在其表面涂油
【答案】D
【解析】
试题分析:根据所学知识可知,A.硬铝片比纯铝片硬度大;B.钢的性能优良,是铁的合金; C.沙漠地区的
铁制品锈蚀较慢,因为空气干燥; D.为防止钢铁生锈,可在其表面涂油,是正确的叙述,这样可
以隔绝氧气;故答案选择D
考点:金属材料、金属的防护
3. 下列物质都属于纯净物的一组是 ( )
1①冰水混合物 ②洁净的空气 ③液氮 ④石灰水
A.①③ B.②④ C.①② D.③④
【答案】A
考点:纯净物和混合物的判断
4.下列有关化学变化的说法正确的是 ( )
A.从海水中获得物质都需要经过化学变化
B.用石灰浆粉刷墙壁,干燥后墙面变硬发生了化学变化
C.石油分馏后得到汽油、煤油、柴油等属于化学变化
D.潮湿的衣服被晒干了是化学变化
【答案】C
【解析】
试题分析:化学变化是有新物质生成的变化,物理变化是没有新物质生成的变化,二者的本质区别是是否有
新物质生成; A.从海水中获得物质都需要经过化学变化是错误的叙述,海水晒烟是物理变化; C.
石油分馏后得到汽油、煤油、柴油等属于化学变化,是错误的叙述,没有新物质生成,属于物理变化;
B.用石灰浆粉刷墙壁,干燥后墙面变硬发生了化学变化,是正确的叙述;D.潮湿的衣服被晒干了是化学
变化,是错误的叙述,没有新物质生成,属于物理变化;故答案选择C
考点:物理变化和化学变化的判定
5.从分子的角度分析并解释下列事实,说法不正确的是( )
序号 事实 解释
A 碘酒是混合物 由不同分子构成
B 端午节粽飘香 分子在不断地运动
C 气体受热膨胀 温度升高,分子自身体积增大
D 碘受热升华 碘分子间的间隔增大
【答案】C
【解析】
2考点:微粒的特征的应用
6.用CO 和NH 反应合成尿素[CO(NH)]是固定和利用CO 的成功范例,化学反应方程式为: CO+2NH 一定
2 3 2 2 2 2 3
条件CO(NH)+HO,下列说法正确的是 ( )
2 2 2
A.上述反应共涉及到三种氧化物
B.C、H、O、N四种元素均位于周期表第二周期
C.尿素含氮高,是一种很好的氮肥
D.尿素种含有CO分子
【答案】C
考点:氧化物、元素周期表的应用、分子构成
7.下列有关化学反应,对其反应类型的判断,正确的是( )
①CuO+2HCl=CuCl+HO ②3CO+FeO ==高==温=== 2Fe+3CO
2 2 2 3 2
③Cu+2AgNO=Cu(NO)+2Ag ④CO+O==高==温=== 2CO
3 3 2 2 2
A.①分解反应 B.②置换反应 C.③复分解反应 D.④化合
反应
【答案】D
【解析】
试题分析:①反应一属于复分解反应;②反应二位氧化还原反应;③反应三属于置换反应;④反应四为化合反
应是正确的叙述;故答案选择D
考点:化学反应的类型
8.一些食物的近似pH值如下,下列说法中不正确的是( )
物质 苹果汁 葡萄汁 牛奶 鸡蛋清
3pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0
A.葡萄汁比苹果汁的酸性强 B.葡萄汁和苹果汁都能使石蕊试液变红
C.牛奶和鸡蛋清都接近中性 D.胃酸过多的人应少饮苹果汁
【答案】A
【解析】
试题分析:根据溶液酸碱度的表示可知, A.葡萄汁比苹果汁的酸性强是错误的叙述;葡萄汁比苹果汁的酸
性弱; B.葡萄汁和苹果汁溶液都显示酸性,故能使石蕊试液变红 ;C.牛奶和鸡蛋清都接近中性是正
确的叙述; D.胃酸过多的人应少饮苹果汁是正确的叙述;故答案选择A
考点;溶液的酸碱度
9.右图为甲、乙两种盐的溶解度曲线。下列说法正确的是 ( )
A.甲、乙两种物质的溶解度都不相等
B.将接近饱和的甲溶液变为饱和溶液,可采用蒸发或降温的方法
C.t℃时,甲、乙两种物质的饱和溶液中,溶质质量分数均为15%
1
D.t℃时,将30克乙物质放入100水中,所得溶质的质量为130克
2
【答案】B
考点:溶解度曲线的应用
10.除去下列物质所含少量杂质,所用试剂或方法不正确的是( )
选项 物质 所含杂质 试剂或方法
A CO H 通入O 点燃
2 2
B N O 通过足量灼热的铜网
2 2
C KNO 溶液 Ba(NO) 滴加适量KSO 过滤
3 3 2 2 4
D NaCl溶液 NaCO 滴加稀盐酸至不再产生气泡
2 3
【答案】A
【解析】
4试题分析:A选项一氧化碳中混有氢气,通入氧气点燃,容易引进新杂质;B选项氮气中混有氧气通过灼热的
铜网,反应掉氧气,净化氮气是正确的叙述;C选项硝酸钾溶液中混有硝酸钡溶液加入硫酸钾溶液反应,
生成硝酸钾溶液和硫酸钡沉淀,过滤除去,是正确的叙述;D选项氯化钠溶液中混有碳酸钠,滴加盐酸至
不再产生气泡,除去碳酸钠是正确的叙述;故答案选择A
考点:物质的除杂
第Ⅱ卷(非选择题 共50分)
二、填空题(本题共3个小题,共22分)
11.(5分)用化学用语填空:
(1)氖 (2)2个二氧化硫分子 (3)地壳中含量最多的金属元素
(4) 表示 的结构示意图 (5)核电荷数为14的元素
【答案】(1)Ne (2)2SO (3)Al (4)Na+ (5)Si
2
考点:化学符号的书写
12.(9分)元素X、Y、Z、M是初中常见的四种元素。有关信息如下表:
元素 有关信息
X 可形成相对分子质量最小的气体单质
Y 形成的一种单质是天然存在的最硬的物质
Z 期单质约占空气总体积的1/5
M 人体内含量最高的金属元素
(1)M元素的名称是 。
(2)Y形成的天然存在的最硬的物质是 ,此物质不属于 (填“有机
物”或“无机物”)
(3)由X、Y两种元素组成的最简单的有机物是 (填化学式),该有机物中X元素
的质量分数为 。
(4)由Y、Z两种元素组成的能用于人工降雨的固体物质是 。
5(5)由Z、M 两种元素按原子个数比1︰1组成的化合物,俗称 ,写出它与水反应
的化学方程式 。
【答案】(1)钙;(2)金刚石 有机物;(3)CH 25%; (4)干冰 (5)生石灰;CaO + HO === Ca(OH)
4 2 2
考点:物质的性质和用途、元素的推断
13.(8分)化学是一门以实验为基础的科学。请根据下列仪器和实验装置回答有关问题:
(1)仪器②的名称是 。
(2)用①②③组合可制备CO,写出实验室用此装置制备CO 的化学方程式 。
2 2
(3)收集CO 应选用装置 (填“④”或“⑤”)
2
(4)利用图⑥所示装置(集气瓶中预先装满CO 气体)来验证CO 的性质,先加入足量氢氧化钠溶液,观察
2 2
到的现象是气球 (填“变大”、“变小”或“不变”),反应方程式为
___________;再加入足量的盐酸,观察到的现象是气球 (填“变大”、
“变小”或“不变”)。
【答案】(1)长颈漏斗;(2)CaCO+2HCl==CaCl+HO+CO↑;(3)④;(4)变大;2NaOH + CO ==== NaCO + HO;
3 2 2 2 2 2 3 2
变小;
【解析】
试题分析:根据所学知识可知,(1)仪器②的名称是长颈漏斗;(2)用①②③组合可制备CO,实验室用此装置
2
制备CO 的化学方程式为:CaCO+2HCl==CaCl+HO+CO↑;(3)收集CO 应选用装置④,因为二氧化碳的密
2 3 2 2 2 2
6度比空气的大;(4)利用图⑥所示装置(集气瓶中预先装满CO 气体)来验证CO 的性质,先加入足量氢氧
2 2
化钠溶液,观察到的现象是气球变大;反应方程式为:2NaOH + CO ==== NaCO + HO; 再加入足量的
2 2 3 2
盐酸,观察到的现象是气球变小;这是因为二氧化碳与氢氧化钠溶液反应,装置内的压强减小,大气压
把空气压入气球膨胀,加入盐酸盐酸与碳酸钠溶液反应,生成二氧化碳装置内的压强增大,把气体压出
气球。
考点:二氧化碳的制取、性质的验证
三、分析题(本题共2个小题,共10分)
14.(4分)在化学反应中,凡是元素化合价发生改变的反应,称为氧化还原反应。配平这类化学方程式往往采
用“化合价升降法”更方便快捷,即反应中元素“化合价升高总数=化合价降低总数”
例如: 具体配平步骤如下:
①“标变价”:找出化合价发生改变的元素,并标出改变前后的化合价。
②“列变化”:列出改变的价态数。
③“找倍数”:找出化合价升、降的最小公倍数3×4=12,从而确定Al、 MnO2的系数。
④“配系数”:再用观察法,配平其它系数 。
根据以上信息,结合已学知识,回答下列问题 :
(1)HNO 中N元素的化合价为 价,NO 中N元素的化合价为 价。
3 2
(2)请配平下列化学方程式,(系数写在方框里,所有系数必须填写)
【答案】(1)+5 ;+4 ;(2)1 4 1 4 2
7考点:化合价的计算、化学方程式的配平
15.(6分)黄铜是以Zn主要元素,添加元素铜的合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、
CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:ZnO+HSO=ZnSO+HO; CuO+HSO=CuSO+HO
2 4 4 2 2 4 4 2
(1) 步骤Ⅰ中产生气体的化学方程式为
。
(2) 溶液A中的金属阳离子有 (填化学式)
(3) 步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作都
要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
【答案】(1)Zn + HSO === ZnSO + H↑;(2)Cu2+ 、 Zn2+ (3)过滤; 玻璃棒;(4)小于
2 4 4 2
【解析】
试题分析:(1)根据题中的叙述可知,能与稀硫酸反应的为金属锌、氧化铜、氧化锌,能产生气体的为金 属
锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn + HSO === ZnSO + H↑;(2) 溶液A中
2 4 4 2
的金属阳离子有Cu2+ 、 Zn2+ ;(3) 步骤Ⅰ、Ⅱ中均为固液分离,故包含的操作名称为过滤,此操作和步
骤Ⅲ中的蒸发操作都要用到的玻璃仪器是 玻璃棒;(4)溶液A小于溶液C的质量,因为溶液A中加入金
属锌能置换出金属铜,金属锌的相对原子质量大于金属铜的相对原子质量。
考点:金属、酸的性质、物质的分离
四、探究题(本题共1个小题,共8分)
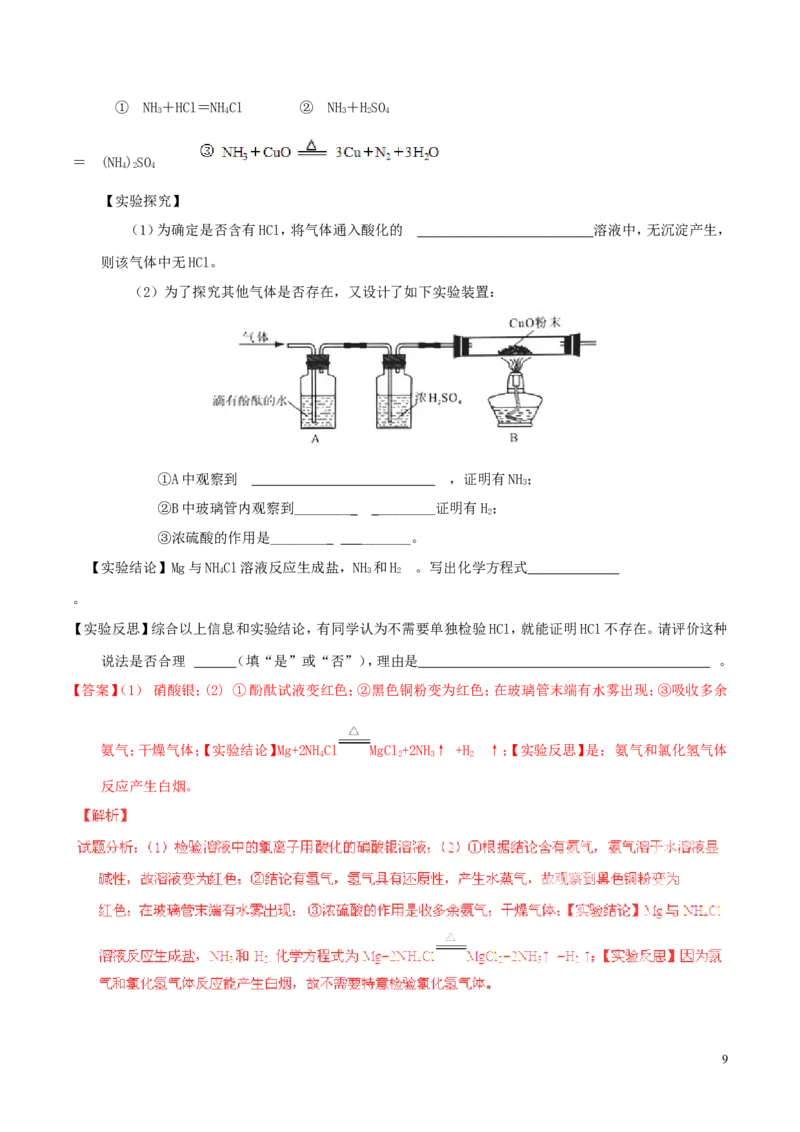
16.(8分)Mg与NHCl溶液反应,除生成一种盐外,还有气泡产生。为确定气体的成分,进行下列实验探 究:
4
【假设与猜想】气体可能是HCl,NH,H 中的一种或几种。
3 2
【查阅资料】
8① NH+HCl=NHCl ② NH+HSO
3 4 3 2 4
= (NH)SO
4 2 4
【实验探究】
(1)为确定是否含有HCl,将气体通入酸化的 溶液中,无沉淀产生,
则该气体中无HCl。
(2)为了探究其他气体是否存在,又设计了如下实验装置:
①A中观察到 ,证明有NH;
3
②B中玻璃管内观察到_________ _________证明有H;
2
③浓硫酸的作用是_________ _________。
【实验结论】Mg与NHCl溶液反应生成盐,NH 和H 。写出化学方程式
4 3 2
。
【实验反思】综合以上信息和实验结论,有同学认为不需要单独检验HCl,就能证明HCl不存在。请评价这种
说法是否合理 (填“是”或“否”),理由是 。
【答案】(1) 硝酸银;(2) ①酚酞试液变红色;②黑色铜粉变为红色;在玻璃管末端有水雾出现;③吸收多余
氨气;干燥气体;【实验结论】Mg+2NHCl MgCl+2NH↑ +H ↑;【实验反思】是; 氨气和氯化氢气体
4 2 3 2
反应产生白烟。
9考点:物质的探究
五、计算题(本题共1个小题,共10分)
17.(10分)有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气。现将
2.5g氧化铜与24.5g氯酸钾的混合物充分加热,残余固体经冷却、称量、质量为17.4g。然后将固体溶于
65.1 g水中,充分搅拌,过滤得到滤液和黑色的滤渣。滤渣又经过洗涤、烘干、称量,质量为2.5g。(不
考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起 作用。
(2)生成的氧气为 克。
(3)所得滤液中溶质是 ,其质量分数为 。
(4)向所得滤液中加入质量分数为16%的AgNO 溶液恰好完全反应,需AgNO 溶液的质量为多少克?(列
3 3
出必要的计算过程)
【答案】(1)催化;(2)9.6g;(3)氯化钾;18.6% ;(4)106.3g
【解析】
试题分析:解(1)因为氧化铜反应前后质量和化学性质没有改变,起到改变化学反应速率的作用,故其催化作
用;(2)根据质量守恒定律,反应前后总质量不变,得到生成氧气的质量为:2.5g+24.5g-17.4g=9.6g;(3)
氯酸钾加热分解生成氯化钾和氧气,故所的溶液中的溶质为氯化钾;设生成氯化钾的质量为x
MnO
2KClO 3 = 2 2KCl + 3O 2 ↑
D
245 149
24.5g x
245/24.5g=149/x
X=14.9g
所得溶液的溶质的质量分数为:14.9g/(14.9g+65.1g)×100%≈18.6%
(4)设与14.9g的氯化钾反应的硝酸银的质量为Y
KCl+AgNO==AgCl↓+KNO
3 3
149 170
14.9g y
149/14.9g=170/y
Y=17g
需AgNO 溶液的质量为:17g/16%≈106.3g
3
考点:根据化学方程式的计算、有关溶液的计算
1011