文档内容
四川省德阳市2018年中考理综(化学部分)真题试题
(与生物、物理共120分钟,化学满分60分)
可能用到的相对原子质量:H一1 C—12 N—14 O一16 Na—23 S一32 Cl—35.5 Ca—40
Fe—56 Cu—64 Ag—108
第Ⅰ卷 (选择题 共24分)
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
11.古丝绸之路贸易中的下列商品,主要成分属于无饥化合物的是( )
A.丝绸 B.草药 C.茶叶 D.瓷器
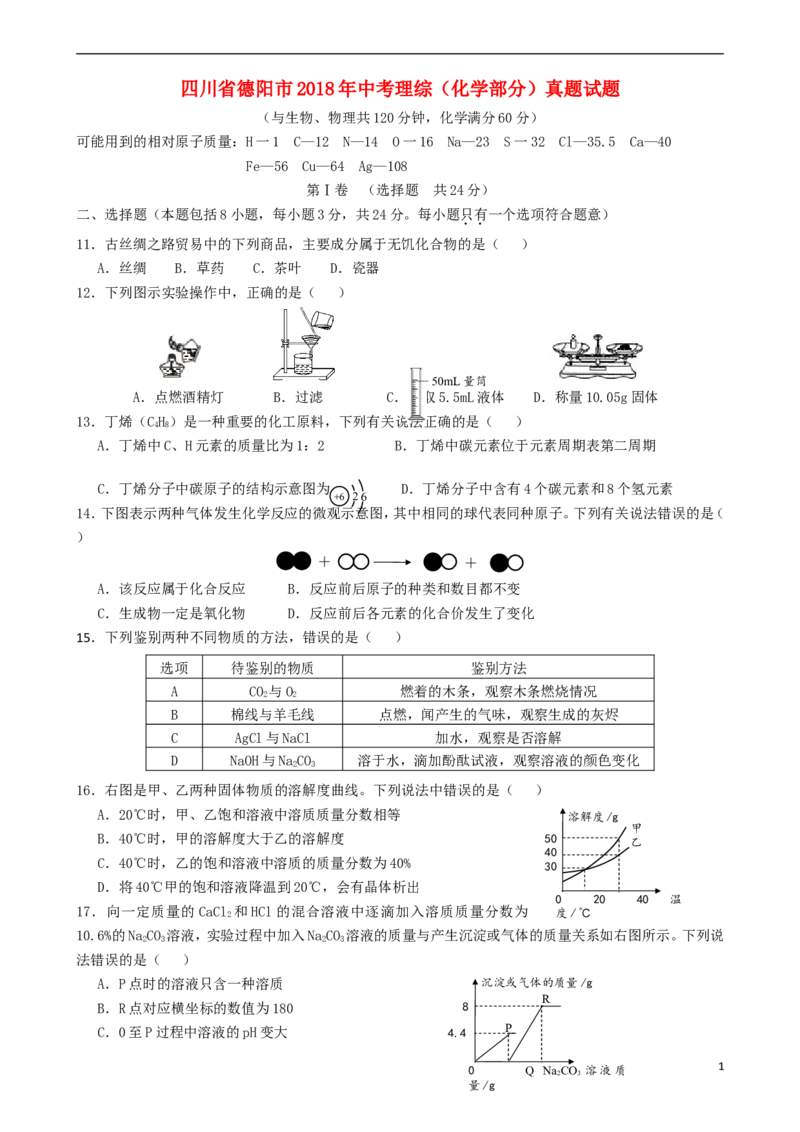
12.下列图示实验操作中,正确的是( )
—50mL量筒
A.点燃酒精灯 B.过滤 C.量取5.5mL液体 D.称量10.05g固体
13.丁烯(CH)是一种重要的化工原料,下列有关说法正确的是( )
4 8
A.丁烯中C、H元素的质量比为1:2 B.丁烯中碳元素位于元素周期表第二周期
C.丁烯分子中碳原子的结构示意图为 D.丁烯分子中含有4个碳元素和8个氢元素
+6 26
14.下图表示两种气体发生化学反应的微观示意图,其中相同的球代表同种原子。下列有关说法错误的是(
)
+ +
A.该反应属于化合反应 B.反应前后原子的种类和数目都不变
C.生成物一定是氧化物 D.反应前后各元素的化合价发生了变化
15.下列鉴别两种不同物质的方法,错误的是( )
选项 待鉴别的物质 鉴别方法
A CO 与O 燃着的木条,观察木条燃烧情况
2 2
B 棉线与羊毛线 点燃,闻产生的气味,观察生成的灰烬
C AgCl与NaCl 加水,观察是否溶解
D NaOH与NaCO 溶于水,滴加酚酞试液,观察溶液的颜色变化
2 3
16.右图是甲、乙两种固体物质的溶解度曲线。下列说法中错误的是( )
A.20℃时,甲、乙饱和溶液中溶质质量分数相等 溶解度/g
甲
B.40℃时,甲的溶解度大于乙的溶解度 50 乙
40
C.40℃时,乙的饱和溶液中溶质的质量分数为40%
30
D.将40℃甲的饱和溶液降温到20℃,会有晶体析出
0 20 40 温
17.向一定质量的CaCl 2 和HCl的混合溶液中逐滴加入溶质质量分数为 度/℃
10.6%的NaCO 溶液,实验过程中加入NaCO 溶液的质量与产生沉淀或气体的质量关系如右图所示。下列说
2 3 2 3
法错误的是( )
A.P点时的溶液只含一种溶质 沉淀或气体的质量/g
R
B.R点对应横坐标的数值为180 8
C.0至P过程中溶液的pH变大 4.4 P
0 Q NaCO 溶液质 1
2 3
量/gD.Q至R段表示生成沉淀的过程
18.向一定量的硝酸铜、硝酸银的混合溶液中加入5.6 g铁粉,充分反应后过滤、洗涤、干燥,称得固体14
g。向固体中加入稀盐酸,无气泡产生,则下列分析正确的是( )
A.滤液中一定不含有硝酸银 B.滤液中一定含有硝酸铜
C.滤出的固体中含有银7.6g D.滤出的固体中含有铜6.4g
第Ⅱ卷 (非选择题 共36分)
四、非选择题(本题包括5小题,共36分)
28.(6分)防治空气污染、改善生态环境已成为全民共识。近年来,一些城市空气中出现可吸入悬浮颗粒物
与雾形成“雾霾”天气。粒径不大于2.5μm的可吸入悬浮颗粒物(PM2.5)富含大量有毒、有害物质。
(1)下列行为可能会导致“雾霾”加重的是 (填标号)。
a.燃煤脱硫 b.植树造林 c.静电除尘 d.燃放鞭炮
(2)为了减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NO 及CH 的排放意义重大。机动车
x x y
尾气污染物的含量与“空/燃比”(空气与燃油气的体积比)的变化关系如右图所示。
①利用氨气可将汽车尾气中的氮氧化物(NO x )在一定条件下转化为对空气 污 A A:NOx
染
无污染的物质。请将该反应的化学方程式补充完整:4xNH +6NO======= 物 B:CO
3 x
的 C:CxHy
(2x+3)N+ 。 含 B
2 量
C
② 随 “ 空 / 燃 比 ” 增 大 , CO 和 CH 的 含 量 减 少 的 原 因 是 。
x y · · · · ·
12 13 14 15 16 17 18
29.(8分)A~F是初中化学的常见物质,A与B的组成元素相同,D、E在通 空/ · 燃比
常状况下是气体,F是大理石的主要成分。其转化关系如下图所示,部分反应物、生成物和反应条件未标出。
(1)A的化学式是 。
② ③
B C
(2)若B+E+F→C,则C是 (填名称或化学式)。
①
(3)反应④的化学方程式是 。 A F
④ ⑤
(4)反应⑤的化学方程式是 。 D E
30.(8分)氢氧化镁是一种重要的化工原料,某矿石由MgO、FeO、CuO和SiO 组成。用它制备氢氧化镁的流
2 3 2
程示意图如下:
熟石灰
溶液B 产品
熟石灰
溶液A
控制pH=7~9
过量稀盐酸 沉淀C
矿石
控制pH<1
沉淀SiO
2
部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 Fe(OH) Cu(OH) Mg(OH)
3 2 2
开始沉淀 1.9 4.2 9.1
完全沉淀 3.2 6.7 11.1
(1)熟石灰主要成分的化学式是 。
(2)溶液A中的阳离子是 (填离子符号)。
(3)沉淀C的成分是 。
(4)溶液B与熟石灰反应的化学方程式是 。
31.(10分)草酸存在于自然界的植物中。草酸晶体(HCO·2HO)无色,熔点为101℃,易溶于水,受热脱水、
2 2 4 2
升华,170℃以上分解。草酸能与氢氧化钙反应生成沉淀:HCO+Ca(OH) === CaCO↓+2HO。
2 2 4 2 2 4 2
2请回答下列问题:
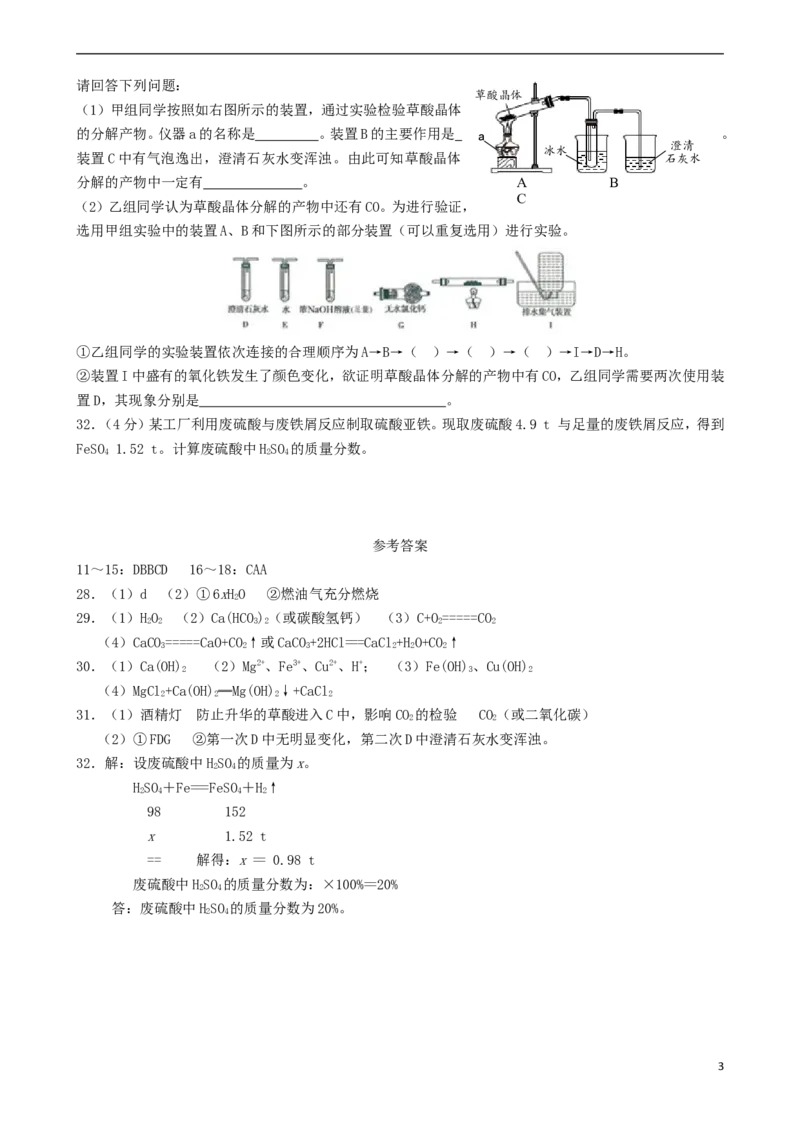
草酸晶体
(1)甲组同学按照如右图所示的装置,通过实验检验草酸晶体
的分解产物。仪器a的名称是 。装置B的主要作用是 a 。
澄清
冰水
装置C中有气泡逸出,澄清石灰水变浑浊。由此可知草酸晶体 石灰水
分解的产物中一定有 。 A B
C
(2)乙组同学认为草酸晶体分解的产物中还有CO。为进行验证,
选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
①乙组同学的实验装置依次连接的合理顺序为A→B→( )→( )→( )→I→D→H。
②装置I中盛有的氧化铁发生了颜色变化,欲证明草酸晶体分解的产物中有CO,乙组同学需要两次使用装
置D,其现象分别是 。
32.(4分)某工厂利用废硫酸与废铁屑反应制取硫酸亚铁。现取废硫酸4.9 t 与足量的废铁屑反应,得到
FeSO 1.52 t。计算废硫酸中HSO 的质量分数。
4 2 4
参考答案
11~15:DBBCD 16~18:CAA
28.(1)d (2)①6xHO ②燃油气充分燃烧
2
29.(1)HO (2)Ca(HCO)(或碳酸氢钙) (3)C+O=====CO
2 2 3 2 2 2
(4)CaCO=====CaO+CO↑或CaCO+2HCl===CaCl+HO+CO↑
3 2 3 2 2 2
30.(1)Ca(OH) (2)Mg2+、Fe3+、Cu2+、H+; (3)Fe(OH)、Cu(OH)
2 3 2
(4)MgCl+Ca(OH)═Mg(OH)↓+CaCl
2 2 2 2
31.(1)酒精灯 防止升华的草酸进入C中,影响CO 的检验 CO(或二氧化碳)
2 2
(2)①FDG ②第一次D中无明显变化,第二次D中澄清石灰水变浑浊。
32.解:设废硫酸中HSO 的质量为x。
2 4
HSO+Fe===FeSO+H↑
2 4 4 2
98 152
x 1.52 t
== 解得:x == 0.98 t
废硫酸中HSO 的质量分数为:×100%==20%
2 4
答:废硫酸中HSO 的质量分数为20%。
2 4
3