文档内容
2025 年江苏高考真题化学试题
一、单选题
1.大气中的氮是取之不尽的天然资源。下列工业生产中以氮气作反应物的是
A.工业合成氨 B.湿法炼铜 C.高炉炼铁 D.接触法制硫酸
2.科学家通过核反应 1n+6Li→3 H+4He发现氚( 3H)。下列说法正确的是
0 3 1 2 1
A. 1n表示一个质子
0
B. 6Li的基态原子核外电子排布式为1s12s2
3
C. 3H与 2H互为同位素
1 1
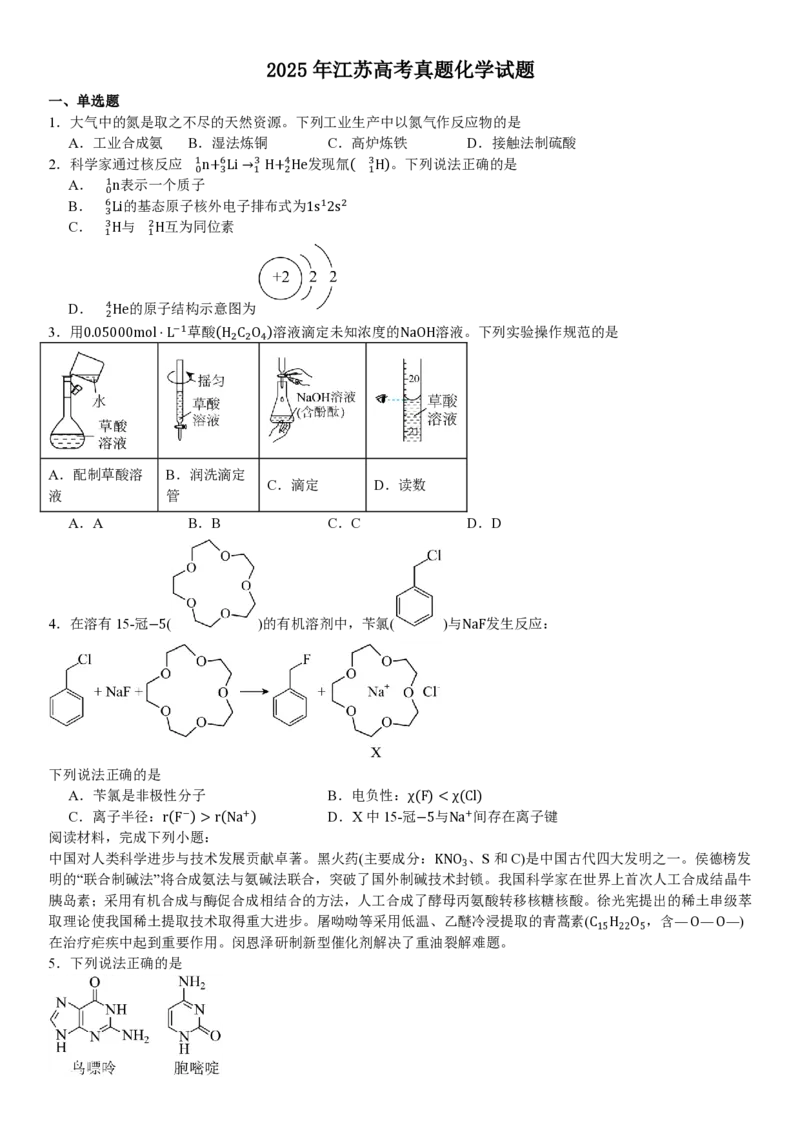
D. 4He的原子结构示意图为
2
3.用0.05000mol⋅L−1草酸(H C O )溶液滴定未知浓度的NaOH溶液。下列实验操作规范的是
2 2 4
A.配制草酸溶 B.润洗滴定
C.滴定 D.读数
液 管
A.A B.B C.C D.D
4.在溶有15-冠−5( )的有机溶剂中,苄氯( )与NaF发生反应:
下列说法正确的是
A.苄氯是非极性分子 B.电负性:χ(F)<χ(Cl)
C.离子半径:r(F−)>r(Na+) D.X中15-冠−5与Na+间存在离子键
阅读材料,完成下列小题:
中国对人类科学进步与技术发展贡献卓著。黑火药(主要成分:KNO 、S和C)是中国古代四大发明之一。侯德榜发
3
明的“联合制碱法”将合成氨法与氨碱法联合,突破了国外制碱技术封锁。我国科学家在世界上首次人工合成结晶牛
胰岛素;采用有机合成与酶促合成相结合的方法,人工合成了酵母丙氨酸转移核糖核酸。徐光宪提出的稀土串级萃
取理论使我国稀土提取技术取得重大进步。屠呦呦等采用低温、乙醚冷浸提取的青蒿素(C H O ,含—O—O—)
15 22 5
在治疗疟疾中起到重要作用。闵恩泽研制新型催化剂解决了重油裂解难题。
5.下列说法正确的是A.硫黄有S 、S2−、S 等多种同素异形体
2 4
B.高温下青蒿素分子结构稳定
C.NH 分子中H—N—H键角大于CH 分子中H—C—H键角
3 4
D.题图所示的碱基鸟嘌呤与胞嘧啶通过氢键互补配对
6.下列化学反应表示正确的是
A.黑火药爆炸:2KNO +C+3S=K CO +N ↑+3SO ↑
3 2 3 2 2
通电
B.电解饱和NaCl溶液制NaOH:Cl−+2H O 2OH−+H ↑+ClO−
2 2
催化剂
C.重油裂解获得的丙烯制聚丙烯:nCH =CH−CH →
2 3
D.向饱和氨盐水中通入过量CO :NaCl+NH +H O+CO =NaHCO ↓+NH Cl
2 3 2 2 3 4
7.下列物质组成或性质与分离提纯方法对应关系正确的是
A.蛋白质能水解,可用饱和(NH ) SO 溶液提纯蛋白质
4 2 4
B.乙醚与青蒿素组成元素相同,可用乙醚提取青蒿素
C.CCl 难溶于水、比水易溶解I ,可用CCl 萃取碘水中的I
4 2 4 2
D.不同的烃密度不同,可通过分馏从石油中获得汽油、柴油
光
8.以稀H SO 为电解质溶液的光解水装置如图所示,总反应为2H O 2H ↑+O ↑。下列说法正确的是
2 4 2 2 2
催化剂
A.电极a上发生氧化反应生成O
2
B.H+通过质子交换膜从右室移向左室
C.光解前后,H SO 溶液的pH不变
2 4
D.外电路每通过0.01mol电子,电极b上产生0.01molH
2
9.化合物Z是一种具有生理活性的多环呋喃类化合物,部分合成路线如下:
下列说法正确的是
A.1molX最多能和4molH 发生加成反应
2
B.Y分子中sp3和sp2杂化的碳原子数目比为1:2
C.Z分子中所有碳原子均在同一个平面上
D.Z不能使Br 的CCl 溶液褪色
2 4
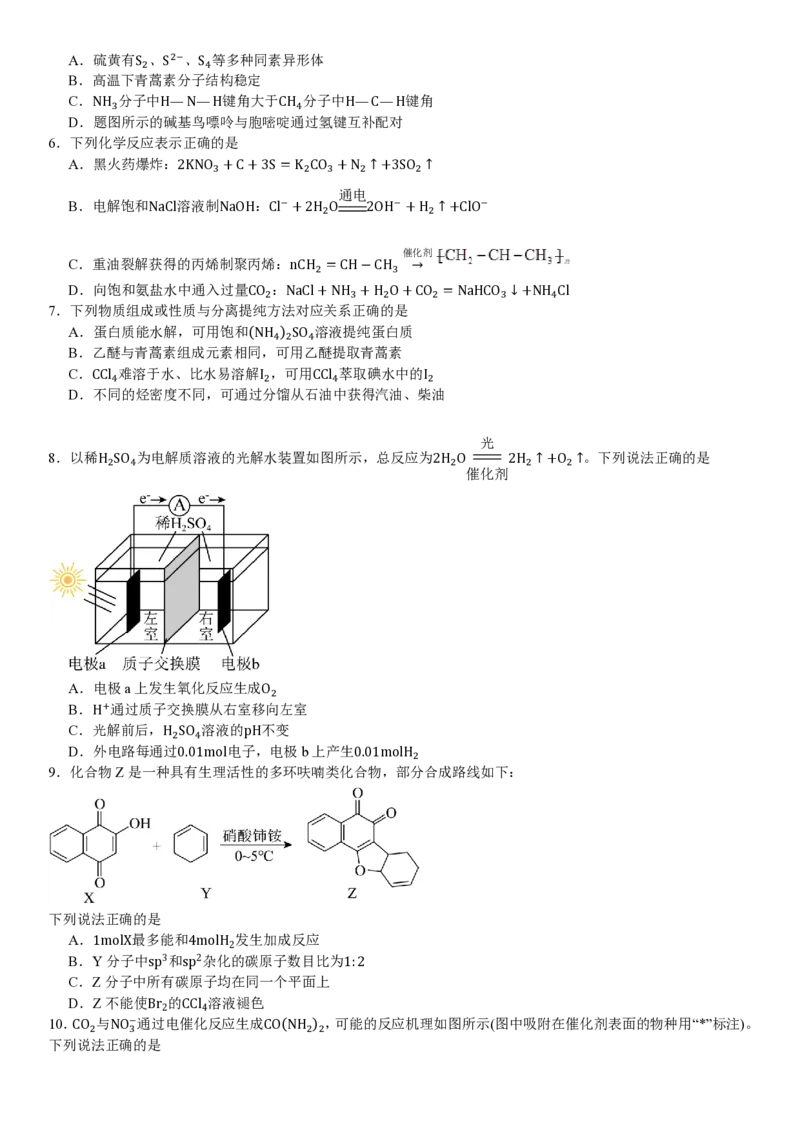
10.CO 与NO−通过电催化反应生成CO(NH ) ,可能的反应机理如图所示(图中吸附在催化剂表面的物种用“*”标注)。
2 3 2 2
下列说法正确的是A.过程Ⅱ和过程Ⅲ都有极性共价键形成
B.过程Ⅱ中NO−发生了氧化反应
3
通电
C.电催化CO 与NO−生成CO(NH ) 的反应方程式:CO +2NO−+18H+ CO(NH ) +7H O
2 3 2 2 2 3 2 2 2
催化剂
D.常温常压、无催化剂条件下,CO 与NH ⋅H O反应可生产CO(NH )
2 3 2 2 2
11.探究含铜化合物性质的实验如下:
步骤Ⅰ 取一定量5%CuSO 溶液,加入适量浓氨水,产生蓝色沉淀。
4
步骤Ⅱ 将沉淀分成两等份,分别加入相同体积的浓氨水、稀盐酸,沉淀均完全溶解,溶液分别呈现深蓝色、蓝色。
步骤Ⅲ 向步骤Ⅱ所得的深蓝色溶液中插入一根打磨过的铁钉,无明显现象;继续加入稀盐酸,振荡后静置,产生少
量气泡,铁钉表面出现红色物质。
下列说法正确的是
A.步骤Ⅰ产生的蓝色沉淀为[Cu(NH ) ]SO
3 4 4
B.步骤Ⅱ的两份溶液中:c (Cu2+)0
3 8 3 2
反应Ⅱ CO(g)+H O(g)=CO (g)+H (g) ΔH<0
2 2 2
反应Ⅲ CO (g)+4H (g)=CH (g)+2H O(g) ΔH<0
2 2 4 2
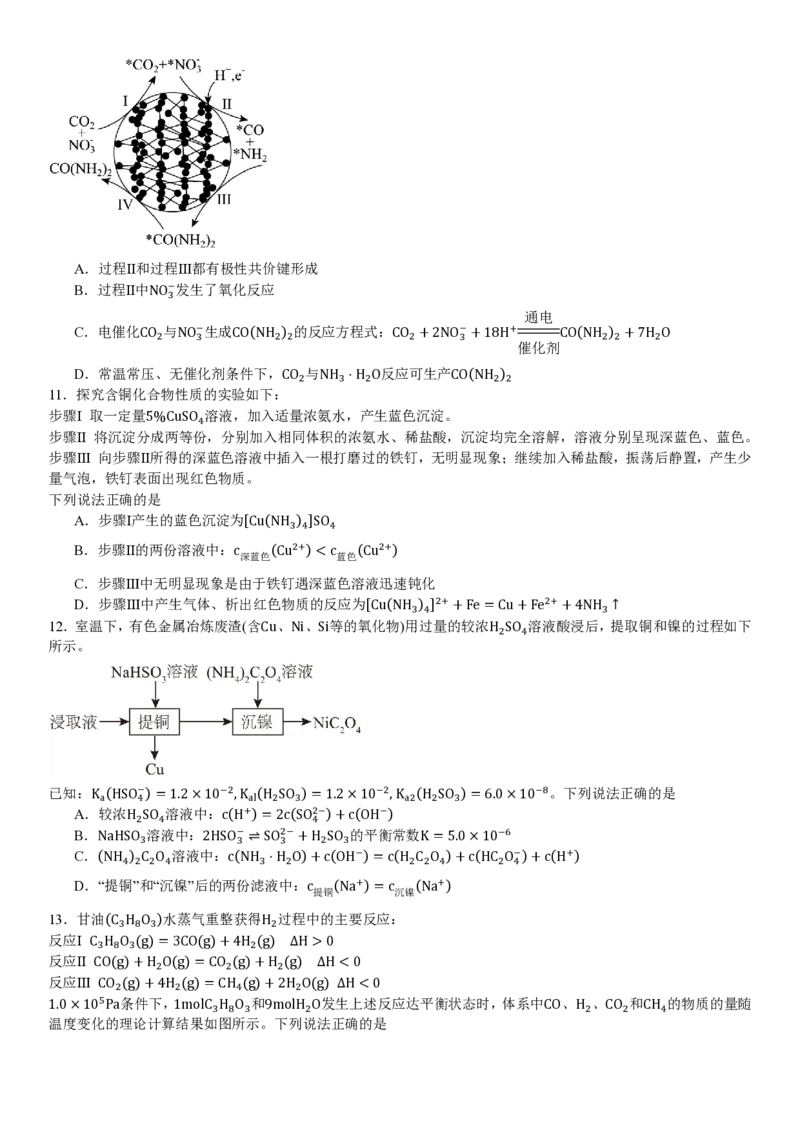
1.0×105Pa条件下,1molC H O 和9molH O发生上述反应达平衡状态时,体系中CO、H 、CO 和CH 的物质的量随
3 8 3 2 2 2 4
温度变化的理论计算结果如图所示。下列说法正确的是A.550℃时,H O的平衡转化率为20%
2
B.550℃反应达平衡状态时,n(CO ):n(CO)=11:25
2
C.其他条件不变,在400~550℃范围,平衡时H O的物质的量随温度升高而增大
2
D.其他条件不变,加压有利于增大平衡时H 的物质的量
2
二、解答题
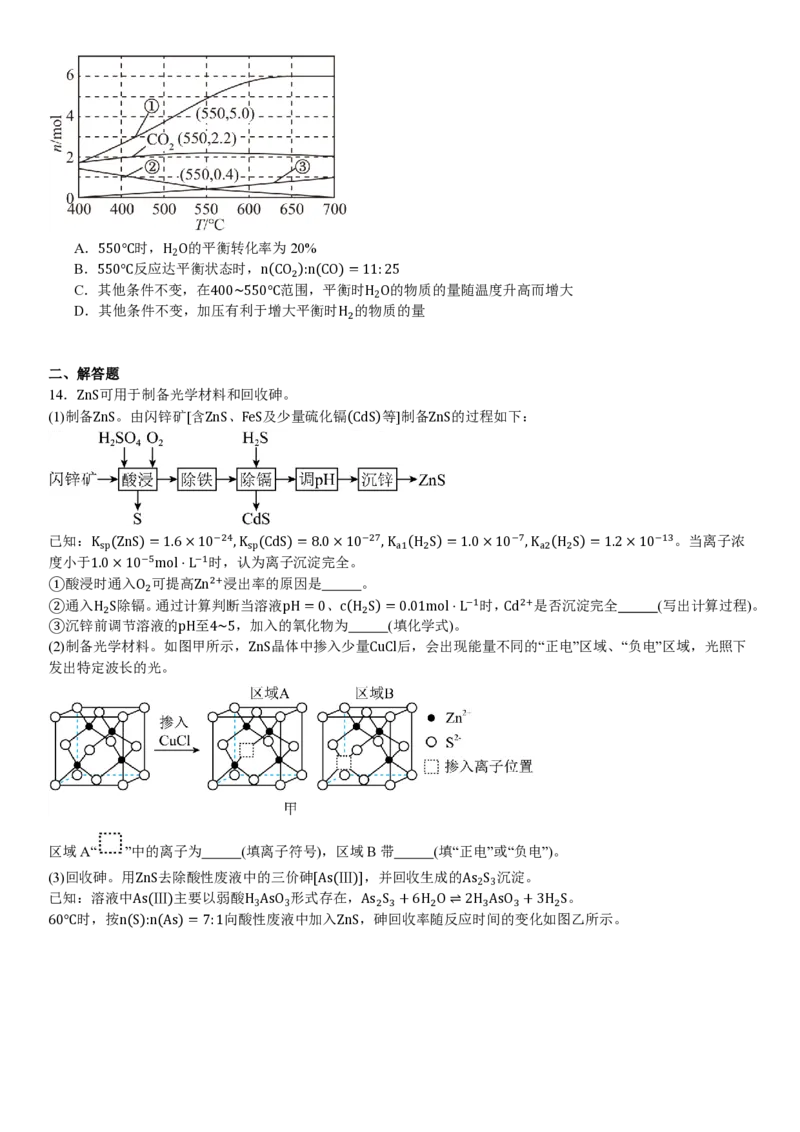
14.ZnS可用于制备光学材料和回收砷。
(1)制备ZnS。由闪锌矿[含ZnS、FeS及少量硫化镉(CdS)等]制备ZnS的过程如下:
已知:K (ZnS)=1.6×10−24,K (CdS)=8.0×10−27,K (H S)=1.0×10−7,K (H S)=1.2×10−13。当离子浓
sp sp a1 2 a2 2
度小于1.0×10−5mol⋅L−1时,认为离子沉淀完全。
①酸浸时通入O 可提高Zn2+浸出率的原因是 。
2
②通入H S除镉。通过计算判断当溶液pH=0、c(H S)=0.01mol⋅L−1时,Cd2+是否沉淀完全 (写出计算过程)。
2 2
③沉锌前调节溶液的pH至4~5,加入的氧化物为 (填化学式)。
(2)制备光学材料。如图甲所示,ZnS晶体中掺入少量CuCl后,会出现能量不同的“正电”区域、“负电”区域,光照下
发出特定波长的光。
区域A“ ”中的离子为 (填离子符号),区域B带 (填“正电”或“负电”)。
(3)回收砷。用ZnS去除酸性废液中的三价砷[As(Ⅲ)],并回收生成的As S 沉淀。
2 3
已知:溶液中As(Ⅲ)主要以弱酸H AsO 形式存在,As S +6H O⇌2H AsO +3H S。
3 3 2 3 2 3 3 2
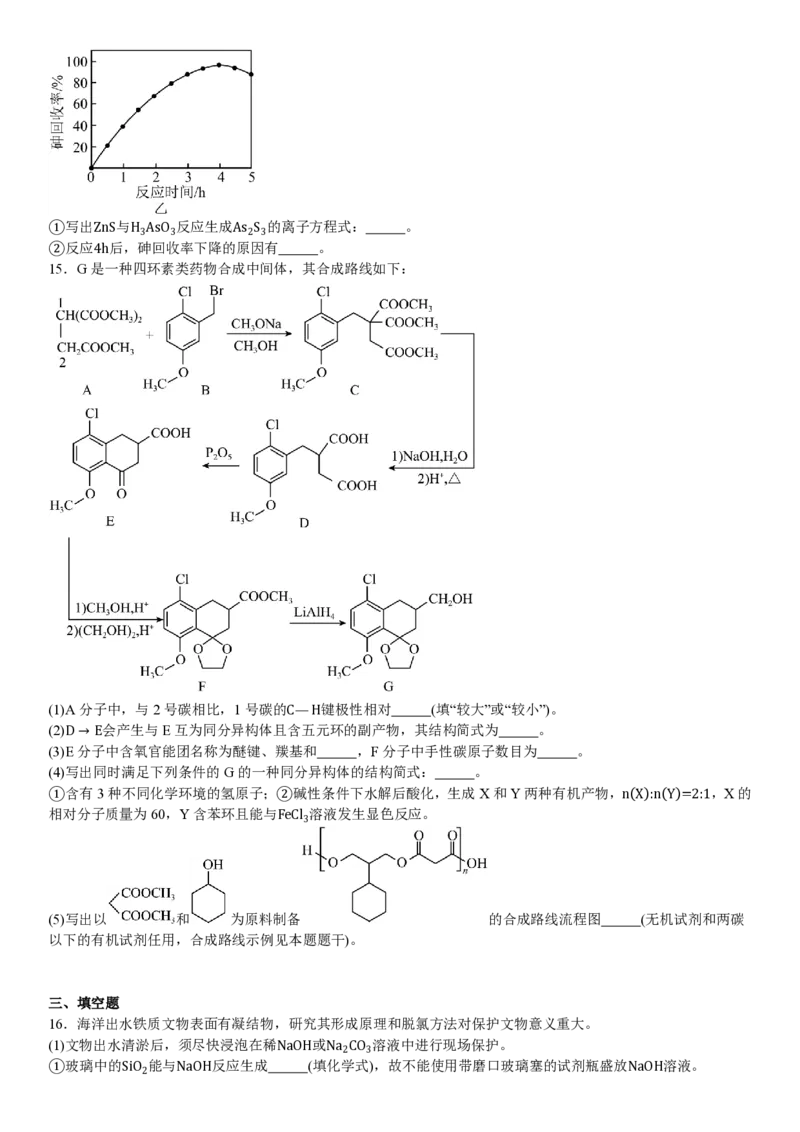
60℃时,按n(S):n(As)=7:1向酸性废液中加入ZnS,砷回收率随反应时间的变化如图乙所示。①写出ZnS与H AsO 反应生成As S 的离子方程式: 。
3 3 2 3
②反应4h后,砷回收率下降的原因有 。
15.G是一种四环素类药物合成中间体,其合成路线如下:
(1)A分子中,与2号碳相比,1号碳的C—H键极性相对 (填“较大”或“较小”)。
(2)D→E会产生与E互为同分异构体且含五元环的副产物,其结构简式为 。
(3)E分子中含氧官能团名称为醚键、羰基和 ,F分子中手性碳原子数目为 。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式: 。
①含有3种不同化学环境的氢原子;②碱性条件下水解后酸化,生成X和Y两种有机产物,n(X):n(Y)=2:1,X的
相对分子质量为60,Y含苯环且能与FeCl 溶液发生显色反应。
3
(5)写出以 和 为原料制备 的合成路线流程图 (无机试剂和两碳
以下的有机试剂任用,合成路线示例见本题题干)。
三、填空题
16.海洋出水铁质文物表面有凝结物,研究其形成原理和脱氯方法对保护文物意义重大。
(1)文物出水清淤后,须尽快浸泡在稀NaOH或Na CO 溶液中进行现场保护。
2 3
①玻璃中的SiO 能与NaOH反应生成 (填化学式),故不能使用带磨口玻璃塞的试剂瓶盛放NaOH溶液。
2②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有 。
(2)文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的Fe与海水中的SO2−在细菌作用下形成FeS等含铁凝结物。写出Fe与SO2−反应生成FeS和
4 4
Fe(OH) 的离子方程式: 。
2
②有氧环境中,海水中的铁质文物表面形成FeOOH等凝结物。
(i)铁在盐水中腐蚀的可能原理如图所示。依据原理设计如下实验:向NaCl溶液中加入K [Fe(CN) ]溶液(能与Fe2+形
3 6
成蓝色沉淀)和酚酞,将混合液滴到生铁片上。预测该实验的现象为 。
(ii)铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集Cl−的可能原因。该胶粒的形成过程中,参与的
主要阳离子有 (填离子符号)。
(3)为比较含氯FeOOH在NaOH溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定量含氯FeOOH模拟样品,
将其分为两等份, ,比较滴加AgNO 溶液体积[K (AgCl)=1.8×10−10。实验须遵循节约试剂用量的原则,
3 sp
必须使用的试剂:蒸馏水、0.5mol⋅L−1NaOH溶液、0.5mol⋅L−1HNO 溶液、0.05mol⋅L−1AgNO 溶液]。
3 3
四、解答题
17.合成气(CO和H )是重要的工业原料气。
2
(1)合成气制备甲醇:CO(g)+2H (g)=CH OH(g)。CO的结构式为C≡O,估算该反应的ΔH需要 (填数字)种化
2 3
学键的键能数据。
(2)合成气经“变换”“脱碳”获得纯H 。
2
低温型催化剂
①合成气变换。向绝热反应器中通入CO、H 和过量的H O(g):CO(g)+H O(g) CO (g)+H (g) ΔH<
2 2 2 2 2
约230°C、3MPa
0。催化作用受接触面积和温度等因素影响,H O(g)的比热容较大。H O(g)过量能有效防止催化剂活性下降,其原
2 2
因有 。
②脱碳在钢制吸收塔中进行,吸收液成分:质量分数30%的K CO 吸收剂、K CrO (Cr正价有+3、+6)缓蚀剂等。
2 3 2 4
K CO 溶液浓度偏高会堵塞设备,导致堵塞的物质是 (填化学式)。K CrO 减缓设备腐蚀的原理是 。
2 3 2 4
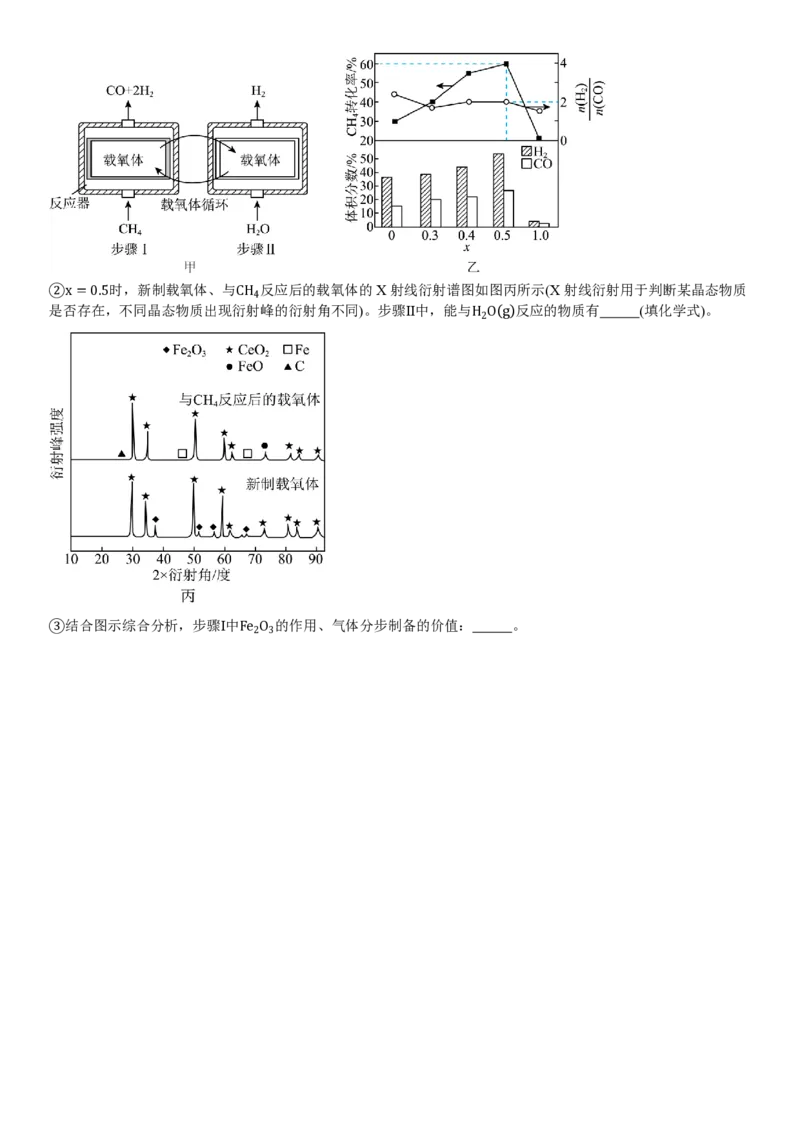
(3)研究CH 、H O(g)与不同配比的铁铈载氧体[ x Fe O ⋅(1−x)CeO ,0≤x≤1,Ce是活泼金属,正价有+3、+4]
4 2 2 3 2
2
反应,气体分步制备原理示意如图甲所示。相同条件下,先后以一定流速通入固定体积的CH 、H O(g),依次发生
4 2
的主要反应:
载氧体供氧
步骤Ⅰ CH → CO+2H
4 2
850℃
载氧体夺氧
步骤Ⅱ H O → H
2 2
400℃
①步骤Ⅰ中,产物气体积分数、CH
转化率、n(H2 ) 与x的关系如图乙所示。x=0时,n(H2 )
大于理论值2的可能原因
4
n(CO) n(CO)
n (CO)
有 ;x=0.5时,通入标准状况下300mL的CH 至反应结束,CO的选择性= 生成 ×100%=80%,则生成标
4 n
转化
(CH4 )
准状况下CO和H 的总体积为 mL。
2②x=0.5时,新制载氧体、与CH 反应后的载氧体的X射线衍射谱图如图丙所示(X射线衍射用于判断某晶态物质
4
是否存在,不同晶态物质出现衍射峰的衍射角不同)。步骤Ⅱ中,能与H O(g)反应的物质有 (填化学式)。
2
③结合图示综合分析,步骤Ⅰ中Fe O 的作用、气体分步制备的价值: 。
2 3