医疗器械:设计和开发要求形成的文件
点击蓝字关注我哦


来源:medworld器械世界
《医疗器械生产质量管理规范 附录体外诊断试剂现场检查指导原则》国药总局(2015年第103号)第5章对医疗器械设计和开发工作做出了明确的规定。
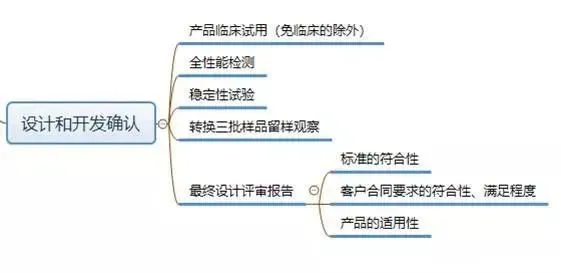
按照《指导原则》,设计和开发工作可分为:策划、输入、输出、转换和验证、确认,以及设计和开发更改等阶段。
现在,我们给大家梳理一下设计和开发工作要求形成的文件:
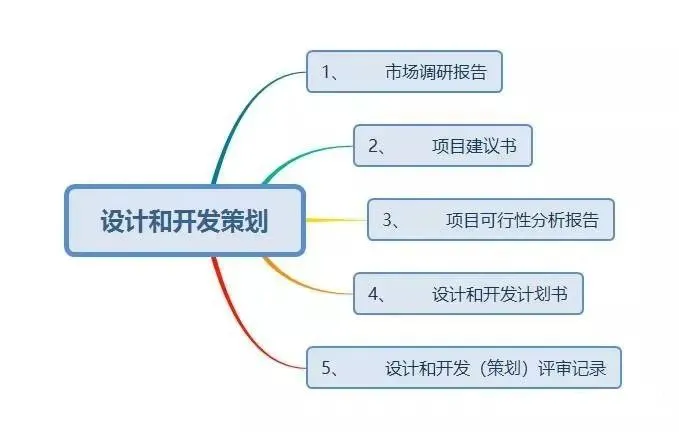
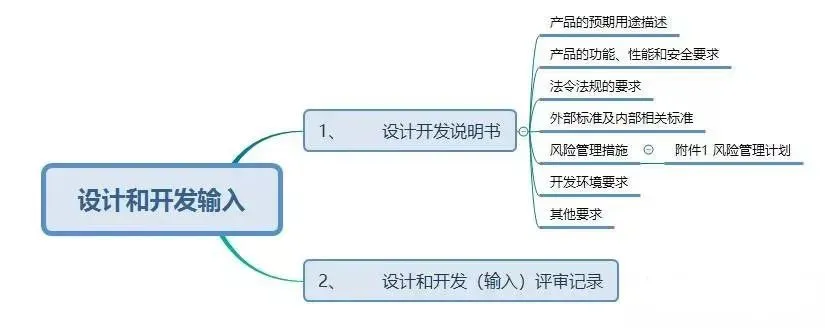
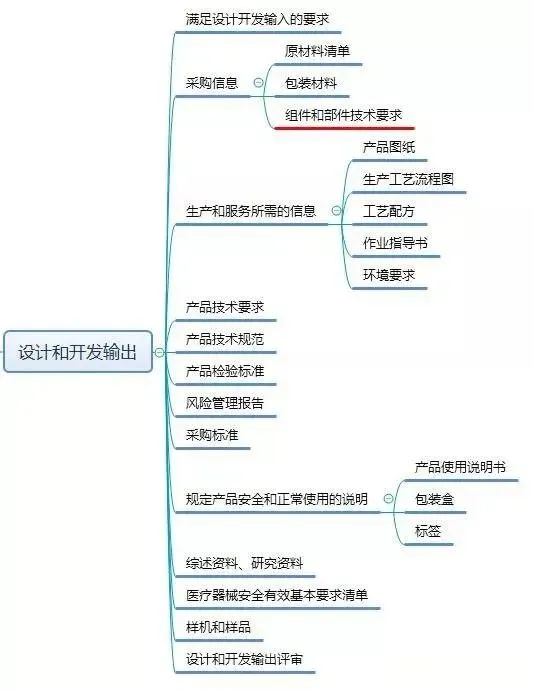
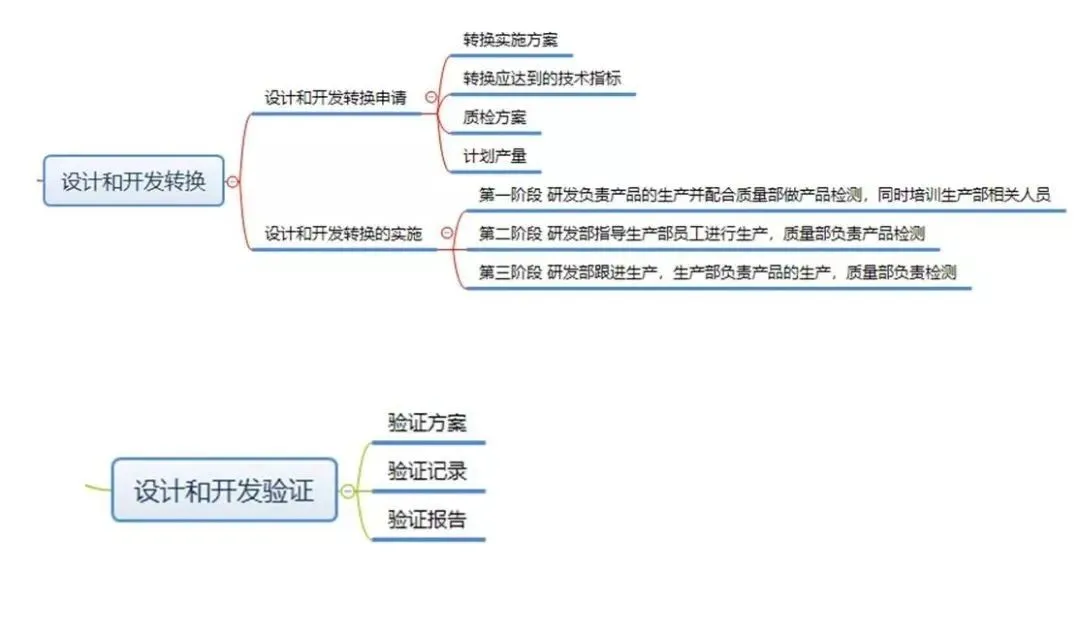
结束语:
设计和开发工作除了以上要求形成的文件以外,还应保留设计和开发期间相应的过程记录。
此外,若在设计和开发期间发生更改,还应保留设计和开发更改的相关记录。并对设计和开发更改进行相应的评审和风险风险分析。
End


往期导览




 夜雨聆风
夜雨聆风





