文档内容
题型 02 无机与工艺流程综合题
内容概览
考点01 无机综合题
考点02 工艺流程综合题
考点01 无机综合题
1.(2024·高一上·天津市重点校·期末)已知A为淡黄色固体,T、R为日常生活中两种常见的用途很广的
金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰
绿色,最终变为红褐色固体M。
(1)写出下列物质的化学式:A: ,D: ,W: 。
(2)按要求写出下列方程式:
①A和水反应的化学方程式: 。
②D能与HI溶液反应,该反应的离子方程式: 。
③H在潮湿空气中变成M的化学方程式: 。
(3)检验W中阳离子的方法是: 。
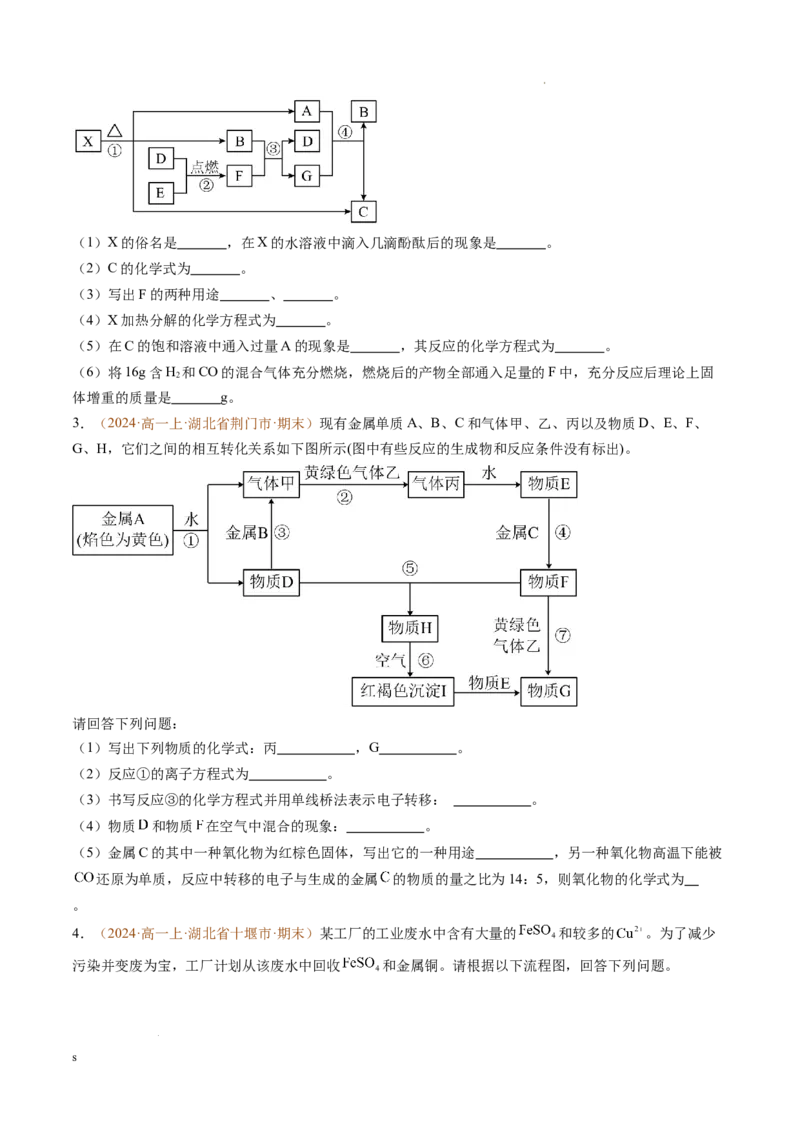
2.(2024·高一上·重庆·期末)有八种常见物质的转化关系如下图所示。D、E是单质,其余的均是化合
物,X为医学上治疗胃酸过多的一种药剂的主要成分,F为淡黄色固体,B常温下为无色液体,E为金属单
质。请回答下列有关问题:
s
学科网(北京)股份有限公司(1)X的俗名是 ,在X的水溶液中滴入几滴酚酞后的现象是 。
(2)C的化学式为 。
(3)写出F的两种用途 、 。
(4)X加热分解的化学方程式为 。
(5)在C的饱和溶液中通入过量A的现象是 ,其反应的化学方程式为 。
(6)将16g含H 和CO的混合气体充分燃烧,燃烧后的产物全部通入足量的F中,充分反应后理论上固
2
体增重的质量是 g。
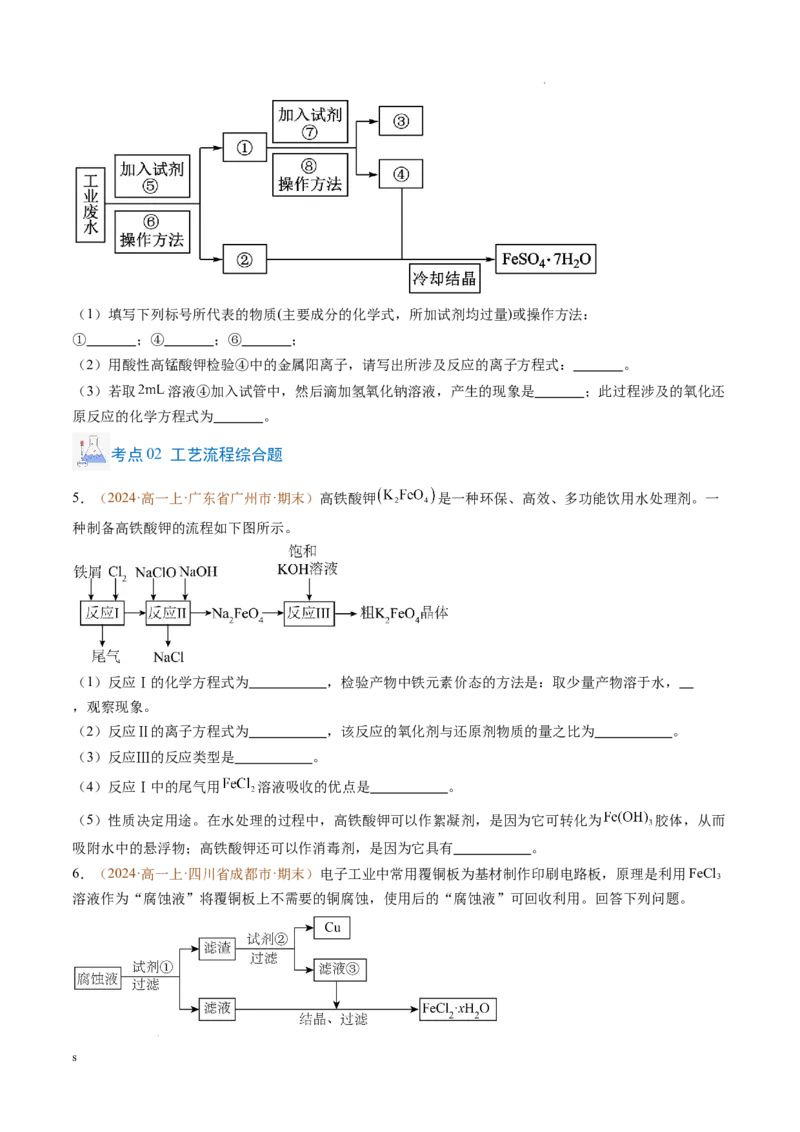
3.(2024·高一上·湖北省荆门市·期末)现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、
G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:丙 ,G 。
(2)反应①的离子方程式为 。
(3)书写反应③的化学方程式并用单线桥法表示电子转移: 。
(4)物质 和物质 在空气中混合的现象: 。
(5)金属C的其中一种氧化物为红棕色固体,写出它的一种用途 ,另一种氧化物高温下能被
还原为单质,反应中转移的电子与生成的金属 的物质的量之比为14:5,则氧化物的化学式为
。
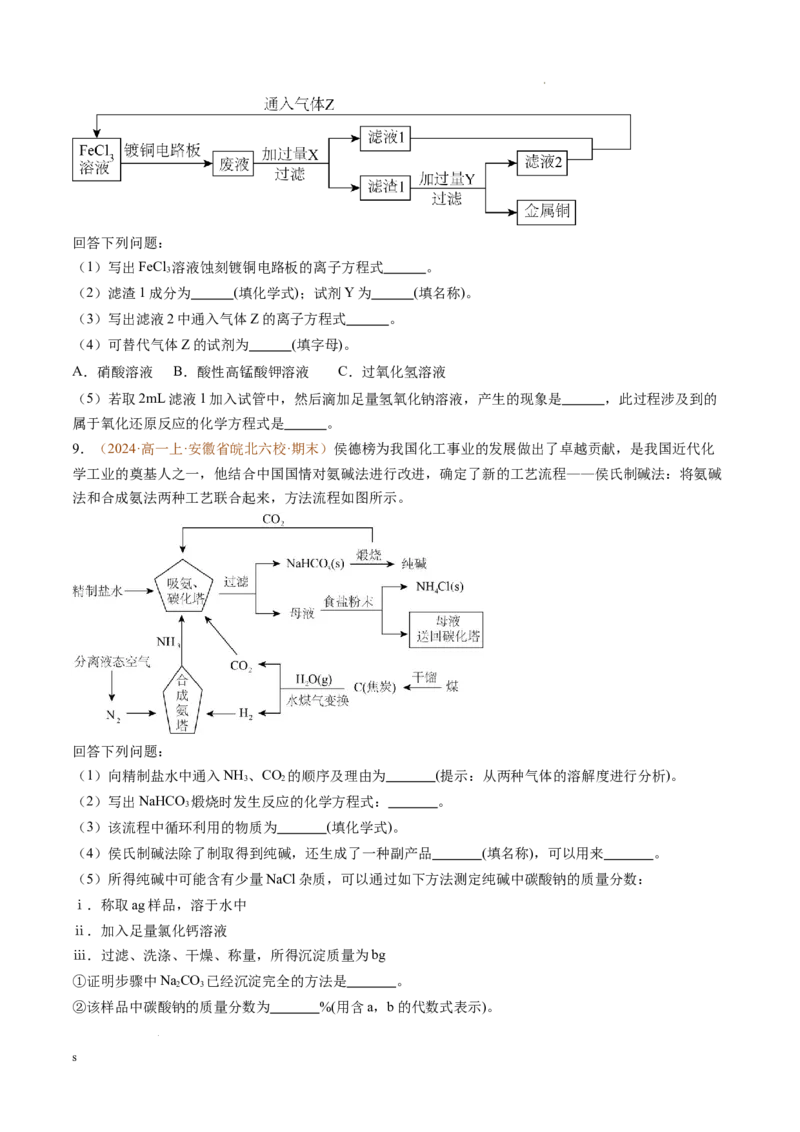
4.(2024·高一上·湖北省十堰市·期末)某工厂的工业废水中含有大量的 和较多的 。为了减少
污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题。
s
学科网(北京)股份有限公司(1)填写下列标号所代表的物质(主要成分的化学式,所加试剂均过量)或操作方法:
① ;④ ;⑥ ;
(2)用酸性高锰酸钾检验④中的金属阳离子,请写出所涉及反应的离子方程式: 。
(3)若取 溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是 ;此过程涉及的氧化还
原反应的化学方程式为 。
考点02 工艺流程综合题
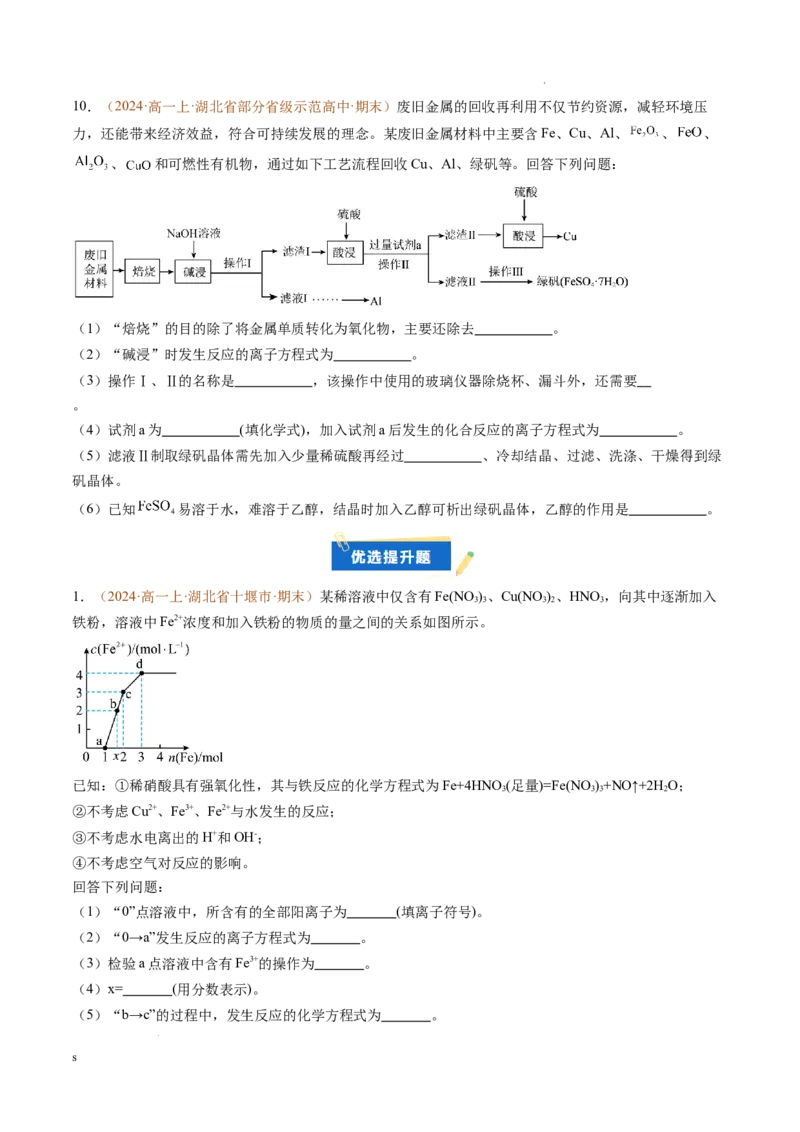
5.(2024·高一上·广东省广州市·期末)高铁酸钾 是一种环保、高效、多功能饮用水处理剂。一
种制备高铁酸钾的流程如下图所示。
(1)反应Ⅰ的化学方程式为 ,检验产物中铁元素价态的方法是:取少量产物溶于水,
,观察现象。
(2)反应Ⅱ的离子方程式为 ,该反应的氧化剂与还原剂物质的量之比为 。
(3)反应Ⅲ的反应类型是 。
(4)反应Ⅰ中的尾气用 溶液吸收的优点是 。
(5)性质决定用途。在水处理的过程中,高铁酸钾可以作絮凝剂,是因为它可转化为 胶体,从而
吸附水中的悬浮物;高铁酸钾还可以作消毒剂,是因为它具有 。
6.(2024·高一上·四川省成都市·期末)电子工业中常用覆铜板为基材制作印刷电路板,原理是利用FeCl
3
溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀,使用后的“腐蚀液”可回收利用。回答下列问题。
s
学科网(北京)股份有限公司(1)FeCl 溶液腐蚀电路板的化学方程式为 。
3
(2)过量试剂①为 ;过量试剂②为 。
(3)鉴别滤液③中的金属阳离子,应滴加的试剂依次是 ,现象是 。FeCl 长时间暴露在空气
2
中会变质,主要原因是 。
(4)取2mL滤液③加入试管中,逐滴加入NaOH溶液。填写下列表格:
序号 现象 用方程式解释现象
① 开始无明显现象
② 稍后出现白色沉淀 Fe2++2OH-=Fe(OH) ↓
2
空气中放置一段时间后,出现红褐色沉
③
淀
7.(2024·高一上·湖北省荆门市·期末)二氧化氯( )、亚氯酸钠( )是两种新型水处理剂。已知纯
易分解爆炸,高于 时 易分解。一种制备亚氯酸钠晶体的工艺流程如下:
(1) 发生器中发生反应的化学方程式为 ,混合气中空气的作用是 。
(2)关于二氧化氯( )、亚氯酸钠( ),下列说法正确的是 。
A.用于工业和饮用水处理过程中,宜用廉价的 代替
B.工业上将 转化为 ,更便于储存与运输
C.饮用水中残留的少量 ,可加入适量 溶液去除
(3)吸收塔中发生反应的离子方程式为 ,氧化产物为 。
(4)吸收塔中要严格控制温度低于 ,目的是 。
(5)每生成 ,理论上需消耗标准状态下 的体积为 L。
8.(23-24高一上·安徽省合肥市六校联盟·期末)电子工业中,人们常用FeCl 溶液蚀刻印刷电路板,并进
3
一步从腐蚀液中回收Cu和FeCl 溶液。实验室模拟流程如图所示:
3
s
学科网(北京)股份有限公司回答下列问题:
(1)写出FeCl 溶液蚀刻镀铜电路板的离子方程式 。
3
(2)滤渣1成分为 (填化学式);试剂Y为 (填名称)。
(3)写出滤液2中通入气体Z的离子方程式 。
(4)可替代气体Z的试剂为 (填字母)。
A.硝酸溶液 B.酸性高锰酸钾溶液 C.过氧化氢溶液
(5)若取2mL滤液1加入试管中,然后滴加足量氢氧化钠溶液,产生的现象是 ,此过程涉及到的
属于氧化还原反应的化学方程式是 。
9.(2024·高一上·安徽省皖北六校·期末)侯德榜为我国化工事业的发展做出了卓越贡献,是我国近代化
学工业的奠基人之一,他结合中国国情对氨碱法进行改进,确定了新的工艺流程——侯氏制碱法:将氨碱
法和合成氨法两种工艺联合起来,方法流程如图所示。
回答下列问题:
(1)向精制盐水中通入NH 、CO 的顺序及理由为 (提示:从两种气体的溶解度进行分析)。
3 2
(2)写出NaHCO 煅烧时发生反应的化学方程式: 。
3
(3)该流程中循环利用的物质为 (填化学式)。
(4)侯氏制碱法除了制取得到纯碱,还生成了一种副产品 (填名称),可以用来 。
(5)所得纯碱中可能含有少量NaCl杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:
ⅰ.称取ag样品,溶于水中
ⅱ.加入足量氯化钙溶液
ⅲ.过滤、洗涤、干燥、称量,所得沉淀质量为bg
①证明步骤中NaCO 已经沉淀完全的方法是 。
2 3
②该样品中碳酸钠的质量分数为 %(用含a,b的代数式表示)。
s
学科网(北京)股份有限公司10.(2024·高一上·湖北省部分省级示范高中·期末)废旧金属的回收再利用不仅节约资源,减轻环境压
力,还能带来经济效益,符合可持续发展的理念。某废旧金属材料中主要含Fe、Cu、Al、 、 、
、 和可燃性有机物,通过如下工艺流程回收Cu、Al、绿矾等。回答下列问题:
(1)“焙烧”的目的除了将金属单质转化为氧化物,主要还除去 。
(2)“碱浸”时发生反应的离子方程式为 。
(3)操作Ⅰ、Ⅱ的名称是 ,该操作中使用的玻璃仪器除烧杯、漏斗外,还需要
。
(4)试剂a为 (填化学式),加入试剂a后发生的化合反应的离子方程式为 。
(5)滤液Ⅱ制取绿矾晶体需先加入少量稀硫酸再经过 、冷却结晶、过滤、洗涤、干燥得到绿
矾晶体。
(6)已知 易溶于水,难溶于乙醇,结晶时加入乙醇可析出绿矾晶体,乙醇的作用是 。
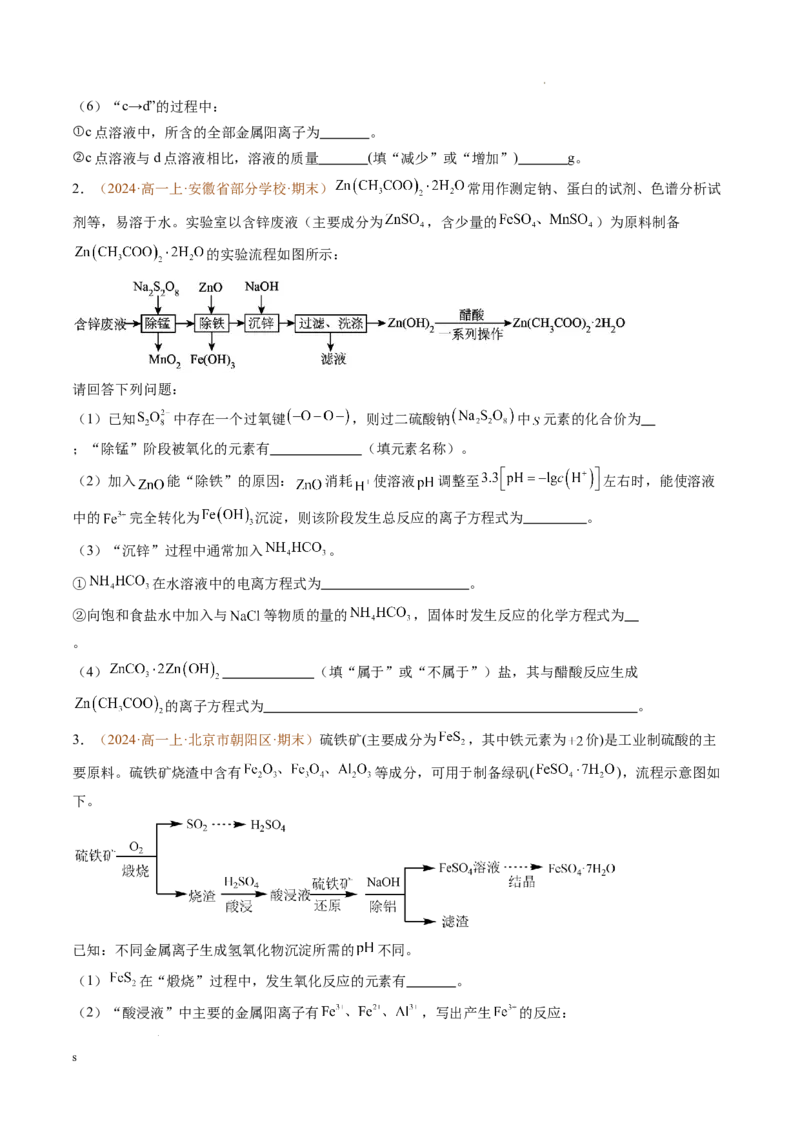
1.(2024·高一上·湖北省十堰市·期末)某稀溶液中仅含有Fe(NO )、Cu(NO )、HNO,向其中逐渐加入
3 3 3 2 3
铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。
已知:①稀硝酸具有强氧化性,其与铁反应的化学方程式为Fe+4HNO (足量)=Fe(NO )+NO↑+2HO;
3 3 3 2
②不考虑Cu2+、Fe3+、Fe2+与水发生的反应;
③不考虑水电离出的H+和OH-;
④不考虑空气对反应的影响。
回答下列问题:
(1)“0”点溶液中,所含有的全部阳离子为 (填离子符号)。
(2)“0→a”发生反应的离子方程式为 。
(3)检验a点溶液中含有Fe3+的操作为 。
(4)x= (用分数表示)。
(5)“b→c”的过程中,发生反应的化学方程式为 。
s
学科网(北京)股份有限公司(6)“c→d”的过程中:
①c点溶液中,所含的全部金属阳离子为 。
②c点溶液与d点溶液相比,溶液的质量 (填“减少”或“增加”) g。
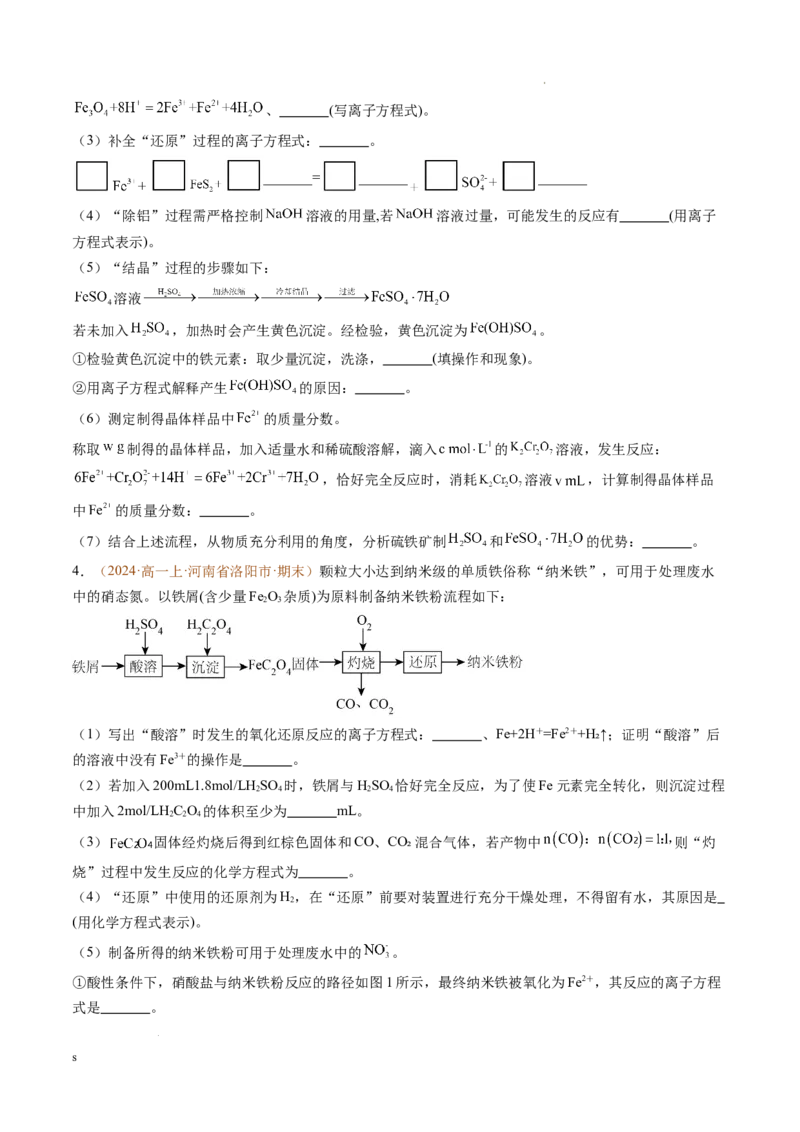
2.(2024·高一上·安徽省部分学校·期末) 常用作测定钠、蛋白的试剂、色谱分析试
剂等,易溶于水。实验室以含锌废液(主要成分为 ,含少量的 )为原料制备
的实验流程如图所示:
请回答下列问题:
(1)已知 中存在一个过氧键 ,则过二硫酸钠 中 元素的化合价为
;“除锰”阶段被氧化的元素有 (填元素名称)。
(2)加入 能“除铁”的原因: 消耗 使溶液 调整至 左右时,能使溶液
中的 完全转化为 沉淀,则该阶段发生总反应的离子方程式为 。
(3)“沉锌”过程中通常加入 。
① 在水溶液中的电离方程式为 。
②向饱和食盐水中加入与 等物质的量的 ,固体时发生反应的化学方程式为
。
(4) (填“属于”或“不属于”)盐,其与醋酸反应生成
的离子方程式为 。
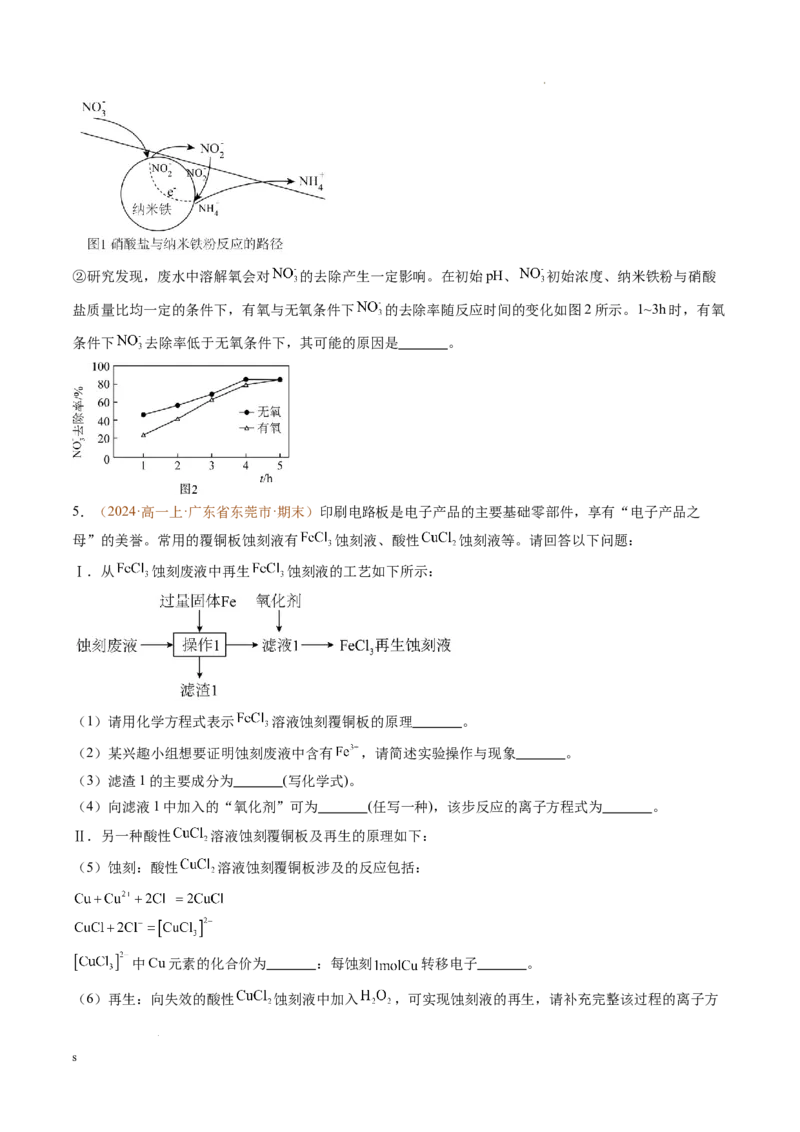
3.(2024·高一上·北京市朝阳区·期末)硫铁矿(主要成分为 ,其中铁元素为 价)是工业制硫酸的主
要原料。硫铁矿烧渣中含有 等成分,可用于制备绿矾( ),流程示意图如
下。
已知:不同金属离子生成氢氧化物沉淀所需的 不同。
(1) 在“煅烧”过程中,发生氧化反应的元素有 。
(2)“酸浸液”中主要的金属阳离子有 ,写出产生 的反应:
s
学科网(北京)股份有限公司、 (写离子方程式)。
(3)补全“还原”过程的离子方程式: 。
_______= _______ _______
(4)“除铝”过程需严格控制 溶液的用量,若 溶液过量,可能发生的反应有 (用离子
方程式表示)。
(5)“结晶”过程的步骤如下:
溶液
若未加入 ,加热时会产生黄色沉淀。经检验,黄色沉淀为 。
①检验黄色沉淀中的铁元素:取少量沉淀,洗涤, (填操作和现象)。
②用离子方程式解释产生 的原因: 。
(6)测定制得晶体样品中 的质量分数。
称取 制得的晶体样品,加入适量水和稀硫酸溶解,滴入 的 溶液,发生反应:
,恰好完全反应时,消耗 溶液 ,计算制得晶体样品
中 的质量分数: 。
(7)结合上述流程,从物质充分利用的角度,分析硫铁矿制 和 的优势: 。
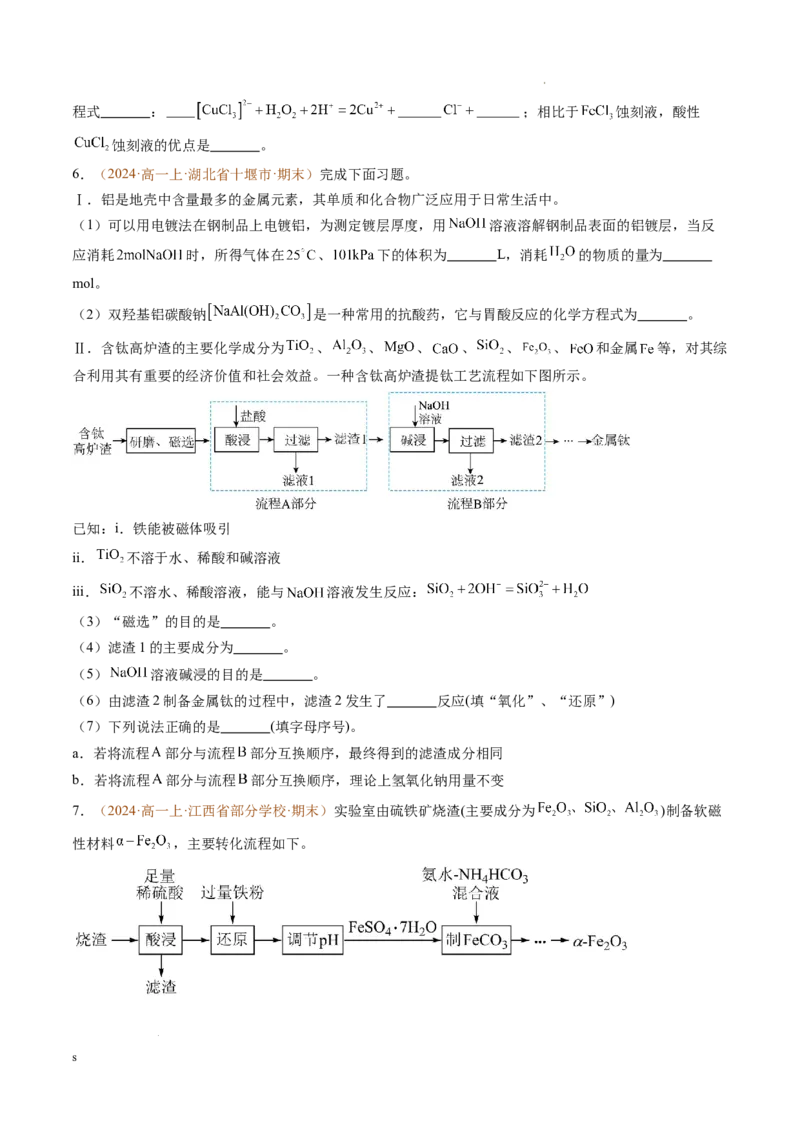
4.(2024·高一上·河南省洛阳市·期末)颗粒大小达到纳米级的单质铁俗称“纳米铁”,可用于处理废水
中的硝态氮。以铁屑(含少量Fe O 杂质)为原料制备纳米铁粉流程如下:
2 3
(1)写出“酸溶”时发生的氧化还原反应的离子方程式: 、Fe+2H+=Fe2++H₂↑;证明“酸溶”后
的溶液中没有Fe3+的操作是 。
(2)若加入200mL1.8mol/LH SO 时,铁屑与HSO 恰好完全反应,为了使Fe元素完全转化,则沉淀过程
2 4 2 4
中加入2mol/LHC O 的体积至少为 mL。
2 2 4
(3) 固体经灼烧后得到红棕色固体和CO、CO₂混合气体,若产物中 则“灼
烧”过程中发生反应的化学方程式为 。
(4)“还原”中使用的还原剂为H,在“还原”前要对装置进行充分干燥处理,不得留有水,其原因是
2
(用化学方程式表示)。
(5)制备所得的纳米铁粉可用于处理废水中的 。
①酸性条件下,硝酸盐与纳米铁粉反应的路径如图1所示,最终纳米铁被氧化为Fe2+,其反应的离子方程
式是 。
s
学科网(北京)股份有限公司②研究发现,废水中溶解氧会对 的去除产生一定影响。在初始pH、 初始浓度、纳米铁粉与硝酸
盐质量比均一定的条件下,有氧与无氧条件下 的去除率随反应时间的变化如图2所示。1~3h时,有氧
条件下 去除率低于无氧条件下,其可能的原因是 。
5.(2024·高一上·广东省东莞市·期末)印刷电路板是电子产品的主要基础零部件,享有“电子产品之
母”的美誉。常用的覆铜板蚀刻液有 蚀刻液、酸性 蚀刻液等。请回答以下问题:
Ⅰ.从 蚀刻废液中再生 蚀刻液的工艺如下所示:
(1)请用化学方程式表示 溶液蚀刻覆铜板的原理 。
(2)某兴趣小组想要证明蚀刻废液中含有 ,请简述实验操作与现象 。
(3)滤渣1的主要成分为 (写化学式)。
(4)向滤液1中加入的“氧化剂”可为 (任写一种),该步反应的离子方程式为 。
Ⅱ.另一种酸性 溶液蚀刻覆铜板及再生的原理如下:
(5)蚀刻:酸性 溶液蚀刻覆铜板涉及的反应包括:
中Cu元素的化合价为 :每蚀刻 转移电子 。
(6)再生:向失效的酸性 蚀刻液中加入 ,可实现蚀刻液的再生,请补充完整该过程的离子方
s
学科网(北京)股份有限公司程式 : ;相比于 蚀刻液,酸性
蚀刻液的优点是 。
6.(2024·高一上·湖北省十堰市·期末)完成下面习题。
Ⅰ.铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用 溶液溶解钢制品表面的铝镀层,当反
应消耗 时,所得气体在 、 下的体积为 L,消耗 的物质的量为
mol。
(2)双羟基铝碳酸钠 是一种常用的抗酸药,它与胃酸反应的化学方程式为 。
Ⅱ.含钛高炉渣的主要化学成分为 、 、 、 、 、 、 和金属 等,对其综
合利用其有重要的经济价值和社会效益。一种含钛高炉渣提钛工艺流程如下图所示。
已知:i.铁能被磁体吸引
ii. 不溶于水、稀酸和碱溶液
iii. 不溶水、稀酸溶液,能与 溶液发生反应:
(3)“磁选”的目的是 。
(4)滤渣1的主要成分为 。
(5) 溶液碱浸的目的是 。
(6)由滤渣2制备金属钛的过程中,滤渣2发生了 反应(填“氧化”、“还原”)
(7)下列说法正确的是 (填字母序号)。
a.若将流程 部分与流程 部分互换顺序,最终得到的滤渣成分相同
b.若将流程 部分与流程 部分互换顺序,理论上氢氧化钠用量不变
7.(2024·高一上·江西省部分学校·期末)实验室由硫铁矿烧渣(主要成分为 )制备软磁
性材料 ,主要转化流程如下。
s
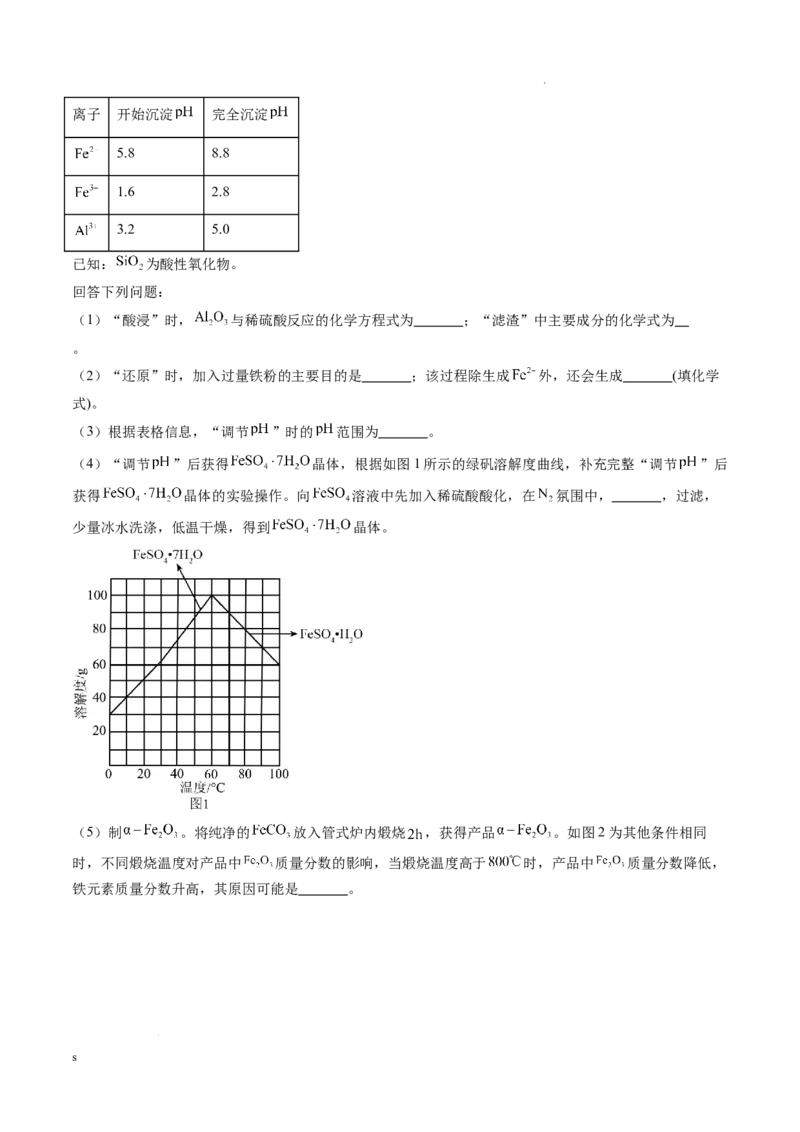
学科网(北京)股份有限公司离子 开始沉淀 完全沉淀
5.8 8.8
1.6 2.8
3.2 5.0
已知: 为酸性氧化物。
回答下列问题:
(1)“酸浸”时, 与稀硫酸反应的化学方程式为 ;“滤渣”中主要成分的化学式为
。
(2)“还原”时,加入过量铁粉的主要目的是 ;该过程除生成 外,还会生成 (填化学
式)。
(3)根据表格信息,“调节 ”时的 范围为 。
(4)“调节 ”后获得 晶体,根据如图1所示的绿矾溶解度曲线,补充完整“调节 ”后
获得 晶体的实验操作。向 溶液中先加入稀硫酸酸化,在 氛围中, ,过滤,
少量冰水洗涤,低温干燥,得到 晶体。
(5)制 。将纯净的 放入管式炉内煅烧 ,获得产品 。如图2为其他条件相同
时,不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于 时,产品中 质量分数降低,
铁元素质量分数升高,其原因可能是 。
s
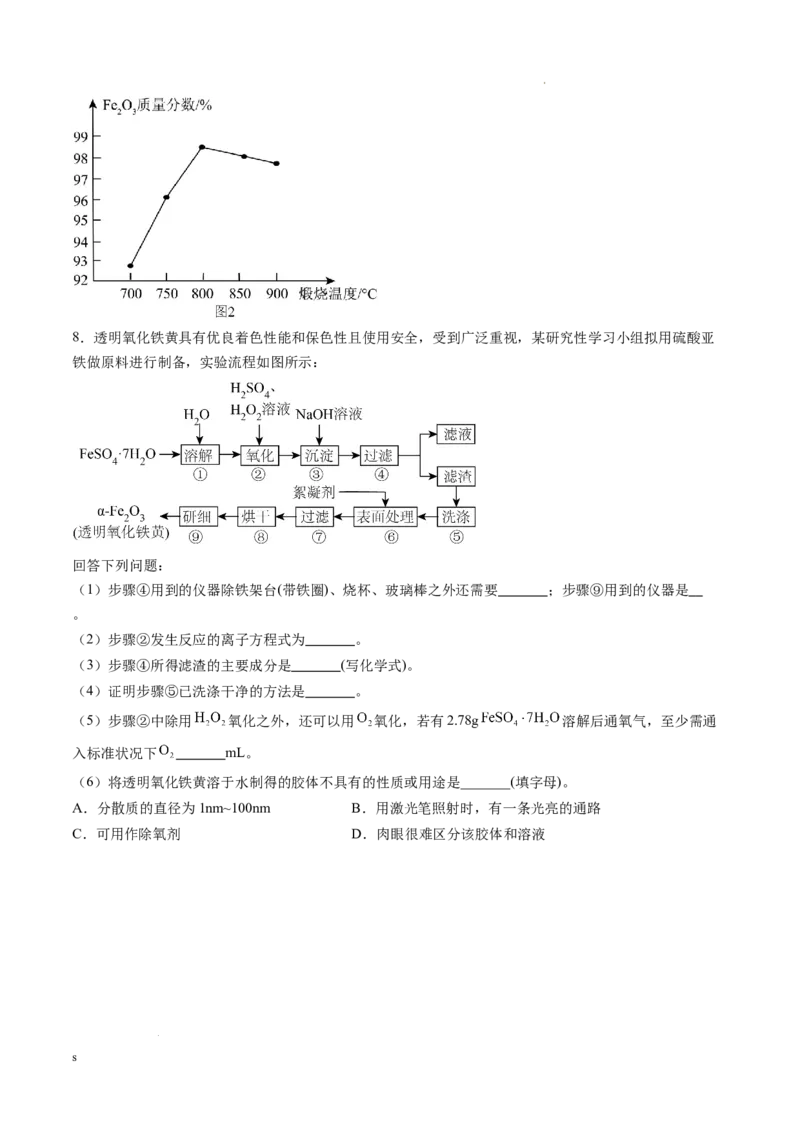
学科网(北京)股份有限公司8.透明氧化铁黄具有优良着色性能和保色性且使用安全,受到广泛重视,某研究性学习小组拟用硫酸亚
铁做原料进行制备,实验流程如图所示:
回答下列问题:
(1)步骤④用到的仪器除铁架台(带铁圈)、烧杯、玻璃棒之外还需要 ;步骤⑨用到的仪器是
。
(2)步骤②发生反应的离子方程式为 。
(3)步骤④所得滤渣的主要成分是 (写化学式)。
(4)证明步骤⑤已洗涤干净的方法是 。
(5)步骤②中除用 氧化之外,还可以用 氧化,若有2.78g 溶解后通氧气,至少需通
入标准状况下 mL。
(6)将透明氧化铁黄溶于水制得的胶体不具有的性质或用途是_______(填字母)。
A.分散质的直径为1nm~100nm B.用激光笔照射时,有一条光亮的通路
C.可用作除氧剂 D.肉眼很难区分该胶体和溶液
s
学科网(北京)股份有限公司