文档内容
2025-2026 学年高一年级化学上学期第一次月考卷
(考试时间:75 分钟 试卷满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第一章(人教版 2019)。
5.难度系数:0.7
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39
Ca-40 Ti-48 Cr-52 Fe-56 Ni-59 Cu-64 Ba-137
第Ⅰ卷(选择题 共 45 分)
一、选择题:本题共 15 个小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
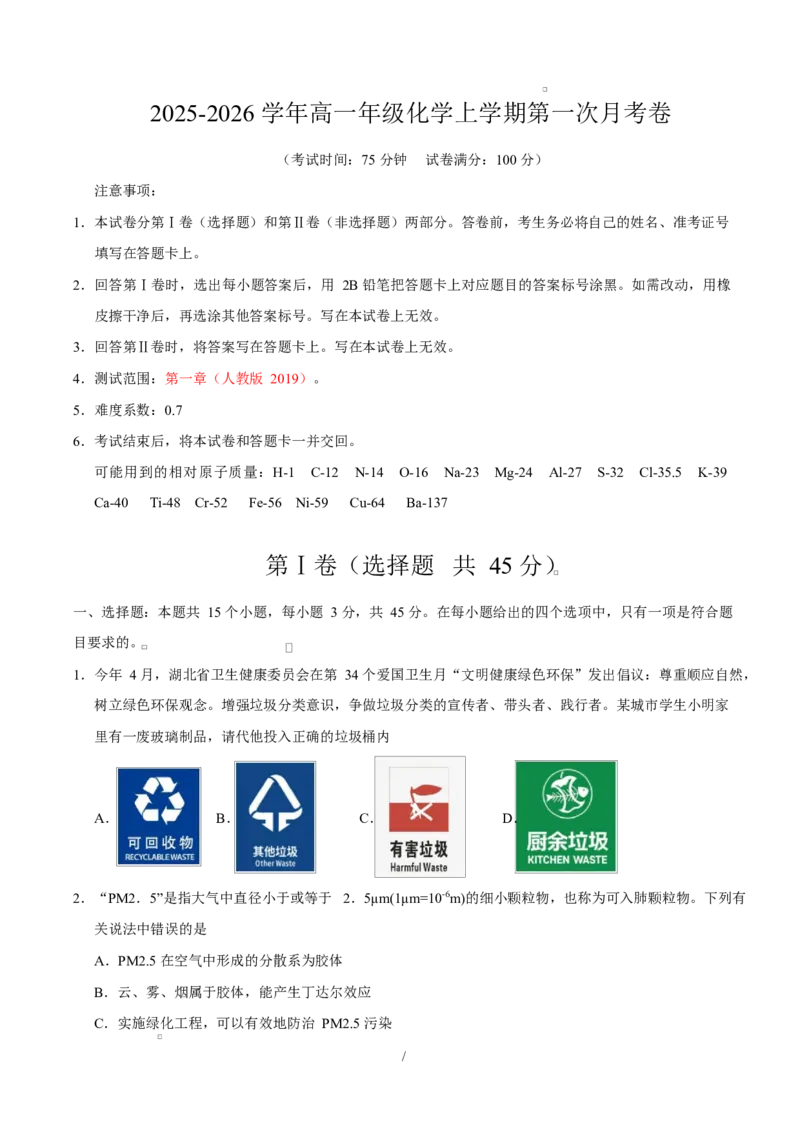
1.今年 4 月,湖北省卫生健康委员会在第 34 个爱国卫生月“文明健康绿色环保”发出倡议:尊重顺应自然,
树立绿色环保观念。增强垃圾分类意识,争做垃圾分类的宣传者、带头者、践行者。某城市学生小明家
里有一废玻璃制品,请代他投入正确的垃圾桶内
A. B. C. D.
2.“PM2.5”是指大气中直径小于或等于 2.5μm(1μm=10-6m)的细小颗粒物,也称为可入肺颗粒物。下列有
关说法中错误的是
A.PM2.5 在空气中形成的分散系为胶体
B.云、雾、烟属于胶体,能产生丁达尔效应
C.实施绿化工程,可以有效地防治 PM2.5 污染
/D.PM2.5 表面积大能吸附大量的有毒、有害物质
3.“纳米磁性固体材料”是当今材料科学研究的前沿,若将纳米磁性固态材料分散到水中,当光路通过时,可
以看到一条光亮的“通路”,下列有关该分散系的说法不正确的是
A.该分散系中的分散质直径小于 B.该分散系的稳定性小于溶液
C.该分散系可以透过滤纸 D.该分散系属于液溶胶
4.下列有关化学术语或表述正确的是
A.钡餐的化学式:
B.熟石膏的化学式:
C. 在水中的电离方程式:
D. 在熔融态的电离方程式:
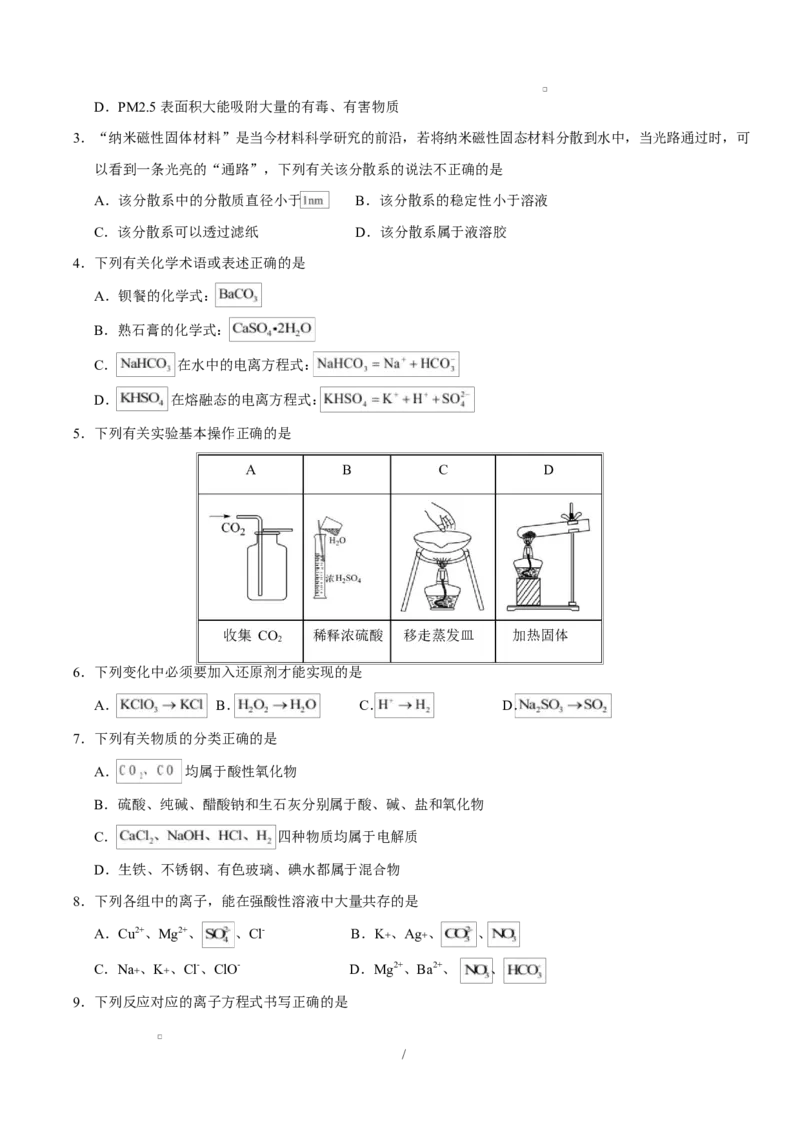
5.下列有关实验基本操作正确的是
A B C D
收集 CO 稀释浓硫酸 移走蒸发皿 加热固体
2
6.下列变化中必须要加入还原剂才能实现的是
A. B. C. D.
7.下列有关物质的分类正确的是
A. 均属于酸性氧化物
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C. 四种物质均属于电解质
D.生铁、不锈钢、有色玻璃、碘水都属于混合物
8.下列各组中的离子,能在强酸性溶液中大量共存的是
A.Cu2+、Mg2+、 、Cl- B.K+ 、Ag+ 、 、
C.Na+ 、K+ 、Cl-、ClO- D.Mg2+、Ba2+、 、
9.下列反应对应的离子方程式书写正确的是
/A.向稀盐酸中加入少量 :
B.铁粉与足量稀硫酸反应:
C.向 溶液中通入少量 :
D. 溶液中加入少量 :
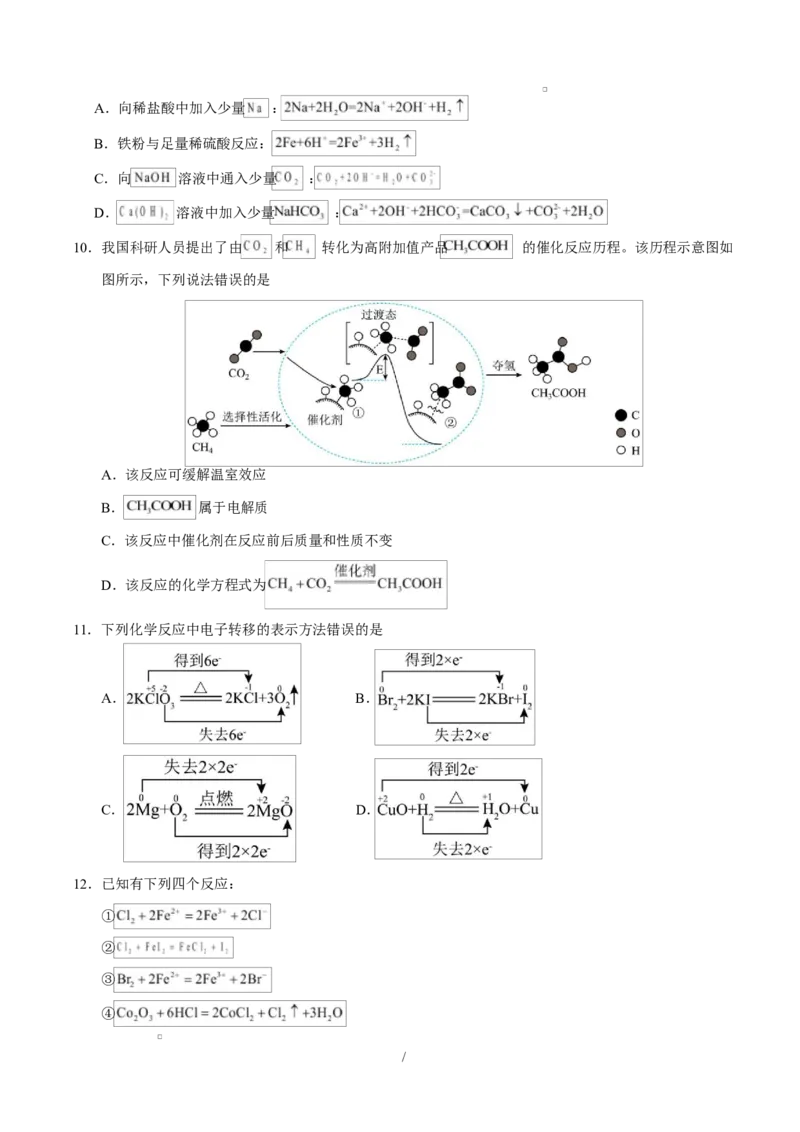
10.我国科研人员提出了由 和 转化为高附加值产品 的催化反应历程。该历程示意图如
图所示,下列说法错误的是
A.该反应可缓解温室效应
B. 属于电解质
C.该反应中催化剂在反应前后质量和性质不变
D.该反应的化学方程式为
11.下列化学反应中电子转移的表示方法错误的是
A. B.
C. D.
12.已知有下列四个反应:
①
②
③
④
/下列有关说法正确的是
A.反应②③④中的氧化产物分别是 、 、
B.根据①②③可以得到还原性:
C.不能发生反应
D.在反应④中参加反应的 和体现还原性的 个数比为
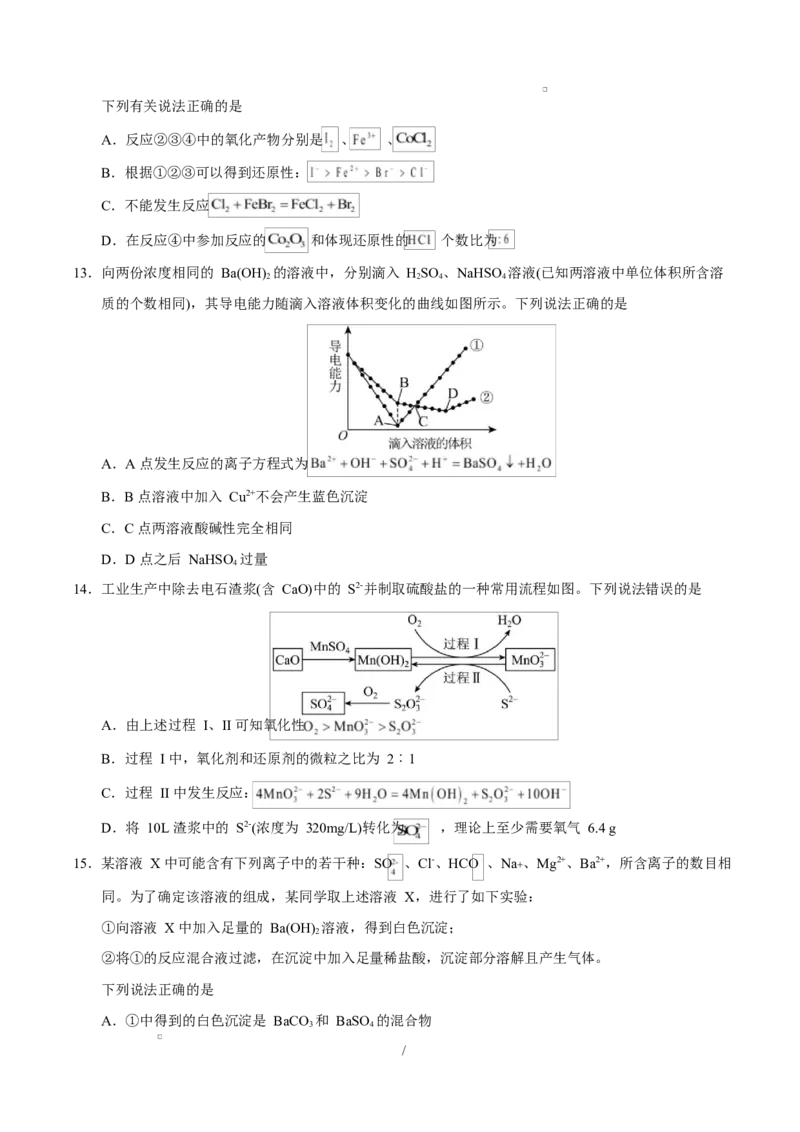
13.向两份浓度相同的 Ba(OH) 的溶液中,分别滴入 HSO 、NaHSO 溶液(已知两溶液中单位体积所含溶
2 2 4 4
质的个数相同),其导电能力随滴入溶液体积变化的曲线如图所示。下列说法正确的是
A.A 点发生反应的离子方程式为
B.B 点溶液中加入 Cu2+不会产生蓝色沉淀
C.C 点两溶液酸碱性完全相同
D.D 点之后 NaHSO 过量
4
14.工业生产中除去电石渣浆(含 CaO)中的 S2-并制取硫酸盐的一种常用流程如图。下列说法错误的是
A.由上述过程 I、II 可知氧化性
B.过程 I 中,氧化剂和还原剂的微粒之比为 2︰1
C.过程 II 中发生反应:
D.将 10L 渣浆中的 S2-(浓度为 320mg/L)转化为 ,理论上至少需要氧气 6.4 g
15.某溶液 X 中可能含有下列离子中的若干种:SO 、Cl-、HCO 、Na+ 、Mg2+、Ba2+,所含离子的数目相
同。为了确定该溶液的组成,某同学取上述溶液 X,进行了如下实验:
①向溶液 X 中加入足量的 Ba(OH) 溶液,得到白色沉淀;
2
②将①的反应混合液过滤,在沉淀中加入足量稀盐酸,沉淀部分溶解且产生气体。
下列说法正确的是
A.①中得到的白色沉淀是 BaCO 和 BaSO 的混合物
3 4
/B.溶液 X 中一定不存在 Ba2+、Cl-
C.溶液 X 中一定存在 SO 、HCO ,可能存在 Mg2+
D.无法确定溶液 X 中是否含有 Na+
第 II 卷(非选择题 共 55 分)
二、非选择题:本题共 4 个小题,共 55 分。
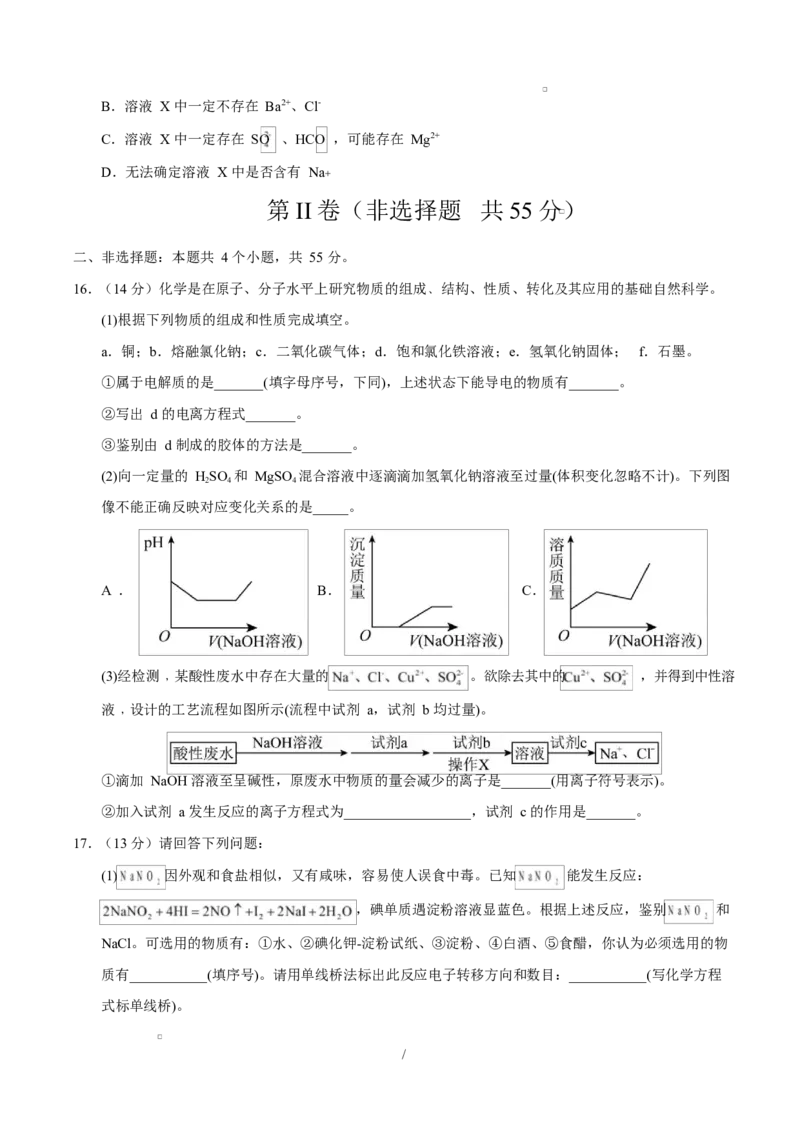
16.(14 分)化学是在原子、分子水平上研究物质的组成﹑结构、性质、转化及其应用的基础自然科学。
(1)根据下列物质的组成和性质完成填空。
a.铜;b.熔融氯化钠;c.二氧化碳气体;d.饱和氯化铁溶液;e.氢氧化钠固体; f.石墨。
①属于电解质的是_______(填字母序号,下同),上述状态下能导电的物质有_______。
②写出 d 的电离方程式_______。
③鉴别由 d 制成的胶体的方法是_______。
(2)向一定量的 HSO 和 MgSO 混合溶液中逐滴滴加氢氧化钠溶液至过量(体积变化忽略不计)。下列图
2 4 4
像不能正确反映对应变化关系的是_____。
A . B. C.
(3)经检测﹐某酸性废水中存在大量的 。欲除去其中的 ,并得到中性溶
液﹐设计的工艺流程如图所示(流程中试剂 a,试剂 b 均过量)。
①滴加 NaOH 溶液至呈碱性,原废水中物质的量会减少的离子是_______(用离子符号表示)。
②加入试剂 a 发生反应的离子方程式为__________________,试剂 c 的作用是_______。
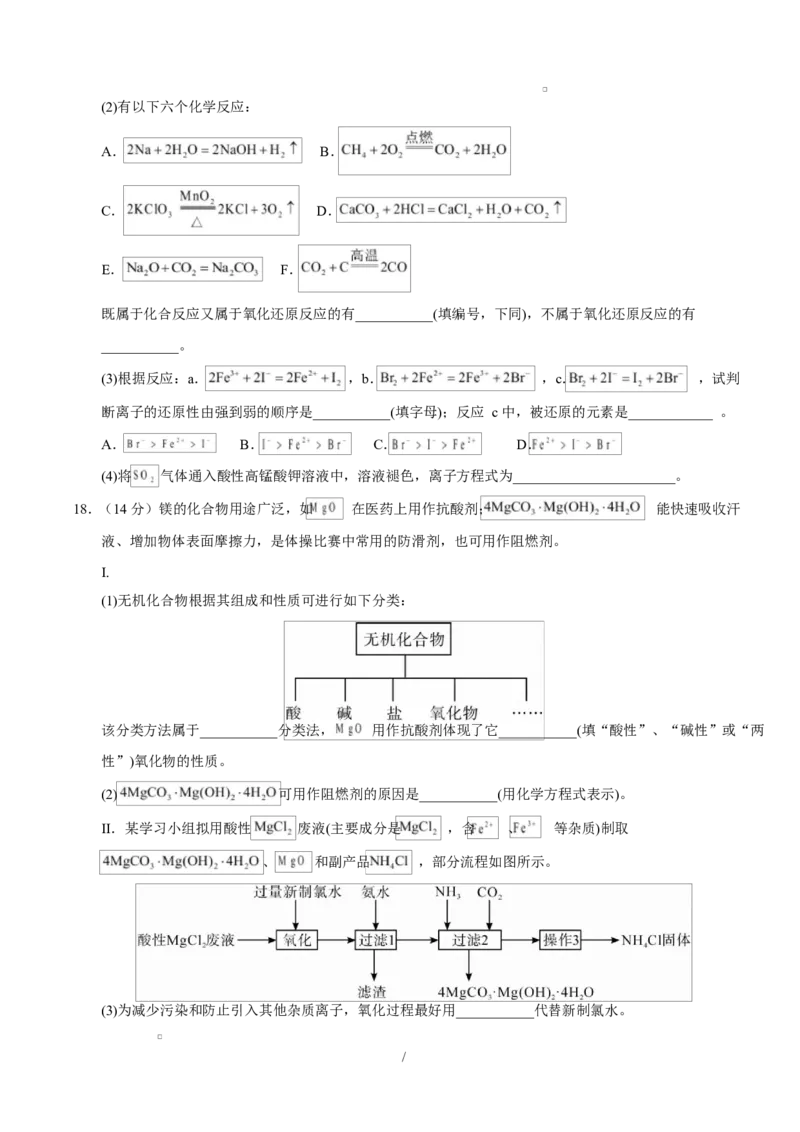
17.(13 分)请回答下列问题:
(1) 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生反应:
,碘单质遇淀粉溶液显蓝色。根据上述反应,鉴别 和
NaCl。可选用的物质有:①水、②碘化钾-淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物
质有___________(填序号)。请用单线桥法标出此反应电子转移方向和数目:___________(写化学方程
式标单线桥)。
/(2)有以下六个化学反应:
A. B.
C. D.
E. F.
既属于化合反应又属于氧化还原反应的有___________(填编号,下同),不属于氧化还原反应的有
___________。
(3)根据反应:a. ,b. ,c. ,试判
断离子的还原性由强到弱的顺序是___________(填字母);反应 c 中,被还原的元素是____________ 。
A. B. C. D.
(4)将 气体通入酸性高锰酸钾溶液中,溶液褪色,离子方程式为_______________________。
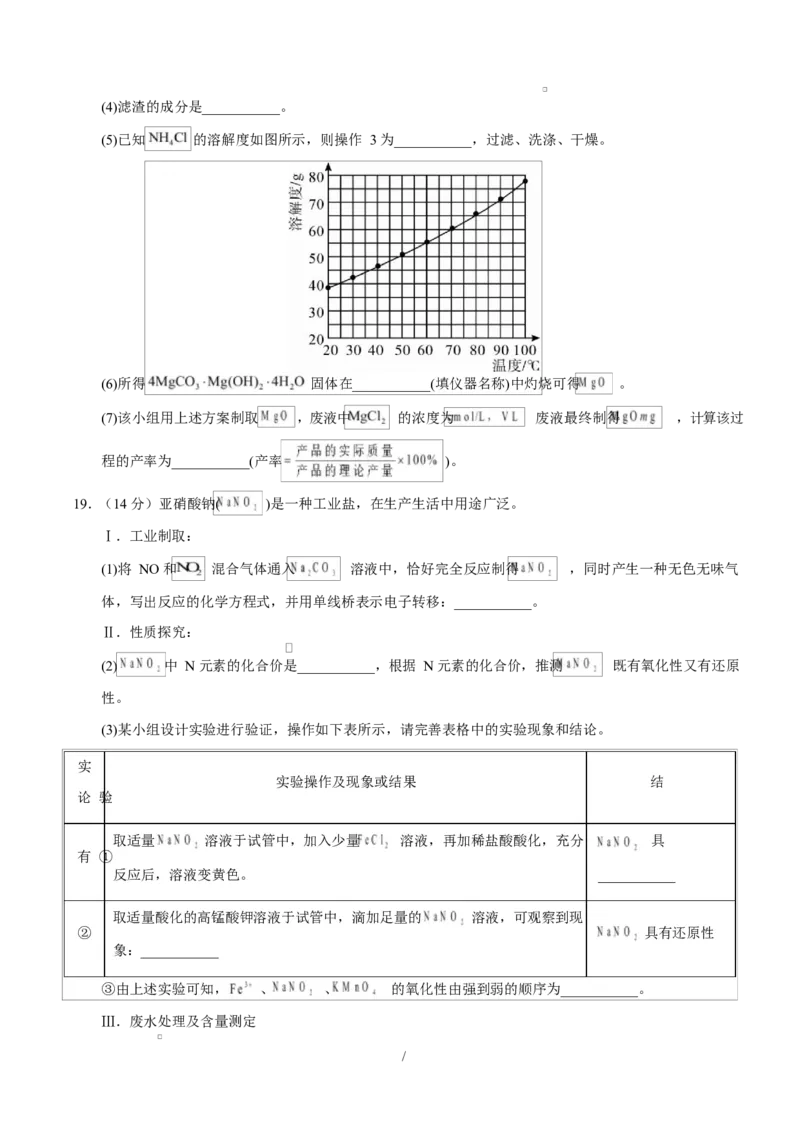
18.(14 分)镁的化合物用途广泛,如 在医药上用作抗酸剂; 能快速吸收汗
液、增加物体表面摩擦力,是体操比赛中常用的防滑剂,也可用作阻燃剂。
I.
(1)无机化合物根据其组成和性质可进行如下分类:
该分类方法属于___________分类法, 用作抗酸剂体现了它___________(填“酸性”、“碱性”或“两
性”)氧化物的性质。
(2) 可用作阻燃剂的原因是___________(用化学方程式表示)。
II.某学习小组拟用酸性 废液(主要成分是 ,含 、 等杂质)制取
、 和副产品 ,部分流程如图所示。
(3)为减少污染和防止引入其他杂质离子,氧化过程最好用___________代替新制氯水。
/(4)滤渣的成分是___________。
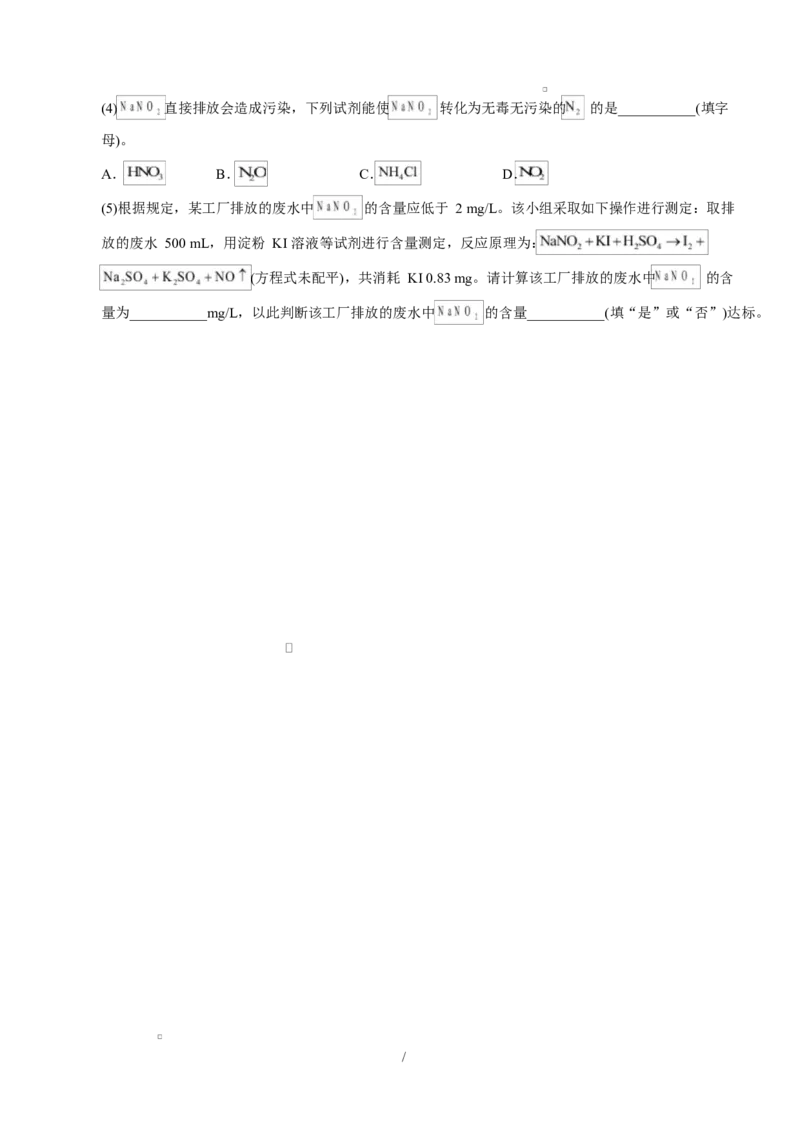
(5)已知 的溶解度如图所示,则操作 3 为___________,过滤、洗涤、干燥。
(6)所得 固体在___________(填仪器名称)中灼烧可得 。
(7)该小组用上述方案制取 ,废液中 的浓度为 废液最终制得 ,计算该过
程的产率为___________(产率 )。
19.(14 分)亚硝酸钠( )是一种工业盐,在生产生活中用途广泛。
Ⅰ.工业制取:
(1)将 NO 和 混合气体通入 溶液中,恰好完全反应制得 ,同时产生一种无色无味气
体,写出反应的化学方程式,并用单线桥表示电子转移:___________。
Ⅱ.性质探究:
(2) 中 N 元素的化合价是___________,根据 N 元素的化合价,推测 既有氧化性又有还原
性。
(3)某小组设计实验进行验证,操作如下表所示,请完善表格中的实验现象和结论。
实
实验操作及现象或结果 结
论 验
取适量 溶液于试管中,加入少量 溶液,再加稀盐酸酸化,充分 具
有 ①
反应后,溶液变黄色。 ___________
取适量酸化的高锰酸钾溶液于试管中,滴加足量的 溶液,可观察到现
② 具有还原性
象:___________
③由上述实验可知, 、 、 的氧化性由强到弱的顺序为___________。
Ⅲ.废水处理及含量测定
/(4) 直接排放会造成污染,下列试剂能使 转化为无毒无污染的 的是___________(填字
母)。
A. B. C. D.
(5)根据规定,某工厂排放的废水中 的含量应低于 2 mg/L。该小组采取如下操作进行测定:取排
放的废水 500 mL,用淀粉 KI 溶液等试剂进行含量测定,反应原理为:
(方程式未配平),共消耗 KI 0.83 mg。请计算该工厂排放的废水中 的含
量为___________mg/L,以此判断该工厂排放的废水中 的含量___________(填“是”或“否”)达标。
/