文档内容
专题 12 工艺流程综合题
考点 三年考情(2022-2024) 命题趋势
化学工艺流程题是将化工生产中的生产流
◆物质分离和提纯类工艺流程题:2024广 程用框图形式表示出来,并根据生产流程
中有关的化学知识步步设问。化工流程题
东卷、2024湖南卷、2024河北卷、2024新
以现代工业生产为基础,与化学反应原
课标卷、2024全国甲卷、2024黑吉辽卷、
理、产品提纯、环境保护等相融合,具有
2024安徽卷、2023新课标卷、2023湖北
考查知识面广、综合性强、思维容量大的
卷、2023辽宁卷、2023广东卷、2023浙江
特点。这类题型不但综合考查考生在中学
卷、2022湖南卷、2022湖北卷、2022重庆
阶段所学的元素及其化合物知识以及物质
卷、2022全国乙卷
考点1 工艺流 结构、元素周期律、氧化还原反应、化学
◆物质制备类工艺流程题:2024北京卷、
程综合题 用语、电解质溶液、化学平衡、电化学、
2024甘肃卷、2024浙江卷6月、2024江苏
实验操作等知识,而且更重要的是能突出
卷、2024山东卷、2024湖北卷、2024浙江
考查考生的综合分析判断能力、逻辑推理
卷1月、2023全国甲卷、2023全国乙卷、
能力,且这类试题陌生度高,文字量大,
2023湖南卷、2023山东卷、2023北京卷、
包含信息多,思维能力要求高。近年高考
2023浙江卷、2022全国甲卷、2022福建
有关考查要点和设问方式没有大的变化,
卷、2022辽宁卷、2022广东卷、2022北京 注意的是有关化学方程式的书写的考查,
卷、河北卷 有加强的趋势,一般有2~3个小问会涉及
方程式的书写。
考法01 物质分离提纯类工艺流程题
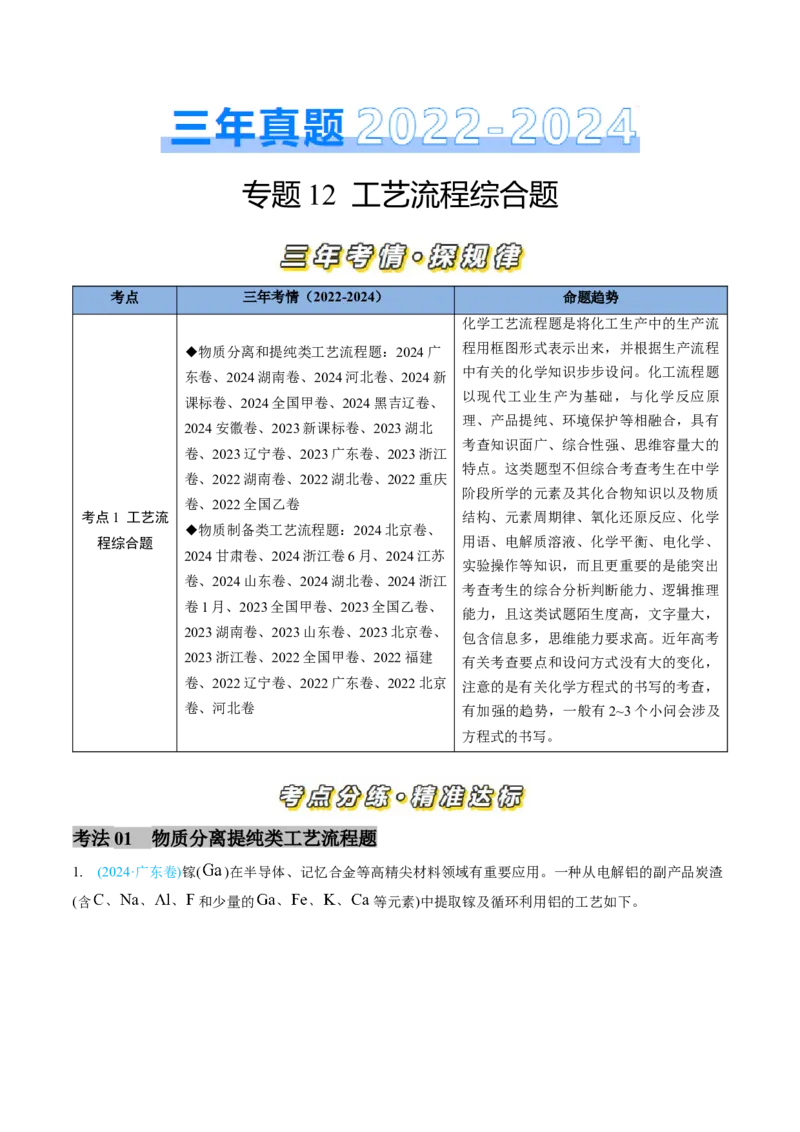
1. (2024·广东卷)镓( )在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣
(含 和少量的 等元素)中提取镓及循环利用铝的工艺如下。工艺中, 是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。用
提取金属离子 的原理如图。已知:
① 。
② (冰晶石)的 为 。
③浸取液中, 和 以 微粒形式存在, 最多可与2个 配位,其他
金属离子与 的配位可忽略。
(1)“电解”中,反应的化学方程式为_______。
(2)“浸取”中,由 形成 的离子方程式为_______。
(3)“还原”的目的:避免_______元素以_______(填化学式)微粒的形式通过 ,从而有利于
的分离。
(4)“ 提取”中,原料液的 浓度越_______,越有利于 的提取;研究表明,原料液酸度过
高,会降低 的提取率。因此,在不提高原料液酸度的前提下,可向I室中加入_______(填化学式),以
进一步提高 的提取率。
(5)“调 ”中, 至少应大于_______,使溶液中 ,有利于 配离子及
晶体的生成。若“结晶”后溶液中 ,则 浓度为_______ 。
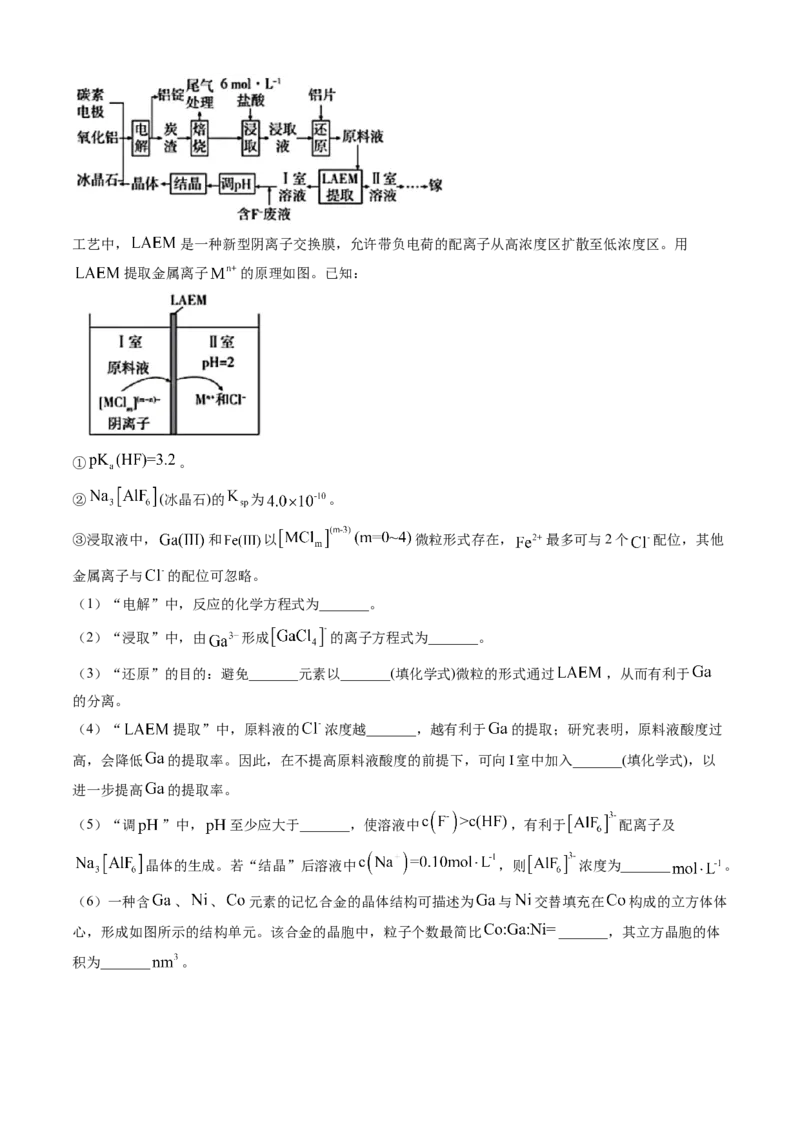
(6)一种含 、 、 元素的记忆合金的晶体结构可描述为 与 交替填充在 构成的立方体体
心,形成如图所示的结构单元。该合金的晶胞中,粒子个数最简比 _______,其立方晶胞的体
积为_______ 。2. (2024·湖南卷)铜阳极泥(含有Au、 、 、 等)是一种含贵金属的可再生资源,回收
贵金属的化工流程如下:
已知:①当某离子的浓度低于 时,可忽略该离子的存在;
② ;
③ 易从溶液中结晶析出;
④不同温度下 的溶解度如下:
温度
0 20 40 60 80
℃
溶解
14.4 26.1 37.4 33.2 29.0
度/g
回答下列问题:
(1)Cu属于_______区元素,其基态原子的价电子排布式为_______;
(2)“滤液1”中含有 和 ,“氧化酸浸”时 反应的离子方程式为_______;
(3)“氧化酸浸”和“除金”工序抣需加入一定量的 :
①在“氧化酸浸”工序中,加入适量 的原因是_______。
②在“除金”工序溶液中, 浓度不能超过_______ 。
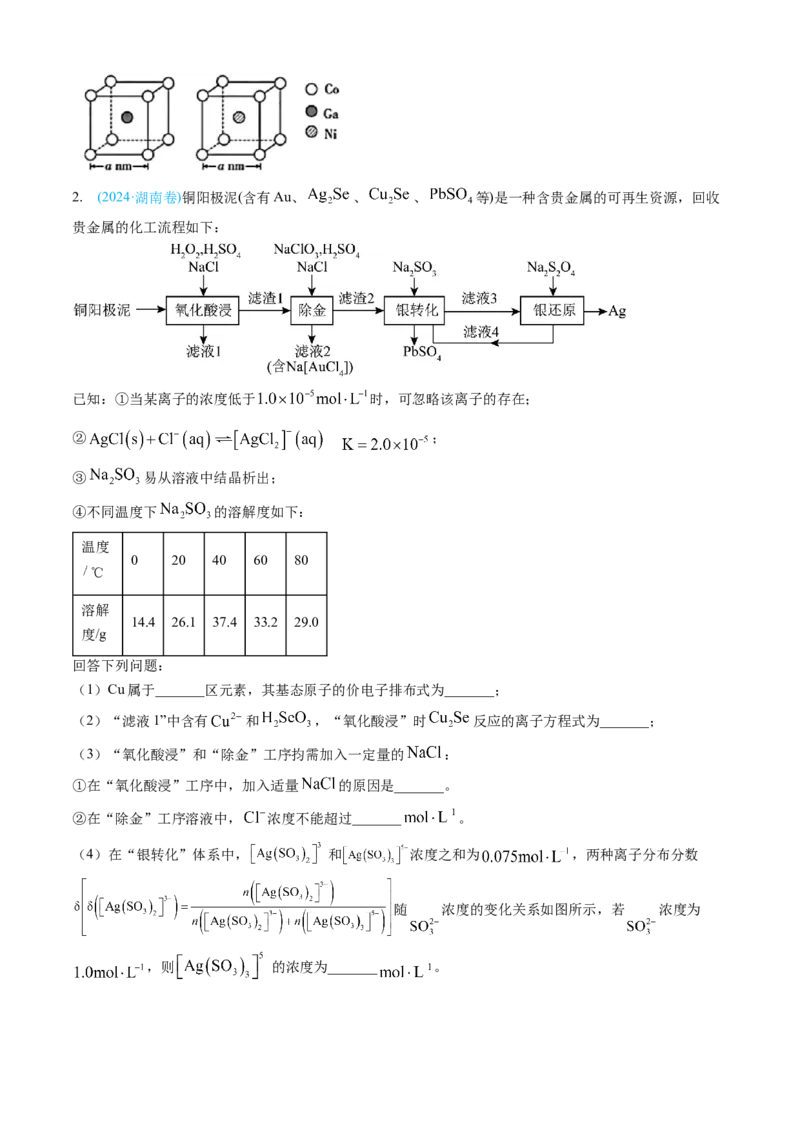
(4)在“银转化”体系中, 和 浓度之和为 ,两种离子分布分数
随 浓度的变化关系如图所示,若 浓度为
,则 的浓度为_______ 。(5)滤液4中溶质主要成分为_______(填化学式);在连续生产的模式下,“银转化”和“银还原”工序
需在 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是_______。
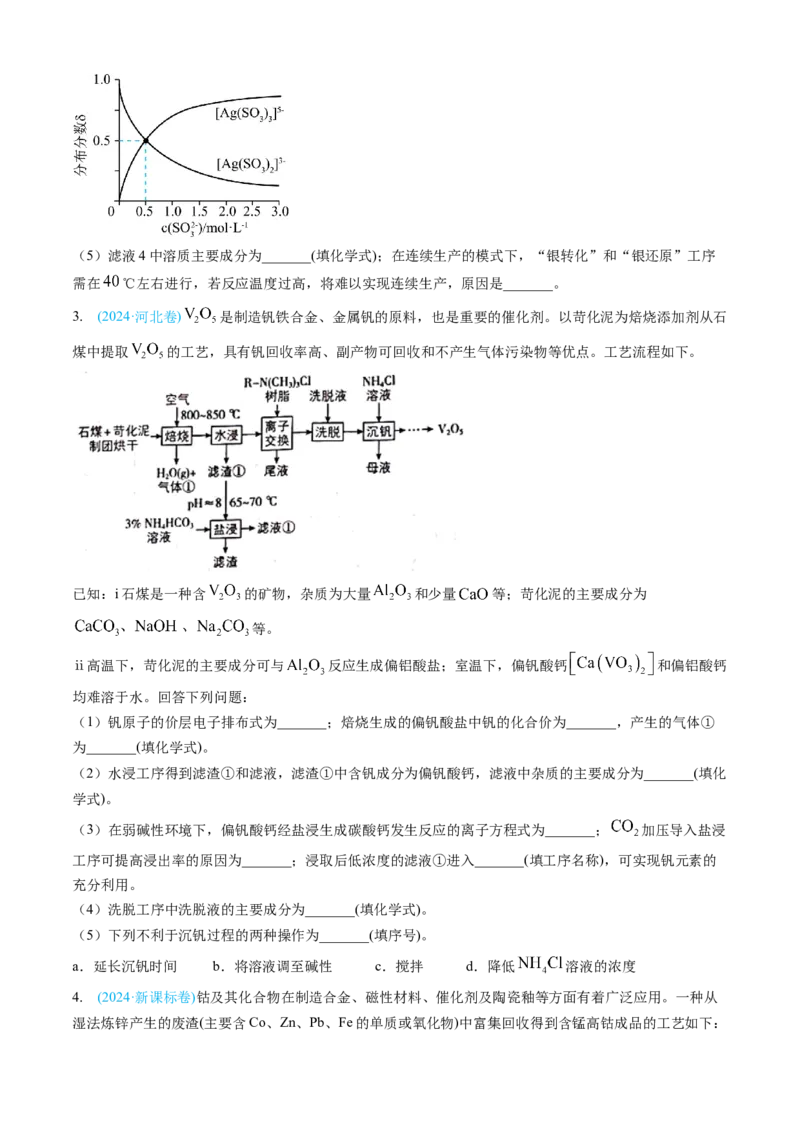
3. (2024·河北卷) 是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石
煤中提取 的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
已知:i石煤是一种含 的矿物,杂质为大量 和少量 等;苛化泥的主要成分为
等。
ⅱ高温下,苛化泥的主要成分可与 反应生成偏铝酸盐;室温下,偏钒酸钙 和偏铝酸钙
均难溶于水。回答下列问题:
(1)钒原子的价层电子排布式为_______;焙烧生成的偏钒酸盐中钒的化合价为_______,产生的气体①
为_______(填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_______(填化
学式)。
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_______; 加压导入盐浸
工序可提高浸出率的原因为_______;浸取后低浓度的滤液①进入_______(填工序名称),可实现钒元素的
充分利用。
(4)洗脱工序中洗脱液的主要成分为_______(填化学式)。
(5)下列不利于沉钒过程的两种操作为_______(填序号)。
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低 溶液的浓度
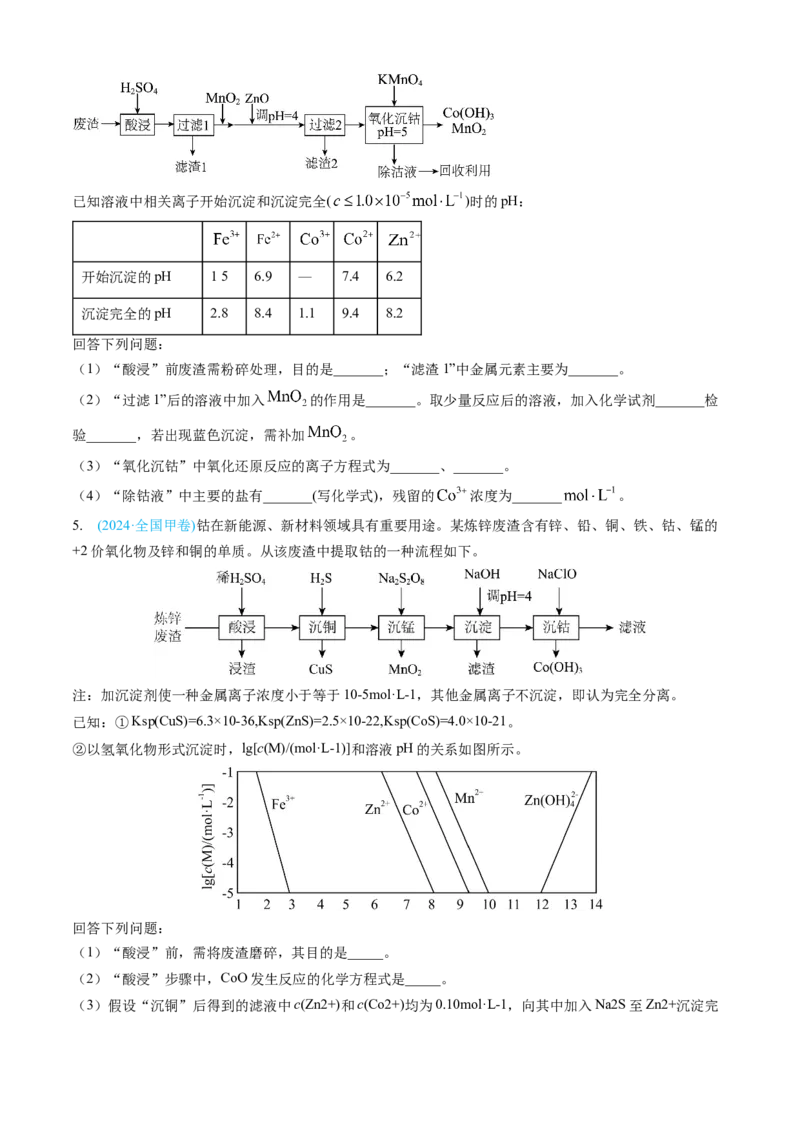
4. (2024·新课标卷)钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广泛应用。一种从
湿法炼锌产生的废渣(主要含Co、Zn、Pb、Fe的单质或氧化物)中富集回收得到含锰高钴成品的工艺如下:已知溶液中相关离子开始沉淀和沉淀完全( )时的pH:
.
开始沉淀的pH 15 6.9 — 7.4 6.2
沉淀完全的pH 2.8 8.4 1.1 9.4 8.2
回答下列问题:
(1)“酸浸”前废渣需粉碎处理,目的是_______;“滤渣1”中金属元素主要为_______。
(2)“过滤1”后的溶液中加入 的作用是_______。取少量反应后的溶液,加入化学试剂_______检
验_______,若出现蓝色沉淀,需补加 。
(3)“氧化沉钴”中氧化还原反应的离子方程式为_______、_______。
(4)“除钴液”中主要的盐有_______(写化学式),残留的 浓度为_______ 。
5. (2024·全国甲卷)钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的
+2价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
注:加沉淀剂使一种金属离子浓度小于等于10-5mol·L-1,其他金属离子不沉淀,即认为完全分离。
已知:①Ksp(CuS)=6.3×10-36,Ksp(ZnS)=2.5×10-22,Ksp(CoS)=4.0×10-21。
②以氢氧化物形式沉淀时,lg[c(M)/(mol·L-1)]和溶液pH的关系如图所示。
回答下列问题:
(1)“酸浸”前,需将废渣磨碎,其目的是_____。
(2)“酸浸”步骤中,CoO发生反应的化学方程式是_____。
(3)假设“沉铜”后得到的滤液中c(Zn2+)和c(Co2+)均为0.10mol·L-1,向其中加入Na2S至Zn2+沉淀完全,此时溶液中c(Co2+)=_____mol·L-1,据此判断能否实现Zn2+和Co2+的完全分离_____(填“能”或
“不能”)。
(4)“沉锰”步骤中,生成1.0molMnO ,产生H+的物质的量为_____。
2
(5)“沉淀”步骤中,用NaOH调pH=4,分离出的滤渣是_____。
(6)“沉钴”步骤中,控制溶液pH=5.0~5.5,加入适量的NaClO氧化Co2+,其反应的离子方程式为_____。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_____。
6. (2024·黑吉辽卷)中国是世界上最早利用细菌冶金的国家。已知金属硫化物在“细菌氧化”时转化为硫
酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的 颗粒被 、 包裹),以提高金的
浸出率并冶炼金,工艺流程如下:
回答下列问题:
(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为
_______(填化学式)。
(2)“细菌氧化”中, 发生反应的离子方程式为_______。
(3)“沉铁砷”时需加碱调节 ,生成_______(填化学式)胶体起絮凝作用,促进了含 微粒的沉降。
(4)“培烧氧化”也可提高“浸金”效率,相比“培烧氧化”,“细菌氧化”的优势为_______(填标号)。
A. 无需控温 B. 可减少有害气体产生
C. 设备无需耐高温 D. 不产生废液废渣
(5)“真金不拍火炼”,表明 难被 氧化,“浸金”中 的作用为_______。
(6)“沉金”中 的作用为_______。
(7)滤液②经 酸化, 转化为 和 的化学方程式为_______。用碱中和
可生成_______(填溶质化学式)溶液,从而实现循环利用。
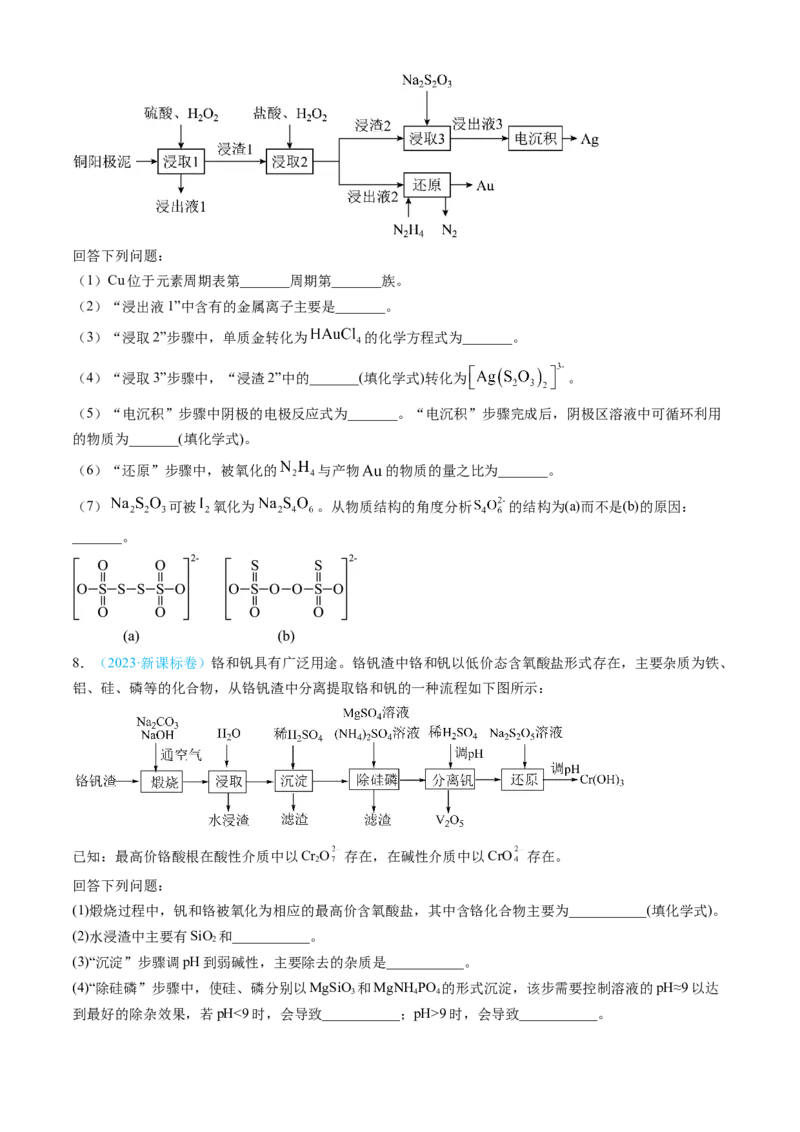
7. (2024·安徽卷)精炼铜产生的铜阳极泥富含 等多种元素。研究人员设计了一种从铜阳极
泥中分离提收金和银的流程,如下图所示。回答下列问题:
(1)Cu位于元素周期表第_______周期第_______族。
(2)“浸出液1”中含有的金属离子主要是_______。
(3)“浸取2”步骤中,单质金转化为 的化学方程式为_______。
(4)“浸取3”步骤中,“浸渣2”中的_______(填化学式)转化为 。
(5)“电沉积”步骤中阴极的电极反应式为_______。“电沉积”步骤完成后,阴极区溶液中可循环利用
的物质为_______(填化学式)。
(6)“还原”步骤中,被氧化的 与产物 的物质的量之比为_______。
(7) 可被 氧化为 。从物质结构的角度分析 的结构为(a)而不是(b)的原因:
_______。
8.(2023·新课标卷)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、
铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以Cr O 存在,在碱性介质中以CrO 存在。
2
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________(填化学式)。
(2)水浸渣中主要有SiO 和___________。
2
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO 和MgNH PO 的形式沉淀,该步需要控制溶液的pH≈9以达
3 4 4
到最好的除杂效果,若pH<9时,会导致___________;pH>9时,会导致___________。(5)“分离钒”步骤中,将溶液pH调到1.8左右得到VO 沉淀,VO 在pH<1时,溶解为VO 或VO3+在碱
2 5 2 5
性条件下,溶解为VO 或VO ,上述性质说明VO 具有___________(填标号)。
2 5
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na SO)溶液,反应的离子方程式为___________。
2 2 5
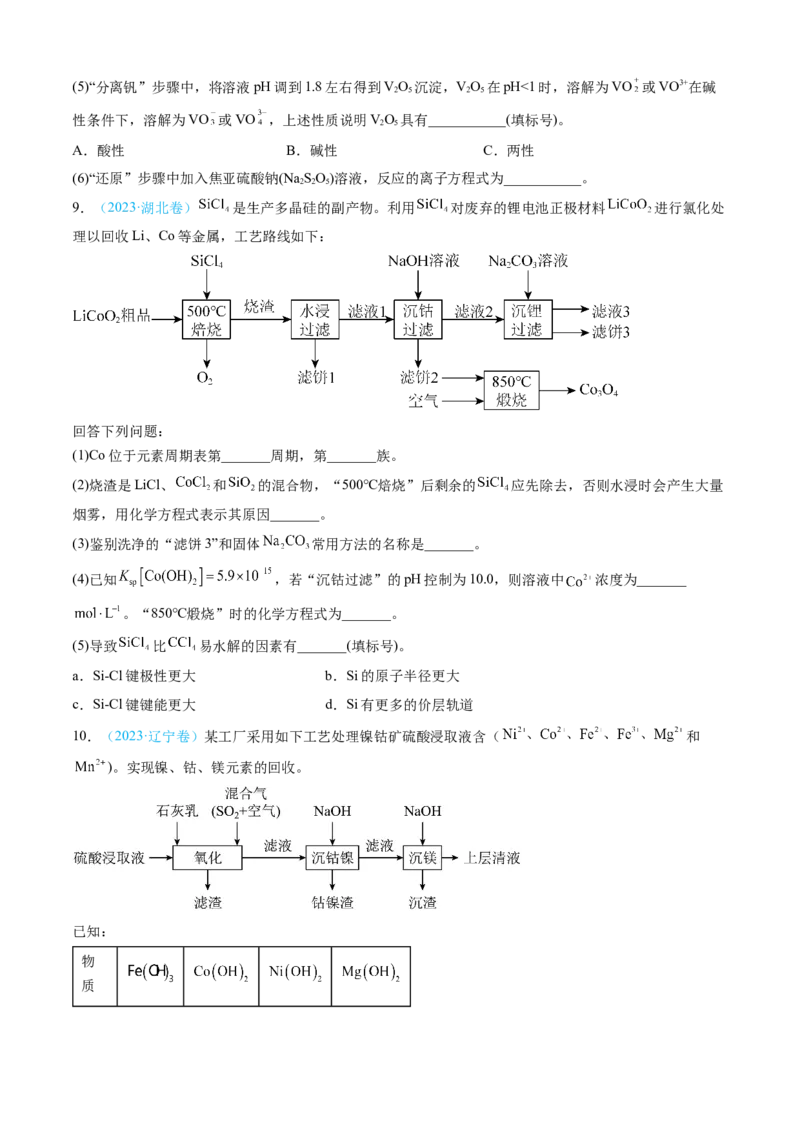
9.(2023·湖北卷) 是生产多晶硅的副产物。利用 对废弃的锂电池正极材料 进行氯化处
理以回收Li、Co等金属,工艺路线如下:
回答下列问题:
(1)Co位于元素周期表第_______周期,第_______族。
(2)烧渣是LiCl、 和 的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量
烟雾,用化学方程式表示其原因_______。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是_______。
(4)已知 ,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为_______
。“850℃煅烧”时的化学方程式为_______。
(5)导致 比 易水解的因素有_______(填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
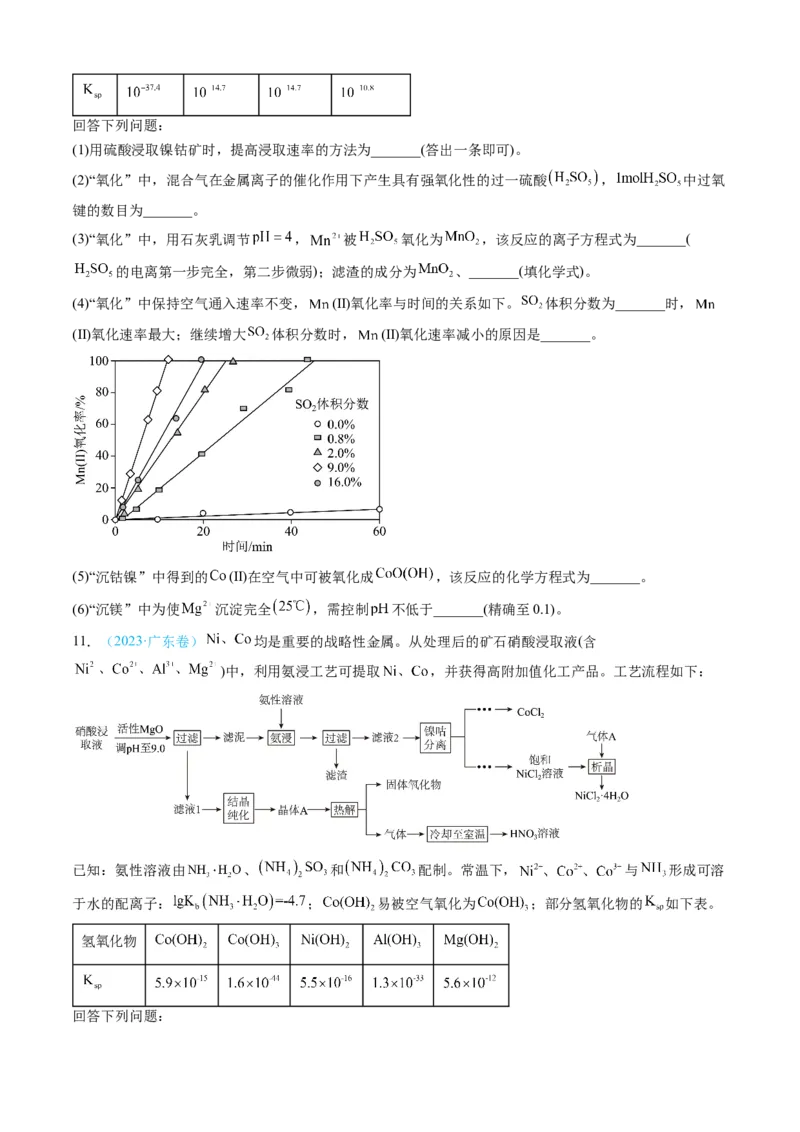
10.(2023·辽宁卷)某工厂采用如下工艺处理镍钴矿硫酸浸取液含( 和
)。实现镍、钴、镁元素的回收。
已知:
物
质回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧
键的数目为_______。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为_______(
的电离第一步完全,第二步微弱);滤渣的成分为 、_______(填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。 体积分数为_______时,
(Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是_______。
(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为_______。
(6)“沉镁”中为使 沉淀完全 ,需控制 不低于_______(精确至0.1)。
11.(2023·广东卷) 均是重要的战略性金属。从处理后的矿石硝酸浸取液(含
)中,利用氨浸工艺可提取 ,并获得高附加值化工产品。工艺流程如下:
已知:氨性溶液由 、 和 配制。常温下, 与 形成可溶
于水的配离子: ; 易被空气氧化为 ;部分氢氧化物的 如下表。
氢氧化物
回答下列问题:(1)活性 可与水反应,化学方程式为 。
(2)常温下, 的氨性溶液中, (填“>”“<”或“=”)。
(3)“氨浸”时,由 转化为 的离子方程式为 。
(4) 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出
现了 的明锐衍射峰。
① 属于 (填“晶体”或“非晶体”)。
② 提高了 的浸取速率,其原因是 。
(5)①“析晶”过程中通入的酸性气体A为 。
②由 可制备 晶体,其立方晶胞如图。 与O最小间距大于 与O最小间距,x、y为整数,
则 在晶胞中的位置为 ;晶体中一个 周围与其最近的O的个数为 。
(6)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得 溶液中 与
的比值,理论上最高为 。
②“热解”对于从矿石提取 工艺的意义,在于可重复利用 和 (填化学式)。
12.(2023·浙江卷)工业上煅烧含硫矿物产生的 可以按如下流程脱除或利用。
已知:
请回答:
(1)富氧煅烧燃煤产生的低浓度的 可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
。
(2)煅烧含硫量高的矿物得到高浓度的 ,通过途径Ⅱ最终转化为化合物A。
①下列说法正确的是 。
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的 也可用浓 吸收
②一定压强下,化合物A的沸点低于硫酸的原因是 。
(3)设计实验验证化合物A中含有S元素 ;写出实验过程中涉及的反应方程式 。
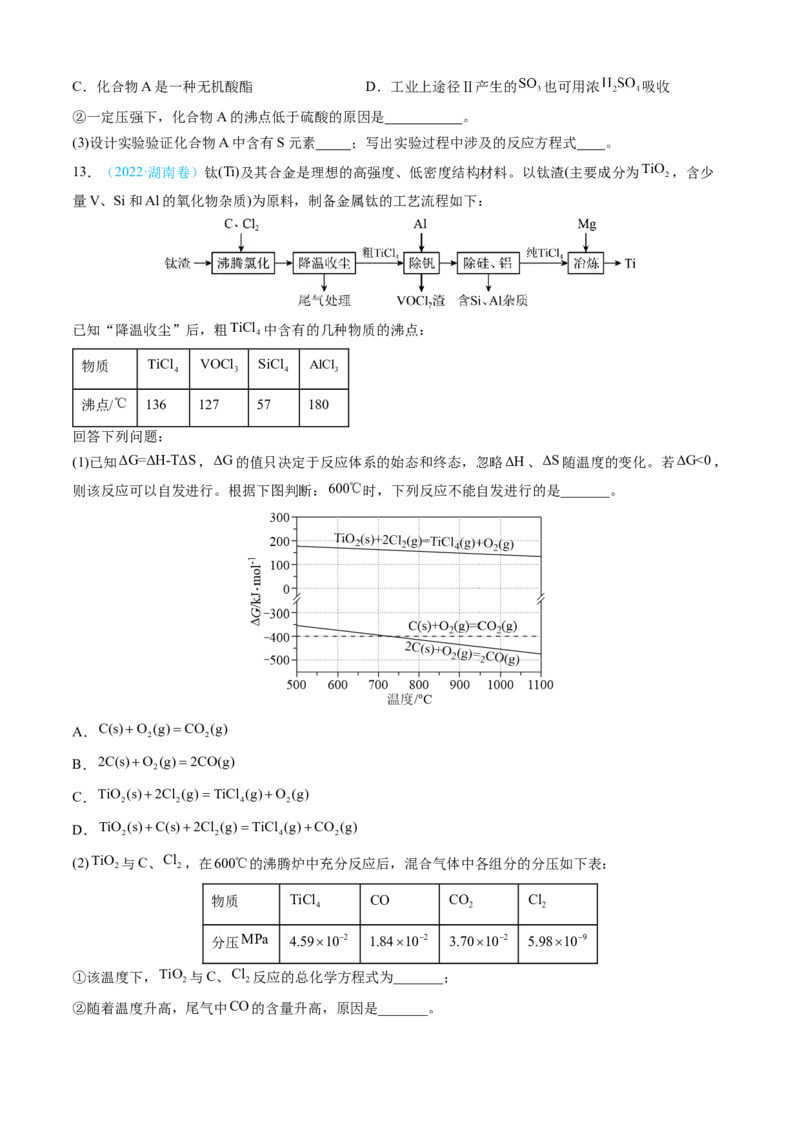
13.(2022·湖南卷)钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO ,含少
2
量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗TiCl 中含有的几种物质的沸点:
4
物质 TiCl VOCl SiCl AlCl
4 3 4 3
沸点/℃ 136 127 57 180
回答下列问题:
(1)已知ΔG=ΔH-TΔS,ΔG的值只决定于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化。若ΔG<0,
则该反应可以自发进行。根据下图判断:600℃时,下列反应不能自发进行的是_______。
A.C(s)O (g)CO (g)
2 2
B.2C(s)O (g)2CO(g)
2
C.TiO (s)2Cl (g)TiCl (g)O (g)
2 2 4 2
D.TiO (s)C(s)2Cl (g)TiCl (g)CO (g)
2 2 4 2
(2)TiO 与C、Cl ,在600℃的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
2 2
物质 TiCl CO CO Cl
4 2 2
分压MPa 4.59102 1.84102 3.70102 5.98109
①该温度下,TiO 与C、Cl 反应的总化学方程式为_______;
2 2
②随着温度升高,尾气中CO的含量升高,原因是_______。(3)“除钒”过程中的化学方程式为_______;“除硅、铝”过程中,分离TiCl
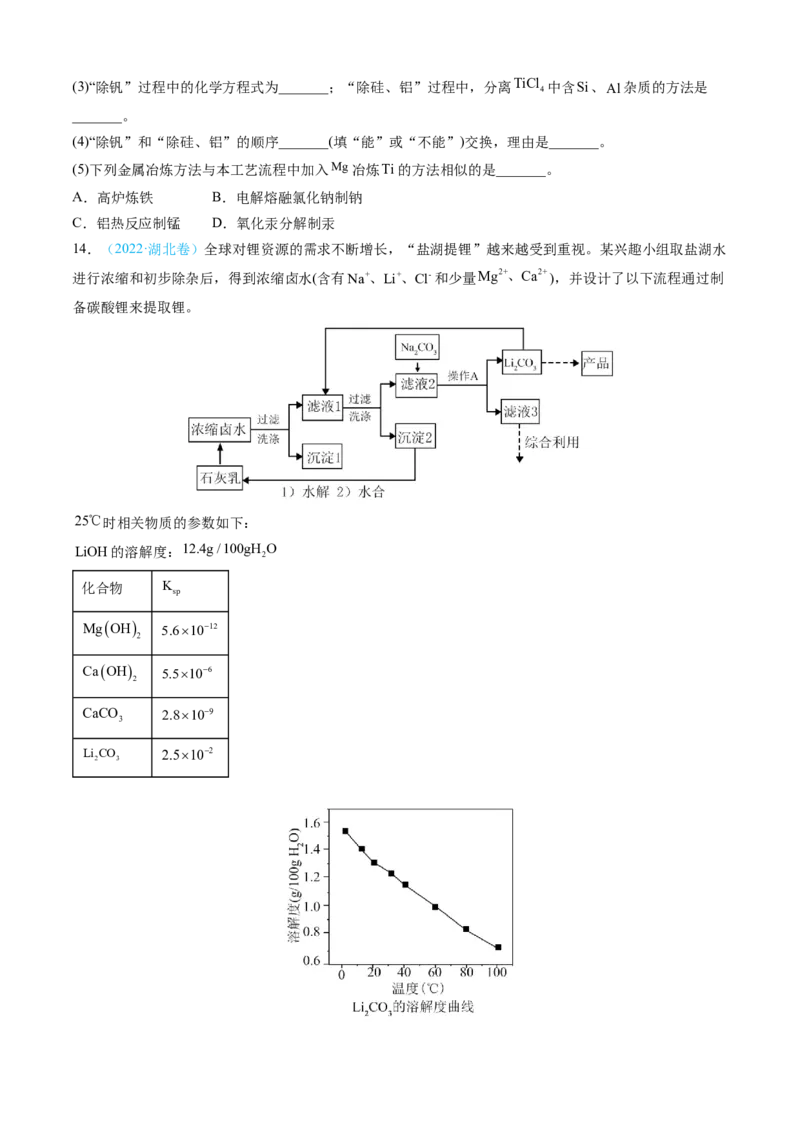
4
中含Si、Al杂质的方法是
_______。
(4)“除钒”和“除硅、铝”的顺序_______(填“能”或“不能”)交换,理由是_______。
(5)下列金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是_______。
A.高炉炼铁 B.电解熔融氯化钠制钠
C.铝热反应制锰 D.氧化汞分解制汞
14.(2022·湖北卷)全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水
进行浓缩和初步除杂后,得到浓缩卤水(含有Na+、Li+、Cl-和少量Mg2+、Ca2+),并设计了以下流程通过制
备碳酸锂来提取锂。
25℃时相关物质的参数如下:
LiOH的溶解度:12.4g/100gH O
2
化合物 K
sp
MgOH 5.61012
2
CaOH 5.5106
2
CaCO 2.8109
3
Li CO 2.5102
2 3回答下列问题:
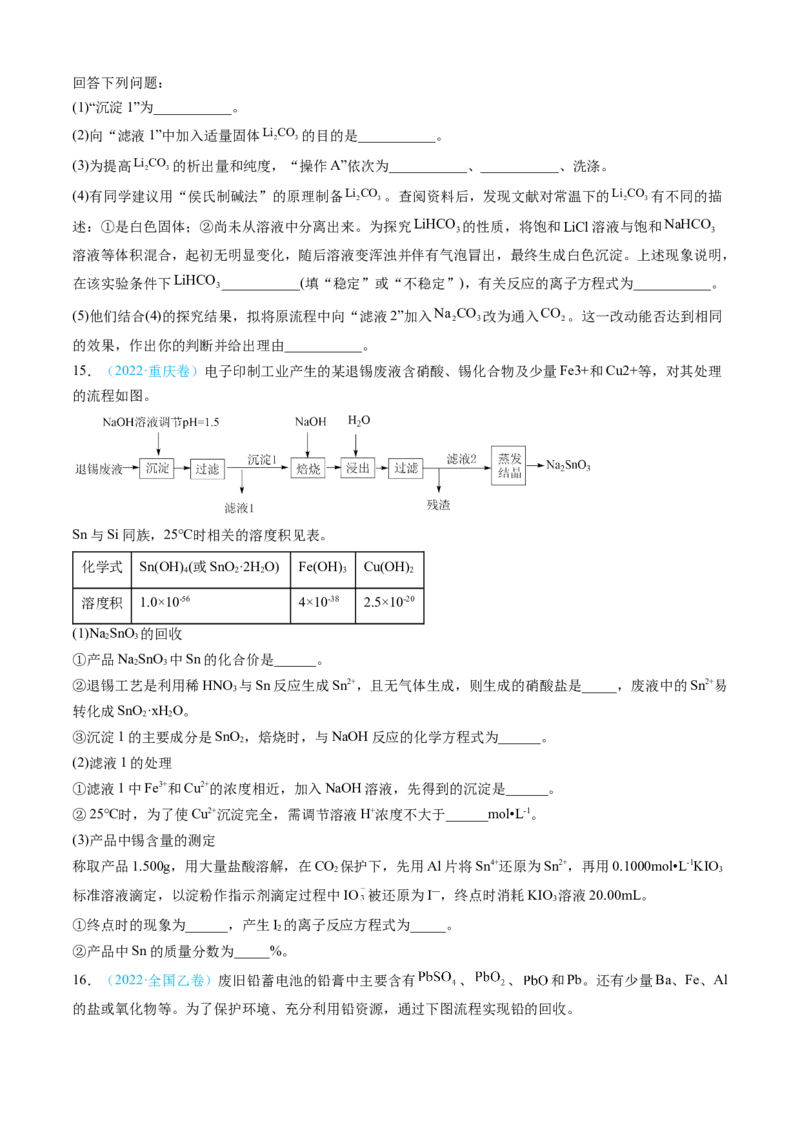
(1)“沉淀1”为___________。
(2)向“滤液1”中加入适量固体Li CO 的目的是___________。
2 3
(3)为提高Li CO 的析出量和纯度,“操作A”依次为___________、___________、洗涤。
2 3
(4)有同学建议用“侯氏制碱法”的原理制备Li CO 。查阅资料后,发现文献对常温下的Li CO 有不同的描
2 3 2 3
述:①是白色固体;②尚未从溶液中分离出来。为探究LiHCO 的性质,将饱和LiCl溶液与饱和NaHCO
3 3
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,
在该实验条件下LiHCO ___________(填“稳定”或“不稳定”),有关反应的离子方程式为___________。
3
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入Na CO 改为通入CO 。这一改动能否达到相同
2 3 2
的效果,作出你的判断并给出理由___________。
15.(2022·重庆卷)电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理
的流程如图。
Sn与Si同族,25℃时相关的溶度积见表。
化学式 Sn(OH)(或SnO ·2H O) Fe(OH) Cu(OH)
4 2 2 3 2
溶度积 1.0×10-56 4×10-38 2.5×10-20
(1)Na SnO 的回收
2 3
①产品NaSnO 中Sn的化合价是______。
2 3
②退锡工艺是利用稀HNO 与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是_____,废液中的Sn2+易
3
转化成SnO ·xH O。
2 2
③沉淀1的主要成分是SnO ,焙烧时,与NaOH反应的化学方程式为______。
2
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是______。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于______mol•L-1。
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO 保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO
2 3
标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO 溶液20.00mL。
3
①终点时的现象为______,产生I 的离子反应方程式为_____。
2
②产品中Sn的质量分数为_____%。
16.(2022·全国乙卷)废旧铅蓄电池的铅膏中主要含有 、 、 和Pb。还有少量Ba、Fe、Al
的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。一些难溶电解质的溶度积常数如下表:
难溶电解
质
一定条件下,一些金属氢氧化物沉淀时的 如下表:
金属氢氧化物
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为 ,用沉淀溶解平衡原理解释选择 的原因
。
(2)在“脱硫”中,加入 不能使铅膏中 完全转化,原因是 。
(3)在“酸浸”中,除加入醋酸( ),还要加入 。
(ⅰ)能被 氧化的离子是 ;
(ⅱ) 促进了金属Pb在醋酸中转化为 ,其化学方程式为 ;
(ⅲ) 也能使 转化为 , 的作用是 。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是 。
(5)“沉铅”的滤液中,金属离子有 。
考法02 物质制备类工艺流程
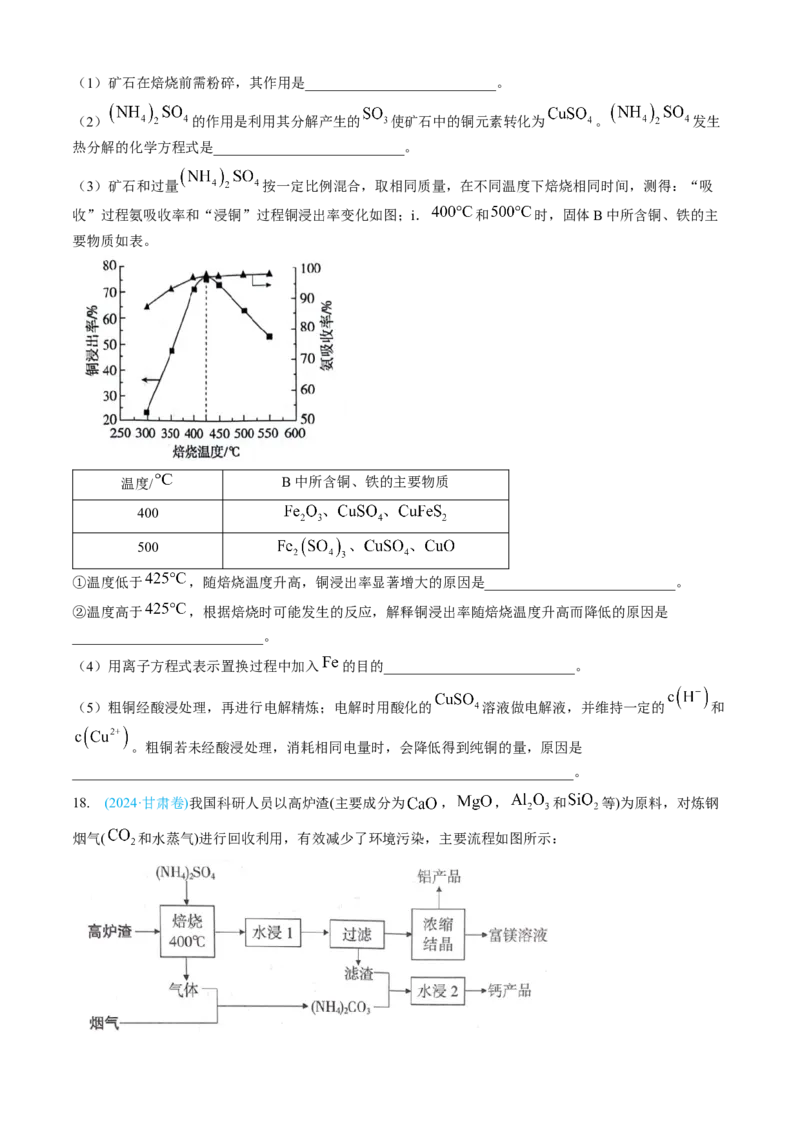
17.(2024·北京卷)利用黄铜矿(主要成分为 ,含有 等杂质)生产纯铜,流程示意图如下。(1)矿石在焙烧前需粉碎,其作用是___________________________。
(2) 的作用是利用其分解产生的 使矿石中的铜元素转化为 。 发生
热分解的化学方程式是___________________________。
(3)矿石和过量 按一定比例混合,取相同质量,在不同温度下焙烧相同时间,测得:“吸
收”过程氨吸收率和“浸铜”过程铜浸出率变化如图;i. 和 时,固体B中所含铜、铁的主
要物质如表。
温度/ B中所含铜、铁的主要物质
400
500
①温度低于 ,随焙烧温度升高,铜浸出率显著增大的原因是___________________________。
②温度高于 ,根据焙烧时可能发生的反应,解释铜浸出率随焙烧温度升高而降低的原因是
___________________________。
(4)用离子方程式表示置换过程中加入 的目的___________________________。
(5)粗铜经酸浸处理,再进行电解精炼;电解时用酸化的 溶液做电解液,并维持一定的 和
。粗铜若未经酸浸处理,消耗相同电量时,会降低得到纯铜的量,原因是
_______________________________________________________________________。
18. (2024·甘肃卷)我国科研人员以高炉渣(主要成分为 , , 和 等)为原料,对炼钢
烟气( 和水蒸气)进行回收利用,有效减少了环境污染,主要流程如图所示:已知:
(1)高炉渣与 经焙烧产生的“气体”是_______。
(2)“滤渣”的主要成分是 和_______。
(3)“水浸2”时主要反应的化学方程式为_______,该反应能进行的原因是_______。
(4)铝产品 可用于_______。
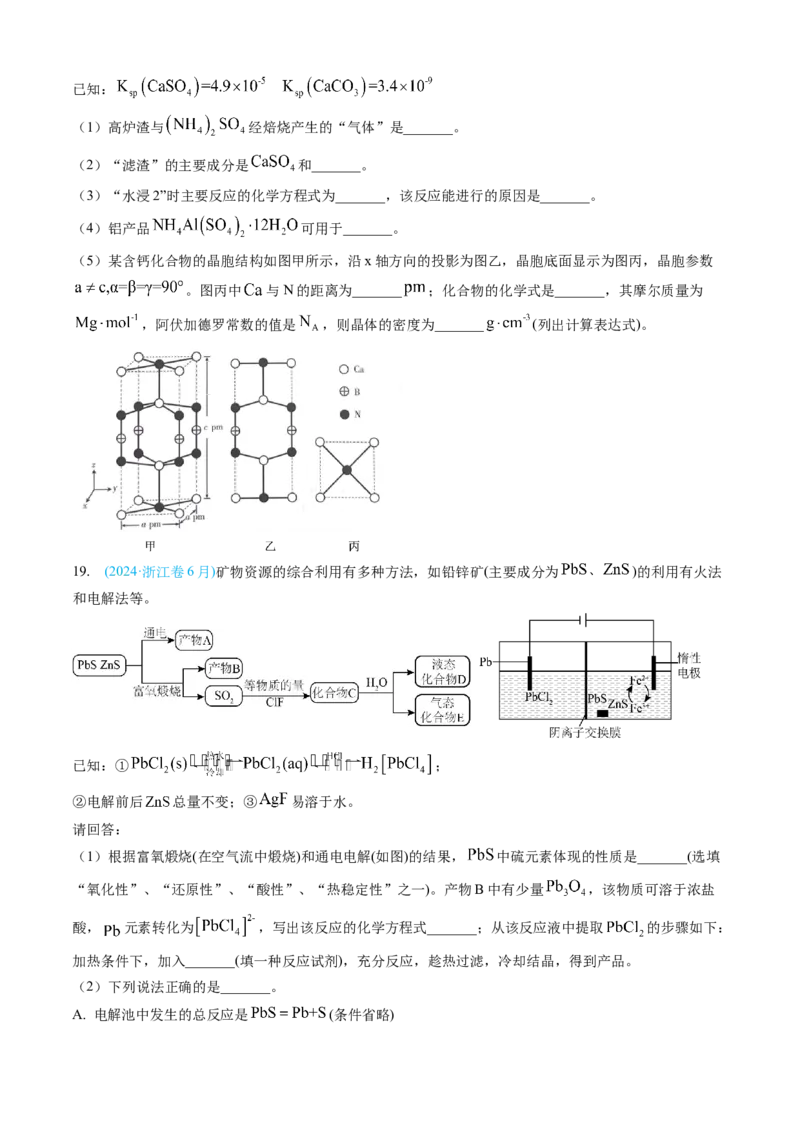
(5)某含钙化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数
。图丙中 与N的距离为_______ ;化合物的化学式是_______,其摩尔质量为
,阿伏加德罗常数的值是 ,则晶体的密度为_______ (列出计算表达式)。
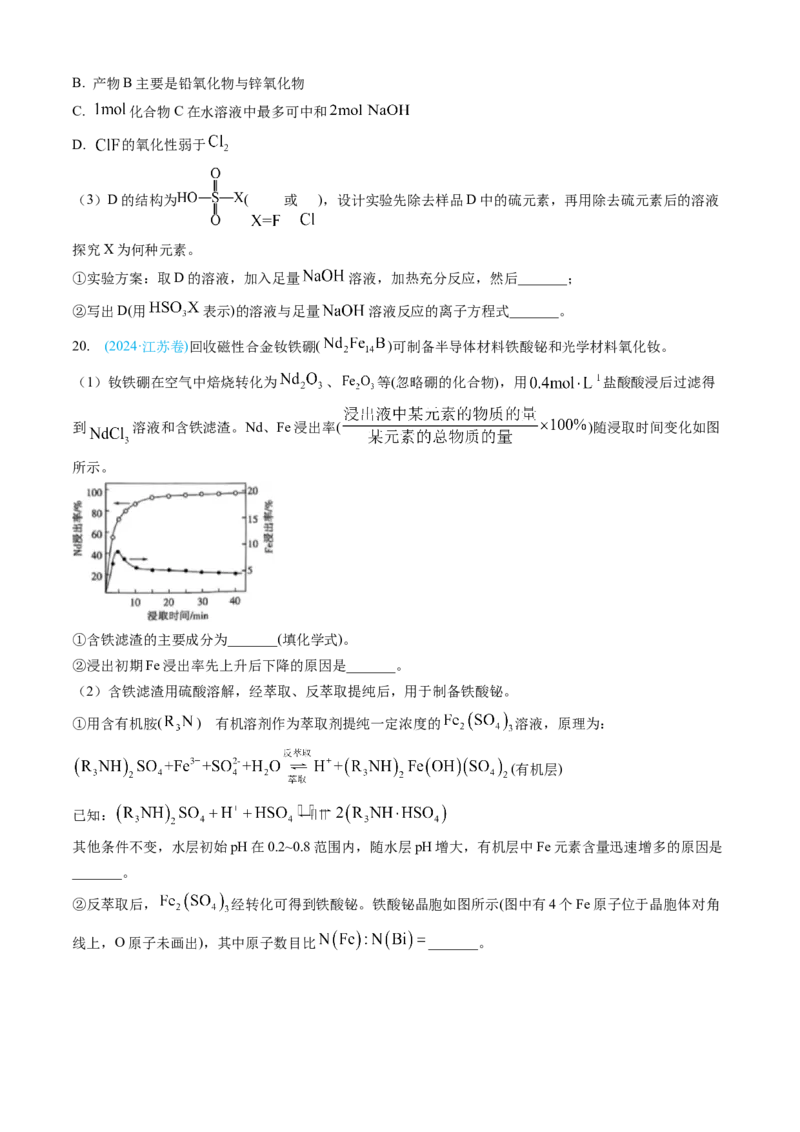
19. (2024·浙江卷6月)矿物资源的综合利用有多种方法,如铅锌矿(主要成分为 )的利用有火法
和电解法等。
已知:① ;
②电解前后 总量不变;③ 易溶于水。
请回答:
(1)根据富氧煅烧(在空气流中煅烧)和通电电解(如图)的结果, 中硫元素体现的性质是_______(选填
“氧化性”、“还原性”、“酸性”、“热稳定性”之一)。产物B中有少量 ,该物质可溶于浓盐
酸, 元素转化为 ,写出该反应的化学方程式_______;从该反应液中提取 的步骤如下:
加热条件下,加入_______(填一种反应试剂),充分反应,趁热过滤,冷却结晶,得到产品。
(2)下列说法正确的是_______。
A. 电解池中发生的总反应是 (条件省略)B. 产物B主要是铅氧化物与锌氧化物
C. 化合物C在水溶液中最多可中和
D. 的氧化性弱于
(3)D的结构为 ( 或 ),设计实验先除去样品D中的硫元素,再用除去硫元素后的溶液
探究X为何种元素。
①实验方案:取D的溶液,加入足量 溶液,加热充分反应,然后_______;
②写出D(用 表示)的溶液与足量 溶液反应的离子方程式_______。
20. (2024·江苏卷)回收磁性合金钕铁硼( )可制备半导体材料铁酸铋和光学材料氧化钕。
(1)钕铁硼在空气中焙烧转化为 、 等(忽略硼的化合物),用 盐酸酸浸后过滤得
到 溶液和含铁滤渣。Nd、Fe浸出率( )随浸取时间变化如图
所示。
①含铁滤渣的主要成分为_______(填化学式)。
②浸出初期Fe浸出率先上升后下降的原因是_______。
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺( ) 的有机溶剂作为萃取剂提纯一定浓度的 溶液,原理为:
(有机层)
已知:
其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是
_______。
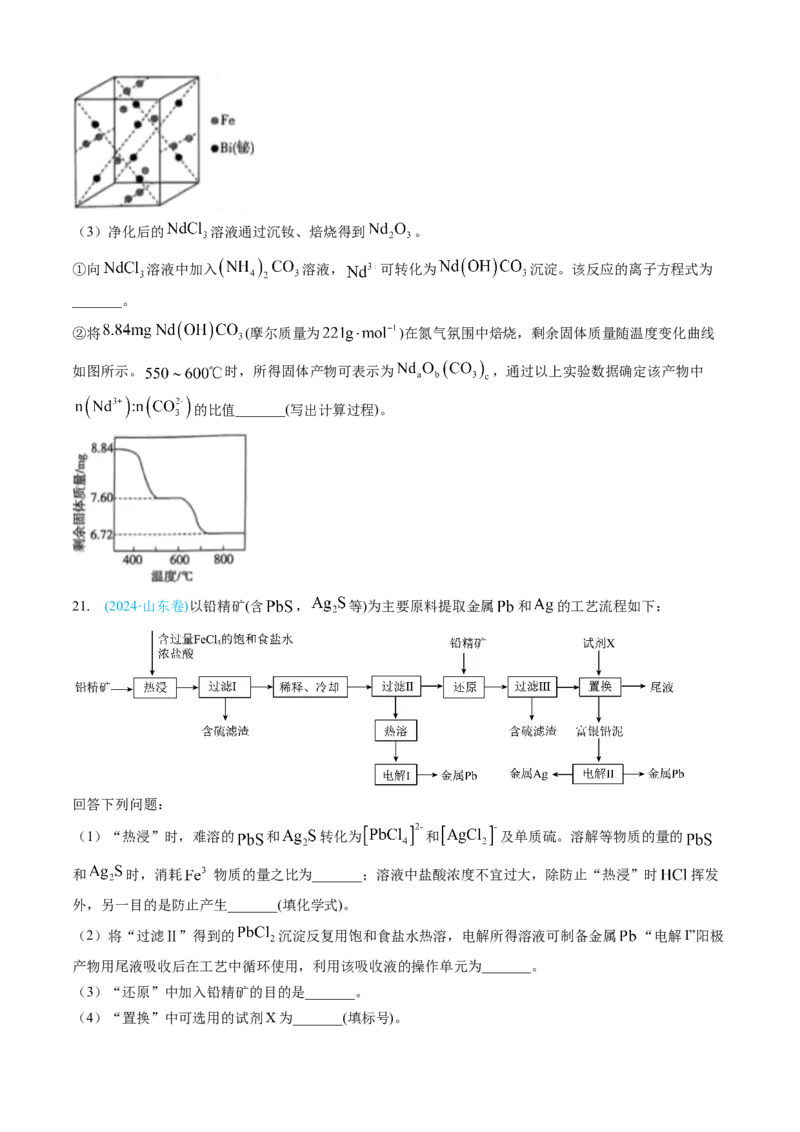
②反萃取后, 经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角
线上,O原子未画出),其中原子数目比 _______。(3)净化后的 溶液通过沉钕、焙烧得到 。
①向 溶液中加入 溶液, 可转化为 沉淀。该反应的离子方程式为
_______。
②将 (摩尔质量为 )在氮气氛围中焙烧,剩余固体质量随温度变化曲线
如图所示。 时,所得固体产物可表示为 ,通过以上实验数据确定该产物中
的比值_______(写出计算过程)。
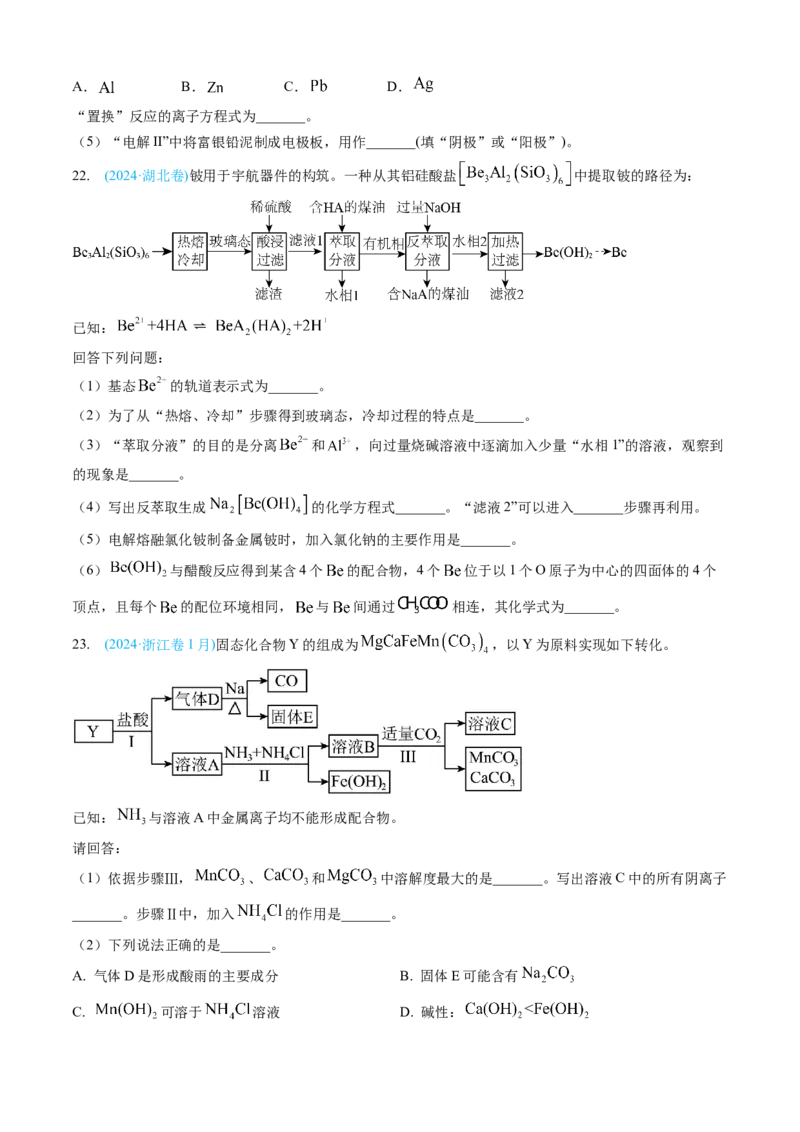
21. (2024·山东卷)以铅精矿(含 , 等)为主要原料提取金属 和 的工艺流程如下:
回答下列问题:
(1)“热浸”时,难溶的 和 转化为 和 及单质硫。溶解等物质的量的
和 时,消耗 物质的量之比为_______;溶液中盐酸浓度不宜过大,除防止“热浸”时 挥发
外,另一目的是防止产生_______(填化学式)。
(2)将“过滤Ⅱ”得到的 沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属 “电解I”阳极
产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为_______。
(3)“还原”中加入铅精矿的目的是_______。
(4)“置换”中可选用的试剂X为_______(填标号)。A. B. C. D.
“置换”反应的离子方程式为_______。
(5)“电解II”中将富银铅泥制成电极板,用作_______(填“阴极”或“阳极”)。
22. (2024·湖北卷)铍用于宇航器件的构筑。一种从其铝硅酸盐 中提取铍的路径为:
已知:
回答下列问题:
(1)基态 的轨道表示式为_______。
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是_______。
(3)“萃取分液”的目的是分离 和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到
的现象是_______。
(4)写出反萃取生成 的化学方程式_______。“滤液2”可以进入_______步骤再利用。
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_______。
(6) 与醋酸反应得到某含4个 的配合物,4个 位于以1个O原子为中心的四面体的4个
顶点,且每个 的配位环境相同, 与 间通过 相连,其化学式为_______。
23. (2024·浙江卷1月)固态化合物Y的组成为 ,以Y为原料实现如下转化。
已知: 与溶液A中金属离子均不能形成配合物。
请回答:
(1)依据步骤Ⅲ, 、 和 中溶解度最大的是_______。写出溶液C中的所有阴离子
_______。步骤Ⅱ中,加入 的作用是_______。
(2)下列说法正确的是_______。
A. 气体D是形成酸雨的主要成分 B. 固体E可能含有
C. 可溶于 溶液 D. 碱性:(3)酸性条件下,固体 (微溶于水,其还原产物为无色 的)可氧化 为 ,根据该反
应原理,设计实验验证Y中含有 元素_______;写出 转化为 的离子方程式_______。
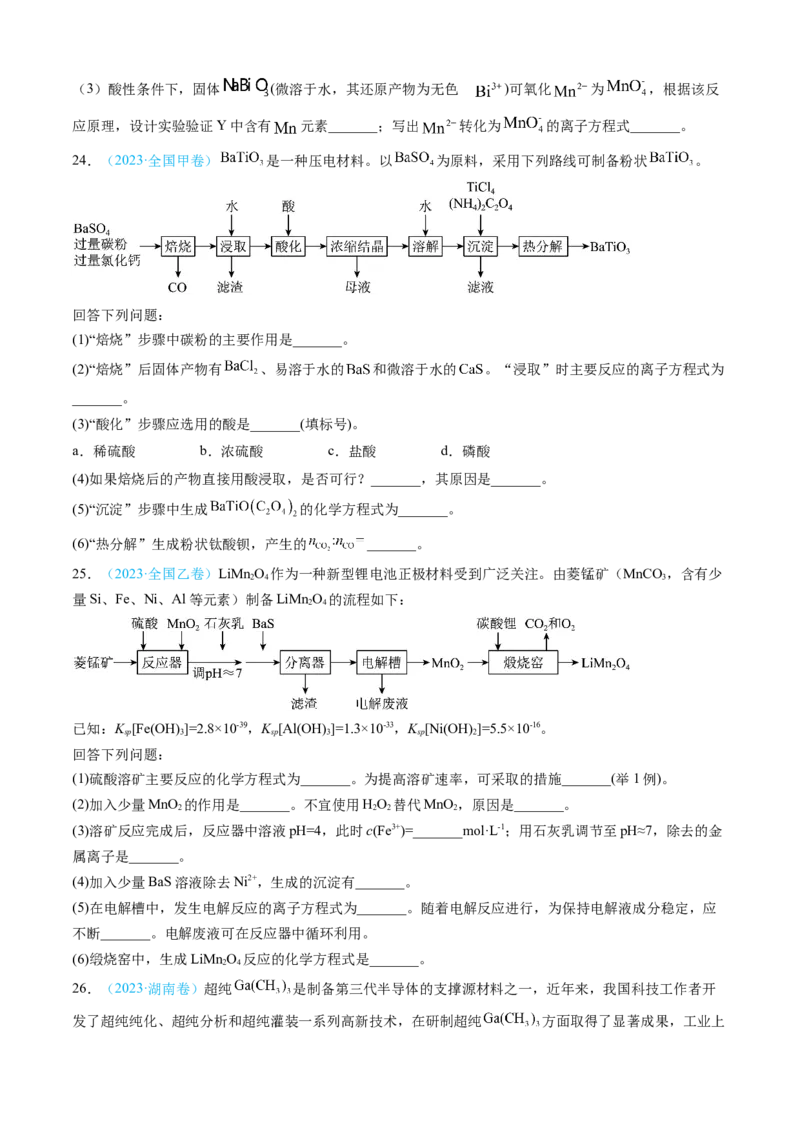
24.(2023·全国甲卷) 是一种压电材料。以 为原料,采用下列路线可制备粉状 。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是_______。
(2)“焙烧”后固体产物有 、易溶于水的 和微溶于水的 。“浸取”时主要反应的离子方程式为
_______。
(3)“酸化”步骤应选用的酸是_______(填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?_______,其原因是_______。
(5)“沉淀”步骤中生成 的化学方程式为_______。
(6)“热分解”生成粉状钛酸钡,产生的 _______。
25.(2023·全国乙卷)LiMn O 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO ,含有少
2 4 3
量Si、Fe、Ni、Al等元素)制备LiMn O 的流程如下:
2 4
已知:K [Fe(OH) ]=2.8×10-39,K [Al(OH) ]=1.3×10-33,K [Ni(OH) ]=5.5×10-16。
sp 3 sp 3 sp 2
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为_______。为提高溶矿速率,可采取的措施_______(举1例)。
(2)加入少量MnO 的作用是_______。不宜使用HO 替代MnO ,原因是_______。
2 2 2 2
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=_______mol·L-1;用石灰乳调节至pH≈7,除去的金
属离子是_______。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有_______。
(5)在电解槽中,发生电解反应的离子方程式为_______。随着电解反应进行,为保持电解液成分稳定,应
不断_______。电解废液可在反应器中循环利用。
(6)缎烧窑中,生成LiMn O 反应的化学方程式是_______。
2 4
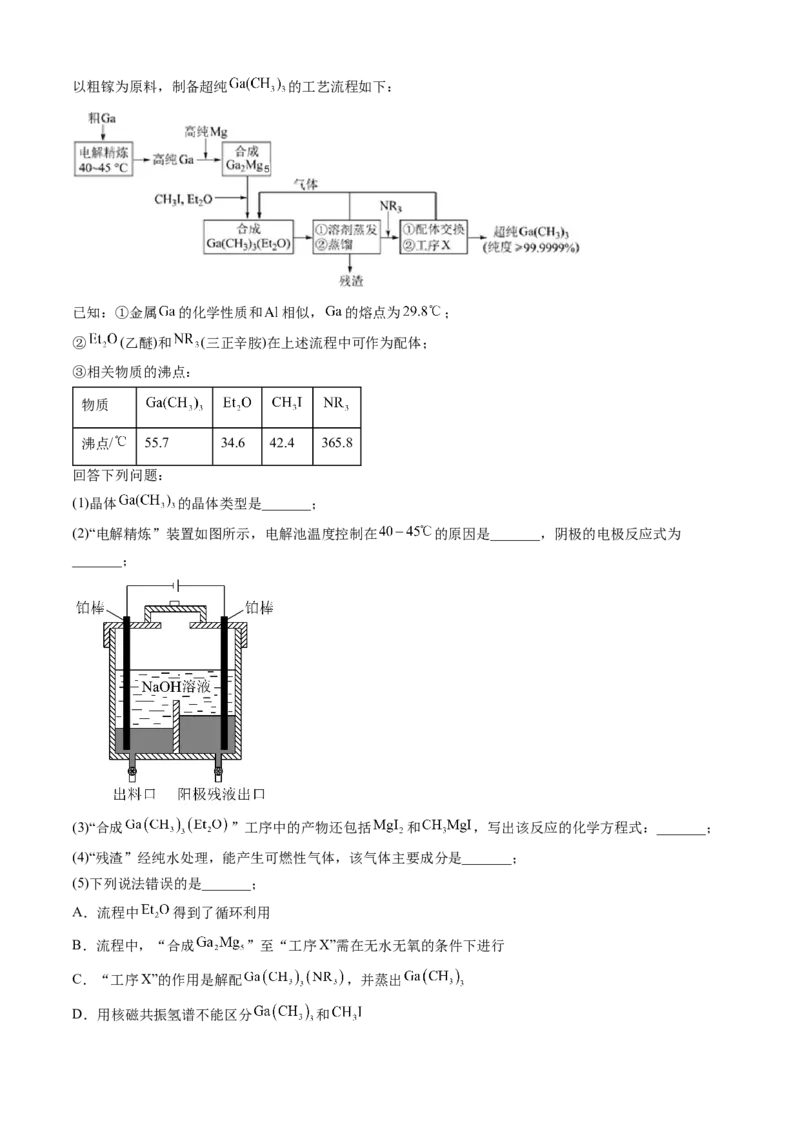
26.(2023·湖南卷)超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开
发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
已知:①金属 的化学性质和 相似, 的熔点为 ;
② (乙醚)和 (三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质
沸点/ 55.7 34.6 42.4 365.8
回答下列问题:
(1)晶体 的晶体类型是_______;
(2)“电解精炼”装置如图所示,电解池温度控制在 的原因是_______,阴极的电极反应式为
_______;
(3)“合成 ”工序中的产物还包括 和 ,写出该反应的化学方程式:_______;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______;
(5)下列说法错误的是_______;
A.流程中 得到了循环利用
B.流程中,“合成 ”至“工序X”需在无水无氧的条件下进行
C.“工序X”的作用是解配 ,并蒸出
D.用核磁共振氢谱不能区分 和(6)直接分解 不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
的理由是_______;
(7)比较分子中的 键角大小: _______ (填“>”“<”或“=”),其原因是
_______。
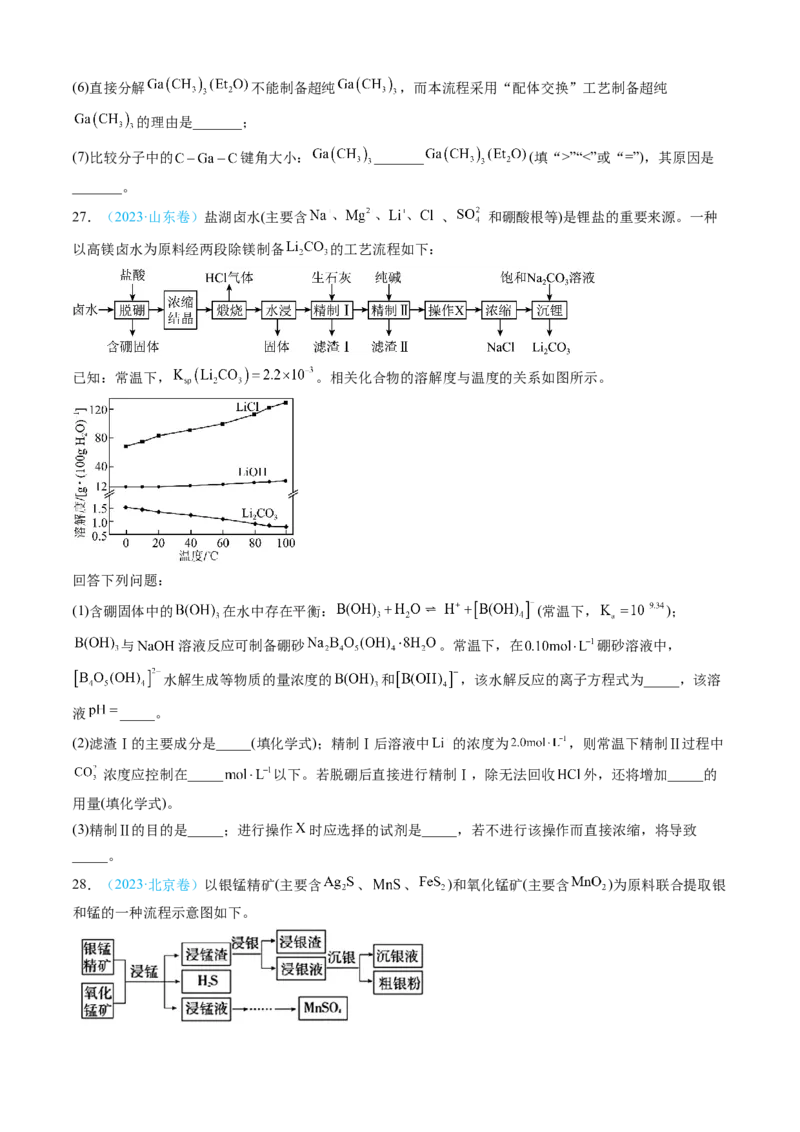
27.(2023·山东卷)盐湖卤水(主要含 、 和硼酸根等)是锂盐的重要来源。一种
以高镁卤水为原料经两段除镁制备 的工艺流程如下:
已知:常温下, 。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的 在水中存在平衡: (常温下, );
与 溶液反应可制备硼砂 。常温下,在 硼砂溶液中,
水解生成等物质的量浓度的 和 ,该水解反应的离子方程式为_____,该溶
液 _____。
(2)滤渣Ⅰ的主要成分是_____(填化学式);精制Ⅰ后溶液中 的浓度为 ,则常温下精制Ⅱ过程中
浓度应控制在_____ 以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加_____的
用量(填化学式)。
(3)精制Ⅱ的目的是_____;进行操作 时应选择的试剂是_____,若不进行该操作而直接浓缩,将导致
_____。
28.(2023·北京卷)以银锰精矿(主要含 、 、 )和氧化锰矿(主要含 )为原料联合提取银
和锰的一种流程示意图如下。已知:酸性条件下, 的氧化性强于 。
(1) “浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出:矿石中
的银以 的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应 ,则可推断: __________(填“>”或
“<”) 。
②在 溶液中,银锰精矿中的 和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
__________。
(2) “浸银”时,使用过量 和 的混合液作为浸出剂,将 中的银以 形式浸出。
①将“浸银”反应的离子方程式补充完整:__________。
②结合平衡移动原理,解释浸出剂中 的作用:____________________。
(3) “沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有______________________________。
②一定温度下, 的沉淀率随反应时间的变化如图所示。解释 分钟后 的沉淀率逐渐减小的原因:
______________。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:________。
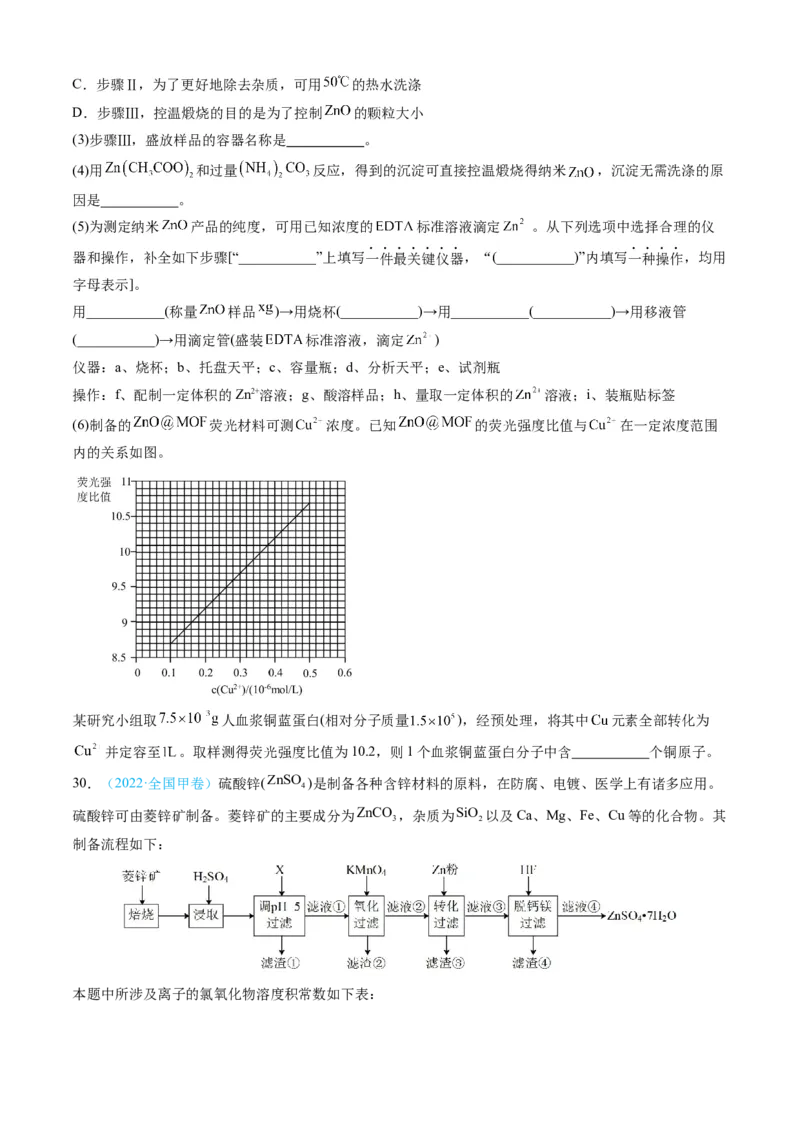
29.(2023·浙江卷)某研究小组制备纳米 ,再与金属有机框架 )材料复合制备荧光材料
,流程如下:
已知:①含
锌组分间的转化关系:
② 是 的一种晶型, 以下稳定。
请回答:
(1)步骤Ⅰ,初始滴入 溶液时,体系中主要含锌组分的化学式是 。
(2)下列有关说法不正确的是___________。
A.步骤Ⅰ,搅拌的作用是避免反应物浓度局部过高,使反应充分
B.步骤Ⅰ,若将过量 溶液滴入 溶液制备 ,可提高 的利用率C.步骤Ⅱ,为了更好地除去杂质,可用 的热水洗涤
D.步骤Ⅲ,控温煅烧的目的是为了控制 的颗粒大小
(3)步骤Ⅲ,盛放样品的容器名称是 。
(4)用 和过量 反应,得到的沉淀可直接控温煅烧得纳米 ,沉淀无需洗涤的原
因是 。
(5)为测定纳米 产品的纯度,可用已知浓度的 标准溶液滴定 。从下列选项中选择合理的仪
器和操作,补全如下步骤[“___________”上填写一件最关键仪器,“(___________)”内填写一种操作,均用
字母表示]。
用___________(称量 样品 )→用烧杯(___________)→用___________(___________)→用移液管
(___________)→用滴定管(盛装 标准溶液,滴定 )
仪器:a、烧杯;b、托盘天平;c、容量瓶;d、分析天平;e、试剂瓶
操作:f、配制一定体积的Zn2+溶液;g、酸溶样品;h、量取一定体积的 溶液;i、装瓶贴标签
(6)制备的 荧光材料可测 浓度。已知 的荧光强度比值与 在一定浓度范围
内的关系如图。
某研究小组取 人血浆铜蓝蛋白(相对分子质量 ),经预处理,将其中 元素全部转化为
并定容至 。取样测得荧光强度比值为10.2,则1个血浆铜蓝蛋白分子中含 个铜原子。
30.(2022·全国甲卷)硫酸锌(ZnSO )是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。
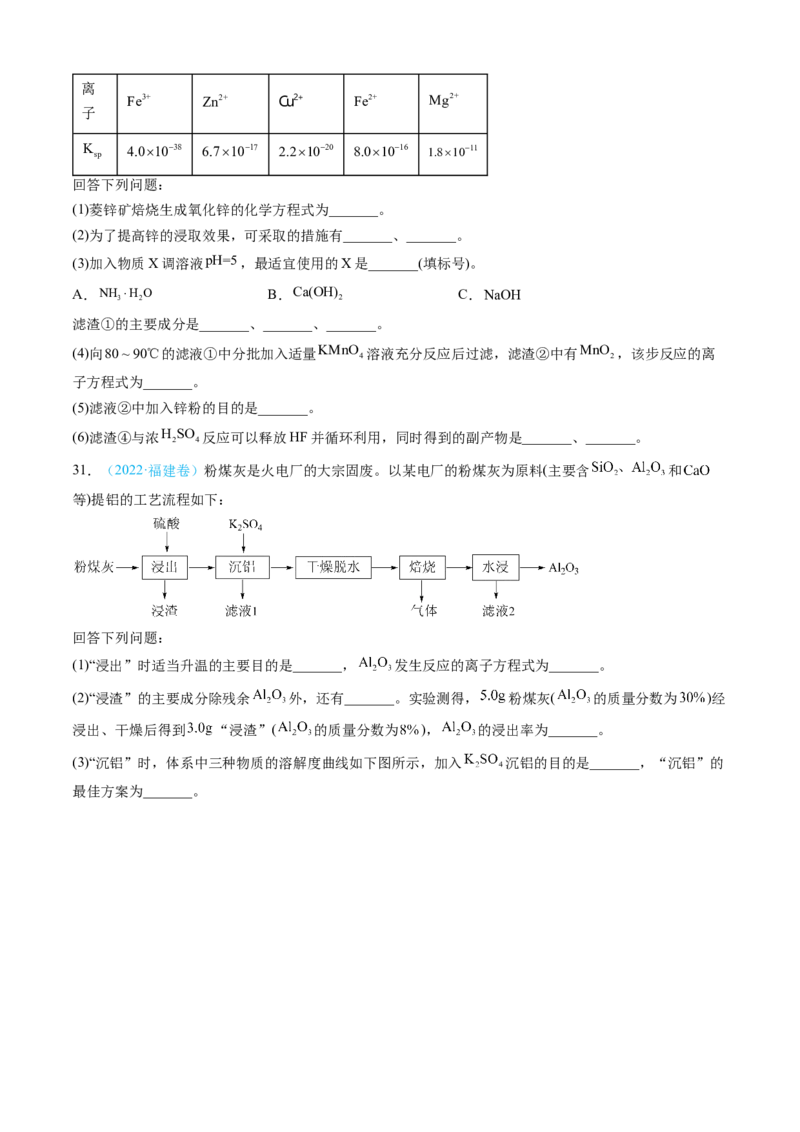
4
硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO ,杂质为SiO 以及Ca、Mg、Fe、Cu等的化合物。其
3 2
制备流程如下:
本题中所涉及离子的氯氧化物溶度积常数如下表:离
Fe3+ Zn2+ Cu2+ Fe2+ Mg2+
子
K
sp
4.01038 6.71017 2.21020 8.01016 1.81011
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______。
(2)为了提高锌的浸取效果,可采取的措施有_______、_______。
(3)加入物质X调溶液pH=5,最适宜使用的X是_______(填标号)。
A.NH H O B.Ca(OH) C.NaOH
3 2 2
滤渣①的主要成分是_______、_______、_______。
(4)向80~90℃的滤液①中分批加入适量KMnO 溶液充分反应后过滤,滤渣②中有MnO ,该步反应的离
4 2
子方程式为_______。
(5)滤液②中加入锌粉的目的是_______。
(6)滤渣④与浓H SO 反应可以释放HF并循环利用,同时得到的副产物是_______、_______。
2 4
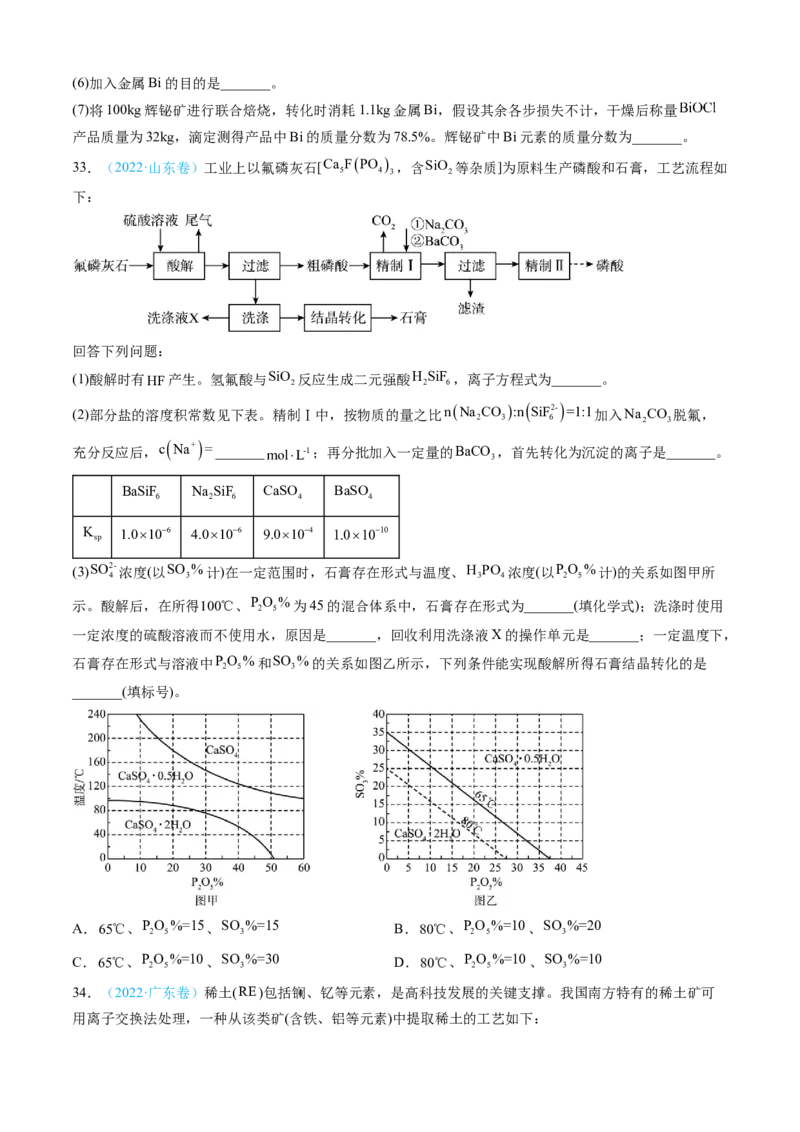
31.(2022·福建卷)粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含 和
等)提铝的工艺流程如下:
回答下列问题:
(1)“浸出”时适当升温的主要目的是_______, 发生反应的离子方程式为_______。
(2)“浸渣”的主要成分除残余 外,还有_______。实验测得, 粉煤灰( 的质量分数为 )经
浸出、干燥后得到 “浸渣”( 的质量分数为 ), 的浸出率为_______。
(3)“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入 沉铝的目的是_______,“沉铝”的
最佳方案为_______。(4)“焙烧”时,主要反应的化学方程式为_______。
(5)“水浸”后得到的“滤液2”可返回_______工序循环使用。
32.(2022·辽宁卷)某工厂采用辉铋矿(主要成分为 ,含有 、 杂质)与软锰矿(主要成分为
)联合焙烧法制各 和 ,工艺流程如下:
已知:①焙烧时过量的 分解为 , 转变为 ;
②金属活动性: ;
③相关金属离子形成氢氧化物的 范围如下:
开始沉淀 完全沉淀
6.5 8.3
1.6 2.8
8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_______。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2) 在空气中单独焙烧生成 ,反应的化学方程式为_______。
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出 和 ;②_______。
(4)滤渣的主要成分为_______(填化学式)。
(5)生成气体A的离子方程式为_______。(6)加入金属Bi的目的是_______。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_______。
33.(2022·山东卷)工业上以氟磷灰石[Ca FPO ,含SiO 等杂质]为原料生产磷酸和石膏,工艺流程如
5 4 3 2
下:
回答下列问题:
(1)酸解时有HF产生。氢氟酸与SiO
2
反应生成二元强酸H
2
SiF
6
,离子方程式为_______。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比nNa CO :n SiF2- =1:1加入Na CO 脱氟,
2 3 6 2 3
充分反应后,c
Na+
=_______molL-1;再分批加入一定量的BaCO ,首先转化为沉淀的离子是_______。
3
BaSiF Na SiF CaSO BaSO
6 2 6 4 4
K 1.0106 4.0106 9.0104 1.01010
sp
(3)SO2- 浓度(以SO %计)在一定范围时,石膏存在形式与温度、H PO 浓度(以PO %计)的关系如图甲所
4 3 3 4 2 5
示。酸解后,在所得100℃、PO %为45的混合体系中,石膏存在形式为_______(填化学式);洗涤时使用
2 5
一定浓度的硫酸溶液而不使用水,原因是_______,回收利用洗涤液X的操作单元是_______;一定温度下,
石膏存在形式与溶液中PO %和SO %的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
2 5 3
_______(填标号)。
A.65℃、PO %=15、SO %=15 B.80℃、PO %=10、SO %=20
2 5 3 2 5 3
C.65℃、PO %=10、SO %=30 D.80℃、PO %=10、SO %=10
2 5 3 2 5 3
34.(2022·广东卷)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可
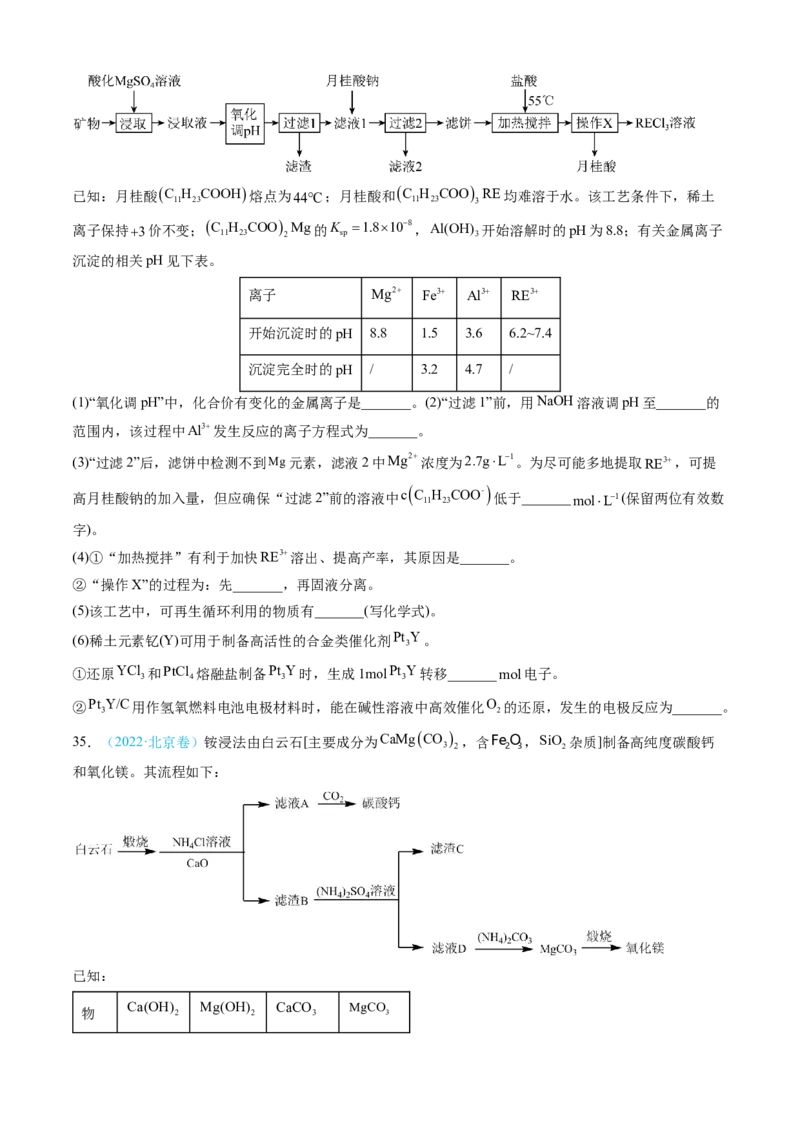
用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:已知:月桂酸 C H COOH 熔点为44C;月桂酸和 C H COO RE均难溶于水。该工艺条件下,稀土
11 23 11 23 3
离子保持3价不变; C H COO Mg的K 1.8108 ,Al(OH) 开始溶解时的pH为8.8;有关金属离子
11 23 2 sp 3
沉淀的相关pH见下表。
离子 Mg2 Fe3 Al3 RE3
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是_______。(2)“过滤1”前,用NaOH溶液调pH至_______的
范围内,该过程中Al3发生反应的离子方程式为_______。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2浓度为2.7gL1。为尽可能多地提取RE3,可提
高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c
C
11
H
23
COO-
低于_______molL1(保留两位有效数
字)。
(4)①“加热搅拌”有利于加快RE3溶出、提高产率,其原因是_______。
②“操作X”的过程为:先_______,再固液分离。
(5)该工艺中,可再生循环利用的物质有_______(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt Y。
3
①还原YCl 和PtCl 熔融盐制备Pt Y时,生成1molPt Y转移_______mol电子。
3 4 3 3
②Pt Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O 的还原,发生的电极反应为_______。
3 2
35.(2022·北京卷)铵浸法由白云石[主要成分为CaMgCO
,含FeO,SiO 杂质]制备高纯度碳酸钙
3 2 2 3 2
和氧化镁。其流程如下:
已知:
Ca(OH) Mg(OH) CaCO MgCO
物 2 2 3 3质
K 5.5106 1.81012 2.8109 3.5108
sp
(1)煅烧白云石的化学方程式为___________。
(2)根据下表数据分析:
nNH
4
Cl:n(CaO) CaO浸出率/% MgO 浸出率/% wCaCO
3
理论值/% wCaCO
3
实测值/%
2.1:1 98.4 1.1 99.7 -
2.2:1 98.8 1.5 99.2 99.5
2.3:1 98.9 1.8 98.8 99.5
2.4:1 99.1 6.0 95.6 97.6
已知:i.对浸出率给出定义
ii.对wCaCO
给出定义
3
①“沉钙”反应的化学方程式为___________。
②CaO浸出率远高于MgO浸出率的原因为___________。
③不宜选用的“nNH Cl:n(CaO)”数值为___________。
4
④wCaCO
实测值大于理论值的原因为___________。
3
⑤蒸馏时,随馏出液体积增大,MgO浸出率可出68.7%增加至98.9%,结合化学反应原理解释MgO浸出
率提高的原因为___________。
(3)滤渣C为___________。
(4)可循环利用的物质为___________。
36.(2022·河北卷)以焙烧黄铁矿 (杂质为石英等)产生的红渣为原料制备铵铁蓝 颜
料。工艺流程如下:
回答下列问题:
(1)红渣的主要成分为 (填化学式),滤渣①的主要成分为 (填化学式)。(2)黄铁矿研细的目的是 。
(3)还原工序中,不生成S单质的反应的化学方程式为 。
(4)工序①的名称为 ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀 中 的化合价为 ,氧化工序发生反应的离子方程式
为 。
(6)若用还原工序得到的滤液制备 和 ,所加试剂为 和 (填化学式,不
引入杂质)。