文档内容
宜宾市普通高中 2023 级第一次诊断性测
化 学
试
(考试时间:75分钟;全卷满分:100分)
注意事项:
1. 答卷前,考生务必将自己的考号、姓名、班级填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑。
如 需改动,用橡皮擦擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡
上。写 在本试卷上无效。
3. 考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: H1 C12 N14016 Na 23 Fe 56
一 、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一
项是 符合题目要求的。
1. 江安竹簧属于国家级非物质文化遗产。下列制作江安竹簧的物品中,主要成分属于无机非金
属材料的是
A. 竹龄五年以上的楠竹 B. 用于雕刻竹簧的平口钢刀
C. 用于维护刻刀的碳化硅磨刀石 D. 用于抛光竹簧产品的棉布
2.下列对物质性质的解释正确的是
选项 物质性质 解释
A SbH₃ (锑化氢)的沸点高于 NH₃ SbH₃ 分子间存在氢键
B SiO₂延展性较差 Si一0键键能较大
C C₂H₅NH₃NO₃ (硝酸乙基铵)常温下为液态 C₂H₅NH₃NO₃ 属于分子晶体
D O₃ 在水中溶解度大于 O₂ O₃ 和 H₂O 均是极性分子
3. 实验室制取KCIO₃ 的反应 下列有关化学用语
为 表述正确的是
A.Cl₂ 中共价键的电子云图:
B.KOH 的电子式:K:O:H
C.KC1 中 Cl-的结构示意图:
D.KCIO₃ 中 CIO3 的VSEPR 模 型 :
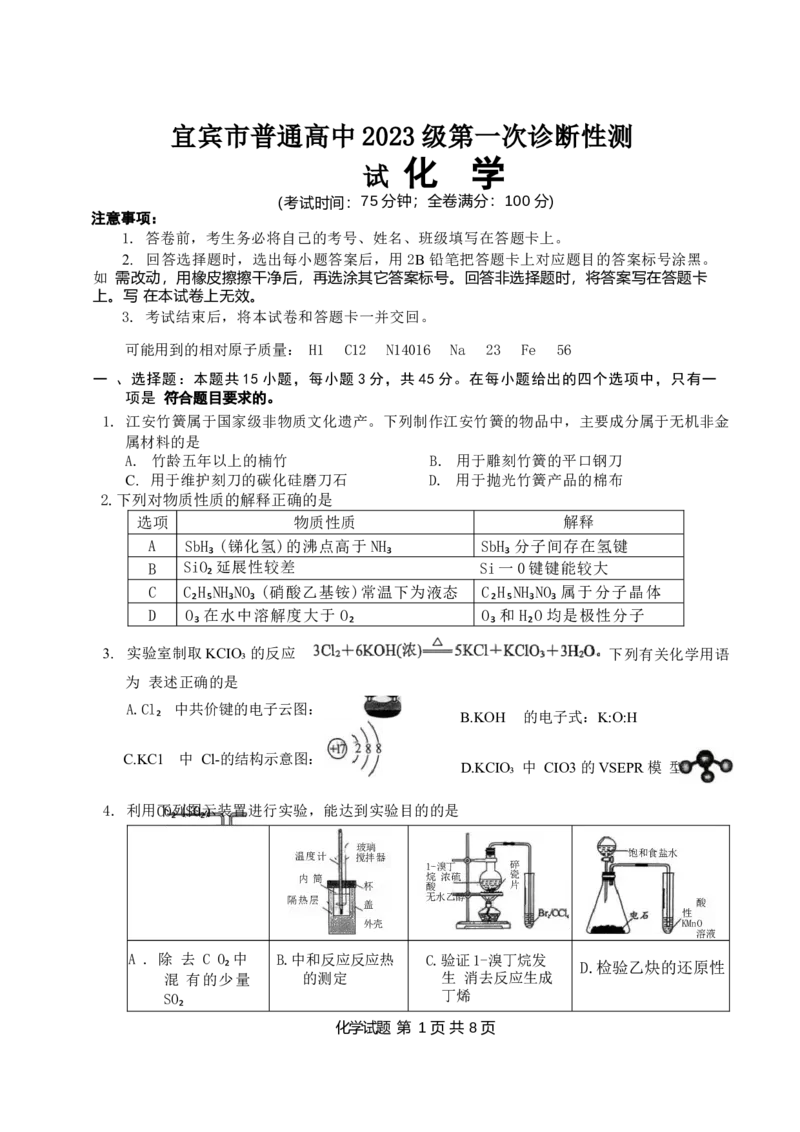
4. 利用下CO₂列 (S图O₂示) 装置进行实验,能达到实验目的的是
玻璃
温度计 、 搅拌器 饱和食盐水
1-溴丁 碎
内 筒 、 烷 浓硫 瓷
杯 酸 片
饱和Na₂CO₃溶液
隔热层 、 盖 无水乙醇 酸
性
外壳 KMnO
溶液
A . 除 去 C O₂ 中 B.中和反应反应热 C.验证1-溴丁烷发
D.检验乙炔的还原性
混 有的少量 的测定 生 消去反应生成
SO₂ 丁烯
化学试题 第 1 页 共 8 页5. 磷酸奥司他韦常用于治疗流感,合成磷酸奥司他韦的某中间体结构如下图。下列关于该中
间 体的说法错误的是
A. 分子式为C16H₂₆N₂O₄
B. 手性碳原子数目为3
C.sp² 杂化的碳原子数目为4
D.1mol 该中间体最多能与1 molH₂ 发生加成反应
6. 合成氨工业中,原料气在进入合成塔前需经过铜氨液除去其中的CO, 反应为[Cu(NH₃)₂ ]+
+ CO+NH₃ [Cu(NH₃)₃CO]+△H<0 。 下列说法正确的是
A.Cu+ 的价层电子排布式为3d⁹4s¹
B.[Cu(NH₃)₃CO]+ 中提供孤电子对的是Cu+
C. 反应前后,Cu+的配位数由2变为4
D. 吸收CO 后的铜氨液经冷却处理可再生
7 下列过程中涉及反应的离子方程式错误的是
A. 稀HNO₃ 清洗试管壁上的银镜:3Ag+4H++NO₃=3Ag+
+NO↑+2H₂O B.Na₂S 溶液中通入过量SO₂:S²-
+2SO₂+2H₂O=H₂S↑+2HSO₃
C. 草酸溶液中滴加酸性KMnO₄溶液:
2MnO4+5H₂C₂O₄+6H+=2Mn²++10CO₂↑+8H₂O
D.FeCl₂ 溶液中滴加K₃[Fe(CN)6]溶液:K++Fe²++[Fe(CN)6]³-=KFe[Fe(CN)6]↓
8 某无机盐MR₂(ZY4)₂·2X₂Y 可作增强型防锈颜料。X 、Y 、Z 、M 、R是原子序数依次增
大的 前四周期元素,Y 是地壳中含量最多的元素,X 和 Z 的最外层电子数之和等于Y 的
最外层电 子数;M 和 R 为同周期金属元素,且未成对电子数均为0。下列说法错误的是
A. 原子半径:Z>Y>X
B. 该无机盐中Z 的化合价为+6价
C. 化合物MY 可作干燥剂
D.R 的第一电离能大于同周期相邻元素
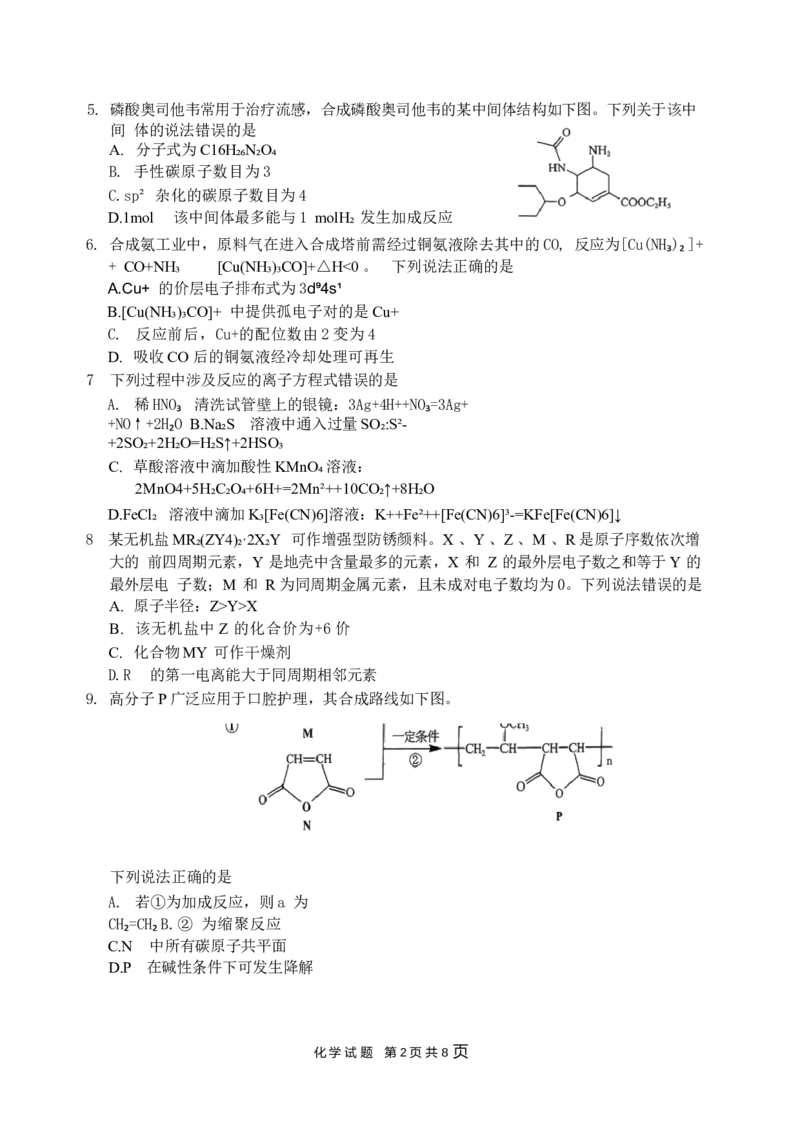
9. 高分子P 广泛应用于口腔护理,其合成路线如下图。
下列说法正确的是
A. 若①为加成反应,则a 为
CH₂=CH₂ B.② 为缩聚反应
C.N 中所有碳原子共平面
D.P 在碱性条件下可发生降解
化 学 试 题 第 2 页 共 8 页10. 市售85%磷酸溶液经减压蒸馏除水、结晶得到纯磷酸晶体,该纯化过程需严格控制温度和
水 分,实验装置如图(夹持装置省略)。
P₂O₃
CaCl₂ 毛
抽气 细
磷酸 溶液 管
浓
空气
硫
酸 电热板
已知:纯磷酸熔点为42℃,易吸水潮解。
下列说法错误的是
A.CaCl₂ 、 浓硫酸和P₂Os 均用于干燥空气
B. 通过毛细管提供的微小气泡可防止暴沸
C. 通入空气的目的是吹出磷酸溶液中的水
D. 电热板加热温度宜控制在35℃左右
11. 全球首例可充电氢负离子全固态电池由我国科学家于2025年研发成功。电池结构如图所
示, 固态电解质仅允许H 自由移动。电池放电时的总反应为3NaAIH₄+6CeH₂=Na₃AIH₆+
2A1+6CeH₃ 。 下列说法错误的是
负载
CeH₂
BaH₂ C e BaH₂
A. 放 电 时 ,A 极发生了氧化反应
B. 放电时,H- 由 A 极移动到B 极
C. 充电时,B 极电极反应式为Na₃AIH₆+2A1+6H--6e-=3NaAlH₄
D. 充电时,当外电路通过1mol 电子时,理论上两电极质量变化差值为2g
12. 利用某铁尾渣(含Fe₂O₃ 、SiO₂及少量Nd₂O₃ 、Al₂O₃ 、Co₂O₃) 可获得稀土钕(Nd)、 钴
(Co)
的富集渣及高纯度的FeSO₄·7H₂O, 其工艺流程如下图。
FeS
活性炭 H₂SO₄
还 原还原渣 酸溶 调pH
铁尾渣 滤渣 含Nd(OH₃、 Al(OH)₃等 除 钴 系列操作→FeSO₄·7H₂O
一 的富集渣 含CoS的 富集渣
已知:还原渣中铁元素主要以Fe、FeO 和少量Fe₃O4 的形式存
在。 下列说法正确的是
A. 可通过观察还原渣的颜色判断铁尾渣的还原程度
B. “还原”步骤中,仅Fe₂O₃ 被活性炭还原
C. “除钴”过程发生反应 S²-+Co²+—CoS↓
D. “系列操作”为蒸发结晶、过滤等
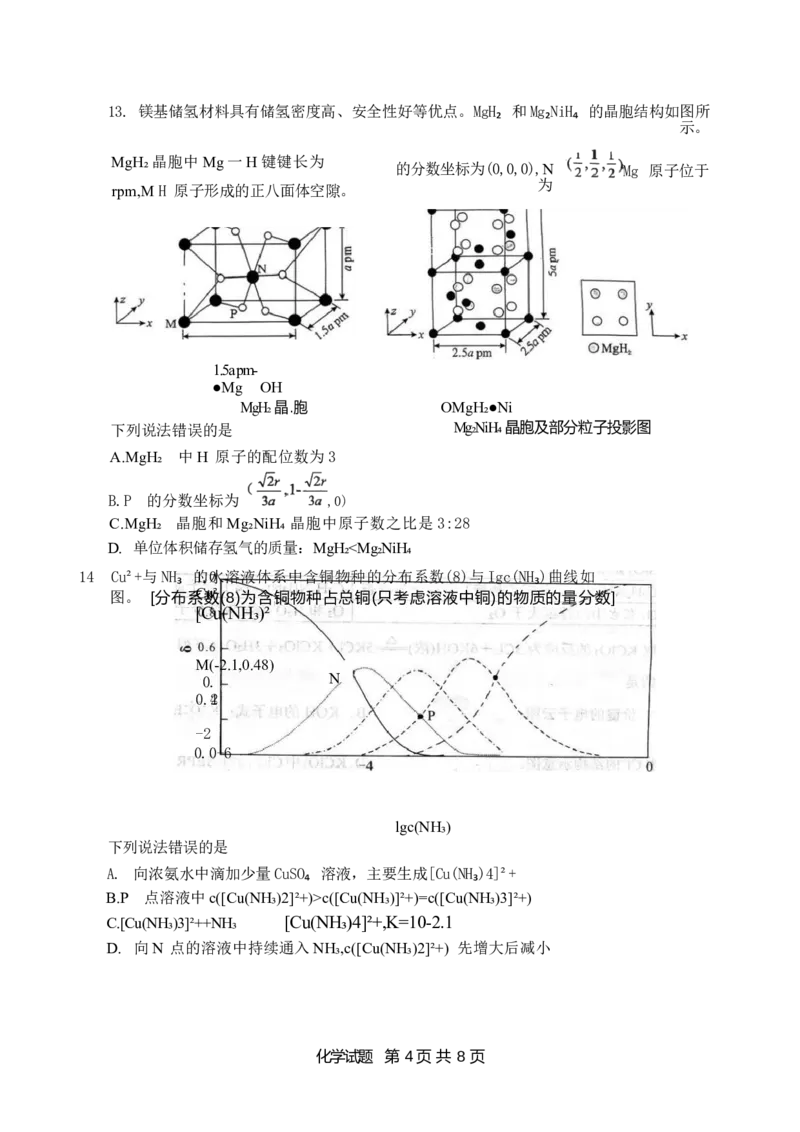
化学试题 第 3 页共 8 页13. 镁基储氢材料具有储氢密度高、安全性好等优点。MgH₂ 和Mg₂NiH₄ 的晶胞结构如图所
示。
MgH₂晶胞中Mg一H 键键长为
的分数坐标为(0,0,0),N 4Mg 原子位于
为
rpm,M H 原子形成的正八面体空隙。
1.5a pm-
●Mg OH
MgH₂晶.胞 OMgH₂●Ni
下列说法错误的是 Mg₂NiH₄晶胞及部分粒子投影图
A.MgH₂ 中H 原子的配位数为3
B.P 的分数坐标为 ,0)
C.MgH₂ 晶胞和Mg₂NiH₄ 晶胞中原子数之比是3:28
D. 单位体积储存氢气的质量:MgH₂c([Cu(NH₃)]²+)=c([Cu(NH₃)3]²+)
C.[Cu(NH₃)3]²++NH₃ [Cu(NH₃)4]²+,K=10-2.1
D. 向N 点的溶液中持续通入NH₃,c([Cu(NH₃)2]²+) 先增大后减小
化学试题 第 4 页 共 8 页15. 碳一碳键的构筑始终是有机化学研究的核心。在无水AlCl₃ 催化下,(CH₃)₃CCI 与苯反应生
成 叔丁基苯[C₆H₅-C(CH₃)₃], 反应历程的能量变化如下图(反应物的相对能量均为
0,相TS对 代能 量表 过(k渡cal/态mo,l) IM 代表中间体)。
GCcs
C(CH)
(CH₂),CCl
1.0
AICl₃ 生成
反应物 物
-7.8
[AICL]- [AlCL₄]
-16.7
【CH₃)₃CJ[AIC
反应历程
下列说法错误的是
A. 由 C-C1 键键能和A1-Cl 键键能可计算生成IM1 的△H
B.IM2 中[(CH₃)₃C] 与苯环中大π键电子云产生了相互作用
C. 活化能:Ea(TS1)>Ea(TS2)
D.TS2 到生成物过程放热,主要原因是苯环中形成了稳定的大π键
二、非选择题:共4题,共55分。
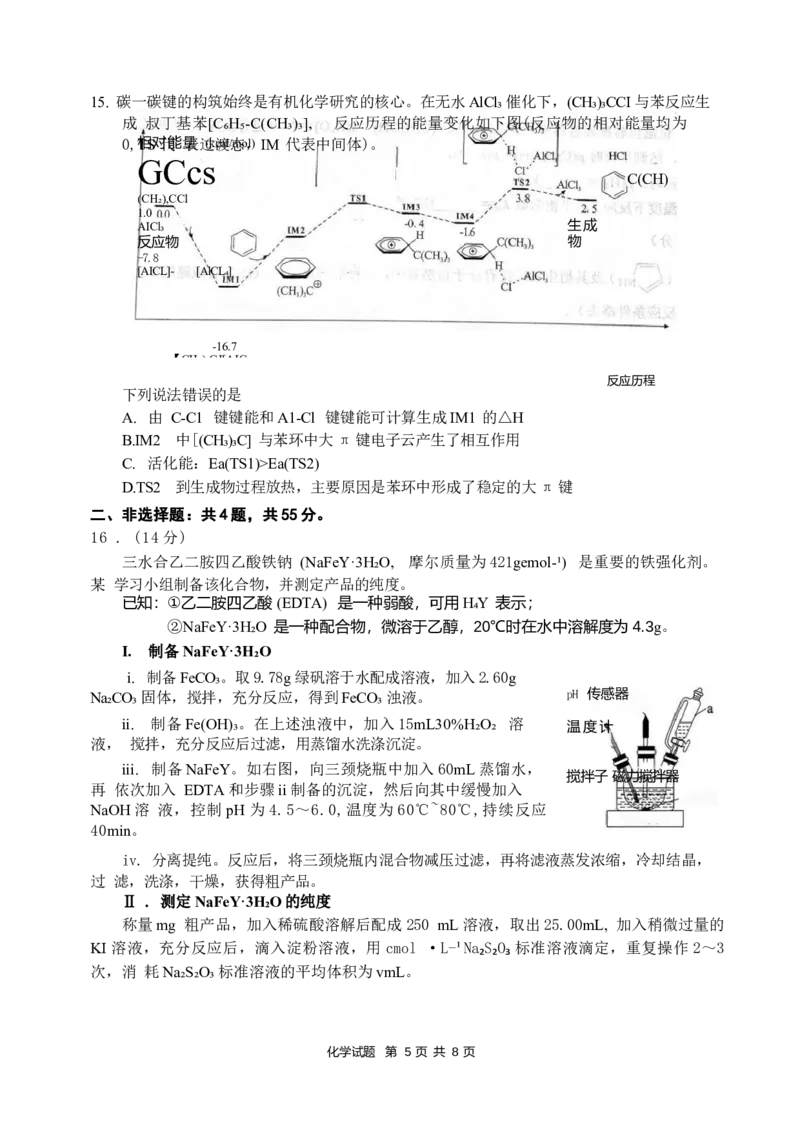
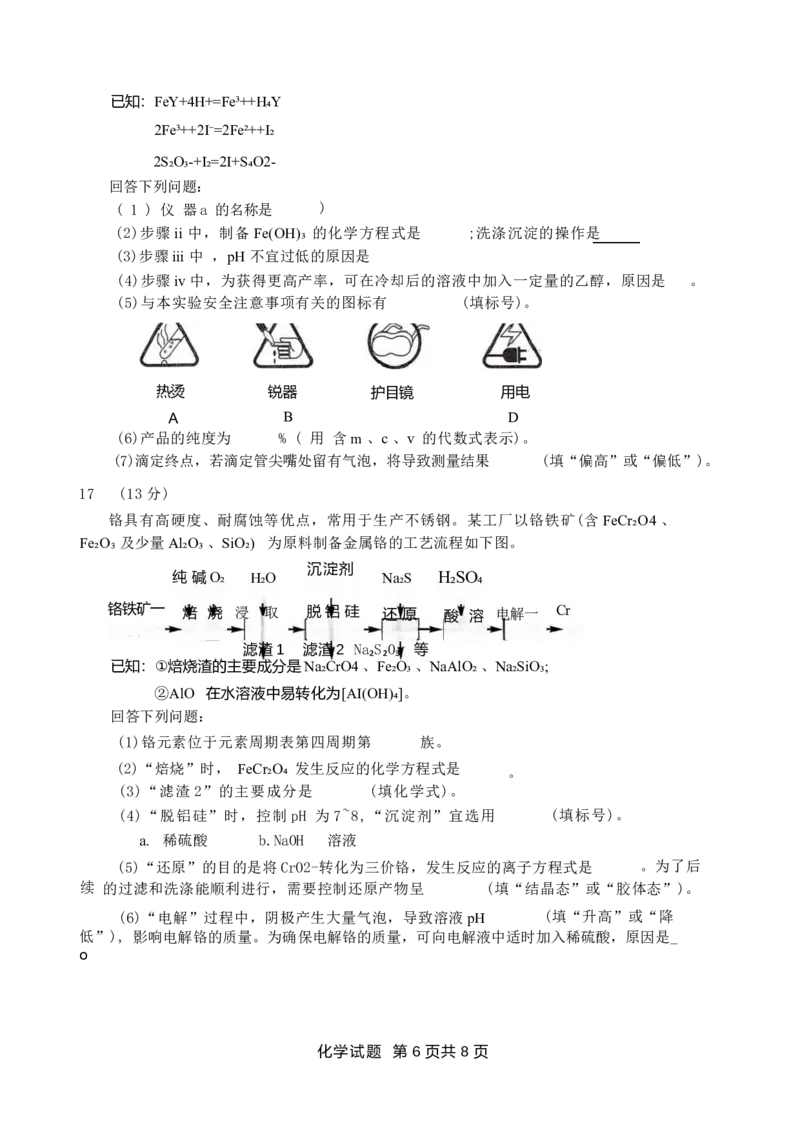
16 . (14 分)
三水合乙二胺四乙酸铁钠 (NaFeY·3H₂O, 摩尔质量为421gemol-¹) 是重要的铁强化剂。
某 学习小组制备该化合物,并测定产品的纯度。
已知:①乙二胺四乙酸 (EDTA) 是一种弱酸,可用H₄Y 表示;
②NaFeY·3H₂O 是一种配合物,微溶于乙醇,20℃时在水中溶解度为4.3g。
I. 制备NaFeY·3H₂O
i. 制备FeCO₃。取9.78g 绿矾溶于水配成溶液,加入2.60g
Na₂CO₃ 固体,搅拌,充分反应,得到FeCO₃ 浊液。 pH 传感器
ii. 制备Fe(OH)₃。在上述浊液中,加入15mL30%H₂O₂ 溶 温度计
液, 搅拌,充分反应后过滤,用蒸馏水洗涤沉淀。
iii. 制备NaFeY。如右图,向三颈烧瓶中加入60mL 蒸馏水,
搅拌子 磁力搅拌器
再 依次加入 EDTA 和步骤ii 制备的沉淀,然后向其中缓慢加入
NaOH 溶 液,控制pH 为4.5~6.0,温度为60℃~80℃,持续反应
40min。
iv. 分离提纯。反应后,将三颈烧瓶内混合物减压过滤,再将滤液蒸发浓缩,冷却结晶,
过 滤,洗涤,干燥,获得粗产品。
Ⅱ . 测定NaFeY·3H₂O的纯度
称量mg 粗产品,加入稀硫酸溶解后配成250 mL 溶液,取出25.00mL, 加入稍微过量的
KI 溶液,充分反应后,滴入淀粉溶液,用 cmol ·L-¹Na₂S₂O₃ 标准溶液滴定,重复操作 2~3
次,消 耗Na₂S₂O₃ 标准溶液的平均体积为vmL。
化学试题 第 5 页 共 8 页已知:FeY+4H+=Fe³++H₄Y
2Fe³++2I⁻=2Fe²++I₂
2S₂O₃-+I₂=2I+S₄O2-
回答下列问题:
( 1 ) 仪 器a 的名称是 )
(2)步骤ii 中,制备Fe(OH)₃ 的化学方程式是 ;洗涤沉淀的操作是
(3)步骤iii 中 ,pH 不宜过低的原因是
(4)步骤iv 中,为获得更高产率,可在冷却后的溶液中加入一定量的乙醇,原因是 。
(5)与本实验安全注意事项有关的图标有 (填标号)。
热烫 锐器 护目镜 用电
A B D
(6)产品的纯度为 % ( 用 含m 、c 、v 的代数式表示)。
(7)滴定终点,若滴定管尖嘴处留有气泡,将导致测量结果 (填“偏高”或“偏低”)。
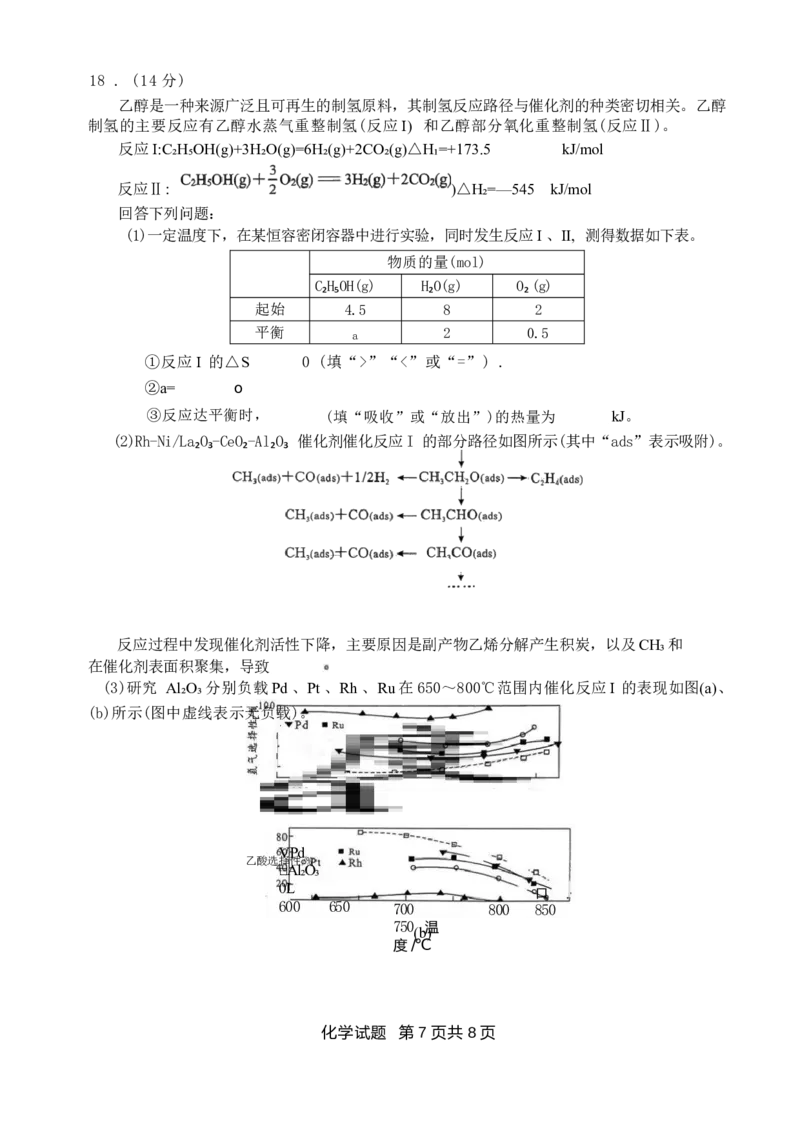
17 (13 分)
铬具有高硬度、耐腐蚀等优点,常用于生产不锈钢。某工厂以铬铁矿(含FeCr₂O4 、
Fe₂O₃ 及少量Al₂O₃ 、SiO₂) 为原料制备金属铬的工艺流程如下图。
沉淀剂
纯 碱O₂ H₂O Na₂S H₂SO₄
铬铁矿一 焙 烧 浸 取 脱 铝 硅 还 原 酸 溶 电解一 Cr
滤渣1 滤渣2 Na₂S₂O₃ 等
已知:①焙烧渣的主要成分是Na₂CrO4 、Fe₂O₃ 、NaAlO₂ 、Na₂SiO₃;
②AlO 在水溶液中易转化为[AI(OH)₄]。
回答下列问题:
(1)铬元素位于元素周期表第四周期第 族。
(2)“焙烧”时, FeCr₂O₄ 发生反应的化学方程式是 。
(3)“滤渣 2”的主要成分是 (填化学式)。
(4)“脱铝硅”时,控制 pH 为 7~8,“沉淀剂”宜选用 (填标号)。
a. 稀硫酸 b.NaOH 溶液
(5)“还原”的目的是将CrO2-转化为三价铬,发生反应的离子方程式是 。为了后
续 的过滤和洗涤能顺利进行,需要控制还原产物呈 (填“结晶态”或“胶体态”)。
(6)“电解”过程中,阴极产生大量气泡,导致溶液pH (填“升高”或“降
低”), 影响电解铬的质量。为确保电解铬的质量,可向电解液中适时加入稀硫酸,原因是_
o
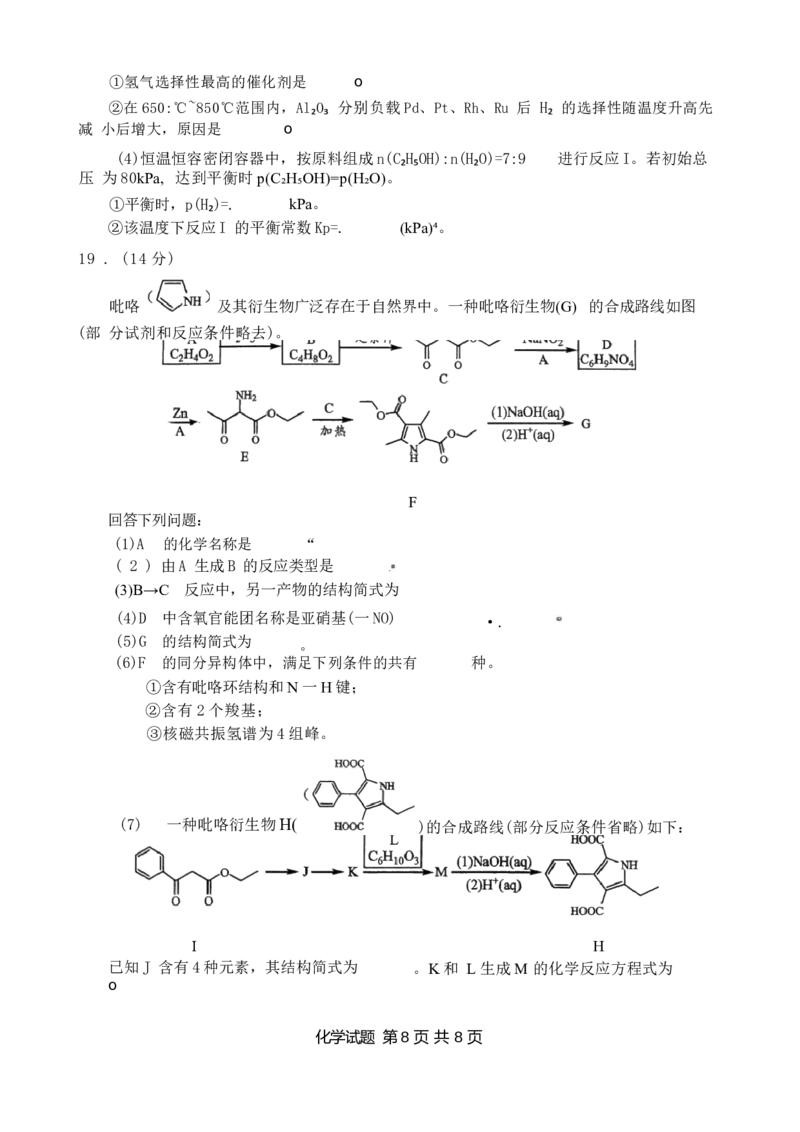
化学试题 第 6 页共 8 页18 . (14 分)
乙醇是一种来源广泛且可再生的制氢原料,其制氢反应路径与催化剂的种类密切相关。乙醇
制氢的主要反应有乙醇水蒸气重整制氢(反应I) 和乙醇部分氧化重整制氢(反应Ⅱ)。
反应I:C₂H₅OH(g)+3H₂O(g)=6H₂(g)+2CO₂(g)△H₁=+173.5 kJ/mol
反应Ⅱ: )△H₂=—545 kJ/mol
回答下列问题:
(1)一定温度下,在某恒容密闭容器中进行实验,同时发生反应I 、Ⅱ, 测得数据如下表。
物质的量(mol)
C₂H₅OH(g) H₂O(g) O₂ (g)
起始 4.5 8 2
平衡 2 0.5
a
①反应I 的△S 0 (填“>”“<”或“=”) .
②a= o
③反应达平衡时, (填“吸收”或“放出”)的热量为 kJ。
(2)Rh-Ni/La₂O₃-CeO₂-Al₂O₃ 催化剂催化反应I 的部分路径如图所示(其中“ads”表示吸附)。
反应过程中发现催化剂活性下降,主要原因是副产物乙烯分解产生积炭,以及CH₃ 和
在催化剂表面积聚集,导致
(3)研究 Al₂O₃分别负载Pd 、Pt 、Rh 、Ru在650~800℃范围内催化反应I 的表现如图(a)、
(b)所示(图中虚线表示无负载)。
VPd
乙酸选择性/%
□Al₂O₃
0L
口
600 650 700 800 850
750 温
(b)
度/℃
化学试题 第 7 页共 8 页①氢气选择性最高的催化剂是 o
②在650:℃~850℃范围内,Al₂O₃ 分别负载Pd、Pt、Rh、Ru 后 H₂ 的选择性随温度升高先
减 小后增大,原因是 o
(4)恒温恒容密闭容器中,按原料组成n(C₂H₅OH):n(H₂O)=7:9 进行反应I。若初始总
压 为80kPa, 达到平衡时p(C₂H₅OH)=p(H₂O)。
①平衡时,p(H₂)=. kPa。
②该温度下反应I 的平衡常数Kp=. (kPa)⁴。
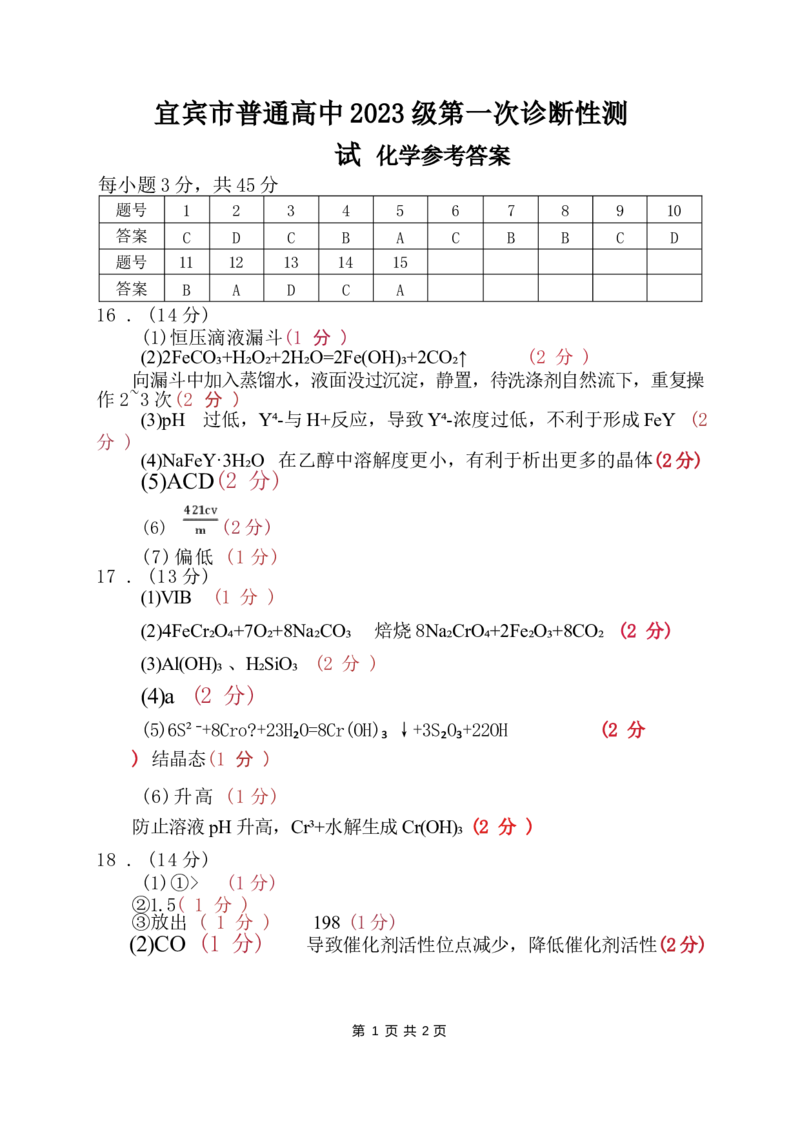
19 . (14 分)
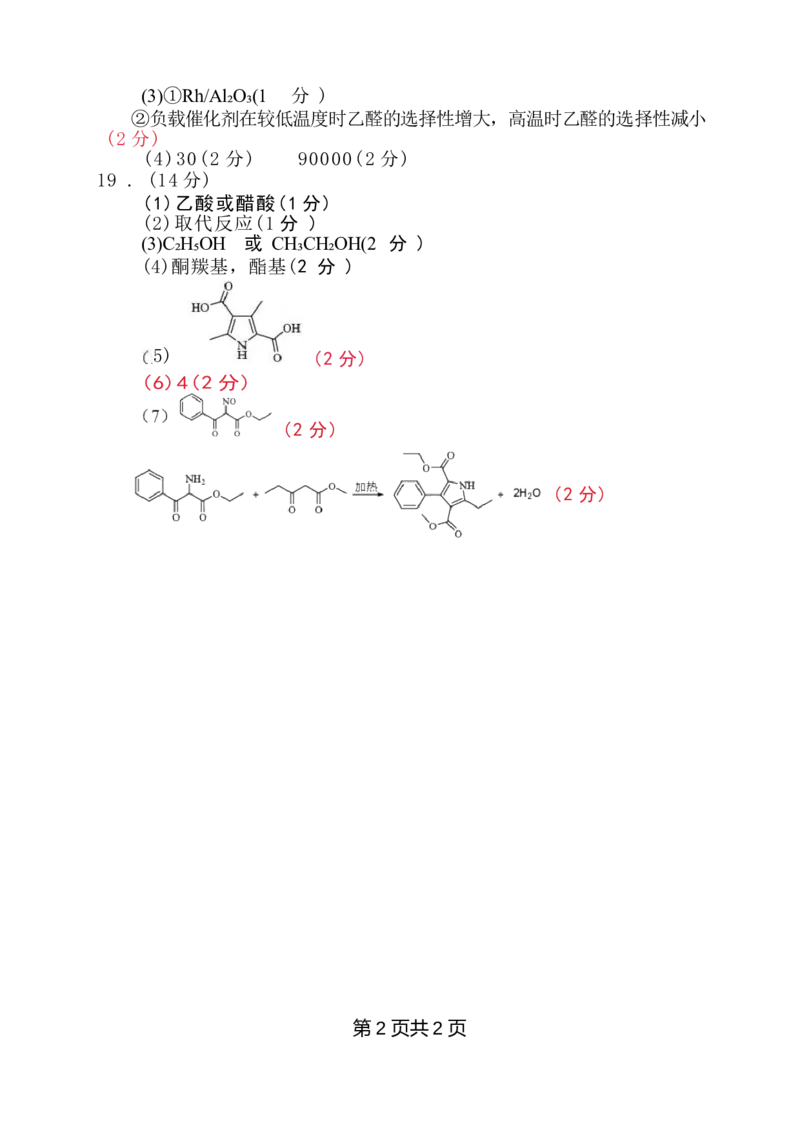
吡咯 及其衍生物广泛存在于自然界中。一种吡咯衍生物(G) 的合成路线如图
(部 分试剂和反应条件略去)。
F
回答下列问题:
(1)A 的化学名称是 “
( 2 ) 由A 生成B 的反应类型是
(3)B→C 反应中,另一产物的结构简式为
(4)D 中含氧官能团名称是亚硝基(一NO) ·.
(5)G 的结构简式为 。
(6)F 的同分异构体中,满足下列条件的共有 种。
①含有吡咯环结构和N 一H 键;
②含有2个羧基;
③核磁共振氢谱为4组峰。
(7) 一种吡咯衍生物H( )的合成路线(部分反应条件省略)如下:
I H
已知J 含有4种元素,其结构简式为 。K 和 L 生成M 的化学反应方程式为
o
化学试题 第8 页 共 8 页宜宾市普通高中 2023 级第一次诊断性测
试 化学参考答案
每小题3分,共45分
题号 1 2 3 4 5 6 7 8 9 10
答案 C D C B A C B B C D
题号 11 12 13 14 15
答案 B A D C A
16 . (14 分)
(1)恒压滴液漏斗(1 分 )
(2)2FeCO₃+H₂O₂+2H₂O=2Fe(OH)₃+2CO₂↑ (2 分 )
向漏斗中加入蒸馏水,液面没过沉淀,静置,待洗涤剂自然流下,重复操
作 2~3 次(2 分 )
(3)pH 过低,Y⁴-与H+反应,导致Y⁴-浓度过低,不利于形成FeY (2
分 )
(4)NaFeY·3H₂O 在乙醇中溶解度更小,有利于析出更多的晶体(2分)
(5)ACD(2 分)
(6) (2 分)
(7)偏低 (1 分)
17 . (13 分)
(1)VIB (1 分 )
(2)4FeCr₂O₄+7O₂+8Na₂CO₃ 焙烧8Na₂CrO₄+2Fe₂O₃+8CO₂ (2 分)
(3)Al(OH)₃ 、H₂SiO₃ (2 分 )
(4)a (2 分)
(5)6S²⁻+8Cro?+23H₂O=8Cr(OH)₃ ↓+3S₂O₃+22OH (2 分
) 结晶态(1 分 )
(6)升高 (1 分)
防止溶液pH 升高,Cr³+水解生成Cr(OH)₃ (2 分 )
18 . (14 分)
(1)①> (1 分)
②1.5( 1 分 )
③放出 ( 1 分 ) 198 (1分)
(2)CO (1 分) 导致催化剂活性位点减少,降低催化剂活性(2分)
第 1 页 共 2 页(3)①Rh/Al₂O₃(1 分 )
②负载催化剂在较低温度时乙醛的选择性增大,高温时乙醛的选择性减小
(2 分)
(4)30(2 分) 90000(2 分)
19 . (14 分)
(1)乙酸或醋酸(1 分)
(2)取代反应(1 分 )
(3)C₂H₅OH 或 CH₃CH₂OH(2 分 )
(4)酮羰基,酯基(2 分 )
5) (2 分)
(6)4(2 分)
(2 分)
(2 分)
第2 页共2 页