文档内容
届高三 月考试
2026 1 5.下列说法正确的是
化学 学科
A.56Fe与 58Fe为同一种核素
26 26
(本试卷满分100分,考试时间75分钟)
B.Fe(CO)5 是离子化合物
可能用到的相对原子质量:H—1 C—12 N—14 O—16 I—127
一、单项选择题:共 14题,每题 3 分,共42 分。每题只有一个选项最符合题意。
C.Fe2+基态核外电子排布式为[Ar]3d 6
....
1.我国自主研制的AG60E电动飞机成功首飞。AG60E采用了SiC电控系统,SiC晶体属于
D.完全储氢后,距离Fe等距离且最近的H2 个数是8
6.下列化学反应表示正确的是
A.分子晶体 B.混合晶体 C.共价晶体 D.过渡晶体
2.下列化学用语或图示表达正确的是
A.Fe和O
2
反应生成Fe2O3 :4Fe(s)+3O
2
(g)═2Fe2O3(s) ΔH=- 822kJ·mol-¹
A.O3 分子的球棍模型:
B.电解法制Na2FeO
4
的阳极反应:Fe-6e - + 8OH - ═FeO
4
2 - +4H2O
B.K+和S2-的最外层电子排布图均为
C.酸性条件下,FeO
4
2-遇水产生O
2
的反应:FeO
4
2 - +4H+═Fe2++O2↑+2H2O
C.CaC2 的电子式:
D.向FeCl3 溶液中滴加少量Na2S溶液的反应:2Fe3++3S2 - ═Fe2S3 ↓
7.下列物质结构或性质与用途不具有对应关系的是
D.p-pπ键形成的轨道重叠示意图:
A.铁具有良好的延展性且易形成合金,所以铁的用途广泛
3.一种以铜为原料制取[Cu(NH ) ]SO 溶液并验证SO 性质的装置中,原理正确并能达到实验目的的是
3 4 4 2
B.五羰基合铁Fe(CO)5 常温下是液体,所以受热易分解
C.FeOOH具有吸附性,可用于净水
D.高铁酸盐具有强氧化性,可用于杀菌消毒
8.下列各溶液中一定能大量共存的离子组是
A.常温下c H 1014molL1溶液中:Na、 K、 S2、SO2-
3
A.用装置甲制CuSO4 B.用装置乙验证SO2具有漂白性 B.使石蕊试纸呈红色的溶液中:Fe2、 K、NO-、Cl
3
C.用装置丙稀释混合物得CuSO
4
溶液 D.用装置丁制[Cu(NH
3
)
4
]SO
4
溶液 C.常温下的溶液中: Cl、 Al3、 Na、CO
3
2-
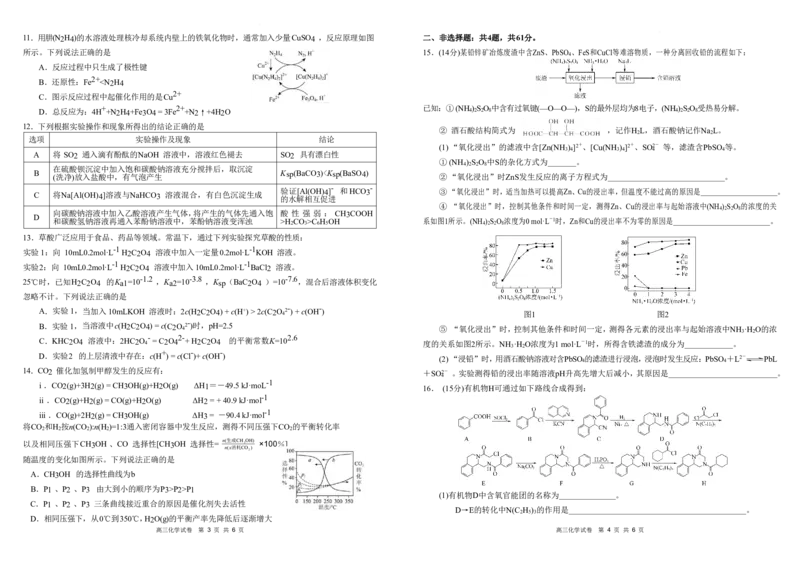
4.一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中 D.使酚酞试剂呈红色的溶液中:Mg2、 Cu2、SO2-、 K
4
[C(NH2)3]+为平面结构。 9.利用热再生氨电池可实现CuSO4 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同
的CuSO4 电镀废液,向甲室加入足量氨水后电池开始工作。
下列说法正确的是
A.隔膜为阳离子交换膜
下列说法不正确的是 B.电池工作过程中,两电极质量均减轻
A.该晶体中存在N-H…O氢键 B.基态原子的第一电离能:C<O<N C.甲室中电极反应为:Cu-2e - +4NH3=[Cu(NH3)4] 2+
C.电负性:χ(B)<χ(C) D.晶体中C、N和O原子轨道的杂化类型相同 D.其他条件不变,NH3 若扩散到乙室将增大电流强度
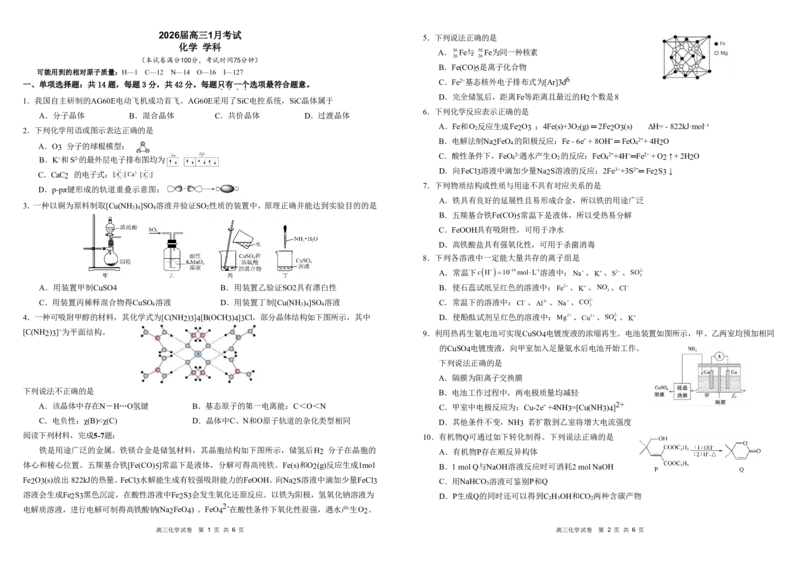
阅读下列材料,完成5-7题: 10.有机物Q可通过如下转化制得。下列说法正确的是
铁是用途广泛的金属。铁镁合金是储氢材料,其晶胞结构如下图所示,储氢后H2 分子在晶胞的 A.有机物P存在顺反异构体
体心和棱心位置。五羰基合铁[Fe(CO)5]常温下是液体,分解可得高纯铁。Fe(s)和O2(g)反应生成1mol B.1molQ与NaOH溶液反应时可消耗2molNaOH
Fe2O3(s)放出 822kJ的热量。FeCl3 水解能生成有较强吸附能力的FeOOH。向Na2S溶液中滴加少量FeCl3 C.用NaHCO 溶液可鉴别P和Q
3
溶液会生成Fe2S3 黑色沉淀,在酸性溶液中Fe2S3 会发生氧化还原反应。以铁为阳极,氢氧化钠溶液为 D.P生成Q的同时还可以得到C H OH和CO 两种含碳产物
2 5 2
2-
电解质溶液,进行电解可制得高铁酸钠(Na2FeO4) 。FeO4 在酸性条件下氧化性很强,遇水产生O2 。
高三化学试卷 第 1 页 共 6 页 高三化学试卷 第 2 页 共 6 页11.用肼(N2H4)的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量CuSO4 ,反应原理如图 二、非选择题:共4题,共61分。
所示。下列说法正确的是 15.(14分)某铅锌矿冶炼废渣中含ZnS、PbSO 、FeS和CuCl等难溶物质,一种分离回收铅的流程如下:
4
A.反应过程中只生成了极性键
B.还原性:Fe 2+ H CO >C H OH 系如图1所示。(NH ) S O 浓度为0mol·L-1时,Zn和Cu的浸出率不为零的原因是________________________。
2 3 6 5 4 2 2 8
13.草酸广泛应用于食品、药品等领域。常温下,通过下列实验探究草酸的性质:
实验1:向 10mL0.2mol·L -1 H2C2O4 溶液中加入一定量0.2mol·L -1 KOH 溶液。
实验2:向 10mL0.2mol·L -1 H2C2O4 溶液中加入10mL0.2mol·L -1 BaCl2 溶液。
25℃时,已知H2C2O4 的Ka1=10 -1.2 ,Ka2=10 -3.8 ,Ksp (BaC2O4 )=10 -7.6,混合后溶液体积变化
忽略不计。下列说法正确的是
A.实验 1,当加入10mLKOH 溶液时:2c(H2C2O4)+c(H+)>2c(C2O 4 2 - )+c(OH - ) 图1 图2
B.实验1,当溶液中c(H2C2O4)=c(C2O
4
2 - )时,pH=2.5
⑤ “氧化浸出”时,控制其他条件和时间一定,测得各元素的浸出率与起始溶液中NH ·H O的浓
3 2
C.KHC2O4 溶液中:2HC2O 4 - = C2O4 2- +H2C2O4 的平衡常数K=10 2.6 度的关系如图2所示。NH ·H O浓度为1mol·L-1时,所得含铁滤渣的成分为____________。
3 2
D.实验2 的上层清液中存在:c(H + )=c(Cl - )+c(OH - ) (2)“浸铅”时,用酒石酸钠溶液对含PbSO 的滤渣进行浸泡,浸泡时发生反应:PbSO +L2- PbL
4 4
14.CO2 催化加氢制甲醇发生的反应有:
+SO2- 。实验测得铅的浸出率随溶液pH升高先增大后减小,其原因是___________________________。
4
i .CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH1 =-49.5kJ·moL -1 16. (15分)有机物H可通过如下路线合成得到:
ii .CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+40.9kJ·mol -1
iii .CO(g)+2H2(g)=CH3OH(g) ΔH3= -90.4 kJ·mol -1
将CO 和H 按n(CO ):n(H )=1:3通入密闭容器中发生反应,测得不同压强下CO 的平衡转化率
2 2 2 2 2
以及相同压强下CH3OH 、CO 选择性[CH3OH 选择性= n(生成CH 3 OH) ×100%]
n(x消耗CO )
2
随温度的变化如图所示。下列说法正确的是
A.CH3OH 的选择性曲线为b
B.P1 、P2 、P3 由大到小的顺序为P3>P2>P1
(1)有机物D中含氧官能团的名称为______________。
C.P1 、P2 、P3 三条曲线接近重合的原因是催化剂失去活性
D→E的转化中N(C H ) 的作用是____________________________________________。
2 5 3
D.相同压强下,从0℃到350℃,H2O(g)的平衡产率先降低后逐渐增大
高三化学试卷 第 3 页 共 6 页 高三化学试卷 第 4 页 共 6 页(2) C→D的反应分为C→X→D两步,C→X为加成反应,所得产物与D互为同分异构体,则第一步 (4) 花生油碘值的测定过程为称取0.25g花生油于碘量瓶中,加入异己烷,搅拌,再向其中加入25
所得产物的结构简式为____________。 mL 0.05mol·L-1ICl的乙酸溶液,反应后向其中加入足量KI溶液(与过量ICl反应:ICl+KI===KCl+I ),
2
(3) 写出满足下列条件的H的一种同分异构体的结构简式:________________。 用0.02mol·L-1Na S O 溶液滴定(I +2Na S O ===2NaI+Na S O ),终点时消耗Na S O 溶液体积为
2 2 3 2 2 2 3 2 4 6 2 2 3
含两个苯环,酸性条件下能发生水解反应,水解后得到两种产物,两种产物均含有4种不同环境 25.00mL。
的氢原子,其中一种所有碳原子的轨道杂化方式均相同。 ① 实验中加入20mL异己烷的作用为__________________________________。
② 判断滴定到达终点的现象为_______________________________________。
(4) 已知:① ③ 该花生油的碘值为________。
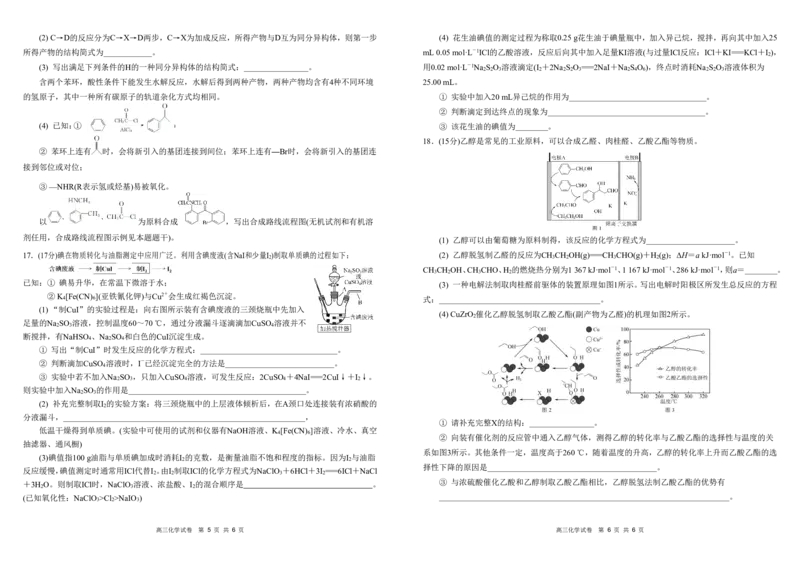
18.(15分)乙醇是常见的工业原料,可以合成乙醛、肉桂醛、乙酸乙酯等物质。
② 苯环上连有 时,会将新引入的基团连接到间位;苯环上连有—Br时,会将新引入的基团连
接到邻位或对位;
③—NHR(R表示氢或烃基)易被氧化。
以 为原料合成 ,写出合成路线流程图(无机试剂和有机溶
剂任用,合成路线流程图示例见本题题干)。
(1) 乙醇可以由葡萄糖为原料制得,该反应的化学方程式为______________________。
17.(17分)碘在物质转化与油脂测定中应用广泛。利用含碘废液(含NaI和少量I )制取单质碘的过程如下: (2) 乙醇脱氢制乙醛的反应为CH CH OH(g)===CH CHO(g)+H (g);ΔH=akJ·mol-1。已知
2 3 2 3 2
CH CH OH、CH CHO、H 的燃烧热分别为1367kJ·mol-1、1167kJ·mol-1、286kJ·mol-1,则a=________。
3 2 3 2
已知:① 碘易升华,在常温下微溶于水; (3) 一种电解法制取肉桂醛前驱体的装置原理如图1所示。写出电解时阳极区所发生总反应的方程
②K 4 [Fe(CN) 6 ](亚铁氰化钾)与Cu2+会生成红褐色沉淀。 式:________________________________________。
(1) “制CuI”的实验过程是:向右图所示装有含碘废液的三颈烧瓶中先加入
(4) CuZrO 催化乙醇脱氢制取乙酸乙酯(副产物为乙醛)的机理如图2所示。
2
足量的Na SO 溶液,控制温度60~70℃,通过分液漏斗逐滴滴加CuSO 溶液并不
2 3 4
断搅拌,有NaHSO 、Na SO 和白色的CuI沉淀生成。
4 2 4
① 写出“制CuI”时发生反应的化学方程式:__________________________________。
② 判断滴加CuSO 溶液时,I-已经沉淀完全的方法是___________________________。
4
③ 实验中若不加入Na SO ,只加入CuSO 溶液,可发生反应:2CuSO +4NaI===2CuI↓+I ↓。
2 3 4 4 2
则实验中加入Na SO 的作用是____________________________________________。
2 3
(2) 补充完整制取I 的实验方案:将三颈烧瓶中的上层液体倾析后,在A颈口处连接装有浓硝酸的
2
分液漏斗,____________________________________________________________,
① 请补充完整X的结构:________________。
低温干燥得到单质碘。(实验中可使用的试剂和仪器有NaOH溶液、K [Fe(CN) ]溶液、冷水、真空
4 6
② 向装有催化剂的反应管中通入乙醇气体,测得乙醇的转化率与乙酸乙酯的选择性与温度的关
抽滤器、通风橱)
系如图3所示。其他条件一定,温度高于260℃,随着温度的升高,乙醇的转化率上升而乙酸乙酯的选
(3)碘值指100g油脂与单质碘加成时消耗I 的克数,是衡量油脂不饱和程度的指标。因为I 与油脂
2 2
择性下降的原因是__________________________________________。
反应缓慢,碘值测定时通常用ICl代替I 。由I 制取ICl的化学方程式为NaClO +6HCl+3I ===6ICl+NaCl
2 2 3 2
③ 与浓硫酸催化乙酸和乙醇制取乙酸乙酯相比,乙醇脱氢法制乙酸乙酯的优势有
+3H O。则制取ICl时,NaClO 溶液、浓盐酸、I 的混合顺序是 。
2 3 2
(已知氧化性:NaClO >Cl >NaIO ) ________________________________________________________________________。
3 2 3
高三化学试卷 第 5 页 共 6 页 高三化学试卷 第 6 页 共 6 页