文档内容
专题 15 物质结构与性质综合题
考点 命题趋势
在当前的旧高考中,"物质结构与性质"属于选择性考试内容,以综合性客观题形式出
现,随着新课程的落实,"物质结构与性质"已成为选择性必修课程,将成为新高考的
必考内容,在新高考中,部分卷区不再设置"物质结构与性质"综合题,而是将其考查
分散到选择题和其他综合题当中。纵观近年来高考真题,物质结构与性质综合题基本
考点1 物质结构 上考的都是最基本、最典型、最主干的知识点。以下是高考时时常考的知识点:原子
与性质综合题 结构与元素的性质方面,如原子电子排布式,元素原子的性质;化学键与物质的性质
方面,如杂化轨道类型,分子(离子)空间构型;分子间作用力与物质的性质方面;如
晶胞判断与计算。试题均建构在以教材为主的中学化学基础知识之上,没有偏离教材
体系和考试说明的要求, 试题基本保持稳定。试卷并不能把所有的知识面全部覆盖,
也不能保证重要知识点可能反复出现。
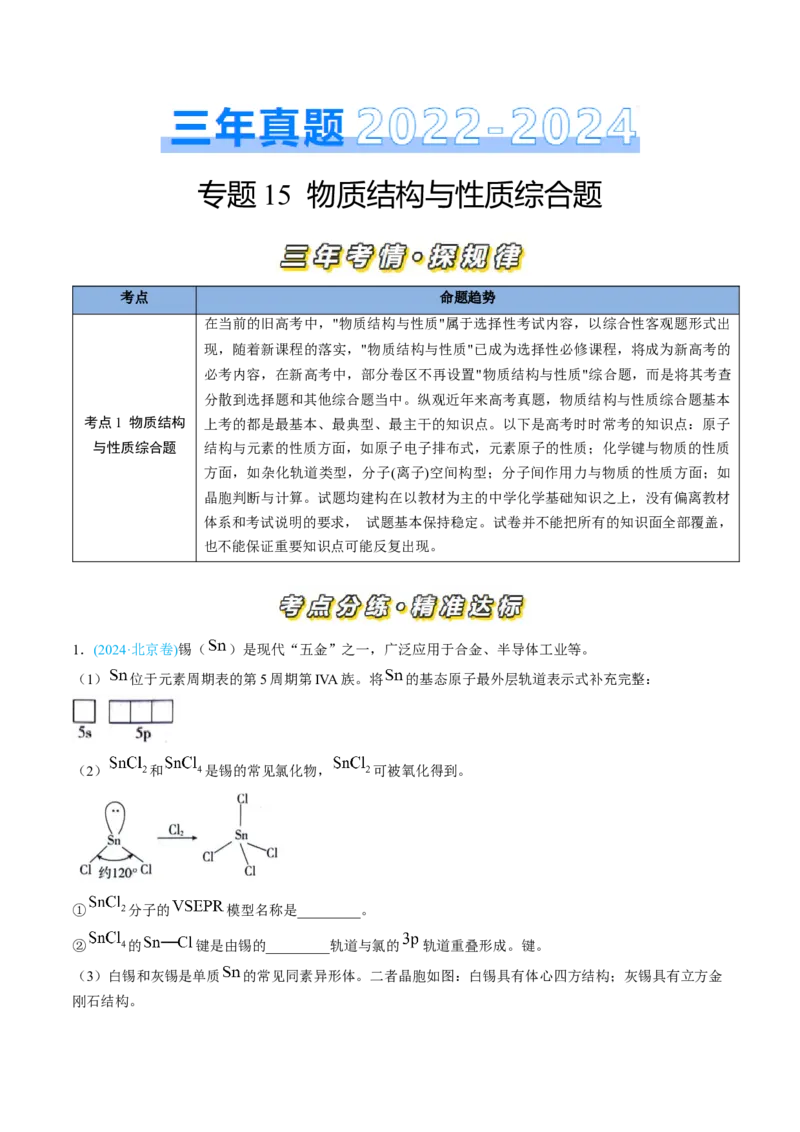
1.(2024·北京卷)锡( )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1) 位于元素周期表的第5周期第IVA族。将 的基态原子最外层轨道表示式补充完整:
(2) 和 是锡的常见氯化物, 可被氧化得到。
① 分子的 模型名称是_________。
② 的 键是由锡的_________轨道与氯的 轨道重叠形成。键。
(3)白锡和灰锡是单质 的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金
刚石结构。①灰锡中每个 原子周围与它最近且距离相等的 原子有_________个。
②若白锡和灰锡的晶胞体积分别为 和 ,则白锡和灰锡晶体的密度之比是_________。
(4)单质 的制备:将 与焦炭充分混合后,于惰性气氛中加热至 ,由于固体之间反应慢,
未明显发生反应。若通入空气在 下, 能迅速被还原为单质 ,通入空气的作用是
_________________________________________________________________________________。
【答案】
(1)
(2)①平面三角形 ② 杂化
(3)①4 ②
(4)与焦炭在高温下反应生成 , 将 还原为单质
【解析】
(1) 加位于元素周期表的第5周期ⅣA族,其基态原子的价电子排布式为 ,所以其轨道表示
式为 。
(2)① 中 的价层电子对数为 , 模型是平面三角形,② 中 的价层电子
对数为 ,有4个 键,所以 采用 杂化方式,则 的 键是由锡的 杂化轨道与
氯的 轨道重叠形成 键。
(3)①灰锡具有立方金刚石结构,所以每个 原子周围与它最近且距离相等的 原子有4个,②白锡
晶胞中均雄可得 原子数目为2,而灰锡晶胞中均摊可得 原子数目为8,所以其密度之比为
。
2. (2024·浙江卷6月)氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图1, 的配位数(紧邻的阳离子数)为_______;写出该化合物的化学式_______,
写出该化合物与足量 溶液反应的化学方程式_______。(2)下列有关单核微粒的描述正确的是_______。
A. 的基态原子电子排布方式只有一种
B. 的第二电离能 的第一电离能
C. 的基态原子简化电子排布式为
D. 原子变成 ,优先失去 轨道上 的电子
(3)化合物 和 的结构如图2。
① 和 中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序_______,
请说明理由_______。
②已知 、 钠盐的碱性 ,请从结构角度说明理由_______。
【答案】(1) ①. 12 ②. KClO ③. KClO+2NHCl+H O=3KCl+2NH ∙HO (2)AB
3 3 4 2 3 2
(3) ①. HC>HB>HA ②. O、S、Se的电负性逐渐减小,键的极性:C=O>C=S>C=Se,使得
HA、HB、HC中羟基的极性逐渐增大,其中羟基与HO形成的氢键逐渐增强 ③. S的原子半径大于O
2
的原子半径,S—H键的键能小于O—H键,同时HC可形成分子间氢键,使得HD比HC更易电离出H+,
酸性HD>HC,C-的水解能力大于D-
【解析】
【小问1详解】
由晶胞结构知,Cl位于8个顶点,O位于体心,K位于面心,1个晶胞中含Cl:8× =1个、含O:1个、
含K:6× =3个,该化合物 化学式为KClO;由图可知,Cl-的配位数为 =12;该化合物可看成
的3
KCl∙KO,故该化合物与足量NH Cl溶液反应生成KCl和NH ∙HO,反应的化学方程式为
2 4 3 2
KClO+2NHCl+H O=3KCl+2NH ∙HO。
3 4 2 3 2
【小问2详解】
A.根据原子核外电子排布规律,基态Ar原子的电子排布方式只有1s22s22p63s23p6一种,A项正确;
B.Na的第二电离能指气态基态Na+失去一个电子转化为气态基态正离子所需的最低能量,Na+和Ne具有
相同的电子层结构,Na+的核电荷数大于Ne,Na+的原子核对外层电子的引力大于Ne的,故Na的第二电
离能>Ne的第一电离能,B项正确;
C.Ge的原子序数为32,基态Ge原子的简化电子排布式为[Ar]3d104s24p2,C项错误;D.基态Fe原子的价电子排布式为3d64s2,Fe原子变成Fe+,优先失去4s轨道上的电子,D项错误;
答案选AB。
【小问3详解】
①O、S、Se的电负性逐渐减小,键的极性:C=O>C=S>C=Se,使得HA、HB、HC中羟基的极性逐渐增
大,从而其中羟基与水形成的氢键由强到弱的顺序为HC>HB>HA;
②HC、HD钠盐的碱性NaC>NaD,说明酸性HC<HD,原因是:S的原子半径大于O的原子半径,S—H
键的键能小于O—H键,同时HC可形成分子间氢键,使得HD比HC更易电离出H+,酸性HD>HC,C-的
水解能力大于D-,钠盐的碱性NaC>NaD。
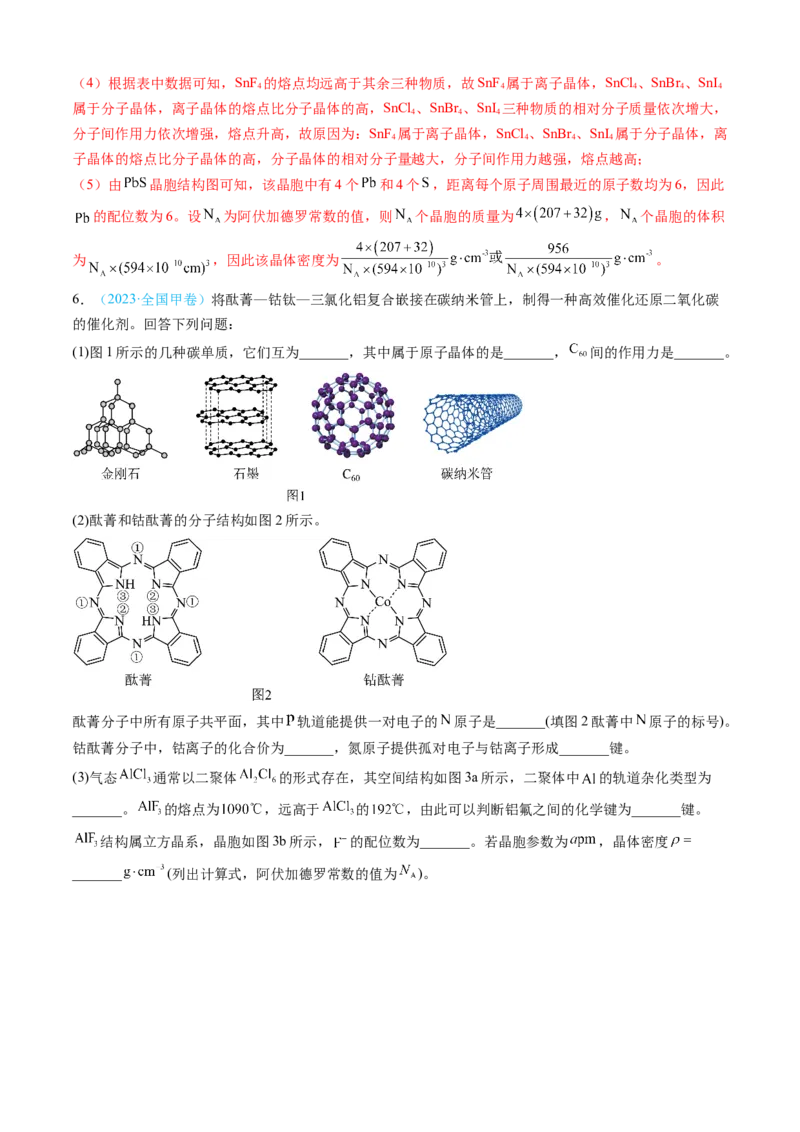
3. (2024·山东卷)锰氧化物具有较大应用价值,回答下列问题:
(1) 在元素周期表中位于第_______周期_______族;同周期中,基态原子未成对电子数比 多的
元素是_______(填元素符号)。
(2) 如某种氧化物 的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为_______。
当 晶体有O原子脱出时,出现O空位, 的化合价_______(填“升高”“降低”或“不变”),O
空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是_______(填标号)。
A. B. C. D.
(3) (见图)是 晶型转变的诱导剂。 的空间构型为_______; 中咪唑环
存在 大 键,则N原子采取的轨道杂化方式为_______。
(4) 可作 转化为 的催化剂(见下图)。 的熔点远大于 ,除相对分子质量
存在差异外,另一重要原因是_______。
【答案】(1) ①. 四 ②. ⅦB ③. Cr
(2) ①. MnO ②. 降低 ③. A
2
(3) ①. 正四面体形 ②. sp2
(4)FDCA形成的分子间氢键更多
【解析】【小问1详解】
Mn的原子序数为25,位于元素周期表第四周期ⅦB族;基态Mn的电子排布式为: ,未成对
电子数有5个,同周期中,基态原子未成对电子数比Mn多的元素是Cr,基态Cr的电子排布式为
,有6个未成对电子;
【小问2详解】
由均摊法得,晶胞中Mn的数目为 ,O的数目为 ,即该氧化物的化学式为
MnO ; 晶体有O原子脱出时,出现O空位,即x减小, 的化合价为+2x,即Mn的化合价降低;
2
CaO中Ca的化合价为+2价、VO 中V的化合价为+5价、Fe O 中Fe的化合价为+3、CuO中Cu的化合价
2 5 2 3
为+2,其中CaO中Ca的化合价下降只能为0,其余可下降得到比0大的价态,说明CaO不能通过这种方
式获得半导体性质;
【小问3详解】
中B形成4个σ键(其中有1个配位键),为sp3杂化,空间构型为正四面体形;咪唑环存在 大
键,N原子形成3个σ键,杂化方式为sp2;
【小问4详解】
由HMF和FDCA的结构可知,HMF和FDCA均能形成分子间氢键,但FDCA形成的分子间氢键更多,使
得FDCA的熔点远大于HMF。
4. (2024·浙江卷1月)氮和氧是构建化合物的常见元素。
已知:
请回答:
(1)某化合物的晶胞如图,其化学式是_______,晶体类型是_______。
(2)下列说法正确的是_______。
A. 电负性:B>N>O B. 离子半径:P3-”、“<”或“=”),请说明理由_______。
②将 与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。
比较氧化性强弱: _______ (填“>”、“<”或“=”);写出A中阴离子的结构式_______。
【答案】(1) ①. ②. 分子晶体 (2)CD
(3) ①. sp3 ②. < ③. 有孤电子对,孤电子对对成键电子排斥力大,键角变小 ④.
> ⑤.
【解析】
【小问1详解】
由晶胞图可知,化学式为 ;由晶胞图可知构成晶胞的粒子为 分子,故为分子
晶体;
【小问2详解】
A同一周期,从左到右,电负性依次增强,故顺序为 ,A错误;
B核外电子排布相同,核电荷数越大,半径越小,故顺序为 ,B错误;
C同一周期,从左到右,电离能增大的趋势,VA族和ⅥA族相反,故顺序为 ,C正确;
D基态 的简化电子排布式: ,Cr2+的简化电子排布式为[Ar]3d4,D正确;
故选CD;
【小问3详解】
① 的价层电子对数 ,故杂化方式为sp3; 价层电子对数为4,有一对孤电子对,
价层电子对数 ,无孤对电子,又因为孤电子对对成键电子的排斥力大于成键电子
对成键电子的排斥力,故键角 中的 < 中的 ;
②将 与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 ,
则A为NO HS O, 为硝酸失去一个OH-,得电子能力更强,氧化性更强,故氧化性强弱: >
2 2 7
;阴离子为 根据已知可知其结构式为 。
5. (2024·全国甲卷)ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为_____,在与其他元素形成化合物时,呈现的最高化合价为_____。(2) 俗称电石,该化合物中不存在的化学键类型为_____(填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是____,硅原子的杂化轨道类型为
_____。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:_____。
物质
熔点/ 442 29 143
(5)结晶型 可作为放射性探测器元件材料,其立方晶胞如图所示。其中 配的位数为_____。设
为阿伏加德罗常数的值,则该晶体密度为_____ (列出计算式)。
11.(1) 2 +4
(2)bd
(3) C
(4)SnF 属于离子晶体,SnCl 、SnBr 、SnI 属于分子晶体,离子晶体的熔点比分子晶体的高,分子晶体的
4 4 4 4
相对分子量越大,分子间作用力越强,熔点越高
(5) 6
【详解】(1)ⅣA族元素基态原子的价层电子排布为 ,其核外未成对电子数为2,因最外层电子数
均为4,所以在与其他元素形成化合物时,呈现的最高化合价为+4;
(2) 俗称电石,其为离子化合物,由 和 构成,两种离子间存在离子键, 中两个C原子
之间存在非极性共价键,因此,该化合物中不存在的化学键类型为极性共价键和配位键,故选bd;
(3)
一种光刻胶薄膜成分为聚甲基硅烷 ,含C、Si、H三种元素,其电负性大小:C>H>Si,则电负性最
大的元素是C,硅原子与周围的4个原子形成共价键,没有孤电子对,价层电子对数为4,则硅原子的杂
化轨道类型为 ;(4)根据表中数据可知,SnF 的熔点均远高于其余三种物质,故SnF 属于离子晶体,SnCl 、SnBr 、SnI
4 4 4 4 4
属于分子晶体,离子晶体的熔点比分子晶体的高,SnCl 、SnBr 、SnI 三种物质的相对分子质量依次增大,
4 4 4
分子间作用力依次增强,熔点升高,故原因为:SnF 属于离子晶体,SnCl 、SnBr 、SnI 属于分子晶体,离
4 4 4 4
子晶体的熔点比分子晶体的高,分子晶体的相对分子量越大,分子间作用力越强,熔点越高;
(5)由 晶胞结构图可知,该晶胞中有4个 和4个 ,距离每个原子周围最近的原子数均为6,因此
的配位数为6。设 为阿伏加德罗常数的值,则 个晶胞的质量为 , 个晶胞的体积
为 ,因此该晶体密度为 。
6.(2023·全国甲卷)将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳
的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为_______,其中属于原子晶体的是_______, 间的作用力是_______。
(2)酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中 轨道能提供一对电子的 原子是_______(填图2酞菁中 原子的标号)。
钴酞菁分子中,钴离子的化合价为_______,氮原子提供孤对电子与钴离子形成_______键。
(3)气态 通常以二聚体 的形式存在,其空间结构如图3a所示,二聚体中 的轨道杂化类型为
_______。 的熔点为 ,远高于 的 ,由此可以判断铝氟之间的化学键为_______键。
结构属立方晶系,晶胞如图3b所示, 的配位数为_______。若晶胞参数为 ,晶体密度
_______ (列出计算式,阿伏加德罗常数的值为 )。【答案】(1)同素异形体 金刚石 范德华力
(2)③ +2 配位
(3) 离子 2
【详解】(1)同一元素形成的不同单质之间互为同素异形体。图1所示的几种碳单质,它们的组成元素均
为碳元素,因此,它们互为同素异形体;其中金刚石属于原子晶体,石墨属于混合型晶体, 属于分子
晶体,碳纳米管不属于原子晶体; 间的作用力是范德华力;
(2)已知酞菁分子中所有原子共平面,则其分子中所有的C原子和所有的N原子均为 杂化,且分子中
存在大π键,其中标号为①和②的N原子均有一对电子占据了一个 杂化轨道,其p轨道只能提供1个电
子参与形成大π键,标号为③的N原子的 p轨道能提供一对电子参与形成大π键,因此标号为③的N原子
形成的N—H键易断裂从而电离出 ;钴酞菁分子中,失去了2个 的酞菁离子与钴离子通过配位键结
合成分子,因此,钴离子的化合价为+2,氮原子提供孤对电子与钴离子形成配位键。
(3)由 的空间结构结合相关元素的原子结构可知,Al原子价层电子对数是4,其与其周围的4个氯
原子形成四面体结构,因此,二聚体中A1的轨道杂化类型为 。AlF 的熔点为1090℃,远高于AlCl 的
3 3
192℃,由于F的电负性最大,其吸引电子的能力最强,因此,可以判断铝氟之间的化学键为离子键。由
AlF 的晶胞结构可知,其中含灰色球的个数为 ,红色球的个数为 ,则灰色的球为 ,距
3
最近且等距的 有2个,则 的配位数为2。若晶胞参数为a pm,则晶胞的体积为
,晶胞的质量为 ,则其晶体密度 。
7.(2023·全国乙卷)中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(
)。回答下列问题:
(1)基态 原子的价电子排布式为_______。橄榄石中,各元素电负性大小顺序为_______,铁的化合价为
_______。
(2)已知一些物质的熔点数据如下表:
物质 熔点/℃800.7
与 均为第三周期元素, 熔点明显高于 ,原因是_______。分析同族元素的氯化物 、
、 熔点变化趋势及其原因_______。 的空间结构为_______,其中 的轨道杂化形式为
_______。
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,
晶胞中含有_______个 。该物质化学式为_______,B-B最近距离为_______。
【答案】(1) O>Si>Fe>Mg +2
(2)钠的电负性小于硅,氯化钠为离子晶体,而 为分子晶体 随着同族元素的电子层数的增多,其
熔点依次升高,其原因是: 、 、 均形成分子晶体,分子晶体的熔点由分子间作用力决定,
分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大 正四面体
(3) 1
【详解】(1) 为26号元素,基态 原子的价电子排布式为 。元素的金属性越强,其电负性越小,
元素的非金属性越强则其电负性越大,因此,橄榄石( )中,各元素电负性大小顺序为O>Si>
Fe>Mg;因为 中 、 、 的化合价分别为+2、+4和-2,x+2-x=2,根据化合物中各元素
的化合价的代数和为0,可以确定铁的化合价为+2。
(2) 与 均为第三周期元素, 熔点明显高于 ,原因是:钠的电负性小于硅,氯化钠为离子
晶体,其熔点较高;而 为分子晶体,其熔点较低。由表中的数据可知, 、 、 熔点
变化趋势为:随着同族元素的电子层数的增多,其熔点依次升高,其原因是: 、 、 均形
成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质
量增大,其分子间作用力依次增大。 的空间结构为正四面体,其中 的价层电子对数为4,因此 的
轨道杂化形式为 。(3)由硼镁化合物的晶体结构可知 位于正六棱柱的顶点和面心,由均摊法可以求出正六棱柱中含有
个 ,由晶胞沿c轴的投影图可知本题所给晶体结构包含三个晶胞,则晶胞中Mg的个数
为1;晶体结构中 在正六棱柱体内共6个,则该物质的化学式为 ;由晶胞沿c轴的投影图可知,B
原子在图中两个正三角形的重心,该点到顶点的距离是该点到对边中点距离的2倍,顶点到对边的垂线长
度为 ,因此B-B最近距离为 。
8.(2023·山东卷)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1) 时, 与冰反应生成 利 。常温常压下, 为无色气休,固态 的晶体类型为
_____, 水解反应的产物为_____(填化学式)。
(2) 中心原子为 , 中心原子为 ,二者均为 形结构,但 中存在大 键 。 中
原子的轨道杂化方式_____;为 键角_____ 键角(填“>”“ <”或“=”)。比较 与
中 键的键长并说明原因_____。
(3)一定条件下, 和 反应生成 和化合物 。已知 属于四方晶系,晶胞结构如图所示(晶胞
参数 ),其中 化合价为 。上述反应的化学方程式为_____。若阿伏加德罗常数
的值为 ,化合物 的密度 _____ (用含 的代数式表示)。
【答案】(1) 分子晶体 HF 、 和
(2) > 分子中 键的键长小于 中 键的键长,其原因是: 分子中既存
在σ键,又存在大 键,原子轨道重叠的程度较大,因此其中 键的键长较小,而 只存在普通的
σ键。
(3)
【详解】(1)常温常压下, 为无色气体,则 的沸点较低,因此,固态HOF的晶体类型为分子
晶体。 分子中F显-1价,其水解时结合 电离的 生成HF,则 结合 电离的 ,两者
反应生成 , 不稳定,其分解生成 ,因此, 水解反应的产物为HF 、 和 。
(2) 中心原子为 , 中心原子为 ,二者均为V形结构,但 中存在大 键( )。由中存在 可以推断,其中 原子只能提供1对电子,有一个 原子提供1个电子,另一个 原子提供1对
电子,这5个电子处于互相平行的 轨道中形成大 键, 提供孤电子对与其中一个 形成配位键,与另
一个 形成的是普通的共价键(σ键,这个 只提供了一个电子参与形成大 键), 的价层电子对数
为3,则 原子的轨道杂化方式为 ; 中心原子为 ,根据价层电子对的计算公式可知
,因此, 的杂化方式为 ;根据价层电子对互斥理论可知, 时,价电子对的几何构
型为正四面体, 时,价电子对的几何构型平面正三角形, 杂化的键角一定大于 的,因此,虽然
和 均为 形结构,但 键角大于 键角,孤电子对对成键电子对的排斥作用也
改变不了这个结论。 分子中 键的键长小于 中 键的键长,其原因是: 分子中既存
在σ键,又存在大 键,原子轨道重叠的程度较大,因此其中 键的键长较小,而 只存在普通的
σ键。
(3)一定条件下, 、 和 反应生成 和化合物X。已知X属于四方晶系,其中Cu化合价为
+2。由晶胞结构图可知,该晶胞中含有黑球的个数为 、白球的个数为 、灰
色球的个数为 ,则X中含有3种元素,其个数比为1:2:4,由于其中Cu化合价为+2、 的化合
价为-1、K的化合价为+1,根据化合价代数和为0,可以推断X为 ,上述反应的化学方程式为
。若阿伏加德罗富数的值为 ,晶胞的质量为 ,晶胞的体积为
,化合物X的密度 。
9.(2023·北京卷)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根 可看作是 中的
一个 原子被 原子取代的产物。
(1)基态 原子价层电子排布式是__________。
(2)比较 原子和 原子的第一电离能大小,从原子结构的角度说明理由:____________________。
(3) 的空间结构是__________。
(4)同位素示踪实验可证实 中两个 原子的化学环境不同,实验过程为
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
和 ,过程ⅱ含硫产物是__________。
(5) 的晶胞形状为长方体,边长分别为 、 ,结构如图所示。晶胞中的 个数为__________。已知 的摩尔质量是 ,阿伏加德罗常数
为 ,该晶体的密度为__________ 。
(6)浸金时, 作为配体可提供孤电子对与 形成 。分别判断 中的中心 原子和
端基 原子能否做配位原子并说明理由:____________________。
【答案】(1)
(2) ,氧原子半径小,原子核对最外层电子的吸引力大,不易失去一个电子
(3)四面体形
(4) 和
(5) 4
(6) 中的中心原子S的价层电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,
能做配位原子
【详解】(1)S是第三周期ⅥA族元素,基态S原子价层电子排布式为 。答案为 ;
(2)S和O为同主族元素,O原子核外有2个电子层,S原子核外有3个电子层,O原子半径小,原子核
对最外层电子的吸引力大,不易失去1个电子,即O的第一电离能大于S的第一电离能。答案为
I(O)>I (S),氧原子半径小,原子核对最外层电子的吸引力大,不易失去一个电子;
1 1
(3) 的中心原子S的价层电子对数为4,无孤电子对,空间构型为四面体形, 可看作是
中1个O原子被S原子取代,则 的空间构型为四面体形。答案为四面体形;
(4)过程Ⅱ中 断裂的只有硫硫键,根据反应机理可知,整个过程中 最终转化为 ,S最终
转化为 。若过程ⅰ所用的试剂为 和 ,过程Ⅱ的含硫产物是 和 。答案为
和 ;
(5)由晶胞结构可知,1个晶胞中含有 个 ,含有4个 ;该晶
体的密度 。答案为4; ;
(6)具有孤电子对的原子就可以给个中心原子提供电子配位。 中的中心原子S的价层电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能做配位原子。
10.(2023年6月·浙江卷)氮的化合物种类繁多,应用广泛。
请回答:
(1)基态N原子的价层电子排布式是 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法不正确的是 。
A.能量最低的激发态N原子的电子排布式:
B.化学键中离子键成分的百分数:
C.最简单的氮烯分子式:
D.氮烷中N原子的杂化方式都是
②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为 。
③给出 的能力: (填“>”或“<”),理由是 。
(3)某含氮化合物晶胞如图,其化学式为 ,每个阴离子团的配位数(紧邻的阳离子数)为
。
【答案】(1)2s22p3
(2) A N H ( ,m为正整数) < 形成配位键后,由于Cu对电子的吸
n n+2−2m
引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂
(3) CaCN 6
2
【详解】(1)N核电荷数为7,核外有7个电子,基态N原子电子排布式为1s22s22p3,则基态N原子的价
层电子排布式是2s22p3;故答案为:2s22p3。
(2)①A.能量最低的激发态N原子应该是2p能级上一个电子跃迁到3s能级,其电子排布式:
,故A错误;B.钙的金属性比镁的金属性强,则化学键中离子键成分的百分数:
,故B正确;C.氮有三个价键,最简单的氮烯即含一个氮氮双键,另一个价键与氢结合,
则其分子式: ,故C正确;D.氮烷中N原子有一对孤对电子,有三个价键,则氮原子的杂化方式都
是 ,故D正确;综上所述,答案为:A。②氮和氢形成的无环氮多烯,一个氮的氮烷为NH ,两个氮的氮烷为NH,三个氮的氮烷为NH,四个氮
3 2 4 3 5
的氮烷为NH,设分子中氮原子数为n,其氮烷分子式通式为NH ,根据又一个氮氮双键,则少2个氢
4 6 n n+2
原子,因此当双键数为m,其分子式通式为NH ( ,m为正整数);故答案为:NH ( ,
n n+2−2m n n+2−2m
m为正整数)。
③ 形成配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,
故其更易断裂,因此给出 的能力: < (填“>”或“<”);故答案为:<; 形成
配位键后,由于Cu对电子的吸引,使得电子云向铜偏移,进一步使氮氢键的极性变大,故其更易断裂。
(3)钙个数为 , 个数为 ,则其化学式为CaCN ;根据六方最密
2
堆积图 ,以上面的面心分析下面红色的有3个,同理上面也应该有3个,本体中分析得
到 ,以这个 进行分析,其俯视图为 ,因此距离最近的钙离
子个数为6,其配位数为6;故答案为:CaCN ;6。
2
11.(2023年1月·浙江卷)硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以 为中心)名称为 ,分子中氮原子的杂化轨道类型是 。
受热分解生成 和 ,其受热不稳定的原因是 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、② 、③ ,有关
这些微粒的叙述,正确的是___________。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。【答案】(1) 四面体 周围的 基团体积较大,受热时斥力较强 中
键能相对较小];产物中气态分子数显著增多(熵增)
(2)AB
(3) 共价晶体
【详解】(1) 分子可视为SiH 分子中的4个氢原子被—NH (氨基)取代形成的,所以
4 2
分子中Si原子轨道的杂化类型是sp3,分子的空间结构(以 为中心)名称为四面体;
氨基(-NH )氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4,N原子轨道的杂化类型是
2
sp3;
周围的 基团体积较大,受热时斥力较强 中 键能相对较小];产物中气态分子数显著
增多(熵增),故 受热不稳定,容易分解生成 和 ;
(2)电子排布式分别为:① 、② 、③ ,可推知分别为基态Si原子、
Si+离子、激发态Si原子;
A.激发态Si原子有四层电子,Si+离子失去了一个电子,根据微粒电子层数及各层电子数多少可推知,微
粒半径:③>①>②,选项A正确;
B.根据上述分析可知,电子排布属于基态原子(或离子)的是:①②,选项B正确;
C.激发态Si原子不稳定,容易失去电子;基态Si原子失去一个电子是硅的第一电离能,Si+离子失去一个
电子是硅的第二电离能,由于I>I ,可以得出电离一个电子所需最低能量:②>①>③,选项C错误;
2 1
D.由C可知②比①更难失电子,则②比①更容易得电子,即得电子能力:②>①,选项D错误;
答案选AB;
(3)Si与P形成的某化合物晶体的晶胞如图可知,原子间通过共价键形成的空间网状结构,形成共价晶
体;根据均摊法可知,一个晶胞中含有 个Si,8个P,故该化合物的化学式为 。
12.(2022·全国甲卷)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实
现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH=CH )与四氟乙烯(CF=CF )的共聚物(ETFE)制
2 2 2 2
成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图
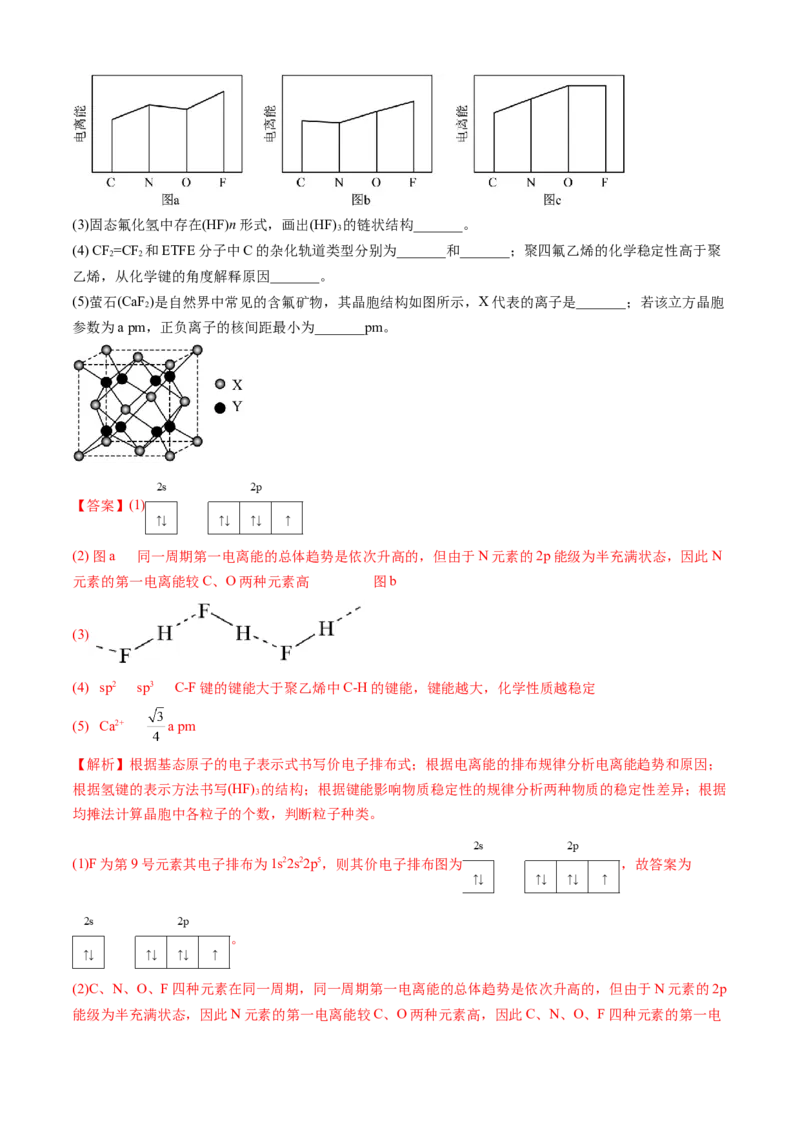
是_______(填标号),判断的根据是_______;第三电离能的变化图是_______(填标号)。(3)固态氟化氢中存在(HF)n形式,画出(HF) 的链状结构_______。
3
(4) CF =CF 和ETFE分子中C的杂化轨道类型分别为_______和_______;聚四氟乙烯的化学稳定性高于聚
2 2
乙烯,从化学键的角度解释原因_______。
(5)萤石(CaF )是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______;若该立方晶胞
2
参数为a pm,正负离子的核间距最小为_______pm。
【答案】(1)
(2) 图a 同一周期第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N
元素的第一电离能较C、O两种元素高 图b
(3)
(4) sp2 sp3 C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定
(5) Ca2+ a pm
【解析】根据基态原子的电子表示式书写价电子排布式;根据电离能的排布规律分析电离能趋势和原因;
根据氢键的表示方法书写(HF) 的结构;根据键能影响物质稳定性的规律分析两种物质的稳定性差异;根据
3
均摊法计算晶胞中各粒子的个数,判断粒子种类。
(1)F为第9号元素其电子排布为1s22s22p5,则其价电子排布图为 ,故答案为
。
(2)C、N、O、F四种元素在同一周期,同一周期第一电离能的总体趋势是依次升高的,但由于N元素的2p
能级为半充满状态,因此N元素的第一电离能较C、O两种元素高,因此C、N、O、F四种元素的第一电离能从小到大的顺序为C一氯乙烯>一氯乙炔 Cl参与形成的大π键越多,形成的C-Cl键的键长
越短
(3) CsCl CsCl为离子晶体,ICl为分子晶体
(4) 电解质
【解析】(1)F的原子序数为9,其基态原子电子排布式为1s22s22p5,
a.1s22s22p43s1,基态氟原子2p能级上的1个电子跃迁到3s能级上,属于氟原子的激发态,a正确;
b.1s22s22p43d2,核外共10个电子,不是氟原子,b错误;
c.1s22s12p5,核外共8个电子,不是氟原子,c错误;
d.1s22s22p33p2,基态氟原子2p能级上的2个电子跃迁到3p能级上,属于氟原子的激发态,d正确;
答案选ad;
而同一原子3p能级的能量比3s能级的能量高,因此能量最高的是1s22s22p33p2,答案选d。
(2)①一氯乙烯的结构式为 ,碳为双键碳,采取sp2杂化,因此C的一个sp2杂化轨道与Cl
的3p 轨道形成C-Clσ键。
x
②C的杂化轨道中s成分越多,形成的C-Cl键越强,C-Cl键的键长越短,一氯乙烷中碳采取sp3杂化,一
氯乙烯中碳采取sp2杂化,一氯乙炔中碳采取sp杂化,sp杂化时p成分少,sp3杂化时p成分多,因此三种
物质中C-Cl键键长顺序为:一氯乙烷>一氯乙烯>一氯乙炔,同时Cl参与形成的大π键越多,形成的C-Cl
键的键长越短,一氯乙烯中Cl的3p 轨道与C的2p 轨道形成3中心4电子的大π键( ),一氯乙炔中Cl
x x
的3p 轨道与C的2p 轨道形成2套3中心4电子的大π键( ),因此三种物质中C-Cl键键长顺序为:一
x x
氯乙烷>一氯乙烯>一氯乙炔。
(3)CsICl 发生非氧化还原反应,各元素化合价不变,生成无色晶体和红棕色液体,则无色晶体为CsCl,红
2
棕色液体为ICl,而CsCl为离子晶体,熔化时,克服的是离子键,ICl为分子晶体,熔化时,克服的是分子
间作用力,因此CsCl的熔点比ICl高。
(4)由题意可知,在电场作用下,Ag+不需要克服太大阻力即可发生迁移,因此α-AgI晶体是优良的离子导
体,在电池中可作为电解质;每个晶胞中含碘离子的个数为8 +1=2个,依据化学式AgI可知,银离子个数也为2个,晶胞的物质的量n= mol= mol,晶胞体积V=a3pm3=(504 10-12)3m3,则α-AgI晶体的
摩尔体积V = = = m3/mol。
m
14.(2022·湖南卷)铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,
回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为 _______;
②该新药分子中有_______种不同化学环境的C原子;
③比较键角大小:气态 分子_______ 离子(填“>”“<”或“=”),原因是_______。
(2)富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中 键与 键的数目比为_______;
②富马酸亚铁中各元素的电负性由大到小的顺序为_______。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将 转化为 ,
反应过程如图所示:
①产物中N原子的杂化轨道类型为_______;
②与 互为等电子体的一种分子为_______(填化学式)。
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:①该超导材料的最简化学式为_______;
②Fe原子的配位数为_______;
③该晶胞参数 、 。阿伏加德罗常数的值为 ,则该晶体的密度为_______ (列出
计算式)。
【答案】(1) [Ar] 3d104s24p4 6 > SeO 的空间构型为平面三角形,SeO 的空间构型为三角锥
3
形
(2) 11:3 O>C>H>Fe
(3) sp3杂化 HO
2
(4) KFe Se 4
2 2
【解析】(1)①硒元素的原子序数为34,基态原子的电子排布式为[Ar] 3d104s24p4;
②由结构简式可知,乙烷硒啉的分子结构对称,分子中含有6种化学环境不同的碳原子;
③三氧化硒分子中硒原子的价层电子对数为3,孤对电子对数为0,分子的空间构型为平面三角形,键角为
120°,亚硒酸根离子中硒原子的价层电子对数为4,孤对电子对数为1,离子的空间构型为三角锥形,键角
小于120°;
(2)①由球棍模型可知,富马酸的结构式为HOOCCH=CHCOOH,分子中的单键为σ键,双键中含有1个σ
键和1个π键,则分子中σ键和π键的数目比为11:3;
②金属元素的电负性小于非金属元素,则铁元素的电负性最小,非金属元素的非金属性越强,电负性越大,
氢碳氧的非金属性依次增强,则电负性依次增大,所以富马酸亚铁中四种元素的电负性由大到小的顺序为
O>C>H>Fe;
(3)①由结构简式可知,产物中氮原子的价层电子对数为4,原子的杂化方式为sp3杂化,故答案为:sp3杂
化;
②水分子和氨基阴离子的原子个数都为3、价电子数都为8,互为等电子体;
(4)①由平面投影图可知,晶胞中位于顶点和体心的钾原子个数为8× +1=2,均位于棱上和面上的铁原子
和硒原子的个数为12× +2× =4,则超导材料最简化学式为KFe Se ;
2 2
②由平面投影图可知,位于棱上的铁原子与位于面上的硒原子的距离最近,所以铁原子的配位数为4;③设晶体的密度为dg/cm3,由晶胞的质量公式可得: =abc×10—21×d,解得d=
。
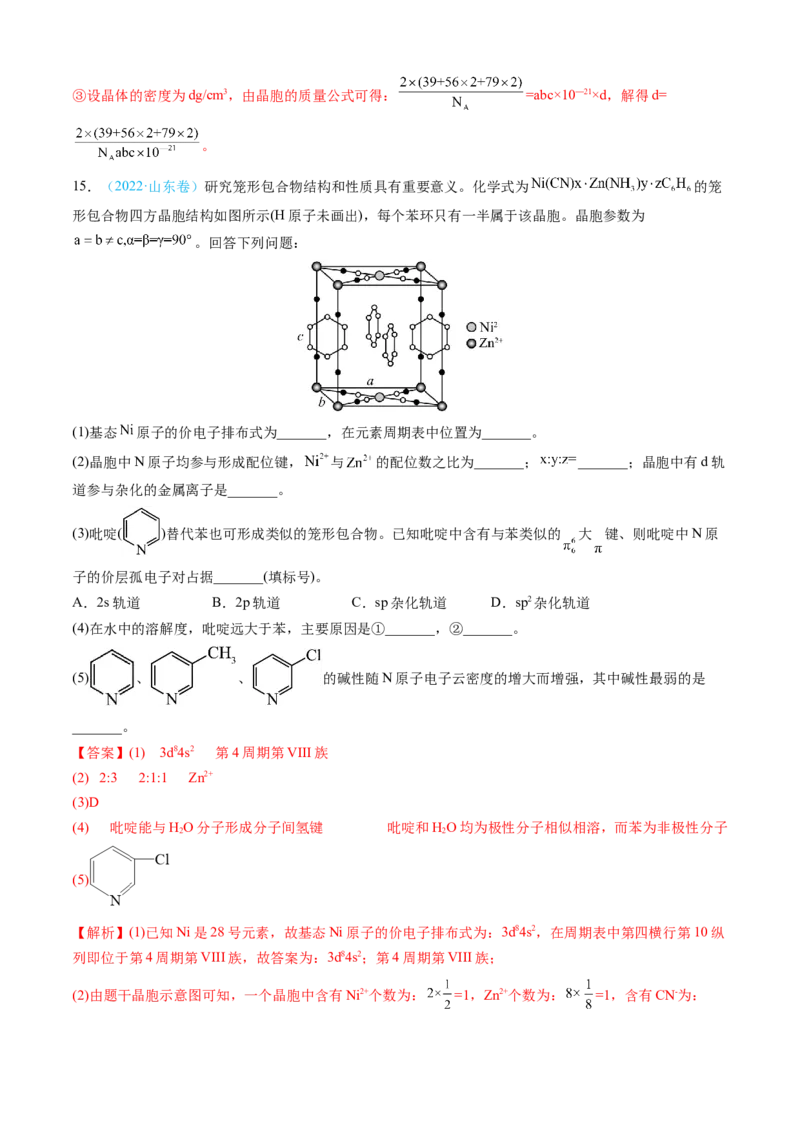
15.(2022·山东卷)研究笼形包合物结构和性质具有重要意义。化学式为 的笼
形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为
。回答下列问题:
(1)基态 原子的价电子排布式为_______,在元素周期表中位置为_______。
(2)晶胞中N原子均参与形成配位键, 与 的配位数之比为_______; _______;晶胞中有d轨
道参与杂化的金属离子是_______。
(3)吡啶( )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的 大 键、则吡啶中N原
子的价层孤电子对占据_______(填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
(4)在水中的溶解度,吡啶远大于苯,主要原因是①_______,②_______。
(5) 、 、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是
_______。
【答案】(1) 3d84s2 第4周期第VIII族
(2) 2:3 2:1:1 Zn2+
(3)D
(4) 吡啶能与HO分子形成分子间氢键 吡啶和HO均为极性分子相似相溶,而苯为非极性分子
2 2
(5)
【解析】(1)已知Ni是28号元素,故基态Ni原子的价电子排布式为:3d84s2,在周期表中第四横行第10纵
列即位于第4周期第VIII族,故答案为:3d84s2;第4周期第VIII族;
(2)由题干晶胞示意图可知,一个晶胞中含有Ni2+个数为: =1,Zn2+个数为: =1,含有CN-为:=4,NH 个数为: =2,苯环个数为: =2,则该晶胞的化学式为: ,
3
且晶胞中每个N原子均参与形成配位键,Ni2+周围形成的配位键数目为:4,Zn2+周围形成的配位键数目为:
6,则 与 的配位数之比,4:6=2:3; 4:2:2=2:1:1;由以上分析可知,Ni2+的配位数为4,则
Ni2+采用sp3杂化,而Zn2+的配位数为6,Zn2+采用sp3d2杂化,即晶胞中有d轨道参与杂化的金属离子是
Zn2+,故答案为:2:3;2:1:1;Zn2+;
(3)吡啶( )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的 大π键,则说明吡啶中
N原子也是采用sp2杂化,杂化轨道只用于形成σ键和存在孤电子对,则吡啶中N原子的价层孤电子对占
据sp2杂化轨道,故答案为:D;
(4)已知苯分子为非极性分子,HO分子为极性分子,且吡啶中N原子上含有孤电子对能与HO分子形成分
2 2
子间氢键,从而导致在水中的溶解度,吡啶远大于苯,故答案为:吡啶能与HO分子形成分子间氢键;吡
2
啶和HO均为极性分子相似相溶,而苯为非极性分子;
2
(5)已知-CH 为推电子基团,-Cl是吸电子基团,则导致N原子电子云密度大小顺序为: >
3
> ,结合题干信息可知,其中碱性最弱的为: ,故答案为:
。
16.(2022·北京卷) 失水后可转为 ,与 可联合制备铁粉精 和 。
I. 结构如图所示。
(1) 价层电子排布式为___________。
(2)比较 和 分子中的键角大小并给出相应解释:___________。
(3) 与 和 的作用分别为___________。
II. 晶胞为立方体,边长为 ,如图所示。(4)①与 紧邻的阴离子个数为___________。
②晶胞的密度为 ___________ 。
(5)以 为燃料,配合 可以制备铁粉精 和 。结合图示解释可充分实现能源和
资源有效利用的原因为___________。
【答案】(1)3d6
(2)SO 的键角大于HO,SO 中S原子的价层电子对数为4、孤对电子对数为0,离子的空间构型为正四
2
面体形,HO分子中O原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形
2
(3)配位键、氢键
(4) 6 ×1021
(5)由图可知,FeS 与O 生成Fe O 的反应为放热反应,FeSO ·H O分解生成Fe O 的反应为吸热反应,放
2 2 x y 4 2 x y
热反应放出的热量有利于吸热反应的进行,有利于反应生成的SO 与HO反应生成HSO
3 2 2 4
【解析】(1)铁元素的原子序数为26,基态亚铁离子的价电子排布式为3d6,故答案为:3d6;
(2)硫酸根离子中硫原子的价层电子对数为4、孤对电子对数为0,离子的空间构型为正四面体形,水分子
中氧原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形,所以硫酸根离子的键角大于
水分子,故答案为:SO 的键角大于HO,SO 中S原子的价层电子对数为4、孤对电子对数为0,离子
2
的空间构型为正四面体形,HO分子中O原子的价层电子对数为4、孤对电子对数为2,分子的空间构型
2
为V形;
(3)由图可知,具有空轨道的亚铁离子与水分子中具有孤对电子的氧原子形成配位键,硫酸根离子与水分子
间形成氢键,故答案为:配位键;氢键;
(4)①由晶胞结构可知,晶胞中位于顶点的亚铁离子与位于棱上的阴离子S 离子间的距离最近,则亚铁离
子紧邻的阴离子个数为6,故答案为:6;
②由晶胞结构可知,晶胞中位于顶点和面心的亚铁离子个数为8× +6× =4,位于棱上和体心的S 离子个数为12× +1=4,设晶体的密度为dg/cm3,由晶胞的质量公式可得: ==10—21a3d,解得d=
×1021,故答案为: ×1021;
(5)由图可知,FeS 与O 生成Fe O 的反应为放热反应,FeSO ·H O分解生成Fe O 的反应为吸热反应,放
2 2 x y 4 2 x y
热反应放出的热量有利于吸热反应的进行,有利于反应生成的SO 与HO反应生成HSO ,所以以FeS 为
3 2 2 4 2
燃料,配合FeSO ·H O可以制备铁粉精和HSO 可充分实现能源和资源有效利用,故答案为:由图可知,
4 2 2 4
FeS 与O 生成Fe O 的反应为放热反应,FeSO ·H O分解生成Fe O 的反应为吸热反应,放热反应放出的热
2 2 x y 4 2 x y
量有利于吸热反应的进行,有利于反应生成的SO 与HO反应生成HSO 。
3 2 2 4
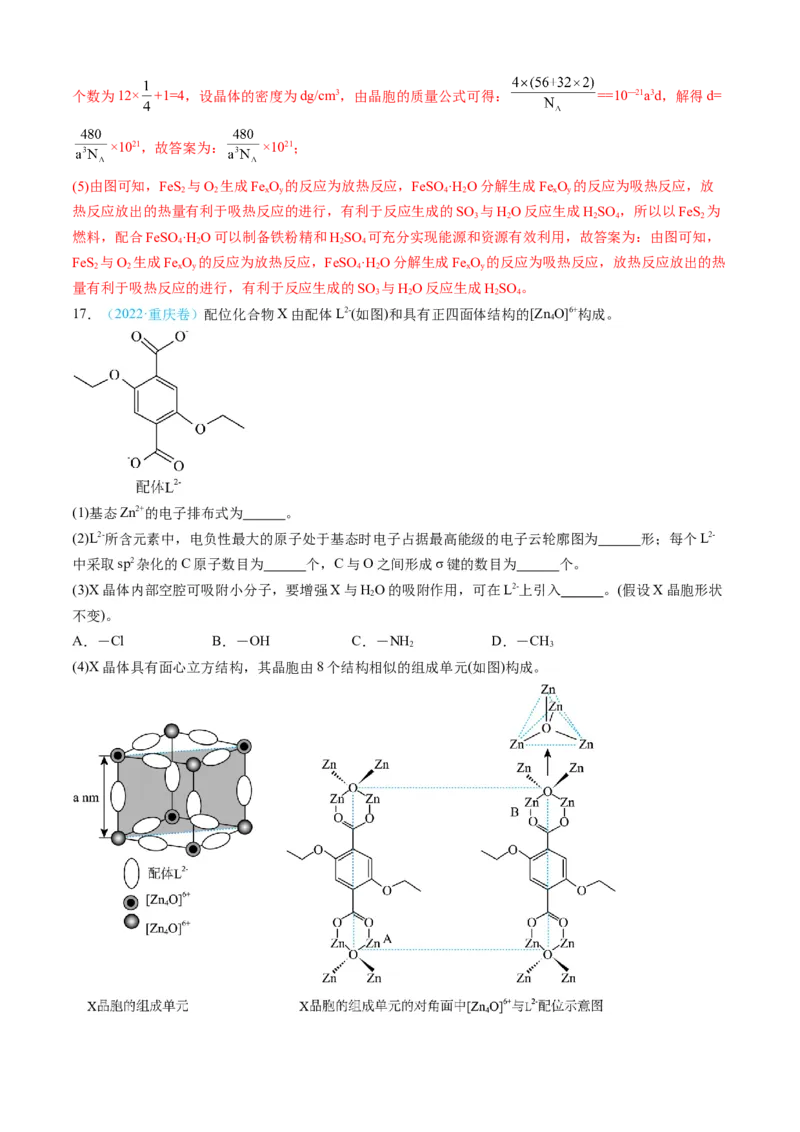
17.(2022·重庆卷)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn O]6+构成。
4
(1)基态Zn2+的电子排布式为 。
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为 形;每个L2-
中采取sp2杂化的C原子数目为 个,C与O之间形成σ键的数目为 个。
(3)X晶体内部空腔可吸附小分子,要增强X与HO的吸附作用,可在L2-上引入 。(假设X晶胞形状
2
不变)。
A.-Cl B.-OH C.-NH D.-CH
2 3
(4)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。①晶胞中与同一配体相连的两个[Zn O]6+的不同之处在于 。
4
②X晶体中Zn2+的配位数为 。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为 nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为N ,L2-与[Zn O]6+的相对分子质量分别为M 和M,则X
A 4 1 2
的晶体密度为 g•cm-3(列出化简的计算式)。
【答案】(1)3d10
(2) 哑铃形 8 8
(3)BC
(4) 与Zn2+相连的双键氧原子不在对称轴的同侧 4 a—2d
【详解】(1)锌元素的原子序数为30,基态锌离子的价电子排布式为3d10,故答案为:3d10;
(2)配体L2-所含元素中氧元素的电负性最大,氧原子处于基态时,电子云轮廓图为哑铃形的2p能级的电
子占据最高能级;由结构简式可知,配体中苯环碳原子和双键碳原子杂化方式为sp2杂化,共有8个;配体
中碳原子与氧原子之间的单键为σ键、双键中含有1个σ键,共有8个,故答案为:哑铃形;8;8;
(3)若在L2-上引入能与水分子形成氢键的羟基和氨基,有利于增强X与水分子的吸附作用,若在L2-上引
入不能与水分子形成氢键的氯原子、甲基,不能增强X与水分子的吸附作用,故选BC;
(4)①由X晶胞的组成单元的对角面可知,晶胞中与同一配体相连的两个[Zn O]6+的不同之处在于与
4
Zn2+相连的双键氧原子不在对称轴的同侧,故答案为:与Zn2+相连的双键氧原子不在对称轴的同侧;
②1个[Zn O]6+上、下、左、右、前、后共有6个L2-,每个L2-与[Zn O]6+形成2个Zn←O配位键,1个
4 4
[Zn O]6+含有4个Zn←O配位键,1个[Zn O]6+中Zn2+形成的配位键数目为6×2+4=16,1个Zn2+的配位数为
4 4
4;
③由X晶胞的组成单元结构可知,[Zn O]6+中两个处于体对角线的氧离子距离、边长和面对角线构成直角
4
三角形,氧离子距离为单元结构的体对角线,设A、B两个锌离子之间的最短距离为xnm,由体对角线的
长度可得:x+2d= ,解得x= a—2d,故答案为: a—2d;
④由X晶胞的组成单元结构可知,单元结构中位于顶点的[Zn O]6+的个数为8× =1,位于棱上的L2-的个数
4
为12× =3,设晶体的密度为dg/cm3,由X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元构
成可得: =(2a×10—7) 3d,解得d= ,故答案为: 。
18.(2022·福建卷)1962年首个稀有气体化合物 问世,目前已知的稀有气体化合物中,含氙( Xe)
54
的最多,氪 ( Kr)次之,氩( Ar)化合物极少。 是 与 分子形成的
36 18
加合物,其晶胞如下图所示。回答下列问题:
(1)基态 原子的价电子排布式为 。
(2) 原子的活泼性依序增强,原因是 。
(3)晶体熔点: (填“>”“<”或“=”),判断依据是 。
(4) 的中心原子 的杂化轨道类型为 。
(5) 加合物中 ,晶体中的微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.极性共价键 d.非极性共价键
【答案】(1)
(2)同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强
(3) < 二者为同构型的分子晶体, 相对分子质量大,范德华力大,熔点高
(4)
(5) 2 bc
【详解】(1) 位于元素周期表中第四周期VA族,原子序数为33,由构造原理写出其价电子排布式为
。
(2)同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐
增强,故 原子的活泼性依序增强。
(3) 和 是同构型的分子晶体, 相对分子质量大,范德华力大,熔点高,晶体熔点: <
。
(4) 的中心原子 的价层电子对数为:3+ =4,杂化轨道类型为 。
(5)由晶胞结构可知,其中含有8个 、4个 、4个 ,则 加合物中
2,晶体中的微粒间作用力有离子键、极性共价键,故选bc。
19.(2022·河北卷)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色
环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为 。(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(3)SnCl 的几何构型为 ,其中心离子杂化方式为 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺
磁性物质的是 (填标号)。
A.[Cu(NH )]Cl B.[Cu(NH )]SO C.[Zn(NH )]SO D.Na[Zn(OH) ]
3 2 3 4 4 3 4 4 2 4
(5)如图是硫的四种含氧酸根的结构:
A. B. C. D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO 的是 (填标号),理由是 。
(6)如图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原
子的坐标为( , , ),则B原子的坐标为 。
【答案】(1)1:2或2:1
(2) Cu Cu的第二电离能失去的是3d10的电子,第一电离能失去的是4s1电子,Zn的第二电离能失
去的是4s1的电子,第一电离能失去的是4s2电子,3d10电子处于全充满状态,其与4s1电子能量差值更大
(3) 三角锥形 sp3杂化
(4)B
(5) D D中含有—1价的O元素,具有强氧化性,能将Mn2+转化为MnO
(6) Cu ZnSnS ( , , )
2 4【详解】(1)基态S的价电子排布是3s23p4,根据基态原子电子排布规则,两种自旋状态的电子数之比为
1:2或2:1,故答案为:1:2或2:1;
(2)铜元素的第二电离能失去的是3d10的电子,第一电离能失去的是4s1电子,锌元素的第二电离能失去
的是4s1的电子,第一电离能失去的是4s2电子,3d10电子处于全充满状态,其与4s1电子能量差值更大,所
以铜与锌相比,第二电离能与第一电离能差值更大的是铜元素,故答案为:Cu;Cu的第二电离能失去的
是3d10的电子,第一电离能失去的是4s1电子,Zn的第二电离能失去的是4s1的电子,第一电离能失去的是
4s2电子,3d10电子处于全充满状态,其与4s1电子能量差值更大;
(3)三氯化锡离子在锡离子的价层电子对数为4、孤对电子对数为1,所以锡离子杂化方式为sp3杂化,离
子的空间构型为三角锥形,故答案为:三角锥形;sp3杂化;
(4)根据题意,具有顺磁性物质含有未成对电子;
A.[Cu(NH )]Cl中亚铜离子外围电子排布是3d10,离子中电子均已成对,该配合物不具有顺磁性,故不符
3 2
合题意;
B.[Cu(NH )]SO 中铜离子外围电子排布是3d9,离子中有未成对电子,该配合物具有顺磁性,故符合题意;
3 4 4
C.[Zn(NH )]SO 中锌离子外围电子排布是3d10,离子中电子均已成对,该配合物不具有顺磁性,故不符
3 4 4
合题意;
D.Na[Zn(OH) ] 中锌离子外围电子排布是3d10,离子中电子均已成对,该配合物不具有顺磁性,故不符
2 4
合题意;
故选B;
(5)由四种含氧酸根的结构式可知,只有过二硫酸根离子中含有过氧链,离子中—1价的氧元素具有强氧
化性,则只有过二硫酸根离子能在酸性溶液中将锰离子氧化为高锰酸根离子,故选D;
(6)①由晶胞结构可知,位于顶点和体心的锌原子个数为8× +1=2,位于面上的铜原子个数为8× =4,
位于面心和棱上的锡原子个数为2× +4× =2,位于体内的硫原子个数为8,则该物质的化学式为
Cu ZnSnS,故答案为:Cu ZnSnS;
2 4 2 4
②若将晶胞先分为上下两个相等的正方体后再将每个正方体继续分为8个相等的小正方体,则B原子位于
上面的正方体分割成的8个小立方体中位于右下后方的小立方体的体心,由A原子的坐标为( , , )
可知,B原子的坐标为( , , ),故答案为:( , , )。
20.(2022·海南卷)以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答
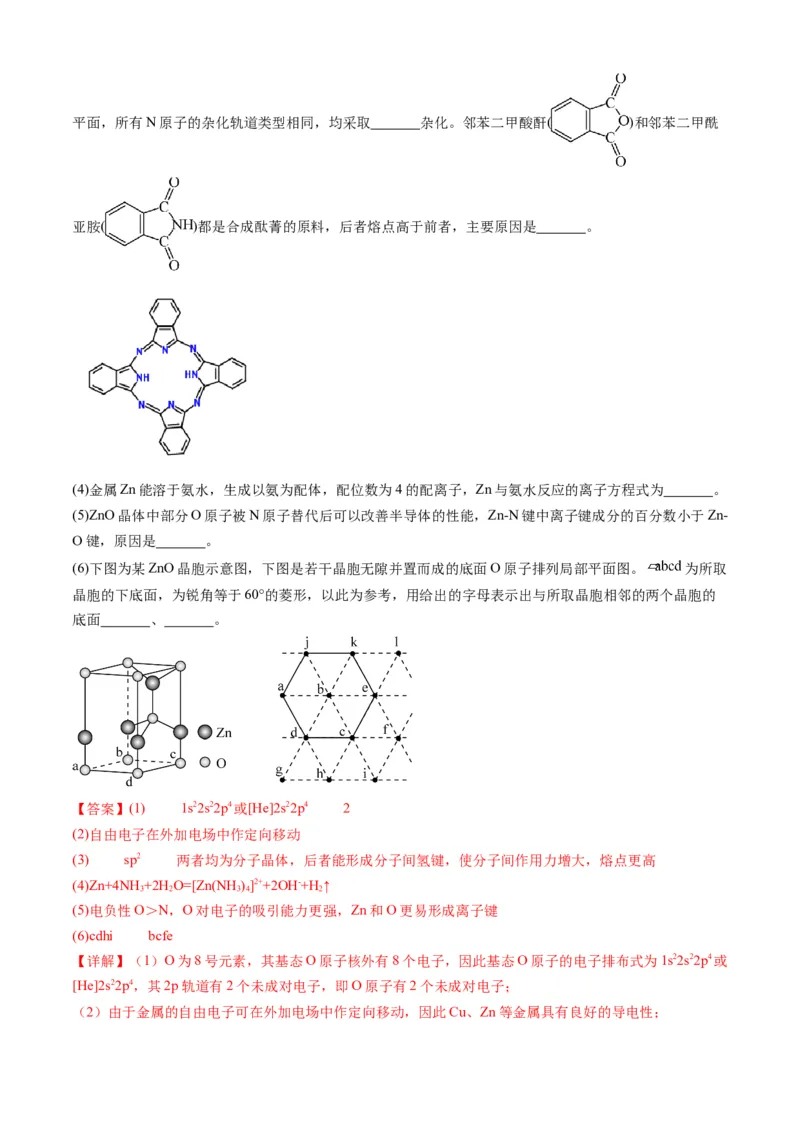
问题:
(1)基态O原子的电子排布式 ,其中未成对电子有 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是 。
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取 杂化。邻苯二甲酸酐( )和邻苯二甲酰
亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-
O键,原因是 。
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取
晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的
底面 、 。
【答案】(1) 1s22s22p4或[He]2s22p4 2
(2)自由电子在外加电场中作定向移动
(3) sp2 两者均为分子晶体,后者能形成分子间氢键,使分子间作用力增大,熔点更高
(4)Zn+4NH+2H O=[Zn(NH )]2++2OH-+H ↑
3 2 3 4 2
(5)电负性O>N,O对电子的吸引能力更强,Zn和O更易形成离子键
(6)cdhi bcfe
【详解】(1)O为8号元素,其基态O原子核外有8个电子,因此基态O原子的电子排布式为1s22s22p4或
[He]2s22p4,其2p轨道有2个未成对电子,即O原子有2个未成对电子;
(2)由于金属的自由电子可在外加电场中作定向移动,因此Cu、Zn等金属具有良好的导电性;(3)根据结构式可知,N原子以双键或以NH三键的形式存在,故N原子的杂化方式均为sp2,由于邻苯
二甲酸酐和邻苯二甲酰亚胺均为分子晶体,而后者能形成分子间氢键,使分子间作用力增大,因此熔点更
高;
(4)金属Zn与氨水反应可生成[Zn(NH )](OH) 和H,反应的离子方程式为Zn+4NH +2H O=[Zn(NH )]2+
3 4 2 2 3 2 3 4
+2OH-+H ↑;
2
(5)由于电负性O>N,O对电子的吸引能力更强,Zn和O更易形成离子键,因此Zn—N键中离子键成
分的百分数小于Zn—O键;
(6)根据晶胞示意图,一个晶胞中8个O原子位于晶胞的顶点,1个O原子位于晶胞体内,4个Zn原子
位于晶胞的棱上,1个Zn原子位于晶胞体内,棱上的3个Zn原子和体内的Zn原子、O原子形成四面体结
构,从底面O原子排列图看,能平移且与abcd共边的只有二个四边形,为cdhi和bcfe。
21.(2022·广东卷)硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我
国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
的新型 分子 的合成路线如下:
(1) 与S同族,基态硒原子价电子排布式为 。
(2) 的沸点低于 ,其原因是 。
(3)关于I~III三种反应物,下列说法正确的有 。
A.I中仅有 键
B.I中的 键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有 。
(5)硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸
钠( )可减轻重金属铊引起的中毒。 的立体构型为 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速
新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿
x、y、z轴方向的投影均为图2。①X的化学式为 。
②设X的最简式的式量为 ,晶体密度为 ,则X中相邻K之间的最短距离为 (列出计
算式, 为阿伏加德罗常数的值)。
【答案】(1)4s24p4
(2)两者都是分子晶体,由于水存在分子间氢键,沸点高
(3)BDE
(4)O、Se
(5) > 正四面体形
(6) K SeBr
2 6
【详解】(1)基态硫原子价电子排布式为3s23p4, 与S同族,Se为第四周期元素,因此基态硒原子价
电子排布式为4s24p4;故答案为:4s24p4。
(2) 的沸点低于 ,其原因是两者都是分子晶体,由于水存在分子间氢键,沸点高;故答案为:
两者都是分子晶体,由于水存在分子间氢键,沸点高。
(3)A.I中有 键,还有大π键,故A错误;B.Se−Se是同种元素,因此I中的 键为非极性共价
键,故B正确;C.烃都是难溶于水,因此II难溶于水,故C错误;D.II中苯环上的碳原子和碳碳双键
上的碳原子杂化类型为sp2,碳碳三键上的碳原子杂化类型为sp,故D正确;E.根据同周期从左到右电负
性逐渐增大,同主族从上到下电负性逐渐减小,因此I~III含有的元素中,O电负性最大,故E正确;综上
所述,答案为:BDE。
(4)根据题中信息IV中O、Se都有孤对电子,碳、氢、硫都没有孤对电子;故答案为:O、Se。
(5)根据非羟基氧越多,酸性越强,因此硒的两种含氧酸的酸性强弱为 > 。 中Se价
层电子对数为 ,其立体构型为正四面体形;故答案为:>;正四面体形。
(6)①根据晶胞结构得到K有8个, 有 ,则X的化学式为KSeBr ;故答案为:
2 6
KSeBr 。
2 6
②设X的最简式的式量为 ,晶体密度为 ,设晶胞参数为anm,得到,解得 ,X中相邻K之间的最短距离为晶胞参数的一半
即 ;故答案为: 。