文档内容
姓名______
准考证号______
绝密★启用前
湘豫名校联考
2023 年 8 月高三秋季入学摸底考试
化学
注意事项:
1.本试卷共 12 页。时间 90 分钟,满分 100 分。答题前,考生先将自己的姓名、准考证号填写
在试卷指定位置,并将姓名、考场号、座位号、准考证号填写在答题卡上,然后认真核对条形
码上的信息,并将条形码粘贴在答题卡上的指定位置。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。作答非选择题时,将答案写在答题卡上对应的答
题区域内。写在本试卷上无效。
3.考试结束后,将试卷和答题卡一并收回。
可能用到的相对原子质量:H 1 He 4 C 12 O 16 Na 23 S 32 Fe 56
一、选择题:本题共 16 小题,每小题 3 分,共 48 分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.人体的健康与安全和环境保护与化学息息相关。下列叙述正确的是( )
A.为了健康和安全禁止使用食品添加剂
B.在燃煤中添加生石灰的主要目的是有效减缓温室效应
C.食用含氯化钾的食盐有助于降低血压
D.发现燃气泄漏,先开电灯再检查管道
2.类比是学习化学的重要方法。下列类比错误的是( )
选项 事实 类比
A 氟元素的电负性大于氯元素 硼元素的电负性大于铝元素
B 干冰升华时破坏了范德华力 碘晶体升华时也只破坏范德华力
C 苯不能使酸性KMnO 溶液褪色 甲苯也不能使酸性KMnO 溶液褪色
4 4
D 用CuO可除去CuCl 溶液中少量FeCl 用MgO也能除去MgCl 溶液中少量AlCl
2 3 2 3
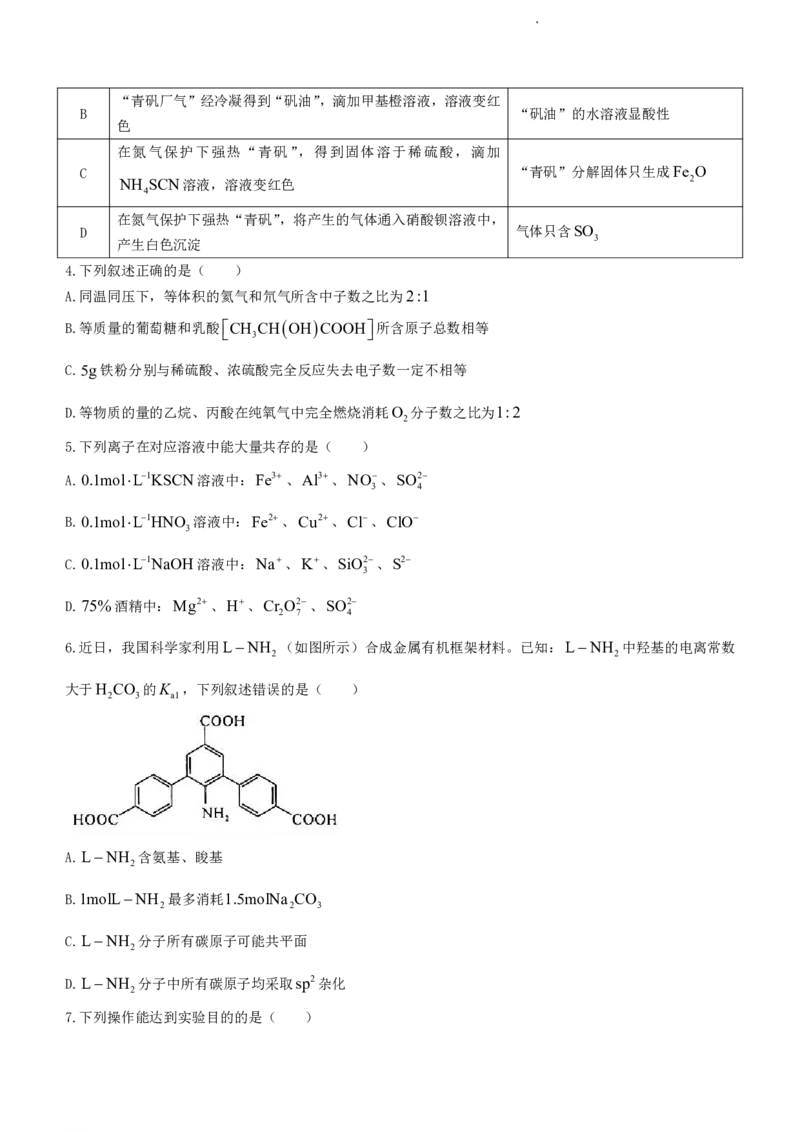
3.绿矾,又名皂矾,始载于唐《新修本草》,原附矾石项下,名青矾。我国早期科技丛书《物理小识・金石类》
(方以智)提到:“青矾厂气熏人,衣服当之易烂,栽木不茂,惟乌桕树不畏其气。”强热“青矾”得固体,
“青矾厂气”可制得“矾油”。下列操作及现象和结论均正确的是( )
选项 操作及现象 结论
A “青矾厂气”通入经盐酸酸化的BaCl 溶液中,产生白色沉淀 “青矾厂气”中含有SO 气体
2 2
学科网(北京)股份有限公司“青矾厂气”经冷凝得到“矾油”,滴加甲基橙溶液,溶液变红
B “矾油”的水溶液显酸性
色
在氮气保护下强热“青矾”,得到固体溶于稀硫酸,滴加
C “青矾”分解固体只生成Fe O
NH SCN溶液,溶液变红色 2
4
在氮气保护下强热“青矾”,将产生的气体通入硝酸钡溶液中,
D 气体只含SO
产生白色沉淀 3
4.下列叙述正确的是( )
A.同温同压下,等体积的氦气和氘气所含中子数之比为2:1
B.等质量的葡萄糖和乳酸CH CH OH COOH所含原子总数相等
3
C.5g铁粉分别与稀硫酸、浓硫酸完全反应失去电子数一定不相等
D.等物质的量的乙烷、丙酸在纯氧气中完全燃烧消耗O 分子数之比为1:2
2
5.下列离子在对应溶液中能大量共存的是( )
A.0.1molL1KSCN溶液中:Fe3、Al3、NO、SO2
3 4
B.0.1molL1HNO 溶液中:Fe2、Cu2、Cl、ClO
3
C.0.1molL1NaOH溶液中:Na、K、SiO2、S2
3
D.75%酒精中:Mg2、H、Cr O2、SO2
2 7 4
6.近日,我国科学家利用LNH (如图所示)合成金属有机框架材料。已知:LNH 中羟基的电离常数
2 2
大于H CO 的K ,下列叙述错误的是( )
2 3 a1
A.LNH 含氨基、睃基
2
B.1molLNH 最多消耗1.5molNa CO
2 2 3
C.LNH 分子所有碳原子可能共平面
2
D.LNH 分子中所有碳原子均采取sp2杂化
2
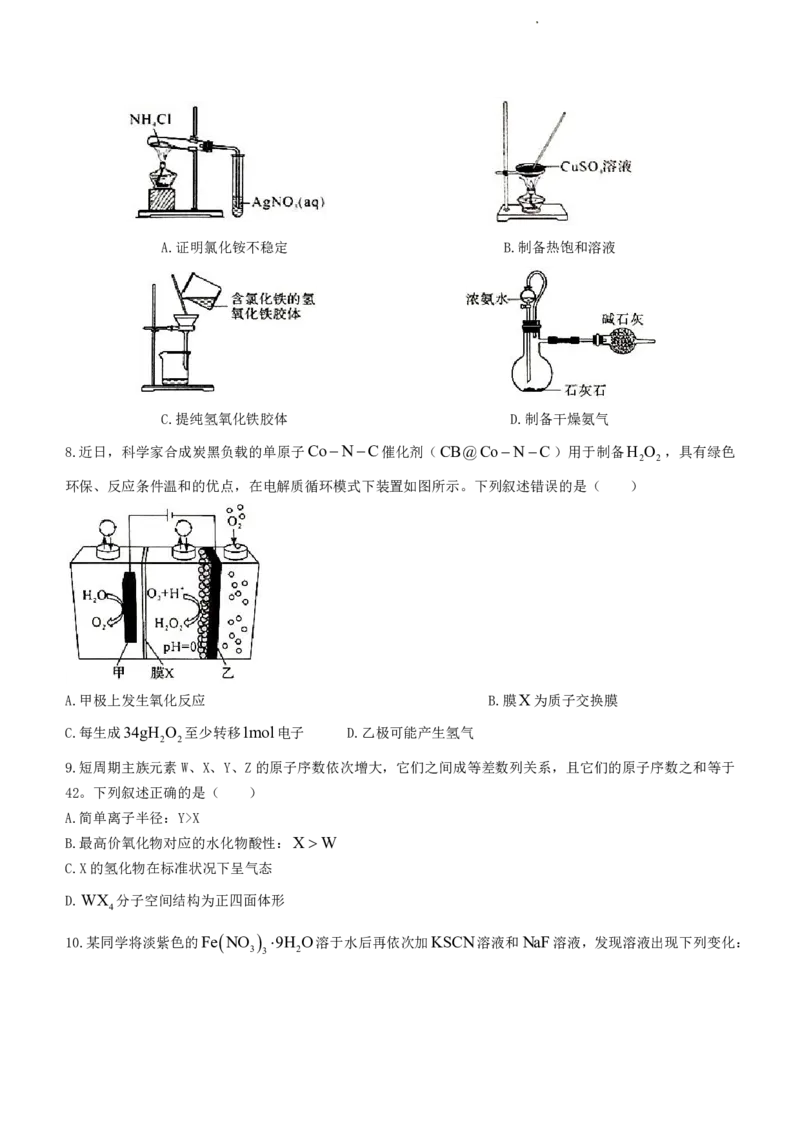
7.下列操作能达到实验目的的是( )
学科网(北京)股份有限公司A.证明氯化铵不稳定 B.制备热饱和溶液
C.提纯氢氧化铁胶体 D.制备干燥氨气
8.近日,科学家合成炭黑负载的单原子CoNC催化剂(CB@CoNC)用于制备H O ,具有绿色
2 2
环保、反应条件温和的优点,在电解质循环模式下装置如图所示。下列叙述错误的是( )
A.甲极上发生氧化反应 B.膜X为质子交换膜
C.每生成34gH O 至少转移1mol电子 D.乙极可能产生氢气
2 2
9.短周期主族元素W、X、Y、Z的原子序数依次增大,它们之间成等差数列关系,且它们的原子序数之和等于
42。下列叙述正确的是( )
A.简单离子半径:Y>X
B.最高价氧化物对应的水化物酸性:XW
C.X的氢化物在标准状况下呈气态
D.WX 分子空间结构为正四面体形
4
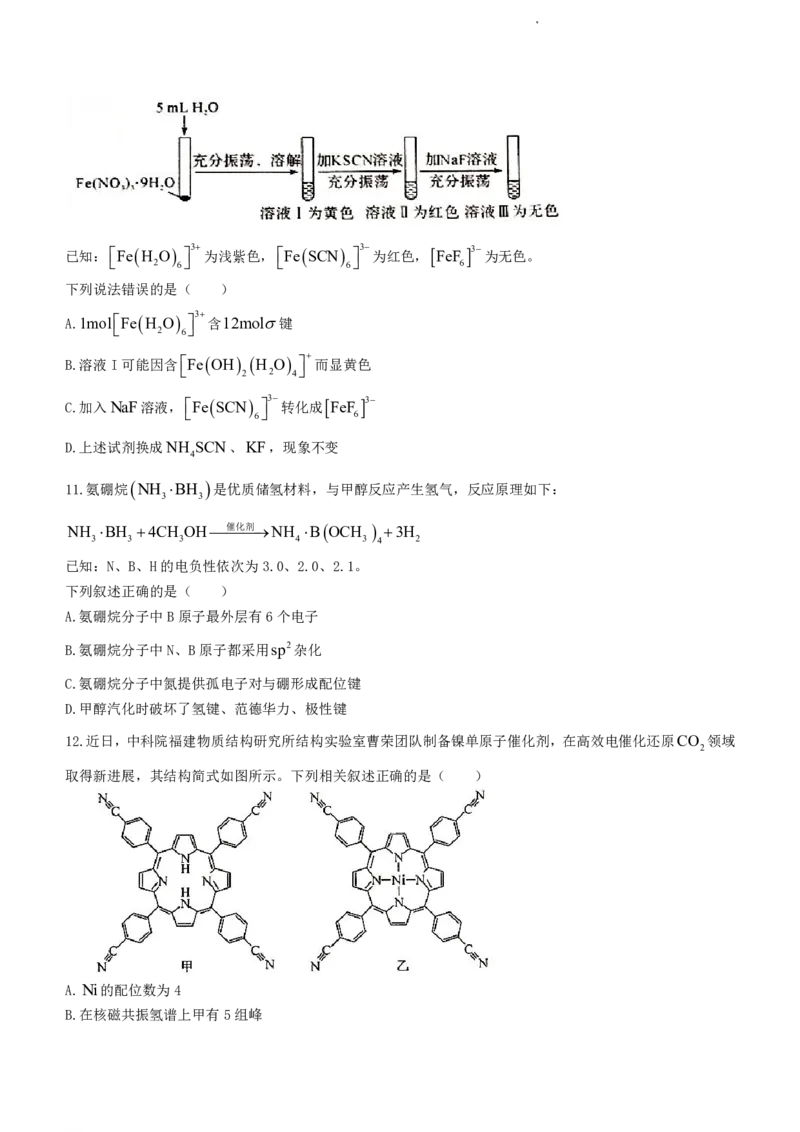
10.某同学将淡紫色的Fe NO 9H O溶于水后再依次加KSCN溶液和NaF溶液,发现溶液出现下列变化:
3 3 2
学科网(北京)股份有限公司已知:Fe H O 3 为浅紫色,Fe SCN 3 为红色, FeF 3 为无色。
2 6 6 6
下列说法错误的是( )
A.1molFe H O 3 含12mol键
2 6
B.溶液I可能因含Fe OH H O 而显黄色
2 2 4
C.加入NaF溶液,Fe SCN 3 转化成 FeF 3
6 6
D.上述试剂换成NH SCN、KF,现象不变
4
11.氨硼烷 NH BH 是优质储氢材料,与甲醇反应产生氢气,反应原理如下:
3 3
NH BH 4CH OH催化剂NH B OCH 3H
3 3 3 4 3 4 2
已知:N、B、H的电负性依次为3.0、2.0、2.1。
下列叙述正确的是( )
A.氨硼烷分子中B原子最外层有6个电子
B.氨硼烷分子中N、B原子都采用sp2杂化
C.氨硼烷分子中氮提供孤电子对与硼形成配位键
D.甲醇汽化时破坏了氢键、范德华力、极性键
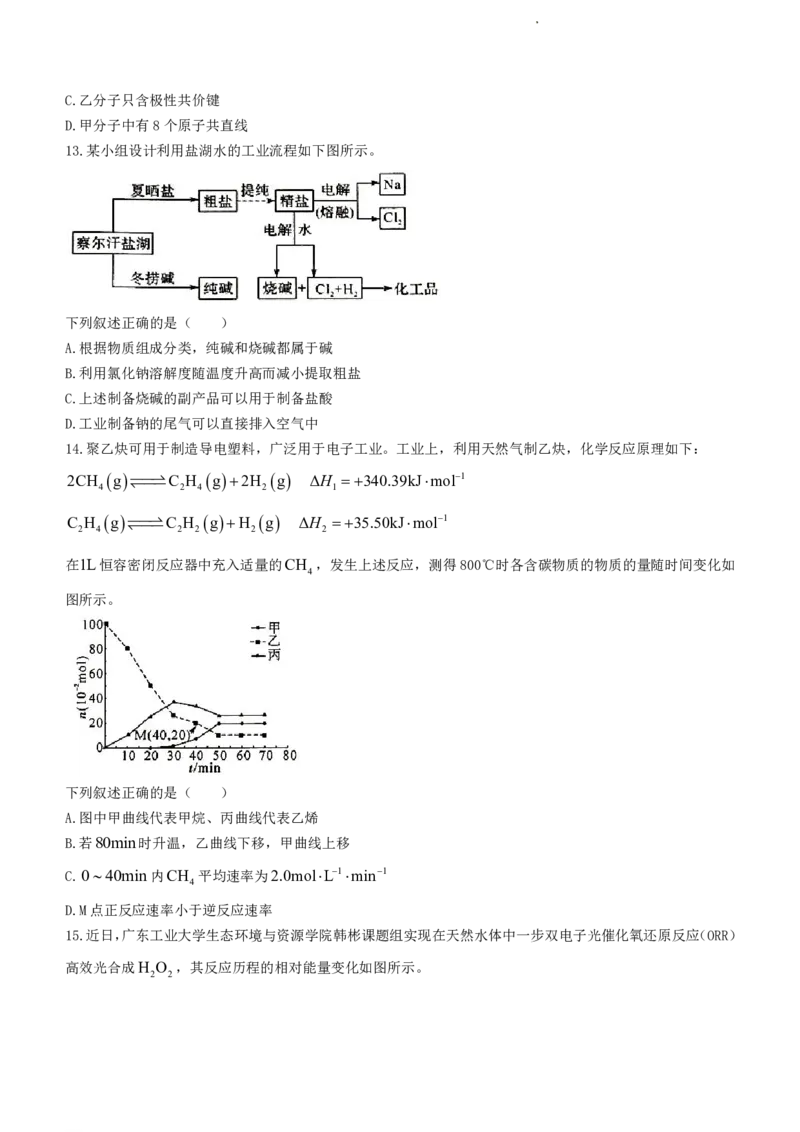
12.近日,中科院福建物质结构研究所结构实验室曹荣团队制备镍单原子催化剂,在高效电催化还原CO 领域
2
取得新进展,其结构简式如图所示。下列相关叙述正确的是( )
A.Ni的配位数为4
B.在核磁共振氢谱上甲有5组峰
学科网(北京)股份有限公司C.乙分子只含极性共价键
D.甲分子中有8个原子共直线
13.某小组设计利用盐湖水的工业流程如下图所示。
下列叙述正确的是( )
A.根据物质组成分类,纯碱和烧碱都属于碱
B.利用氯化钠溶解度随温度升高而减小提取粗盐
C.上述制备烧碱的副产品可以用于制备盐酸
D.工业制备钠的尾气可以直接排入空气中
14.聚乙炔可用于制造导电塑料,广泛用于电子工业。工业上,利用天然气制乙炔,化学反应原理如下:
2CH g C H g 2H g ΔH 340.39kJmol1
4 2 4 2 1
C H g C H g H g ΔH 35.50kJmol1
2 4 2 2 2 2
在1L恒容密闭反应器中充入适量的CH ,发生上述反应,测得800℃时各含碳物质的物质的量随时间变化如
4
图所示。
下列叙述正确的是( )
A.图中甲曲线代表甲烷、丙曲线代表乙烯
B.若80min时升温,乙曲线下移,甲曲线上移
C.040min内CH 平均速率为2.0molL1min1
4
D.M点正反应速率小于逆反应速率
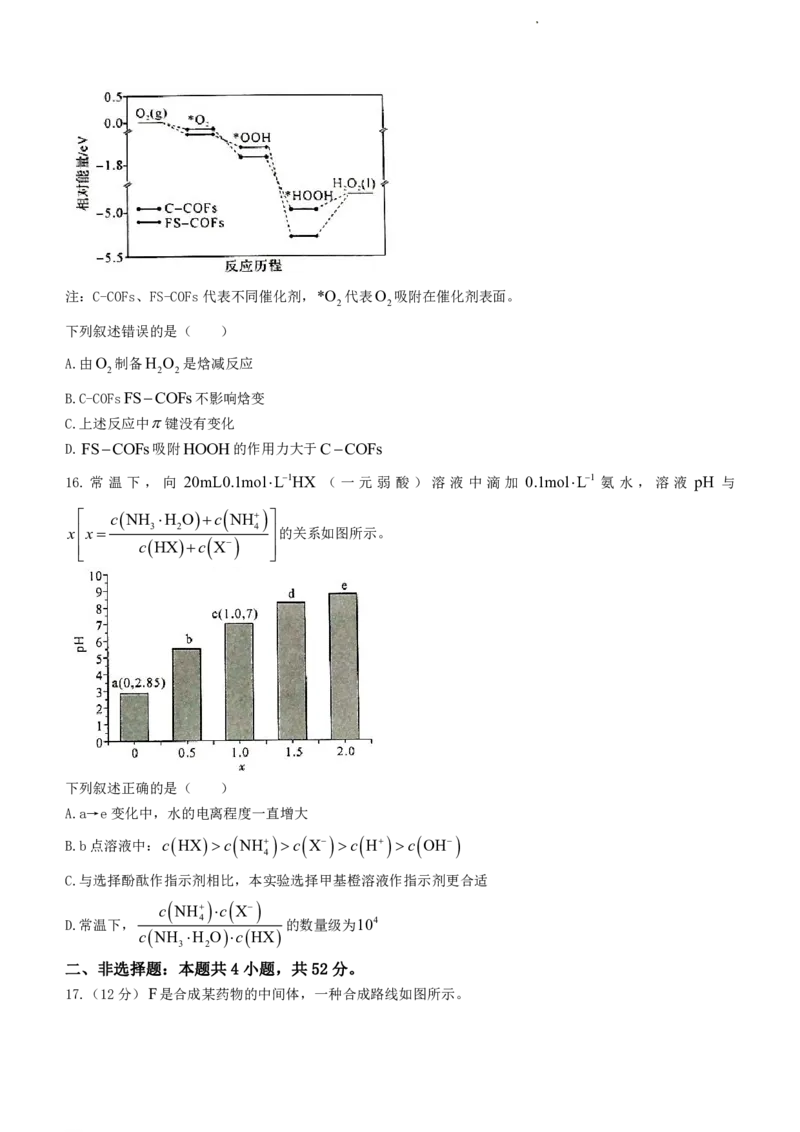
15.近日,广东工业大学生态环境与资源学院韩彬课题组实现在天然水体中一步双电子光催化氧还原反应(ORR)
高效光合成H O ,其反应历程的相对能量变化如图所示。
2 2
学科网(北京)股份有限公司注:C-COFs、FS-COFs代表不同催化剂,*O 代表O 吸附在催化剂表面。
2 2
下列叙述错误的是( )
A.由O 制备H O 是焓减反应
2 2 2
B.C-COFsFSCOFs不影响焓变
C.上述反应中键没有变化
D.FSCOFs吸附HOOH的作用力大于CCOFs
16.常 温 下 , 向 20mL0.1molL1HX ( 一 元 弱 酸 ) 溶 液 中 滴 加 0.1molL1 氨 水 , 溶 液 pH 与
c NH H O c NH
xx 3 2 4 的关系如图所示。
c
HX
c X
下列叙述正确的是( )
A.a→e变化中,水的电离程度一直增大
B.b点溶液中:c HX c NH c X c H c OH
4
C.与选择酚酞作指示剂相比,本实验选择甲基橙溶液作指示剂更合适
c
NH
c
X
D.常温下, 4 的数量级为104
c NH H O c HX
3 2
二、非选择题:本题共4 小题,共 52分。
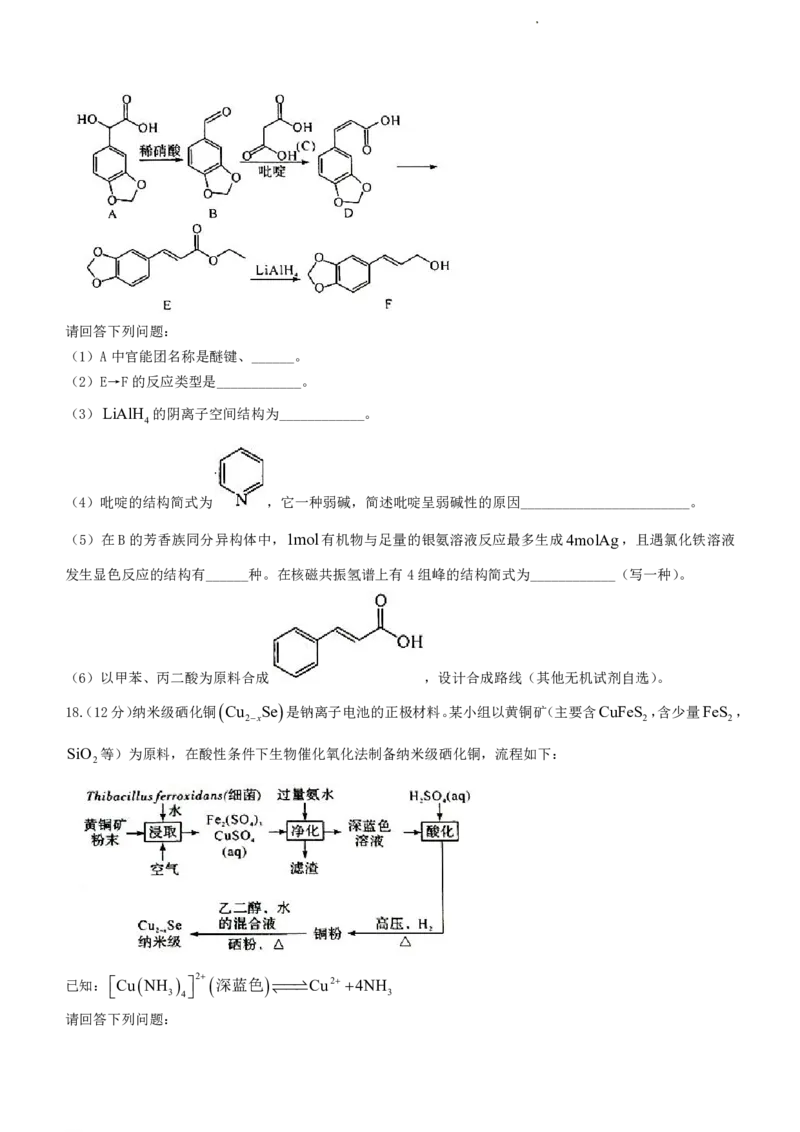
17.(12分)F是合成某药物的中间体,一种合成路线如图所示。
学科网(北京)股份有限公司请回答下列问题:
(1)A中官能团名称是醚键、______。
(2)E→F的反应类型是____________。
(3)LiAlH 的阴离子空间结构为____________。
4
(4)吡啶的结构简式为 ,它一种弱碱,简述吡啶呈弱碱性的原因________________________。
(5)在B的芳香族同分异构体中,1mol有机物与足量的银氨溶液反应最多生成4molAg,且遇氯化铁溶液
发生显色反应的结构有______种。在核磁共振氢谱上有4组峰的结构简式为____________(写一种)。
(6)以甲苯、丙二酸为原料合成 ,设计合成路线(其他无机试剂自选)。
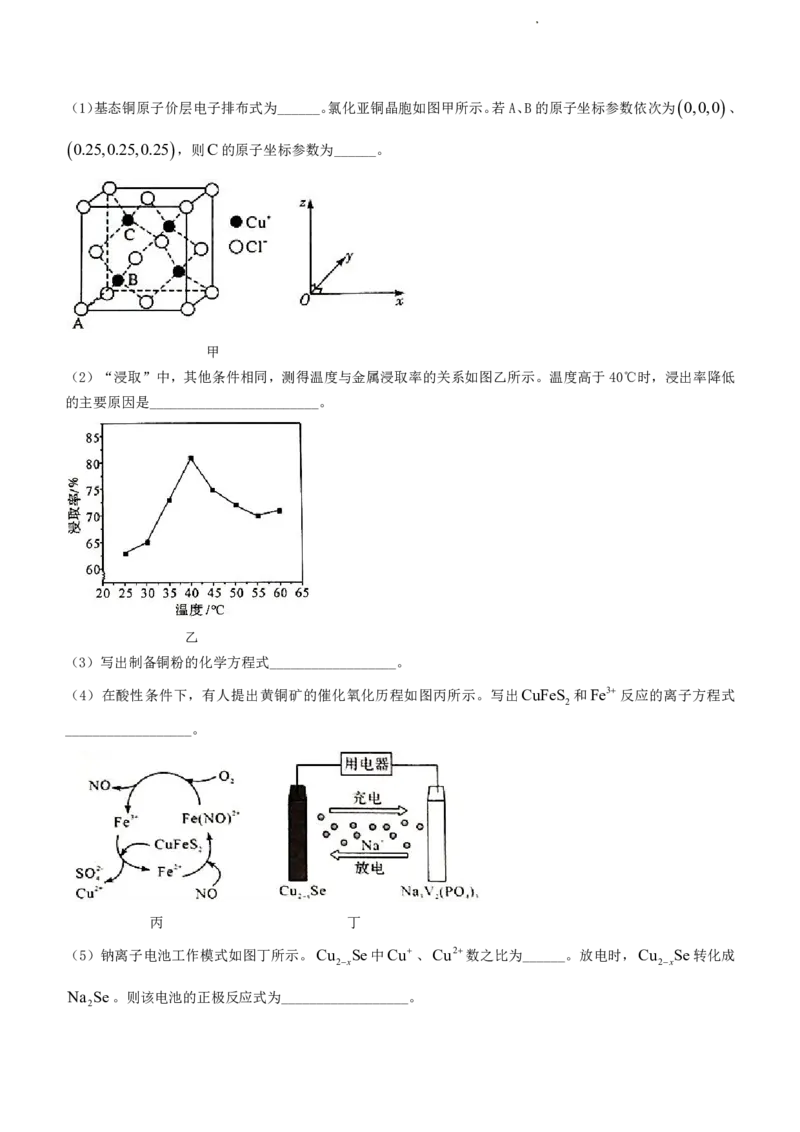
18.(12分)纳米级硒化铜 Cu Se 是钠离子电池的正极材料。某小组以黄铜矿(主要含CuFeS ,含少量FeS ,
2x 2 2
SiO 等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜,流程如下:
2
已知: Cu NH 3 4 2深蓝色 Cu2 4NH 3
请回答下列问题:
学科网(北京)股份有限公司(1)基态铜原子价层电子排布式为______。氯化亚铜晶胞如图甲所示。若A、B的原子坐标参数依次为
0,0,0
、
0.25,0.25,0.25
,则C的原子坐标参数为______。
甲
(2)“浸取”中,其他条件相同,测得温度与金属浸取率的关系如图乙所示。温度高于40℃时,浸出率降低
的主要原因是________________________。
乙
(3)写出制备铜粉的化学方程式__________________。
(4)在酸性条件下,有人提出黄铜矿的催化氧化历程如图丙所示。写出CuFeS 和Fe3 反应的离子方程式
2
__________________。
丙 丁
(5)钠离子电池工作模式如图丁所示。Cu Se中Cu、Cu2数之比为______。放电时,Cu Se转化成
2x 2x
Na Se。则该电池的正极反应式为__________________。
2
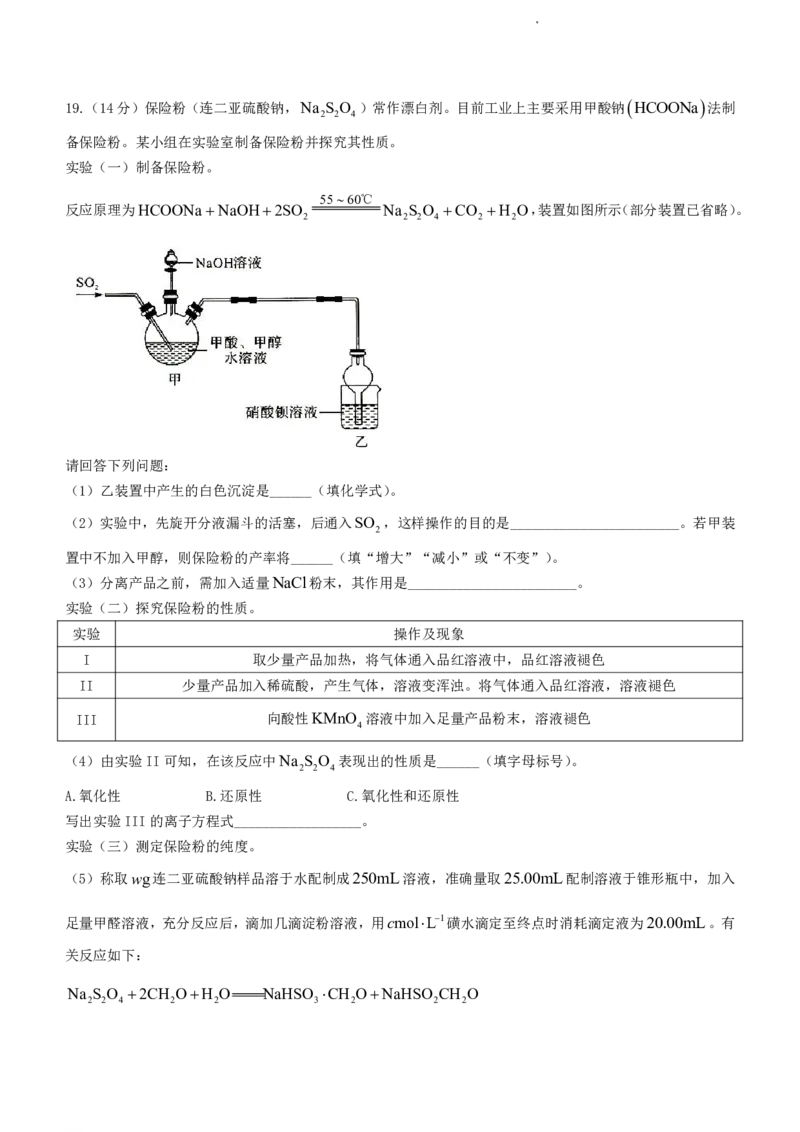
学科网(北京)股份有限公司19.(14分)保险粉(连二亚硫酸钠,Na S O )常作漂白剂。目前工业上主要采用甲酸钠 HCOONa 法制
2 2 4
备保险粉。某小组在实验室制备保险粉并探究其性质。
实验(一)制备保险粉。
5560℃
反应原理为HCOONaNaOH2SO Na S O CO H O,装置如图所示(部分装置已省略)。
2 2 2 4 2 2
请回答下列问题:
(1)乙装置中产生的白色沉淀是______(填化学式)。
(2)实验中,先旋开分液漏斗的活塞,后通入SO ,这样操作的目的是________________________。若甲装
2
置中不加入甲醇,则保险粉的产率将______(填“增大”“减小”或“不变”)。
(3)分离产品之前,需加入适量NaCl粉末,其作用是________________________。
实验(二)探究保险粉的性质。
实验 操作及现象
I 取少量产品加热,将气体通入品红溶液中,品红溶液褪色
II 少量产品加入稀硫酸,产生气体,溶液变浑浊。将气体通入品红溶液,溶液褪色
III 向酸性KMnO 溶液中加入足量产品粉末,溶液褪色
4
(4)由实验II可知,在该反应中Na S O 表现出的性质是______(填字母标号)。
2 2 4
A.氧化性 B.还原性 C.氧化性和还原性
写出实验III的离子方程式__________________。
实验(三)测定保险粉的纯度。
(5)称取wg连二亚硫酸钠样品溶于水配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,加入
足量甲醛溶液,充分反应后,滴加几滴淀粉溶液,用cmolL1磺水滴定至终点时消耗滴定液为20.00mL。有
关反应如下:
Na S O 2CH OH O NaHSO CH ONaHSO CH O
2 2 4 2 2 3 2 2 2
学科网(北京)股份有限公司NaHSO CH O2I 2H O NaHSO 4HICH O
2 2 2 2 4 2
滴定终点的现象是________________________。
该Na S O 样品的纯度为______%(用含字母的式子表示)。
2 2 4
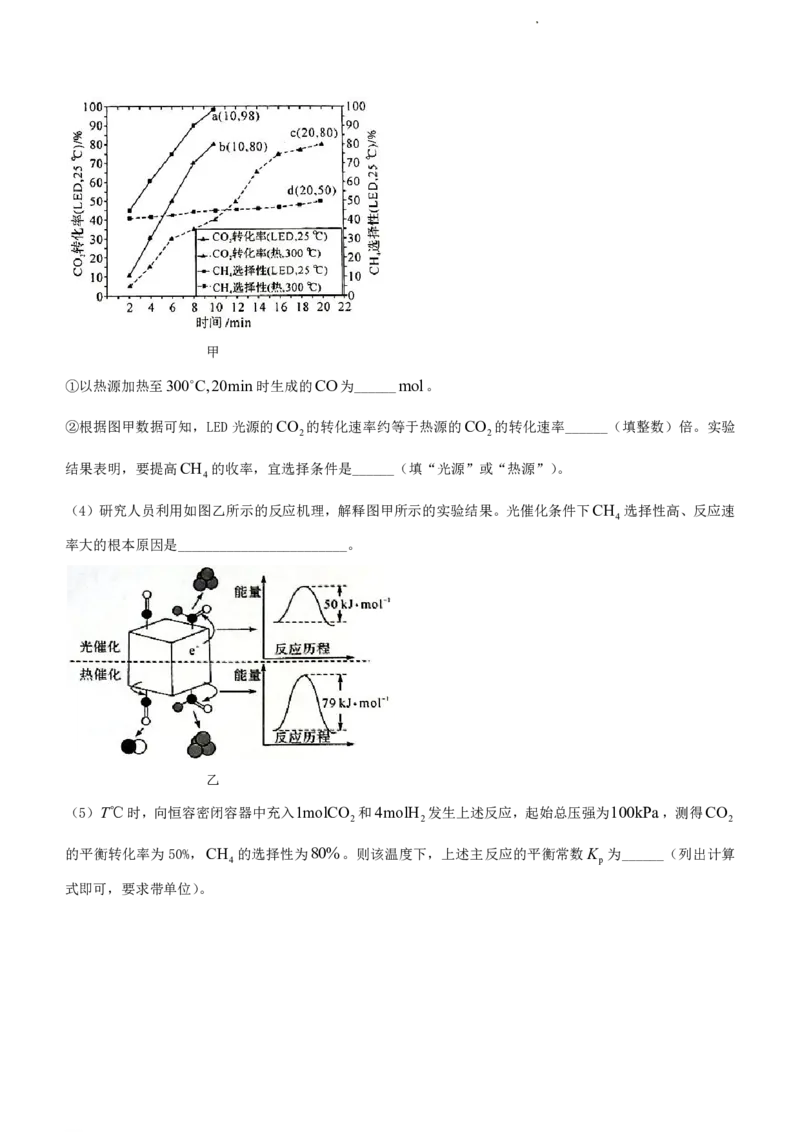
20.(14分)近日,科学家发现通过光照射铑(Rh)纳米粒子,优化CO 甲烷化反应。CO 甲烷化涉及主要
2 2
反应有:
主反应:CO g 4H g CH g 2H O g H
2 2 4 2 1
副反应:CO g H g CO g H O g H
2 2 2 2
(1)已知:H O l H O g ΔH akJmol1,几种可燃物燃烧热的ΔH 数据如下表。
2 2 3
物质 H g CO g CH g
2 4
燃烧热的H / kJmol1 b c d
CO g 4H g CH g 2H O g H ______kJmol1(用含a、b、d 的字母表示)。
2 2 4 2 1
(2)在恒温恒容反应器中充入1molCO 和1molH ,假设只发生主反应,下列叙述错误的是______(填字母
2 2
标号)。
A.加入高效催化剂,能提高单位时间内CH 的产率
4
B.混合气体的压强不随时间变化时达到平衡状态
C.反应体系中甲烷体积分数小于16.7%
D.体系中CO 体积分数不变时一定达到平衡状态
2
(3)近日,研究人员向两个反应室中均加入少量的Rh/Al O 催化剂,并分别通入1molCO 和4molH 的
2 3 2 2
混合气体,分别用高频率紫外LED灯照射、300℃热源加热,测得CO 转化率、CH 选择性与时间关系如图
2 4
甲所示(提示:CH 的选择性等于甲烷的物质的量与CH 和CO总物质的量之比,相当于CH 的收率)。
4 4 4
学科网(北京)股份有限公司甲
①以热源加热至300C,20min时生成的CO为______mol。
②根据图甲数据可知,LED光源的CO 的转化速率约等于热源的CO 的转化速率______(填整数)倍。实验
2 2
结果表明,要提高CH 的收率,宜选择条件是______(填“光源”或“热源”)。
4
(4)研究人员利用如图乙所示的反应机理,解释图甲所示的实验结果。光催化条件下CH 选择性高、反应速
4
率大的根本原因是________________________。
乙
(5)T℃时,向恒容密闭容器中充入1molCO 和4molH 发生上述反应,起始总压强为100kPa,测得CO
2 2 2
的平衡转化率为50%,CH 的选择性为80%。则该温度下,上述主反应的平衡常数K 为______(列出计算
4 p
式即可,要求带单位)。
学科网(北京)股份有限公司学科网(北京)股份有限公司