文档内容
云南省开远市第一中学校 2023-2024 学年高三上学期开学考试
化学试题
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
2.考生作答时,请将答案填涂在答题卡上。第Ⅰ卷每小题选出答案后,用2B铅笔把答题卡上
对应题目的答案标号涂黑;第Ⅱ卷请用直径0.5毫米的黑色墨水签字笔在答题卡上各题的答
题区域内作答,超出答题区域书写的答案无效,在试卷、草稿纸上作答无效。
3.可能用到的相对原子质量:H1 C12 O16 Pb207
第Ⅰ卷 (选择题共42分)
一、选择题:本大题共7小题,每题6分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1. 2022年北京冬奥会采用绿电制绿氢技术,即用光伏、风能等产生绿电,绿电电解水制得的氢气叫绿氢,
对比煤、石油、天然气作燃料,有许多优点。下列说法错误的是
A. 石油分馏出来的各馏分仍是多种烃的混合物
B. 通过气化或液化能把煤转变成清洁能源,属于化学变化
C. 冬奥会火炬采用H 代替天然气作燃料,符合绿色低碳发展理念
2
D. 冬奥会火炬“飞扬”使用的碳纤维属于有机高分子
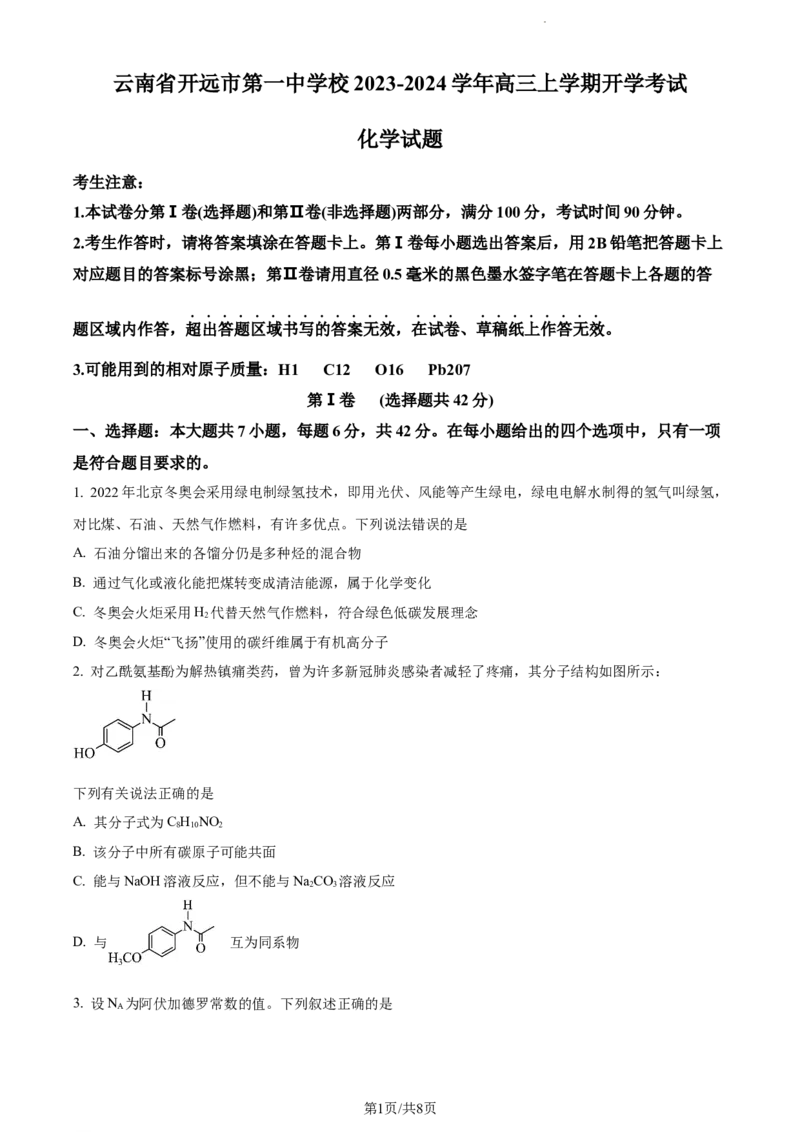
2. 对乙酰氨基酚为解热镇痛类药,曾为许多新冠肺炎感染者减轻了疼痛,其分子结构如图所示:
下列有关说法正确的是
A. 其分子式为C H NO
8 10 2
B. 该分子中所有碳原子可能共面
C. 能与NaOH溶液反应,但不能与NaCO 溶液反应
2 3
D. 与 互为同系物
3. 设N 为阿伏加德罗常数的值。下列叙述正确的是
A
第1页/共8页
学科网(北京)股份有限公司A. 标准状况下,11.2LCH 与11.2LCl 在光照下充分反应后,气体分子数为N
4 2 A
B. 46g乙醇中含有的C-H键的数目为5N
A
C. 1mol·L-1的NaClO溶液中含有的ClO-数目小于N
A
D. 1molAl3+完全转化为 转移电子数为4N
A
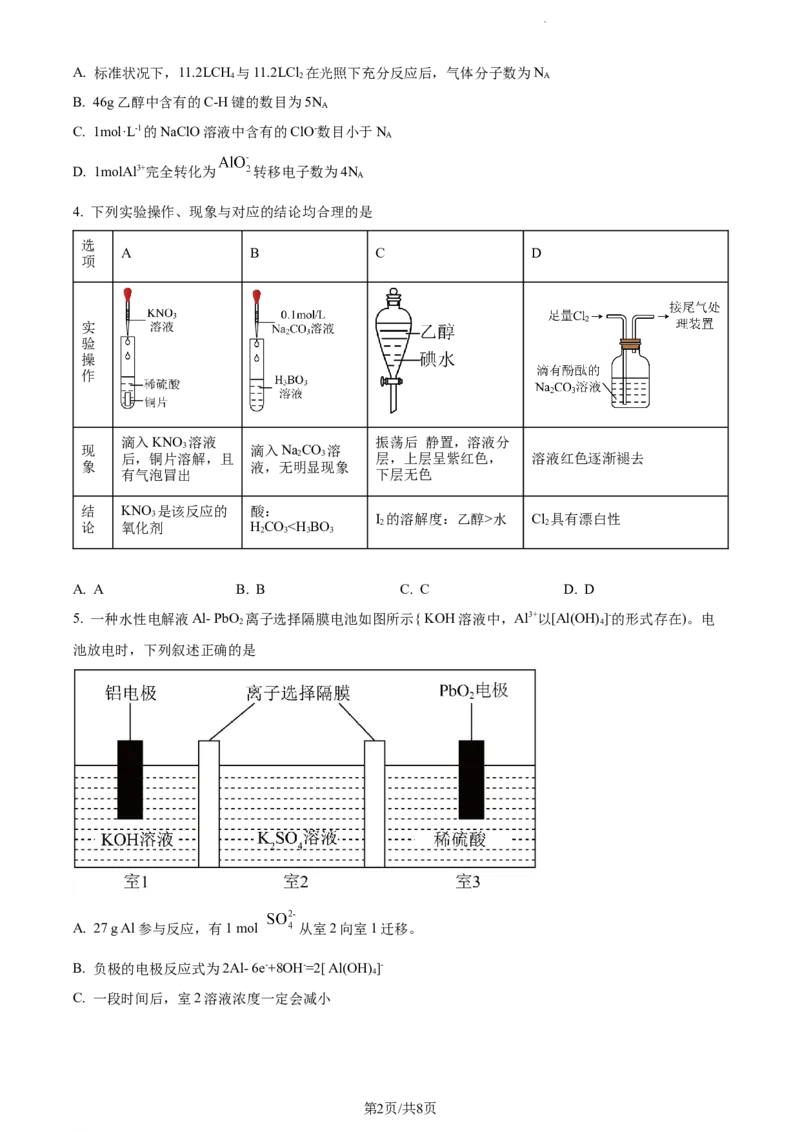
4. 下列实验操作、现象与对应的结论均合理的是
选
A B C D
项
实
验
操
作
滴入KNO 溶液 振荡后 静置,溶液分
现 3 滴入NaCO 溶
后,铜片溶解,且 2 3 层,上层呈紫红色, 溶液红色逐渐褪去
象 液,无明显现象
有气泡冒出 下层无色
结 KNO 是该反应的 酸:
3 I 的溶解度:乙醇>水 Cl 具有漂白性
论 氧化剂 HCOY>X>R
B. 电负性:Z> Y> X
C. 原子半径:X>Y> Z> R
D. M是含极性键和非极性键的共价化合物
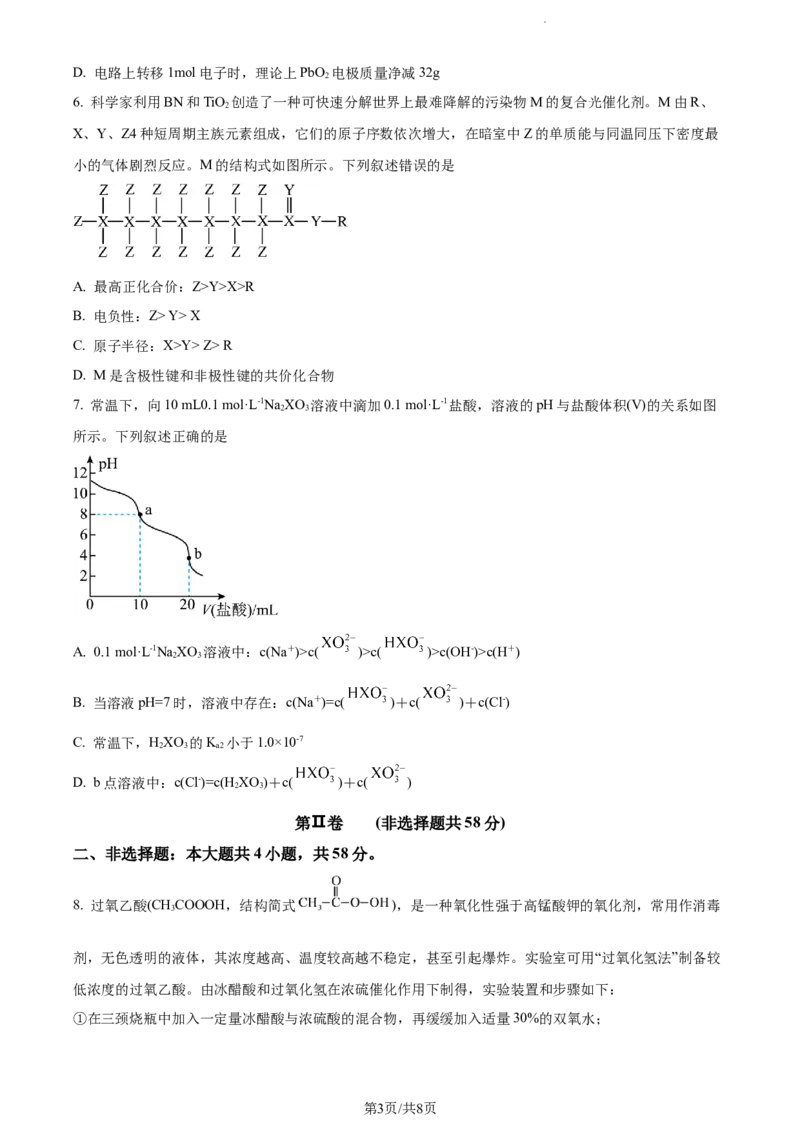
7. 常温下,向10 mL0.1 mol·L-1NaXO 溶液中滴加0.1 mol·L-1盐酸,溶液的pH与盐酸体积(V)的关系如图
2 3
所示。下列叙述正确的是
A. 0.1 mol·L-1NaXO 溶液中:c(Na+)>c( )>c( )>c(OH-)>c(H+)
2 3
B. 当溶液pH=7时,溶液中存在:c(Na+)=c( )+c( )+c(Cl-)
C. 常温下,HXO 的K 小于1.0×10-7
2 3 a2
D. b点溶液中:c(Cl-)=c(H XO )+c( )+c( )
2 3
第Ⅱ卷 (非选择题共58分)
二、非选择题:本大题共4小题,共58分。
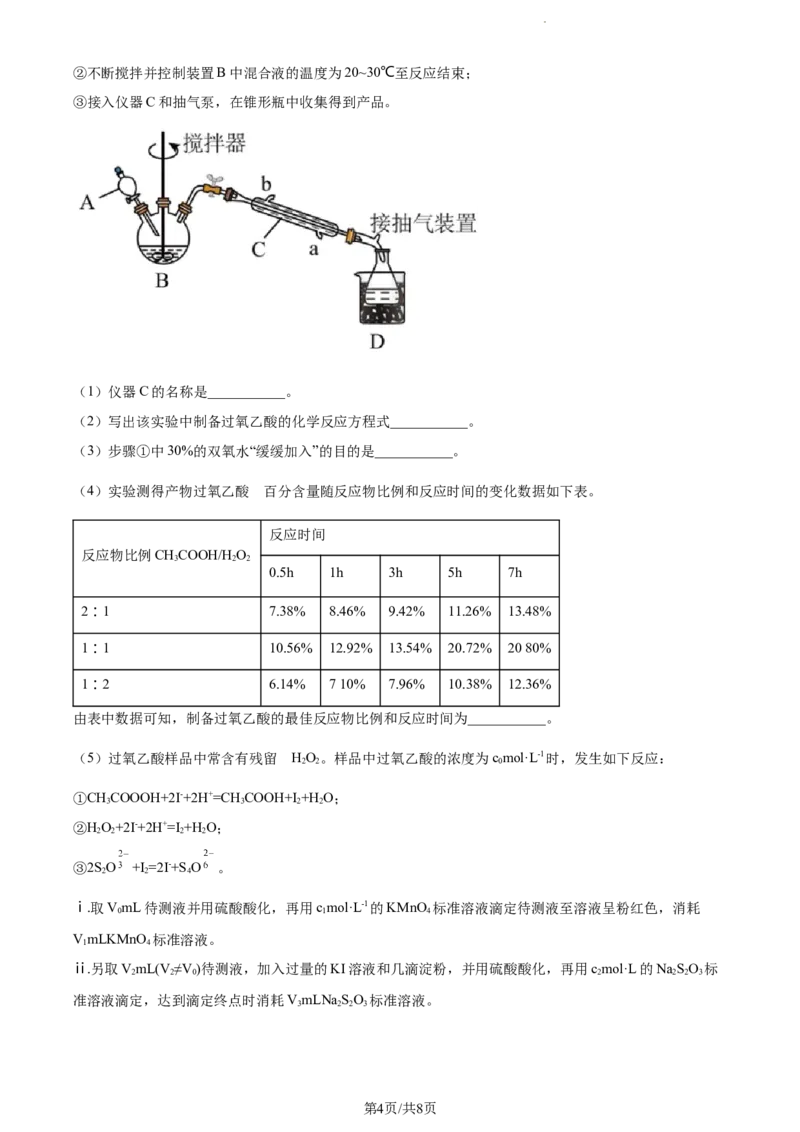
8. 过氧乙酸(CHCOOOH,结构简式 ),是一种氧化性强于高锰酸钾的氧化剂,常用作消毒
3
剂,无色透明的液体,其浓度越高、温度较高越不稳定,甚至引起爆炸。实验室可用“过氧化氢法”制备较
低浓度的过氧乙酸。由冰醋酸和过氧化氢在浓硫催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
第3页/共8页
学科网(北京)股份有限公司②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
(1)仪器C的名称是___________。
(2)写出该实验中制备过氧乙酸的化学反应方程式___________。
(3)步骤①中30%的双氧水“缓缓加入”的目的是___________。
的
(4)实验测得产物过氧乙酸 百分含量随反应物比例和反应时间的变化数据如下表。
反应时间
反应物比例CHCOOH/H O
3 2 2
0.5h 1h 3h 5h 7h
2∶1 7.38% 8.46% 9.42% 11.26% 13.48%
.
1∶1 10.56% 12.92% 13.54% 20.72% 2080%
.
1∶2 6.14% 710% 7.96% 10.38% 12.36%
由表中数据可知,制备过氧乙酸的最佳反应物比例和反应时间为___________。
的
(5)过氧乙酸样品中常含有残留 HO。样品中过氧乙酸的浓度为cmol·L-1时,发生如下反应:
2 2 0
①CHCOOOH+2I-+2H+=CH COOH+I +H O;
3 3 2 2
②HO+2I-+2H+=I +H O;
2 2 2 2
③2SO +I =2I-+S O 。
2 2 4
ⅰ.取VmL待测液并用硫酸酸化,再用cmol·L-1的KMnO 标准溶液滴定待测液至溶液呈粉红色,消耗
0 1 4
VmLKMnO 标准溶液。
1 4
ⅱ.另取VmL(V ≠V)待测液,加入过量的KI溶液和几滴淀粉,并用硫酸酸化,再用cmol·L的NaSO 标
2 2 0 2 2 2 3
准溶液滴定,达到滴定终点时消耗VmLNa SO 标准溶液。
3 2 2 3
第4页/共8页
学科网(北京)股份有限公司ⅰ.中发生反应的离子方程式为___________。
ⅱ.中用NaSO 标准溶液进行滴定时,达到滴定终点的标志是___________,过氧乙酸的浓度
2 2 3
c=___________(用含V、c、V、c、V、V 的代数式表示,通分化到最简式)。
0 0 1 1 2 2 3
(6)当其他操作均正确时,下列实验操作可能使测定结果偏高的是___________(填标号)。
A. 配制NaSO 标准溶液时,容量瓶中还有少量的水
2 2 3
B. 盛装NaSO 标准溶液的滴定管没有用标准液润洗
2 2 3
C. 用NaSO 标准溶液滴定完成后,俯视滴定管读数
2 2 3
D. 用NaSO 标准溶液滴定的过程中振荡锥形瓶的时间过长
2 2 3
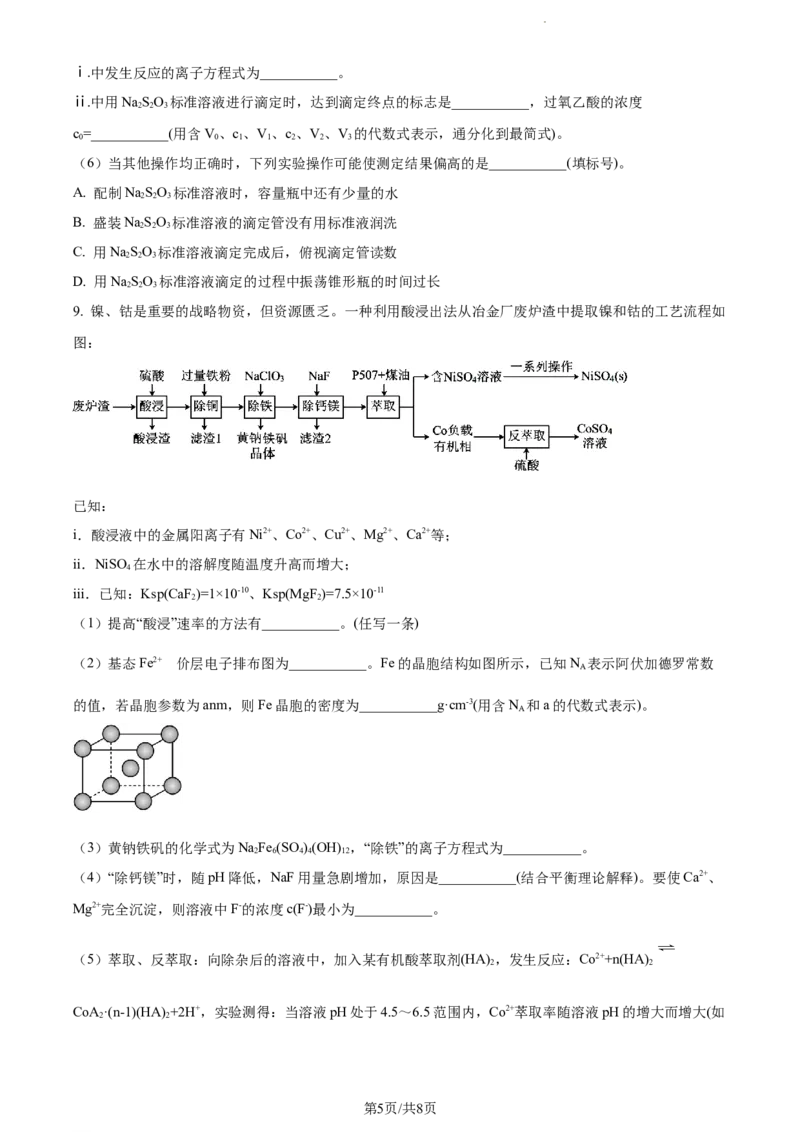
9. 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如
图:
已知:
i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等;
ii.NiSO 在水中的溶解度随温度升高而增大;
4
iii.已知:Ksp(CaF )=1×10-10、Ksp(MgF)=7.5×10-11
2 2
(1)提高“酸浸”速率的方法有___________。(任写一条)
的
(2)基态Fe2+ 价层电子排布图为___________。Fe的晶胞结构如图所示,已知N 表示阿伏加德罗常数
A
的值,若晶胞参数为anm,则Fe晶胞的密度为___________g·cm-3(用含N 和a的代数式表示)。
A
(3)黄钠铁矾的化学式为NaFe (SO )(OH) ,“除铁”的离子方程式为___________。
2 6 4 4 12
(4)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________(结合平衡理论解释)。要使Ca2+、
Mg2+完全沉淀,则溶液中F-的浓度c(F-)最小为___________。
(5)萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂(HA) ,发生反应:Co2++n(HA)
2 2
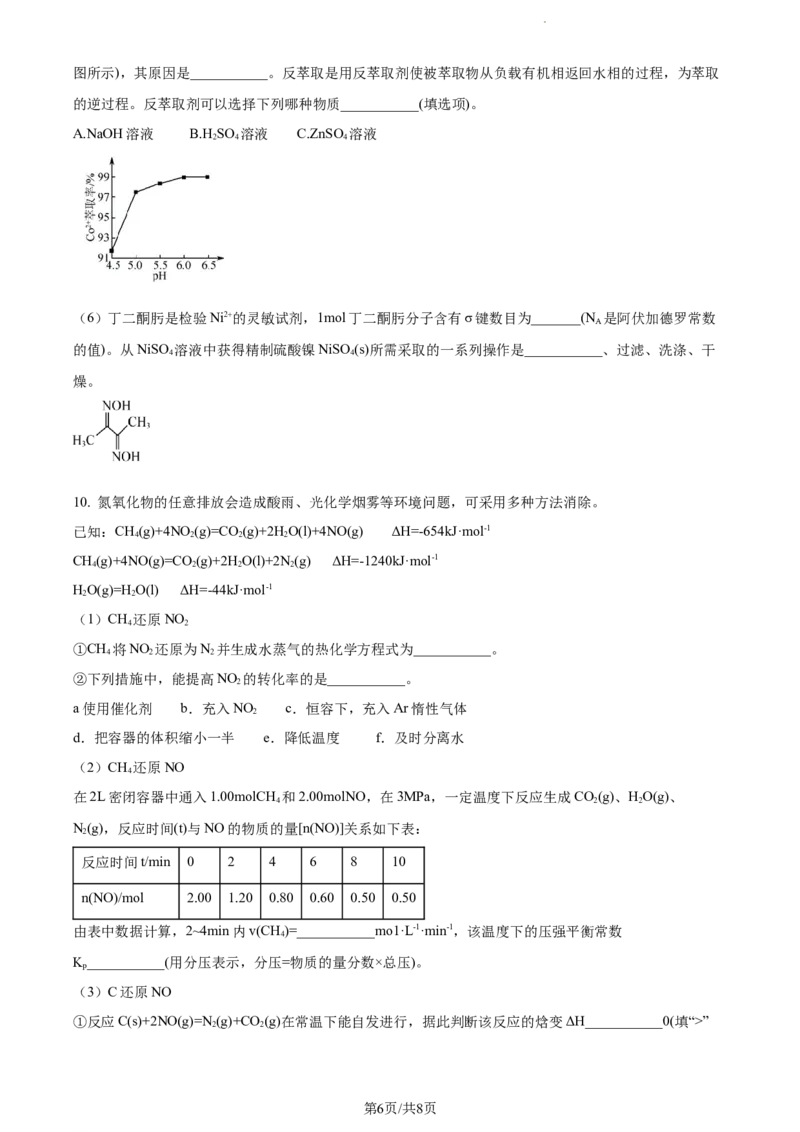
CoA·(n-1)(HA) +2H+,实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如
2 2
第5页/共8页
学科网(北京)股份有限公司图所示),其原因是___________。反萃取是用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取
的逆过程。反萃取剂可以选择下列哪种物质___________(填选项)。
A.NaOH溶液 B.H SO 溶液 C.ZnSO 溶液
2 4 4
(6)丁二酮肟是检验Ni2的灵敏试剂,1mol丁二酮肟分子含有σ键数目为_______(N 是阿伏加德罗常数
A
的值)。从NiSO 溶液中获得精制硫酸镍NiSO (s)所需采取的一系列操作是___________、过滤、洗涤、干
4 4
燥。
10. 氮氧化物的任意排放会造成酸雨、光化学烟雾等环境问题,可采用多种方法消除。
已知:CH(g)+4NO (g)=CO (g)+2HO(l)+4NO(g) ΔH=-654kJ·mol-1
4 2 2 2
CH(g)+4NO(g)=CO (g)+2HO(l)+2N(g) ΔH=-1240kJ·mol-1
4 2 2 2
HO(g)=H O(l) ΔH=-44kJ·mol-1
2 2
(1)CH 还原NO
4 2
①CH 将NO 还原为N 并生成水蒸气的热化学方程式为___________。
4 2 2
②下列措施中,能提高NO 的转化率的是___________。
2
a使用催化剂 b.充入NO c.恒容下,充入Ar惰性气体
2
d.把容器的体积缩小一半 e.降低温度 f.及时分离水
(2)CH 还原NO
4
在2L密闭容器中通入1.00molCH 和2.00molNO,在3MPa,一定温度下反应生成CO(g)、HO(g)、
4 2 2
N(g),反应时间(t)与NO的物质的量[n(NO)]关系如下表:
2
反应时间t/min 0 2 4 6 8 10
n(NO)/mol 2.00 1.20 0.80 0.60 0.50 0.50
由表中数据计算,2~4min内v(CH)=___________mo1·L-1·min-1,该温度下的压强平衡常数
4
K___________(用分压表示,分压=物质的量分数×总压)。
p
(3)C还原NO
①反应C(s)+2NO(g)=N (g)+CO (g)在常温下能自发进行,据此判断该反应的焓变ΔH___________0(填“>”
2 2
第6页/共8页
学科网(北京)股份有限公司“<”或“=”)。
②以上反应可分为如下四步反应历程,写出其中第三步的反应:
第一步:2NO=(NO)
2
第二步:C+(NO) =C(O)+N O
2 2
第三步:___________
第四步:2C(O)=CO+C
2
(4)除上述方法外,还可用电解法将NO转变为NH NO ,其工作原理如图,N极的电极反应式为
4 3
___________,通入NH 的主要原因是___________。
3
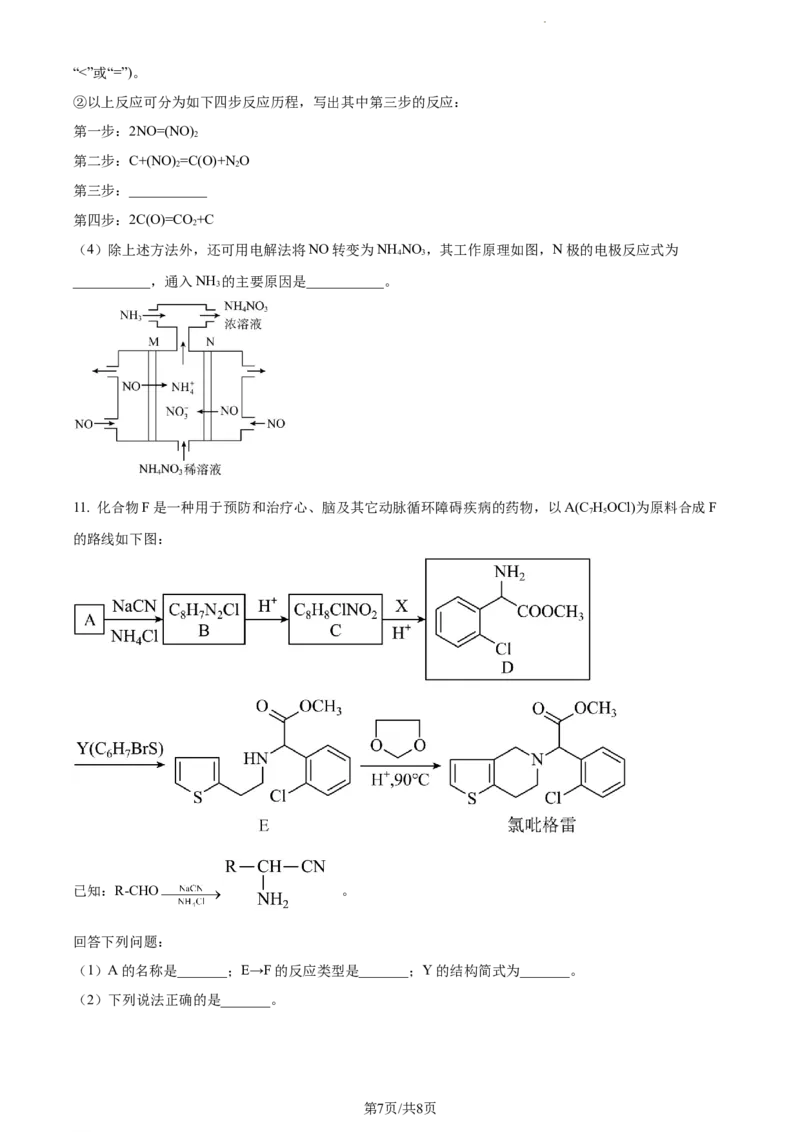
11. 化合物F是一种用于预防和治疗心、脑及其它动脉循环障碍疾病的药物,以A(C HOCl)为原料合成F
7 5
的路线如下图:
已知:R-CHO 。
回答下列问题:
(1)A的名称是_______;E→F的反应类型是_______;Y的结构简式为_______。
(2)下列说法正确的是_______。
第7页/共8页
学科网(北京)股份有限公司A. 有机物B能发生消去反应
B. 有机物C中含酰胺基
C. 有机物D中的碳原子轨道杂化类型有两种
D. 有机物E、F分子中均有一个手性碳原子
(3)C可在一定条件下发生缩聚反应,反应的化学方程式为_______。
(4)G的相对分子质量比A大14,符合下列条件的G的同分异构体(不考虑立体异构)有_______种,写出
满足1H-NMR谱有四组峰且峰面积之比为2:2:2:1的两种结构简式_______。
i属于芳香族化合物;
ii.具有与A相同的官能团。
(5)请结合题中信息,设计以 为有机原料制备化合物 的合
成路线(无机试剂任选)_______。
第8页/共8页
学科网(北京)股份有限公司