文档内容
更多资料关注英子小课堂微信:vip317884137
高中化学知识点补救(误区分析)全国通用
最新高考化学知识点补救:疑点、误区分析 40 点
1、中和热:稀溶液生成1mol水时放出的热量
2、2HS+O==2S↓+2HO(硫磺溶胶)
2 2 2
3、燃烧热:1mol可燃物与氧气完全燃烧最稳定氧化物(如:H生成液态水,C生成CO)
2
时放出的热量。(通常状况:在 25 摄氏度,101 kPa 时)
区别燃烧值:每千克可燃物燃料燃烧放出的热量。单位J/Kg
4、车用汽油是按照其辛烷值的高低以标号来区分的,辛烷值是表示汽油抗爆性的指标,它
是汽油重要的质量指标之一
5、银镜反应中生成物NH 可以不用气体生成符号。
3
6、过滤分离高级脂肪酸钠和甘油。
7、测定物质的含量,不能思维定势,如:测定过氧化钠和氧化钠混合物中氧的百分含量,
我们可以通过测定钠的百分含量,进而等到氧的含量。
8、过氧化钠通常情况下与干燥的二氧化碳、以及氯化氢气体反应很慢,(例如在一些探究
实验中,通常会遇到在干燥条件下基本检验不到氧气,就是这个道理),一般观念认为,
过氧化钠与二氧化碳以及氯化氢可以发生反应产生氧气(只不过是隐含了水分这个条件)。
9、胶头滴管使用时必须高于试管口。
这个看法是不全面的,在某些特殊的条件下,比如必须避免过多的空气杂质混入的实
验中,是不需要使胶头滴管高出试管口的。这种例子在高中的实验中出现了一个,就是
Fe(OH) 的制取实验,为了看到清晰的白色絮状沉淀,往往是把胶头滴管深入到液面下.
2
10、硝酸根离子一定显示氧化性!
其实NO-只在酸性条件下显示氧化性,而在碱性条件下基本是不显示氧化性的。比如 :
3
问到NO-是否可以与硫离子共存时,答案是肯定的。
3
11、白磷和红磷都不溶解于水,而溶解于CS 中!
2
事实上,红磷因其复杂的结构而导致在很多方面(特别是物理性质)显示与白磷不同,
比如在溶解于有机溶剂的方面,在毒性方面,在保管方面等。红磷是不溶解于CS 的。
2
12、放热反应一定要在低温下进行,吸热反应则必须加热。
一个合适的温度取决于很多因素,第一是性价比,第二是催化效率,第三是操作难度,
第四是反应的吸热与放热。其中,比较重要的是性价比和催化效率,而放热的与否往往不
是考虑的对象。在高中关于这个的例子最突出的就是氨气的制取,N 和O 的反应是个放热
2 2
反应,但是由于催化剂活性的考虑,还是选择了500度作为生产温度。
第 1 页 共 6 页
更多资料关注英子小课堂微信:vip317884137更多资料关注英子小课堂微信:vip317884137
高中化学知识点补救(误区分析)全国通用
13、一定要更强的酸(碱)才可以制取较弱的酸(碱)。
在温度和压强发生改变时,这种事情并不是如此,比如强挥发性酸的制取往往是利用
难挥发性酸,而不是考虑酸的强弱。如果在常温常压的条件下,也不一定如此.在反应中如
果出现沉淀或者其他的现象,往往会影响到这一规律。比如强碱中互相制取的一个最显著
的例子,Ca(OH) 制取NaOH。
2
14、一定要金属性强的才可以置换出金属性弱的,这是错的!
如果是在溶液和常温的平等条件下,这个规律往往成立.但是如果金属的状态发生了
改变,这个规律就不适用了。最明显的例子就是最强金属铯Cs的制取,是在稀有气体的保
护下用Mg从CsCl中置换出来的。
15、所有的水解沉淀没什么太大的区别;这是错的!
水解产生沉淀都是有相应的pH值范围限制,Fe3+的水解在pH=4~5时可以稳定存在,
而Fe2+与Cu2+则不行。这也解释了为什么Fe3+的溶液中明显的会出现沉淀(其实这又是一个
误区,就是溶液中的难溶物就是沉淀,然而很多时候有溶胶的出现),而Fe2+和Cu2+的水解
一般要在稍微趋近中性的条件下才比较明显。
16、Si、Al与NaOH溶液的反应中,NaOH是氧化剂,这是错的!
其实在这个反应中,省略掉了两分子的水,而生成的氢气,正是来源于水中,而不是
NaOH,所以NaOH只是起到一个碱性环境的作用。这个知识点可以继续拓展到第三周期元
素与NaOH的反应中.这样就要再次考虑了,(这些反应的氧化剂或者还原剂到底是什么,
我还没怎么确定,请大家补充完整.),依次是Na、Mg、Al、Si、P、S、Cl。
17、只要有淡黄色沉淀就是AgBr,只要有红色沉淀就是Fe(OH),只要有绿色物质就是Fe2+
3
离子的存在,只要有紫色溶液就一定是高锰酸钾....依此类推,这是错的。
黄色沉淀有可能是S/AgPO/金子(比如在王水中置换出来的)/TNT,而红色沉淀有可能
3 4
是CuO/铜单质/HgO,绿色物质可能是铜绿(就是碱式碳酸铜),紫色溶液有可能是碘的CCl
2 4
溶液。
18、 产生CO 的物质中一定要含有CO2-根离子的存在,有Pb离子的一定是NO-盐。
2 3 3
因为你往往在做似乎只有无机物的反应题中忽略掉了有机物的存在,比如草酸和醋
酸,而这些有机物质往往体现出与无机物类似的性质。 大家总是忽略掉了有机和无机相
互连接的路径,除了刚才所将的那些有机酸,还有比如电石产生乙炔的反应,无机酸制取
酯的反应,总是让人忽略掉。
19、将Li用煤油液封保存,液Br保存必须干燥无水。
Li的密度是比煤油小的,所以Li是保存在石蜡的密封下了,而液溴的保存其实是经
常在上面加上水密封的,目的是为了防止溴的挥发。
第 2 页 共 6 页
更多资料关注英子小课堂微信:vip317884137更多资料关注英子小课堂微信:vip317884137
高中化学知识点补救(误区分析)全国通用
20、常温下,纯磷酸和SO 都是液体。
3
常温下,纯磷酸与SO 都是晶体的形态出现,不是所有的酸不是液态就是气态的,固
3
态存在的纯酸其实是很经常看见的。
21、排液体法等于排水法,排气法等于排空气法。
第一个大家比较不会怎么犯错误,大家经常见到比如排饱和食盐水法,排有机溶剂法
都是第一个的体现。
关键是第二个,大家比较不熟悉,举个例子:就是NO的收集(NO=28趋近于29),很
多同学认为NO不能用排气法收集,其实不然,在制取干燥的NO时,常常采用排CO 气体
2
的方法,简单而实效。
22、钠钾合金可以作为原子反应堆的导热剂;
如果在熔融状态下,只要温度合适,置换是可以发生的; 例如工业上制金属钾,是
在850摄氏度下用钠还原熔融的氯化钾。方程式:Na+KCl=NaCl+K↑(蒸气) 因为钠的沸
点在881摄氏度,而钾的沸点在759摄氏度 所以,850度下,钠是液态,而钾是气态。 如
果你学习化学平衡的话,就知道钾蒸气会逸出反应体系,使平衡右移。 这并不能说明钠
的活动性比钾强,只是条件太特殊了而已。
高温下用钠把钛从TiCl 中置换出来。
4
23、离子浓度大小比较需要注意几个隐含信息:酸碱性问题(pH值),决定[H+]与[OH-]
的大小;水解和电离程度大小;三个守恒(电荷守恒、物料守恒、质子守恒),注意质子
守恒可以由电荷守恒与物料守恒推导得出,但是他们之间不一定是简单的加减,可能要注
意等式两边倍数的同时增减。
24、运用改变(破坏)沉淀溶解平衡的方法提纯物质,如对Mg(OH) 含有少量杂质Ca(OH)
2 2
的混合物中提纯,我们可以将混合物加到饱和的MgCl 溶液中搅拌过滤,将微溶的Ca(OH)
2 2
转化为难溶的Mg(OH) ,以沉淀的形式析出。
2
25、侯氏制碱法
NHHCO+NaCl → NaHCO+NHCl : ① NaCl( 饱 和 )+NH+HO+CO=NHCl+NaHCO↓ ②
4 3 3 4 3 2 2 4 3
2NaHCO=加热=NaCO+HO+CO↑碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉
3 2 3 2 2
淀,碳酸氢钠之所以沉淀是因为他的溶解度很小。根据 NHCl 在常温时的溶解度比 NaCl
4
大,而在低温下却比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃ ) 时,向
母液中加入食盐细粉,而使 NHCl 单独结晶析出供做氮肥。
4
26、盖斯定律:实际上就是焓变的加减(概念:化学反应分成二步或分几步完成,总反应
的 H等于各分步反应的代数和)
如:试利用298K 时下列反应焓变的实验数据,计算在此温度下
1
C(s)+ O (g)=CO(g)的反应焓变? 反应3
2
2
C(s)+O (g)=CO (g) △H =-393.5KJ·mol-1 反应1
2 2 1
第 3 页 共 6 页
更多资料关注英子小课堂微信:vip317884137更多资料关注英子小课堂微信:vip317884137
高中化学知识点补救(误区分析)全国通用
1
CO(g)+ O (g)=CO (g) △H =-283.0KJ·mol-1 反应2
2 2 2
2
方法1:以盖斯定律原理求解, 以要求的反应为基准
(1) 找起点C(s),
(2) 终点是CO(g),
(3) 总共经历了两个反应 C→CO →CO。
2
(4) 也就说C→CO的焓变为C→CO ;CO →CO之和。
2 2
注意:CO→CO2 △H =-283.0KJ·mol-1
2
那 CO →CO 的焓变就是= —△H =+283.0KJ·mol-1
2 2
(5) 求解:△H =△H —△H =-393.5KJ·mol-1+283.0KJ·mol-1=-110.5KJ·mol-1
3 1 2
方法2:以盖斯定律原理求解, 以要求的反应为基准
(1)找起点C(s),
(2)终点是CO (g),
2
(3)总共经历了两个反应 C→CO C→CO→CO 。
2; 2
(4)也就说C→CO 的焓变为C→CO;CO→CO 之和。
2 2
则△H =△H +△H
1 3 2
(5)求解:C→CO △H =△H — △H =-110.5KJ·mol-1
3 1 2
方法3:利用方程组求解
(1) 找出头尾 同上
(2) 找出中间产物 CO
2
(3) 利用方程组消去中间产物 反应 -反应 =反应
1 2 3
(4) 列式: △H —△H =△H
1 2 3
(5) 求解可得
27、判断一种酸式盐溶液的酸碱性,主要根据酸本身的性质,特别是中强酸,如:HPO、
3 4
HSO 等特别注意他们的酸式酸根(HPO-、HSO-)在溶液中显酸性。另外,对于那些不太了
2 3 2 4 3
解的酸性物质也要根据题干所给信息判断。
28、羟基就是氢氧根。看上去都是OH组成的一个整体,其实,羟基是一个基团,它只是
物质结构的一部分,不会电离出来。而氢氧根是一个原子团,是一个阴离子,它或强或弱
都能电离出来。所以,羟基不等于氢氧根。
例如:C H OH中的OH是羟基,不会电离出来;硫酸中有两个OH也是羟基,众所周知,
2 5
硫酸不可能电离出OH-的。而在NaOH、Mg(OH) 、Fe(OH) 、Cu (OH) CO 中的OH就是
2 3 2 2 3
离子,能电离出来,因此这里叫氢氧根。
29、Fe3+离子是黄色的。众所周知,FeCl 溶液是黄色的,但是不是意味着Fe3+就是黄色的
3
呢?不是。Fe3+对应的碱Fe(OH) 是弱碱,它和强酸根离子结合成的盐类将会水解产生红棕
3
色的Fe(OH)。因此浓的FeCl 溶液是红棕色的,一般浓度就显黄色,归根结底就是水解生
3 3
成的Fe(OH) 导致的。真正Fe3+离子是淡紫色的而不是黄色的。将Fe3+溶液加入过量的酸来
3
抑制水解,黄色将褪去。
30、AgOH遇水分解。发现不少人都这么说,其实看溶解性表中AgOH一格为“—”就认为
是遇水分解,其实不是的。而是AgOH的热稳定性极差,室温就能分解,所以在复分解时
第 4 页 共 6 页
更多资料关注英子小课堂微信:vip317884137更多资料关注英子小课堂微信:vip317884137
高中化学知识点补救(误区分析)全国通用
得到AgOH后就马上分解,因而AgOH常温下不存在。和水是没有关系的。如果在低温下进
行这个操作,是可以得到AgOH这个白色沉淀的。
31、多元含氧酸具体是几元酸看酸中H的个数。多元酸究竟能电离多少个H+,是要看它结
构中有多少个羟基,非羟基的氢是不能电离出来的。如亚磷酸(HPO),看上去它有三个H,
3 3
好像是三元酸,但是它的结构中,是有一个H和一个O分别和中心原子直接相连的,而不
构成羟基。构成羟基的O和H只有两个。因此HPO 是二元酸。当然,有的还要考虑别的因
3 3
素,如路易斯酸HBO 就不能由此来解释。
3 3
32、酸式盐溶液呈酸性。表面上看,“酸”式盐溶液当然呈酸性啦,其实不然。到底酸式
盐呈什么性,要分情况讨论。如果这是强酸的酸式盐,因为它电离出了大量的H+,而且阴
离子不水解,所以强酸的酸式盐溶液一定呈酸性。而弱酸的酸式盐,则要比较它电离出H+
的能力和阴离子水解的程度了。如果阴离子的水解程度较大(如NaHCO),则溶液呈碱性;
3
反过来,如果阴离子电离出H+的能力较强(如NaHPO),则溶液呈酸性。
2 4
33、HSO 有强氧化性。就这么说就不对,只要在前边加一个“浓”字就对了。浓HSO 以
2 4 2 4
分子形式存在,它的氧化性体现在整体的分子上,HSO 中的S+6易得到电子,所以它有强
2 4
氧化性。而稀HSO(或SO2-)的氧化性几乎没有(连H2S也氧化不了),比HSO(或SO2-)
2 4 4 2 3 3
的氧化性还弱得多。这也体现了低价态非金属的含氧酸根的氧化性比高价态的强,和HClO
与HClO 的酸性强弱比较一样。所以说HSO 有强氧化性时必须严谨,前面加上“浓”字。
4 2 4
34、盐酸是氯化氢的俗称。看上去,两者的化学式都相同,可能会产生误会,盐酸就是氯
化氢的俗称。其实盐酸是混合物,是氯化氢和水的混合物;而氯化氢是纯净物,两者根本
不同的。氯化氢溶于水叫做氢氯酸,氢氯酸的俗称就是盐酸了。
35、易溶于水的碱都是强碱,难溶于水的碱都是弱碱。从常见的强碱NaOH、KOH、Ca(OH)
2
和常见的弱碱Fe(OH)、Cu(OH) 来看,似乎易溶于水的碱都是强碱,难溶于水的碱都是弱
3 2
碱。其实碱的碱性强弱和溶解度无关,其中,易溶于水的碱可别忘了氨水,氨水也是一弱
碱。难溶于水的也不一定是弱碱,学过高一元素周期率这一节的都知道,镁和热水反应后
滴酚酞变红的,证明Mg(OH) 不是弱碱,而是中强碱,但Mg(OH) 是难溶的。还有AgOH,
2 2
看Ag的金属活动性这么弱,想必AgOH一定为很弱的碱。其实不然,通过测定AgNO3溶液
的pH值近中性,也可得知AgOH也是一中强碱。
36、写离子方程式时,强电解质一定拆,弱电解质一定不拆。在水溶液中,的确,强电解
质在水中完全电离,所以肯定拆;而弱电解质不能完全电离,因此不拆。但是在非水溶液
中进行时,或反应体系中水很少时,那就要看情况了。在固相反应时,无论是强电解质还
是弱电解质,无论这反应的实质是否离子交换实现的,都不能拆。如:2NHCl+Ca(OH)=△
4 2
=CaCl+2NH↑+2HO,这条方程式全部都不能拆,因此不能写成离子方程式。有的方程式要
2 3 2
看具体的反应实质,如浓HSO 和Cu反应,尽管浓HSO 的浓度为98%,还有少量水,有
2 4 2 4
部分分子还可以完全电离成H+和SO2-,但是这条反应主要利用了浓HSO 的强氧化性,能
4 2 4
体现强氧化性的是HSO 分子,所以实质上参加反应的是HSO 分子,所以这条反应中H2SO4
2 4 2 4
不能拆。同样,生成的CuSO 因水很少,也主要以分子形式存在,所以也不能拆。弱电解
4
第 5 页 共 6 页
更多资料关注英子小课堂微信:vip317884137更多资料关注英子小课堂微信:vip317884137
高中化学知识点补救(误区分析)全国通用
质也有拆的时候,因为弱电解质只是相对于水是弱而以,在其他某些溶剂中,也许它就变
成了强电解质。如CHCOOH在水中为弱电解质,但在液氨中却为强电解质。在液氨做溶剂
3
时,CHCOOH参加的离子反应,CHCOOH就可以拆。
3 3
37、-COOH、-COO-、C=O 等一般不与氢气发生加成反应,一般情况下,加成反应认为是在
不饱和的碳碳双键或者三键上进行的反应。而且,如果反应能够进行我们通常将它们视为
还原反应。
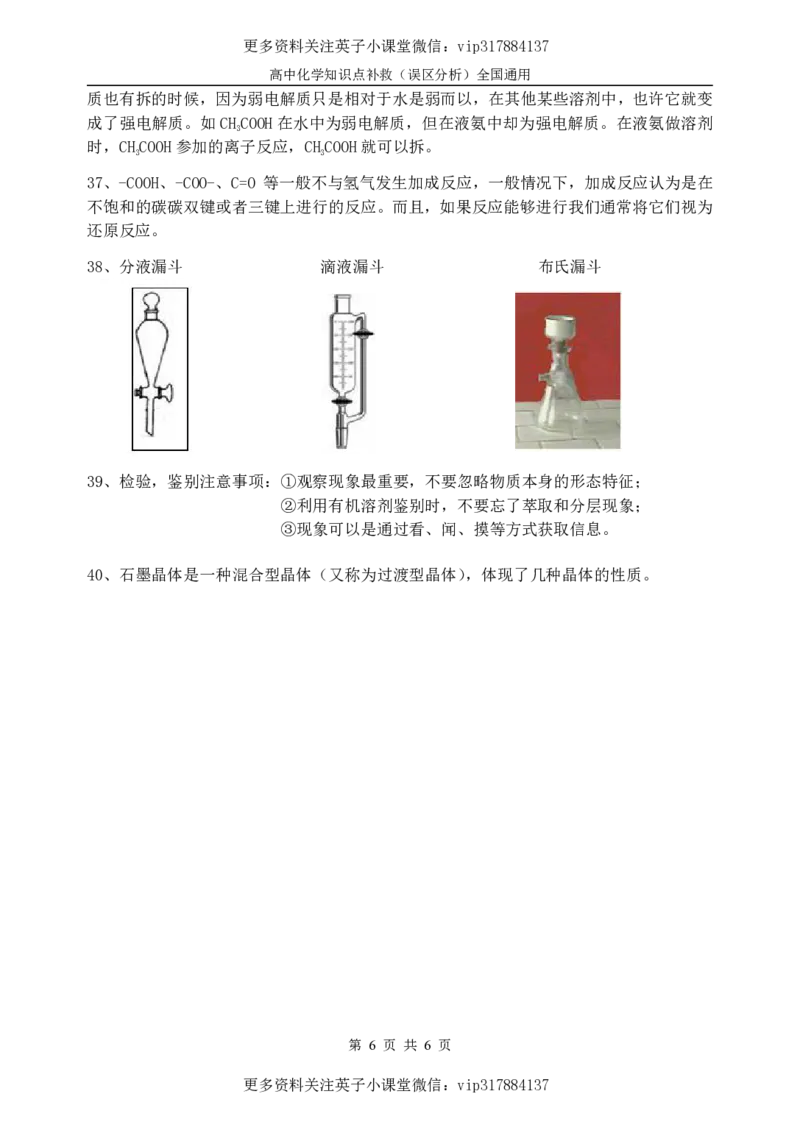
38、分液漏斗 滴液漏斗 布氏漏斗
39、检验,鉴别注意事项:①观察现象最重要,不要忽略物质本身的形态特征;
②利用有机溶剂鉴别时,不要忘了萃取和分层现象;
③现象可以是通过看、闻、摸等方式获取信息。
40、石墨晶体是一种混合型晶体(又称为过渡型晶体),体现了几种晶体的性质。
第 6 页 共 6 页
更多资料关注英子小课堂微信:vip317884137