文档内容
专题20 铁及其化合物
1.【2023年6月浙江卷】氯化铁是一种重要的盐,下列说法不正确的是
A.氯化铁属于弱电解质 B.氯化铁溶液可腐蚀覆铜板
C.氯化铁可由铁与氯气反应制得 D.氯化铁溶液可制备氢氧化铁胶体
【答案】A
【解析】A.氯化铁能完全电离出铁离子和氯离子,属于强电解质,A错误;B.氯化铁溶液与铜反应生成
氯化铜和氯化亚铁,可用来蚀刻铜板,B正确;C.氯气具有强氧化性,氯气与铁单质加热生成氯化
铁,C正确;D.向沸水中滴加饱和氯化铁溶液,继续加热呈红褐色,铁离子发生水解反应可得到氢
氧化铁胶体,D正确;故选:A。
2.【2023年全国乙卷】一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是
硫酸亚铁溶液出现棕黄色沉
A
淀
硫化钠溶液出现浑浊颜色变
B
深
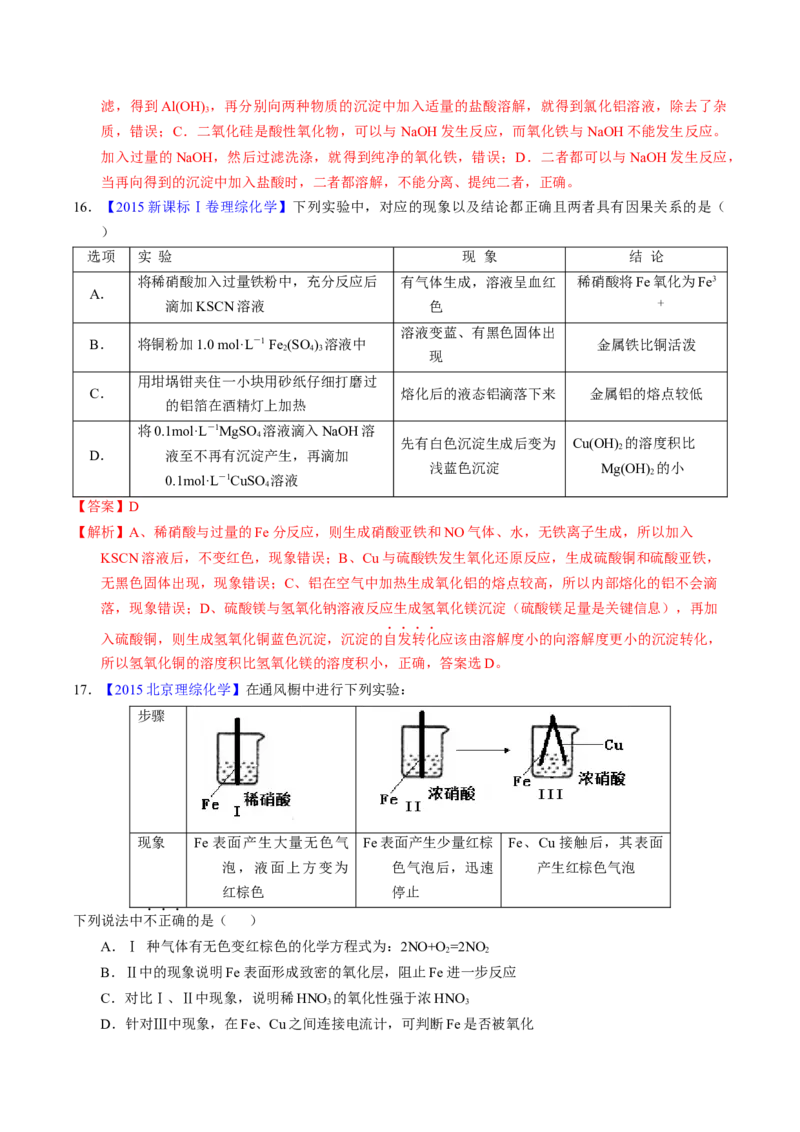
C 溴水颜色逐渐褪去
D 胆矾表面出现白色粉末
【答案】D
【解析】A.溶液呈棕黄色是因为有Fe3+,有浑浊是产生了Fe(OH) ,因为硫酸亚铁久置后易被氧气氧化,
3
化学方程式为:12FeSO +3O +6H O=4Fe (SO )+4Fe(OH) ↓,A错误;B.硫化钠在空气中易被氧气氧
4 2 2 2 4 3 3
化为淡黄色固体硫单质,使颜色加深,化学方程式为:2NaS+O+2H O=4NaOH+2S↓,B错误;C.溴
2 2 2
水的主要成分是溴和水,它们会反应,但速度很慢,Br +H O HBrO+HBr,2HBrO=2HBr+O ,所以
2 2 2
溴水放置太久会变质。但不是生成高溴酸,所以选项中的化学方程式错误,C错误;D.胆矾为
CuSO ·5H O,颜色为蓝色,如果表面失去结晶水,则变为白色的CuSO ,化学方程式为:
4 2 4
CuSO ·5H O=CuSO +5H O,方程式正确,D正确;故选D。
4 2 4 2
3.【2023年全国新课标卷】化学在文物的研究和修复中有重要作用。下列说法错误的是
A.竹简的成分之一纤维素属于天然高分子 B.龟甲的成分之一羟基磷灰石属于无机物
C.古陶瓷修复所用的熟石膏,其成分为Ca(OH) D.古壁画颜料中所用的铁红,其成分为Fe O
2 2 3
【答案】C
【解析】A.纤维素是一种天然化合物,其分子式为(C H O),其相对分子质量较高,是一种天然高分子,
6 10 5 nA正确;B.羟基磷灰石又称又称羟磷灰石、碱式磷酸钙,其化学式为[Ca (PO )(OH) ],属于无机物,
10 4 6 2
B正确;C.熟石膏是主要成分为2CaSO·H O,Ca(OH) 为熟石灰的主要成分,C错误;D.Fe O 为
4 2 2 2 3
红色,常被用于油漆、涂料、油墨和橡胶的红色颜料,俗称铁红,D正确;故答案选C。
4.【2023年广东卷】劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 帮厨活动:帮食堂师傅煎鸡蛋准备午餐 加热使蛋白质变性
B 环保行动:宣传使用聚乳酸制造的包装材料 聚乳酸在自然界可生物降解
C 家务劳动:擦干已洗净的铁锅,以防生锈 铁丝在 中燃烧生成
D 学农活动:利用秸秆、厨余垃圾等生产沼气 沼气中含有的 可作燃料
【答案】C
【解析】A.鸡蛋主要成分是蛋白质,帮食堂师傅煎鸡蛋准备午餐,加热使蛋白质变性,有关联,故A不
符合题意;B.聚乳酸在自然界可生物降解,为了减小污染,宣传使用聚乳酸制造的包装材料,两者
有关联,故B不符合题意;C.擦干已洗净的铁锅,以防生锈,防止生成氧化铁,铁丝在 中燃烧生
成 ,两者没有关联,故C 符合题意;D.利用秸秆、厨余垃圾等生产沼气,沼气主要成分是甲
烷,甲烷用作燃料,两者有关系,故D不符合题意。综上所述,答案为C。
5.【2023年1月浙江卷】探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案 现象 结论
A 往 溶液中加入 片 短时间内无明显现象 的氧化能力比 弱
往 溶液中滴加 溶液,再 溶液先变成血红色后
B 与 的反应不可逆
无明显变化
加入少量 固体
将食品脱氧剂样品中的还原铁粉溶于盐
C 溶液呈浅绿色 食品脱氧剂样品中没有 价铁
酸,滴加 溶液
向沸水中逐滴加5~6滴饱和 溶液, 溶液先变成红褐色再 先水解得 再聚集
D
持续煮沸 析出沉淀 成 沉淀
【答案】D
【解析】A.FeCl 溶液中加入Zn片, ,溶液由浅绿色变为无色,Fe2+的氧化能力比
2
Zn2+强,A错误;B.溶液变成血红色的原因, ,与 和K+无关,B错误;
C.铁离子可能先与单质铁生成亚铁离子,则溶液呈绿色,C错误;D.向沸水中滴加饱和氯化铁溶液,
制取Fe(OH) 胶体,继续加热则胶体因聚沉变为沉淀,D正确;故答案为:D。
36.【2021年江苏卷】下列有关物质的性质与用途不具有对应关系的是
A.铁粉能与O 反应,可用作食品保存的吸氧剂
2
B.纳米Fe O 能与酸反应,可用作铁磁性材料
3 4
C.FeCl 具有氧化性,可用于腐蚀印刷电路板上的Cu
3
D.聚合硫酸铁能水解并形成胶体,可用于净水
【答案】B
【解析】A.因为铁粉能与O 反应,所以可用作食品保存的吸氧剂,A正确;B.纳米Fe O 具有磁性,可
2 3 4
用作铁磁性材料,B错误;C.FeCl 与Cu反应生成FeCl 和CuCl ,主要利用其氧化性,C正确;D.
3 2 2
聚合硫酸铁能水解并形成胶体,具有吸附性,可用于净水,D正确;故选B。
7.【2022年6月浙江卷】关于化合物 的性质,下列推测不合理的是
A.与稀盐酸反应生成 、 、
B.隔绝空气加热分解生成FeO、 、
C.溶于氢碘酸(HI),再加 萃取,有机层呈紫红色
D.在空气中,与 高温反应能生成
【答案】B
【解析】已知化合物 中Fe的化合价为+3价,CHO-带一个单位负电荷,据此分析解题。A.由
3
分析可知,化合物 中Fe的化合价为+3价,故其与稀盐酸反应生成 、 、 ,
反应原理为:FeO(OCH)+3HCl=FeCl +H O+CHOH,A不合题意;B.由分析可知,化合物
3 3 2 3
中Fe的化合价为+3价,C为-2,若隔绝空气加热分解生成FeO、 、 则得失电子
总数不相等,不符合氧化还原反应规律,即不可能生成FeO、 、 ,B符合题意;C.由分析
可知,化合物 中Fe的化合价为+3价,故其溶于氢碘酸(HI)生成的Fe3+能将I-氧化为I,反
2
应原理为:2FeO(OCH)+6HI=2FeI +I +2H O+2CHOH,再加 萃取,有机层呈紫红色,C不合题意;
3 2 2 2 3
D.化合物 在空气中高温将生成Fe O、CO 和HO,然后Fe O 为碱性氧化物,SiO 为酸
2 3 2 2 2 3 2
性氧化物,故化合物 与 高温反应能生成 ,D不合题意;故答案为:B。
8.【2022年湖南卷】为探究 的性质,进行了如下实验( 和 溶液浓度均为 )。
实验 操作与现象
① 在 水中滴加2滴 溶液,呈棕黄色;煮沸,溶液变红褐色。
在 溶液中滴加2滴 溶液,变红褐色;
②
再滴加 溶液,产生蓝色沉淀。在 溶液中滴加2滴 溶液,变红褐色;
③
将上述混合液分成两份,一份滴加 溶液,无蓝色沉淀生;
另一份煮沸,产生红褐色沉淀。
依据上述实验现象,结论不合理的是
A.实验①说明加热促进 水解反应
B.实验②说明 既发生了水解反应,又发生了还原反应
C.实验③说明 发生了水解反应,但没有发生还原反应
D.整个实验说明 对 的水解反应无影响,但对还原反应有影响
【答案】D
【解析】铁离子水解显酸性,亚硫酸根离子水解显碱性,两者之间存在相互促进的水解反应,同时铁离子
具有氧化性,亚硫酸根离子具有还原性,两者还会发生氧化还原反应,在同一反应体系中,铁离子的
水解反应与还原反应共存并相互竞争,结合实验分析如下:实验①为对照实验,说明铁离子在水溶液
中显棕黄色,存在水解反应Fe3++3H O Fe(OH) +3H+,煮沸,促进水解平衡正向移动,得到红褐
2 3
色的氢氧化铁胶体;实验②说明少量亚硫酸根离子加入铁离子后,两者发生水解反应得到红褐色的氢
氧化铁胶体;根据铁氰化钾检测结果可知,同时发生氧化还原反应,使铁离子被还原为亚铁离子,而
出现特征蓝色沉淀;实验③通过反滴操作,根据现象描述可知,溶液仍存在铁离子的水解反应,但由
于铁离子少量,没检测出亚铁离子的存在,说明铁离子的水解反应速率快,铁离子的还原反应未来得
及发生。A.铁离子的水解反应为吸热反应,加热煮沸可促进水解平衡正向移动,使水解程度加深,
生成较多的氢氧化铁,从而使溶液显红褐色,故A正确;B.在5mLFeCl 溶液中滴加2滴同浓度的
3
NaSO 溶液,根据现象和分析可知,Fe3+既发生了水解反应,生成红褐色的氢氧化铁,又被亚硫酸根
2 3
离子还原,得到亚铁离子,加入铁氰化钾溶液后,出现特征蓝色沉淀,故B正确;C.实验③中在
5mL Na SO 溶液中滴加2滴同浓度少量FeCl 溶液,根据现象和分析可知,仍发生铁离子的水解反应,
2 3 3
但未来得及发生铁离子的还原反应,即水解反应比氧化还原反应速率快,故C正确;D.结合三组实
验,说明铁离子与亚硫酸根离子混合时,铁离子的水解反应占主导作用,比氧化还原反应的速率快,
因证据不足,不能说明亚硫酸离子对铁离子的水解作用无影响,事实上,亚硫酸根离子水解显碱性,
可促进铁离子的水解反应,故D错误。综上所述,答案为D。
9.(2021·广东真题)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
A. 可与 反应生成B. 既可被氧化,也可被还原
C.可将 加入浓碱液中制得 的胶体
D.可存在 的循环转化关系
【答案】C
【解析】图中所示铁元素不同化合价的物质:a为Fe,b为FeCl 、FeSO 、Fe(NO ) 等Fe(II)的盐类物质,c
2 4 3 2
为Fe(OH) ,e为FeCl 、Fe (SO )、Fe(NO ) 等Fe(III)的盐类物质,d为Fe(OH) 。A.Fe与Fe(III)的盐
2 3 2 4 3 3 3 3
类物质可发生反应生成Fe(II)的盐类物质,如Fe+2FeCl =3FeCl ,故A不选;B.Fe(II)为铁元素的中
3 2
间价态,既有还原性也有氧化性,因此既可被氧化,也可被还原,故B不选;C.Fe(III)的盐类物质与
浓碱液反应生成Fe(OH) 沉淀,制备Fe(OH) 胶体操作为:向沸水中滴加饱和FeCl 溶液,继续煮沸至
3 3 3
溶液呈红褐色,停止加热,故C选;D. 转化如
,故D不选;综上所述,答案为
C。
10.(2014·上海高考真题)用FeCl 溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充
3
分反应后的溶液分析合理的是
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
【答案】B
【解析】氧化性是Fe3+>Cu2+>Fe2+,还原性是Fe>Cu,则A、若无固体剩余,这说明铁粉完全被氧化,
但此时溶液中不一定还有Fe3+,A不正确;B、若有固体存在,则固体中一定有铜,可能还有铁,因
此溶液中一定有Fe2+,B正确;C、若溶液中有Cu2+,则也可能有部分铜已经被置换出来,因此不一
定没有固体析出,C不正确;D、若溶液中有Fe2+,但如果溶液铁离子过量,则不一定有Cu析出,D
不正确;答案选B。
11.(2020·浙江高考真题)黄色固体X,可能含有漂白粉、FeSO 、Fe (SO ) 、CuCl 、KI之中的几种或
4 2 4 3 2
全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是( )
A.X中含KI,可能含有CuCl
2
B.X中含有漂白粉和FeSO
4
C.X中含有CuCl ,Y中含有Fe(OH)
2 3
D.用H SO 酸化溶液Z,若有黄绿色气体放出,说明X中含有CuCl
2 4 2
【答案】C
【解析】固体X为黄色,则含有Fe (SO ),溶于水后,要使溶液Z为无色碱性,则一定含有漂白粉,且漂
2 4 3
白粉过量,得到深棕色固体混合物Y,则固体Y是Fe(OH) 和Cu(OH) 的混合物,X中一定含有CuCl ,
3 2 2
FeSO 和Fe (SO ) 中含有其中一种或两种都含,据此解答。A.若X含有KI,则会与漂白粉反应生成
4 2 4 3
I,溶液不为无色,A不正确;B.由分析可知,不一定含有FeSO ,B不正确;C.由分析可知, X
2 4含有CuCl ,Y含有Fe(OH) ,C正确;D.酸化后,产生黄绿色气体,为氯气,则发生的发生反应的
2 3
离子反应方程式为:Cl-+ClO-+2H+=Cl↑+H O,此时的Cl-有可能来自于漂白粉氧化FeSO 产生的Cl-,
2 2 4
也有可能是漂白粉自身含有的,不能推导出含有CuCl ,D不正确;故选C。
2
12.(2019江苏) 下列有关化学反应的叙述正确的是
A.Fe在稀硝酸中发生钝化 B.MnO 和稀盐酸反应制取Cl
2 2
C.SO 与过量氨水反应生成(NH )SO D.室温下Na与空气中O 反应制取NaO
2 4 2 3 2 2 2
【答案】C
【解析】A.常温下,Fe在与浓硝酸发生钝化反应,错误;B.二氧化锰与浓盐酸在加热条件下反应制取
氯气,错误;C.二氧化硫与过量氨水反应生成硫酸铵,正确;D.常温下,Na与空气中的氧气反应
生成NaO;加热条件下,钠与氧气反应生成NaO,错误;综上所述,本题应选C。
2 2 2
13.(2019·海南高考真题)我国古代典籍中有“石胆……浅碧色,烧之变白色者真”的记载,其中石胆是
指( )
A. B.
C. D.
【答案】A
【解析】在选项给出的四种物质中只有 、 晶体有色,而 和
均为无色晶体, 加热分解生成CuSO 和HO,CuSO 呈白色;而
4 2 4
加热发生分解反应,生成的Fe O 呈红棕色,所以符合题意的物质是 ,
2 3
故合理选项是A。
14.(2018海南卷)絮凝剂有助于去除工业和生活废水中的悬浮物。下列物质可作为絮凝剂的是
A.NaFe(SO )·6H O B.CaSO·2H O
4 2 2 4 2
C.Pb(CH COO) ·3H O D.KAl(SO )·12H O
3 2 2 4 2 2
【答案】AD
【解析】由题意知,絮凝剂有助于去除工业和生活废水中的悬浮物,因此,絮凝剂本身或与水生成的产物
具有吸附性。A.铁离子能水解生成氢氧化铁胶体可吸附悬浮物,符合题意;B.硫酸钙本身是微溶物,
没有吸附作用,不符合题意;C.醋酸铅没有吸附性,不符合题意;D.明矾可净水,其原理是铝离子
水解生成氢氧化铝胶体,可吸附悬浮物,符合题意;故答案为AD。
15.【2016年高考上海卷】下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是
A.氧化镁中混有氧化铝 B.氯化铝溶液中混有氯化铁
C.氧化铁中混有二氧化硅 D.氯化亚铁溶液中混有氯化铜
【答案】D
【解析】A.MgO是碱性氧化物与NaOH不能反应,而Al O 是两性氧化物,可以与NaOH发生反应产生
2 3
NaAlO ,过滤后洗涤,就得到纯净的MgO,错误;B.向溶液中加入过量的NaOH溶液,氯化铁变为
2
Fe(OH) 沉淀,氯化铝变为NaAlO ,过滤,然后向溶液中加入适量的盐酸,当沉淀达到最大值中,过
3 2滤,得到Al(OH) ,再分别向两种物质的沉淀中加入适量的盐酸溶解,就得到氯化铝溶液,除去了杂
3
质,错误;C.二氧化硅是酸性氧化物,可以与 NaOH发生反应,而氧化铁与NaOH不能发生反应。
加入过量的NaOH,然后过滤洗涤,就得到纯净的氧化铁,错误;D.二者都可以与NaOH发生反应,
当再向得到的沉淀中加入盐酸时,二者都溶解,不能分离、提纯二者,正确。
16.【2015新课标Ⅰ卷理综化学】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是(
)
选项 实 验 现 象 结 论
将稀硝酸加入过量铁粉中,充分反应后 有气体生成,溶液呈血红 稀硝酸将Fe氧化为Fe3
A.
滴加KSCN溶液 色 +
溶液变蓝、有黑色固体出
B. 将铜粉加1.0 mol·L-1 Fe (SO ) 溶液中 金属铁比铜活泼
2 4 3
现
用坩埚钳夹住一小块用砂纸仔细打磨过
C. 熔化后的液态铝滴落下来 金属铝的熔点较低
的铝箔在酒精灯上加热
将0.1mol·L-1MgSO 溶液滴入NaOH溶
4
先有白色沉淀生成后变为 Cu(OH) 的溶度积比
2
D. 液至不再有沉淀产生,再滴加
浅蓝色沉淀 Mg(OH) 的小
2
0.1mol·L-1CuSO 溶液
4
【答案】D
【解析】A、稀硝酸与过量的Fe分反应,则生成硝酸亚铁和NO气体、水,无铁离子生成,所以加入
KSCN溶液后,不变红色,现象错误;B、Cu与硫酸铁发生氧化还原反应,生成硫酸铜和硫酸亚铁,
无黑色固体出现,现象错误;C、铝在空气中加热生成氧化铝的熔点较高,所以内部熔化的铝不会滴
落,现象错误;D、硫酸镁与氢氧化钠溶液反应生成氢氧化镁沉淀(硫酸镁足量是关键信息),再加
入硫酸铜,则生成氢氧化铜蓝色沉淀,沉淀的自发转化应该由溶解度小的向溶解度更小的沉淀转化,
所以氢氧化铜的溶度积比氢氧化镁的溶度积小,正确,答案选D。
17.【2015北京理综化学】在通风橱中进行下列实验:
步骤
现象 Fe 表面产生大量无色气 Fe表面产生少量红棕 Fe、Cu接触后,其表面
泡,液面上方变为 色气泡后,迅速 产生红棕色气泡
红棕色 停止
下列说法中不正确的是( )
A.Ⅰ 种气体有无色变红棕色的化学方程式为:2NO+O =2NO
2 2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO 的氧化性强于浓HNO
3 3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化【答案】C
【解析】I是铁与稀硝酸反应生成无色气体NO,NO被空气中的氧气氧化生成红棕色的NO 气体,正确;
2
II的现象是因为铁发生了钝化,Fe表面形成致密的氧化层,阻止Fe进一步反应,正确;实验II反应
停止是因为发生了钝化,不能用来比较稀硝酸和浓硝酸的氧化性强弱,物质氧化性强弱只能通过比较
物质得电子能力大小来分析,错误;III中Fe、Cu都能与硝酸反应,二者接触,符合原电池构成条件,
要想验证铁是否为负极,发生氧化反应,可以连接电流计,正确。
18.【2015上海化学】检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )
A.NaOH B.KMnO C.KSCN D.苯酚
4
【答案】B
【解析】A.若加入NaOH,硫酸亚铁发生复分解反应产生的白色Fe(OH) 会被硫酸铁发生反应产生的红褐
2
色的Fe(OH) 遮挡,不容易观察到,因此不能鉴定,错误。B.KMnO 有氧化性,硫酸亚铁有还原性,
3 4
会发生氧化还原反应,使KMnO 的紫色褪去,而硫酸铁不能与KMnO 发生反应,因此可以作为鉴定
4 4
试剂,正确。C.KSCN与硫酸铁会发生反应,使溶液变红色,而硫酸亚铁不能反应,因此无论硫酸
亚铁是否存在,溶液都变红色,因此无法鉴定,错误。D.苯酚与硫酸铁溶液发生显色反应,使溶液
变为紫色,而与硫酸亚铁不能发生反应,无论硫酸亚铁是否存在,溶液都变紫色,所以不能作为鉴定
试剂,错误。
19.(2012·江苏高考真题)下列有关物质的性质与应用不相对应的是
A.明矾能水解生成Al(OH) 胶体,可用作净水剂
3
B.FeCl 溶液能与Cu反应,可用于蚀刻印刷电路
3
C.SO 具有氧化性,可用于漂白纸浆
2
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
【答案】C
【解析】A.明矾在水溶液中能电离出Al3+,水解生成Al(OH) 胶体,Al(OH) 胶体具有较强的吸附
3 3
能力,可用于净水,正确;B.Fe3+具有氧化性,可与Cu发生氧化还原反应而用于蚀刻印刷电路,正
确;C.SO 用于漂白纸浆是由于具有漂白性,反应类型为化合反应,与氧化性、还原性无关,错误;
2
D.Zn为活泼金属,具有良好的导电性,易失去电子,可作原电池的负极,正确。故选C。
20、【2012年高考天津卷】下列单质或化合物性质的描述正确的是( )
A.NaHSO 水溶液显中性
4
B.SiO 与酸、碱均不反应
2
C.NO 溶于水时发生氧化还原反应
2
D.Fe在足量Cl 中燃烧生成FeCl 和FeCl
2 2 3
【答案】C
【 解 析 】 NaHSO=Na++H++S ; 溶 液 显 酸 性 ; A 错 误 ; SiO+4HF=SiF ↑+2H O 、
4 2 4 2
SiO+2NaOH=Na SiO+H O;B错误;3NO +H O=2HNO +NO;有化合价变化;为氧化还原反应;C
2 2 3 2 2 2 3
正确;Fe在Cl 中燃烧只得到FeCl ;D错误。
2 3
21.【2015广东理综化学】下列实验操作、现象和结论均正确的是( )选项 实验操作 现象 结论
A 分别加热NaCO 和NaHCO 固体 试管内壁都有水珠 两种物质均受热分解
2 3 3
B 向稀的苯酚水溶液中滴加饱和溴水 生成白色沉淀 产物三溴苯酚不溶于水
向含I-的无色溶液中滴加少量新制氯 加入淀粉后溶液变成蓝
C 氧化性:Cl>I
2 2
水,再滴加淀粉溶液 色
向FeSO 溶液中先滴入KSCN溶液再 加入HO 后溶液变成血 Fe2+既有氧化性又有还
4 2 2
D
滴加HO 溶液 红色 原性
2 2
【答案】BC
【解析】NaCO 加热时产生的水珠是空气中的水凝结形成,不是分解生成的,A错;苯酚溶液中滴加饱和
2 3
溴水生成白色沉淀,说明产物三溴苯酚不溶于水,B对;淀粉溶液变成蓝色则生成了I,说明氯水把I
2
—氧化成了I , 故氧化性:Cl>I ,C对;FeSO 溶液中先滴入KSCN溶液再滴加HO 溶液,溶液变成
2 2 2 4 2 2
血红色,说明HO 把Fe2+氧化为Fe3+,体现了Fe2+的还原性,没有体现氧化性,D错。
2 2
22.【2015天津理综化学】下列关于物质或离子检验的叙述正确的是( )
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO
2
【答案】B
【解析】Fe3+遇KSCN会使溶液呈现红色,Fe2+遇KSCN不反应无现象,如果该溶液既含Fe3+,又含Fe2+,
滴加KSCN 溶液,溶液呈红色,则证明存在Fe3+但并不能证明无Fe2+,项错误;气体通过无水硫酸铜,
粉末变蓝,则发生反应:CuSO +5H O═CuSO·5H O,CuSO ·5H O为蓝色,故可证明原气体中含有水
4 2 4 2 4 2
蒸气,正确;灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,Na+颜色反应为黄色,但并不能证明
无K+,因为黄光可遮住紫光,故K+颜色反应需透过蓝色的钴玻璃滤去黄光后观察,项错误;能使澄
清石灰水变浑浊的气体有CO 、SO 等,故将气体通入澄清石灰水,溶液变浑浊,则原气体比一定是
2 2
CO,错误;本题选B。
2
23.【2022年1月浙江卷】化合物X由4种元素组成。某兴趣小组按如图流程进行实验:
请回答:(1)组成X的元素有______,X的化学式为______。
(2)溶液C中溶质的成分是______(用化学式表示);根据C→D→E的现象,给出相应微粒与阳离子结合
由弱到强的排序______。
(3)X与足量Na反应生成固体F的化学方程式是______。
(4)设计实验确定溶液G中阴离子______。
【答案】(1) Fe、S、O、H FeH(SO )
4 2
(2) FeCl 、HCl、BaCl Cl-、HO、SCN-、OH-
3 2 2
(3)2FeH(SO )+40Na 2Fe+4Na S+16Na O+H
4 2 2 2 2
(4)用玻璃棒蘸取溶液G,点在红色石蕊试纸上,若变蓝,说明存在OH-;取少量溶液G,加入足量
HO,用盐酸酸化,再加入BaCl 溶液,有白色沉淀,说明有S2-
2 2 2
【解析】X形成水溶液,与氯化钡反应生产白色沉淀,且沉淀不与盐酸反应说明生产硫酸钡,说明X含有
硫酸根,溶液加入KSCN变红说明含有Fe3+,B为4.66g则为0.02mol硫酸钡,说明X含有0.02mol的
硫酸根,H中为Fe单质,即为0.01mol,X中含有0.01molFe,由此可知X中应含有0.01的H,据此
分析解题。
(1)由分析可知,组成X的元素有:Fe、S、O、H;X的化学式为FeH(SO );
4 2
(2)X 为FeH(SO ) 与氯化钡反应,溶液C中溶质的成分是FeCl 、HCl以及过量的BaCl ;根据C为溶液,
4 2 3 2
铁离子在水中会水解,C→D形成络合物,D→E形成沉淀,相应微粒与阳离子结合由弱到强的排序:
Cl-、HO、SCN-、OH-;
2
(3)X与足量Na反应生成固体F的化学方程式是:2FeH(SO )+40Na 2Fe+4Na S+16Na O+H;
4 2 2 2 2
(4)设计实验确定溶液G中阴离子:用玻璃棒蘸取溶液G,点在红色石蕊试纸上,若变蓝,说明存在
OH-;取少量溶液G,加入足量HO,用盐酸酸化,再加入BaCl 溶液,有白色沉淀,说明有S2-。
2 2 2