文档内容
鹤岗市第一中学 2022-2023 学年度上学期高三化学开 D. 溶液中:Na、 、K+、
学考试题
相对原子质量 H:1 C:12 N: 14 O:16 S:32 Cl:35.5 Na:23 K:39
5.下列与实验相关的叙述正确的是 ( )
Fe:56 Cu:64
A.碳酸钠溶液应保存在带有玻璃塞的试剂瓶中
第Ⅰ卷 选择题部分 B.将氯化铁溶液直接加热蒸干制得氯化铁晶体
C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+,无K+
一.选择题(55分,1-20,每题2分,21-25,每题3分)
D.配制0.1mol/L的HSO 溶液,用量筒量取浓硫酸时,仰视读数,使结果偏高
1.化学与科技、生产、生活密切相关。下列有关说法不正确的是( ) 2 4
6.下列说法正确的是( )
A. 将Cl 通入冷的石灰乳中制得漂白粉
2
A. 铁与碘反应易生成碘化铁
B. 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
B. 电解熔融AlO 可以得到Al
2 3
C. 赤铁矿的主要成分是FeO
3 4
C. 用生石灰沉淀富镁海水中的Mg2+,生成碳酸镁
D. 我国首艘国产001A型航母用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D. SO 通入BaCl 溶液中生成BaSO 沉淀
2 2 3
2.下列叙述正确的是( )
7.下列除杂试剂或方法选用正确且除杂过程不涉及氧化还原反应的是( )
A.HCl(aq)和NaOH(aq)反应的中和热为 ΔH=–57.3kJ/mol,则HSO(aq)和Ba(OH)(aq)反应的中
2 4 2
物质 括号内为杂质 除杂试剂
和热为 ΔH=2×(–57.3)kJ/mol
B.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得值偏 A. 溶液 粉
小
B. Mg单质(Al单质) 溶液、过滤、洗涤、干燥
C.CO(g)燃烧热ΔH=–283.0kJ/mol,则2CO(g) = 2CO(g) + O(g)反应的ΔH=+2×283.0kJ/mol
2 2
C. NaCO 固体(NaHCO) 加热至恒重
2 3 3
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D. 、无水
3. 下列离子方程式中,书写正确的是( )
A.向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色:2MnO_+5CO2_+16H+=2Mn2++10CO↑+8HO
4 2 4 2 2
B.氧化亚铁溶于稀硝酸:FeO+2H+===Fe2++HO 8.下列有关金属及其化合物的应用不合理的是 ( )
2
C.向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3HO=== Fe(OH)↓+3H+
2 3 A. 可用H 还原MgO制备单质镁
2
D.室温下用稀NaOH溶液吸收Cl:Cl+2OH-===ClO-+Cl-+HO
2 2 2
4.常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 溶液中: 、K+、 、
B.无色溶液中: 、K+、 、
C.含 的溶液中: 、OH-、Na+、
第 1 页 共 7 页
学科网(北京)股份有限公司第 1 页 共 7 页
B. 铝中加入适量锂,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地 含有较多 等 不利于作物生长,可施加石膏进行改良 13.下列“类比”合理的是( )
A.Na与HO反应生成NaOH和H,则Fe与HO反应生成Fe(OH) 和H
D. 无水 ,呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水 2 2 2 3 2
B.NaClO溶液与CO 反应生成NaHCO 和HClO,则NaClO溶液与SO 反应生成NaHSO 和HClO
9.下列说法不正确的是( ) 2 3 2 3
C.NaN与盐酸反应生成NaCl和NHCl,则MgN 与盐酸反应生成MgCl 和NHCl
A.钠着火可用干沙土灭火 3 4 3 2 2 4
D.NaOH溶液与少量AgNO 溶液反应生成AgO和NaNO,则氨水与少量AgNO 溶液反应生成AgO和
B.硅晶体的导电性介于导体和绝缘体之间,是一种重要的半导体材料 3 2 3 3 2
NHNO
4 3
C.光导纤维的主要成分是硅
14.下列有关说法正确的是( )
D.青花瓷胎体的原料为高岭土[AlSiO(OH)],若以氧化物形式表示为AlO·2SiO·2HO
2 2 5 4 2 3 2 2
A.必须通过化学变化才能从海水中获得食盐
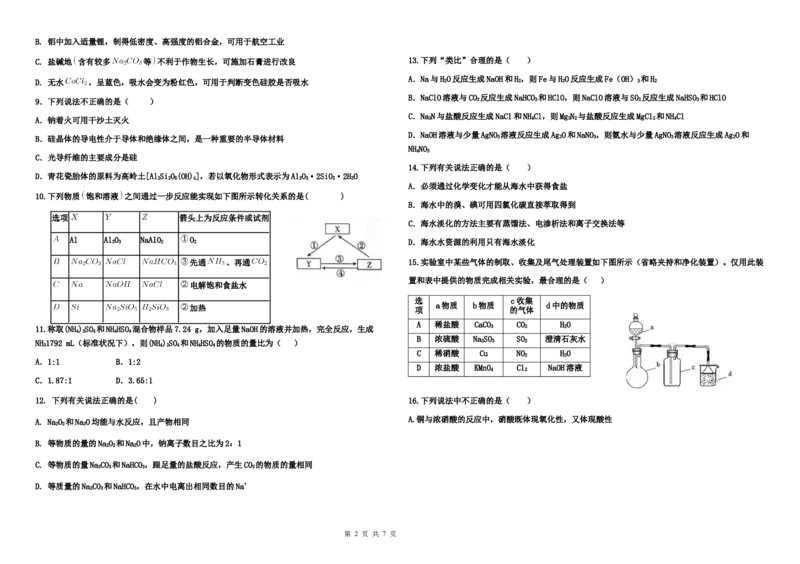
10.下列物质 饱和溶液 之间通过一步反应能实现如下图所示转化关系的是( )
B.海水中的溴、碘可用四氯化碳直接萃取得到
选项 箭头上为反应条件或试剂
C.海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等
Al Al 2 O 3 NaAlO 2 O 2 D.海水水资源的利用只有海水淡化
先通 、再通 15.实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装
置和表中提供的物质完成相关实验,最合理的是( )
电解饱和食盐水
选 c收集
a物质 b物质 d中的物质
加热 项 的气体
A 稀盐酸 CaCO CO HO
11.称取(NH)SO 和NHHSO 混合物样品7.24 g,加入足量NaOH的溶液并加热,完全反应,生成 3 2 2
4 2 4 4 4
B 浓硫酸 NaSO SO 澄清石灰水
NH1792 mL(标准状况下),则(NH)SO 和NHHSO 的物质的量比为( ) 2 3 2
3 4 2 4 4 4
C 稀硝酸 Cu NO HO
2 2
A.1:1 B.1:2
D 浓盐酸 KMnO Cl NaOH溶液
4 2
C.1.87:1 D.3.65:1
12. 下列有关说法正确的是( ) 16.下列说法中不正确的是( )
A.铜与浓硝酸的反应中,硝酸既体现氧化性,又体现酸性
A. NaO 和NaO均能与水反应,且产物相同
2 2 2
B. 等物质的量的NaO 和NaO中,钠离子数目之比为2:1
2 2 2
C. 等物质的量NaCO 和NaHCO,跟足量的盐酸反应,产生CO 的物质的量相同
2 3 3 2
D. 等质量的NaCO 和NaHCO,在水中电离出相同数目的Na+
2 3 3
第 2 页 共 7 页第 2 页 共 7 页
B.常温下,可用铝或铁制容器盛装浓硝酸、浓硫酸 D.用图④装置测量Cu与浓硝酸反应产生气体的体积
C.可用向上排空气方法收集NO 20.将a mL NO、b mL NO 2 和c mL O 2 混合于同一试管中,将试管倒置于水中,充分反应后,试管内
气体全部消失,则a∶b∶c不可能是( )
D.利用氨气极易溶于水的性质可完成喷泉实验
A.1∶1∶1 B.2∶1∶1 C.3∶7∶4 D.1∶5∶2
17.关于硫及含硫化合物的说法中,正确的是( )
21.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解
A.用玻璃棒蘸取浓硫酸滴在胆矾晶体上,晶体表面出现“白斑”,体现浓硫酸的脱水性
9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 已知硝酸只被还
B.自然界中的硫酸钡以重晶石的形式存在,硫酸钙常以石膏(2CaSO H O)的形式存在
4 2
原为NO气体 。下列分析或结果错误的是
C.食品中添加适量SO 可以起到漂白、防腐等作用
2
D.加热条件下,铜和浓硫酸反应生成了蓝色的硫酸铜溶液和能使品红褪色的SO 气体
2
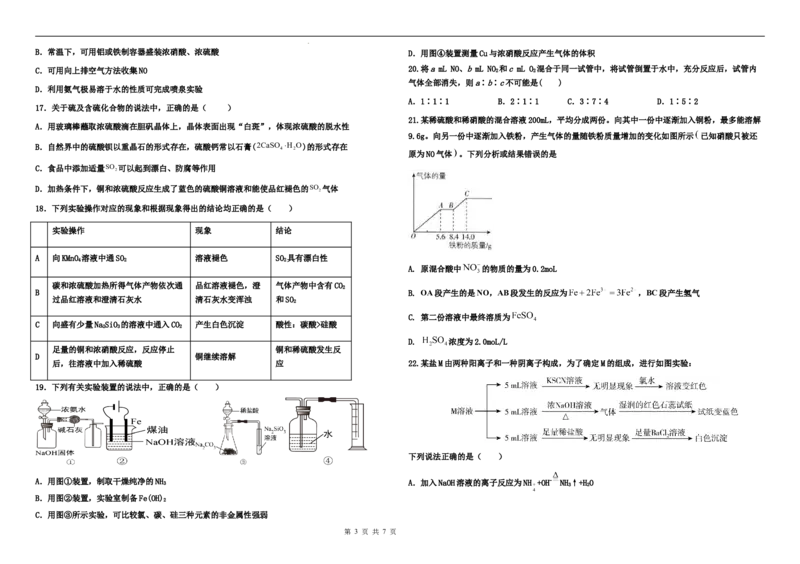
18.下列实验操作对应的现象和根据现象得出的结论均正确的是( )
实验操作 现象 结论
A 向KMnO 溶液中通SO 溶液褪色 SO 具有漂白性
4 2 2
A. 原混合酸中 的物质的量为0.2moL
碳和浓硫酸加热所得气体产物依次通 品红溶液褪色,澄 气体产物中含有CO
2
B B. OA段产生的是NO,AB段发生的反应为 ,BC段产生氢气
过品红溶液和澄清石灰水 清石灰水变浑浊 和SO
2
C. 第二份溶液中最终溶质为
C 向盛有少量NaSiO 的溶液中通入CO 产生白色沉淀 酸性:碳酸>硅酸
2 3 2
D. 浓度为2.0moL/L
足量的铜和浓硝酸反应,反应停止 铜和稀硫酸发生反
D 铜继续溶解
后,往溶液中加入稀硫酸 应 22.某盐M由两种阳离子和一种阴离子构成,为了确定M的组成,进行如图实验:
19.下列有关实验装置的说法中,正确的是( )
下列说法正确的是( )
A.用图①装置,制取干燥纯净的NH 3 A.加入NaOH溶液的离子反应为NH +OH- NH 3 ↑+H 2 O
B.用图②装置,实验室制备Fe(OH)
2
C.用图③所示实验,可比较氯、碳、硅三种元素的非金属性强弱
第 3 页 共 7 页
学科网(北京)股份有限公司第 3 页 共 7 页
B.加入氯水发生的离子反应为Fe2++Cl=2Cl-+Fe3+
2
C.M可能是NHFe(SO)
4 4 2
D.上述白色沉淀是BaSO
4
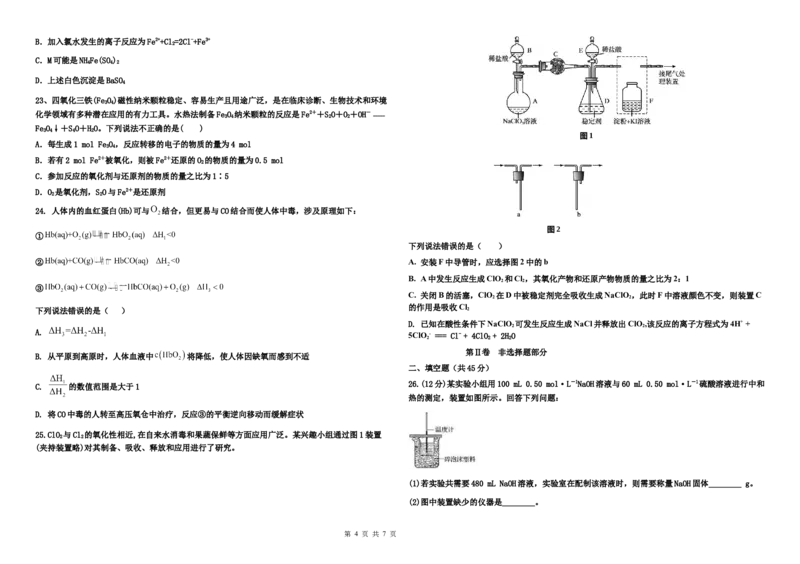
23、四氧化三铁(FeO)磁性纳米颗粒稳定、容易生产且用途广泛,是在临床诊断、生物技术和环境
3 4
化学领域有多种潜在应用的有力工具。水热法制备FeO 纳米颗粒的反应是Fe2++SO+O+OH-
3 4 2 2 -----
FeO↓+SO+HO。下列说法不正确的是( )
3 4 4 2
图1
A.每生成1 mol FeO,反应转移的电子的物质的量为4 mol
3 4
B.若有2 mol Fe2+被氧化,则被Fe2+还原的O 的物质的量为0.5 mol
2
C.参加反应的氧化剂与还原剂的物质的量之比为1∶5
D.O 是氧化剂,SO与Fe2+是还原剂
2 2
24. 人体内的血红蛋白(Hb)可与 结合,但更易与CO结合而使人体中毒,涉及原理如下:
图2
①
下列说法错误的是( )
② A. 安装F中导管时,应选择图2中的b
B. A中发生反应生成ClO 和Cl ,其氧化产物和还原产物物质的量之比为2:1
2 2
③
C. 关闭B的活塞,ClO 在D中被稳定剂完全吸收生成NaClO ,此时F中溶液颜色不变,则装置C
2 2
的作用是吸收Cl
下列说法错误的是( ) 2
D. 已知在酸性条件下NaClO 可发生反应生成NaCl并释放出ClO ,该反应的离子方程式为4H+ +
2 2
A.
5ClO - === Cl- + 4ClO + 2HO
2 2 2
第Ⅱ卷 非选择题部分
B. 从平原到高原时,人体血液中 将降低,使人体因缺氧而感到不适
二、填空题(共45分)
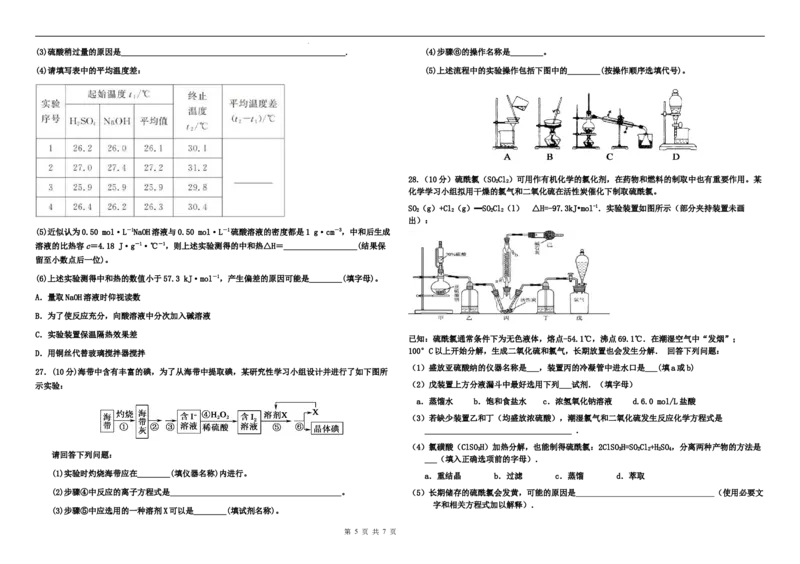
26.(12分)某实验小组用100 mL 0.50 mol·L-1NaOH溶液与60 mL 0.50 mol·L-1硫酸溶液进行中和
C. 的数值范围是大于1
热的测定,装置如图所示。回答下列问题:
D. 将CO中毒的人转至高压氧仓中治疗,反应③的平衡逆向移动而缓解症状
25.ClO 与Cl 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置
2 2
(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)若实验共需要480 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体________ g。
(2)图中装置缺少的仪器是________。
第 4 页 共 7 页第 4 页 共 7 页
(3)硫酸稍过量的原因是_______________________________________________________. (4)步骤⑥的操作名称是________。
(4)请填写表中的平均温度差: (5)上述流程中的实验操作包括下图中的________(按操作顺序选填代号)。
28.(10分)硫酰氯(SOCl)可用作有机化学的氯化剂,在药物和燃料的制取中也有重要作用。某
2 2
化学学习小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯。
SO(g)+Cl(g)═SOCl(l) △H=-97.3kJ•mol-1.实验装置如图所示(部分夹持装置未画
2 2 2 2
出):
(5)近似认为0.50 mol·L-1NaOH溶液与0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成
溶液的比热容c=4.18 J·g-1·℃-1,则上述实验测得的中和热△H=__________________(结果保
留至小数点后一位)。
(6)上述实验测得中和热的数值小于57.3 kJ·mol-1,产生偏差的原因可能是________(填字母)。
A.量取NaOH溶液时仰视读数
B.为了使反应充分,向酸溶液中分次加入碱溶液
C.实验装置保温隔热效果差
已知:硫酰氯通常条件下为无色液体,熔点-54.1℃,沸点69.1℃.在潮湿空气中“发烟”;
D.用铜丝代替玻璃搅拌器搅拌 100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解. 回答下列问题:
(1)盛放亚硫酸纳的仪器名称是___,装置丙的冷凝管中进水口是___(填a或b)
27.(10分)海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如下图所
示实验: (2)戊装置上方分液漏斗中最好选用下列___试剂.(填字母)
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.6.0 mol/L盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应化学方程式是
____________________________________ .
(4)氯磺酸(ClSOH)加热分解,也能制得硫酰氯:2ClSOH=SOCl+HSO,分离两种产物的方法是
3 3 2 2 2 4
请回答下列问题:
___(填入正确选项前的字母).
(1)实验时灼烧海带应在________(填仪器名称)内进行。
a.重结晶 b.过滤 c.蒸馏 d.萃取
(2)步骤④中反应的离子方程式是 。 (5)长期储存的硫酰氯会发黄,可能的原因是 (使用必要文
字和相关方程式加以解释).
(3)步骤⑤中应选用的一种溶剂X可以是________(填试剂名称)。
第 5 页 共 7 页
学科网(北京)股份有限公司第 5 页 共 7 页
29.(13分)以硫铁矿(主要成分为FeS,还有少量CuS、SiO 等杂质)为原料制备绿矾晶体
2 2
(FeSO·7HO)的工艺流程如下:
4 2
(1)“酸浸”过程,矿渣中的FeO 与稀HSO 反应的离子方程式________。
2 3 2 4
(2)烟气中的SO 会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
2
(3)滤液中金属阳离子的检验方法__________。
(4)FeSO 溶液制备绿矾晶体过程中要保持HSO 过量,理由_______________________
4 2 4
(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO 溶液。其
4
过程如图所示:
已知总反应为:FeS+14Fe3++8HO=2SO2-+15Fe2++16H+
2 2 4
将过程I离子方程式补充完整
___FeS +____Fe3++______ = 7Fe2+ + ___SO2- + ___H+
2 2 3
(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1KCrO 溶液滴定至
2 2 7
终点,消耗KCrO 溶液b mL。反应原理:6Fe2++CrO+14H+ =6Fe3++2Cr3++7HO。则绿矾晶体纯度的计
2 2 7 2 2
算式为_____。(FeSO·7HO摩尔质量为278 g/mol)
4 2
第 6 页 共 7 页第 6 页 共 7 页
鹤岗市第一中学高三开学考试化学答案
(5)
选择题(1-20题,每题2分,21-25题每题3分,共55分)
-
1. C 2. C 3. D 4. D 5. D 6. B 7. C 8. A 9. C 10. B
(6)
11. B 12. C 13. C 14. C 15. D
16. C 17. C 18. C 19. B 20. B
1.
21. D 22. D 23. C 24. C 25. B
填空题(共45分)
26.(12分,每空2分)
(1)10.0 (2)环形玻璃搅拌器
(3)使NaOH充分反应,减小反应误差 (4)4.0
(5)-53.5KJ/moL (6)BCD
26. (10分,每空2分)
(1)坩埚 (2)2I-+HO+2H+==I+2HO
2 2 2 2
(3)苯或者四氯化碳 (4)蒸馏 (5)ACD
28.(10分,前2空1分,其余各2分)
(1)蒸馏烧瓶 a (2)b
(3)SO+Cl+2HO=HSO+2HCl (4)C
2 2 2 2 4
(5)SOCl=SO+Cl 分解产生少量的氯气溶解在其中
2 2 2 2
29.(13分,前5空2分,最后1空3分)
(1)FeO+6H+=2Fe3++3HO
2 3 2
(2)SO+2NH·HO=2NH+SO+HO
2 3 2 2
(3)取滤液少许于试管中,滴加K[Fe(CN)](铁氰化钾)溶液,有蓝色沉淀产生,证明滤液中含
3 6
有Fe2+
(4)Fe2++2HO Fe(OH) +2H+,H+过量抑制Fe2+的水解
2 2
第 7 页 共 7 页
学科网(北京)股份有限公司