文档内容
五年(2019-2023)年高考真题分项汇编
专题 09 化学反应速率与化学平衡
〖2023年高考真题〗
考点一 化学反应速率计算与影响因素分析
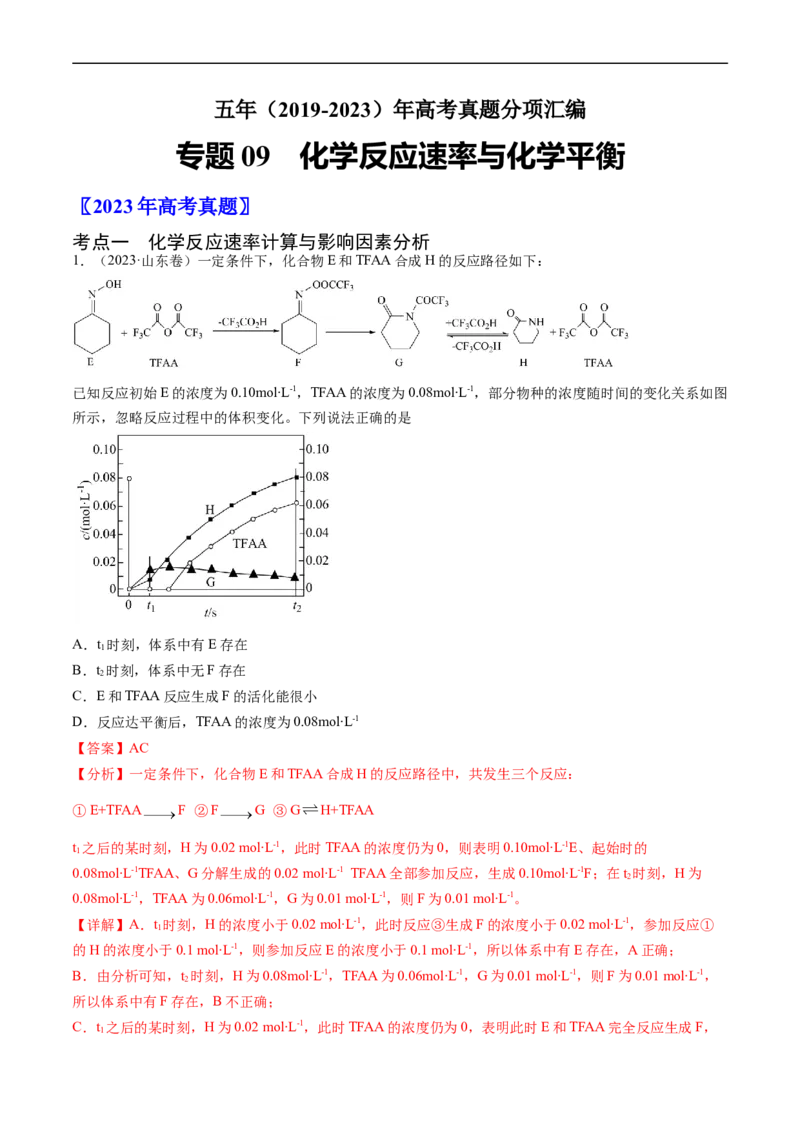
1.(2023·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol∙L-1,TFAA的浓度为0.08mol∙L-1,部分物种的浓度随时间的变化关系如图
所示,忽略反应过程中的体积变化。下列说法正确的是
A.t 时刻,体系中有E存在
1
B.t 时刻,体系中无F存在
2
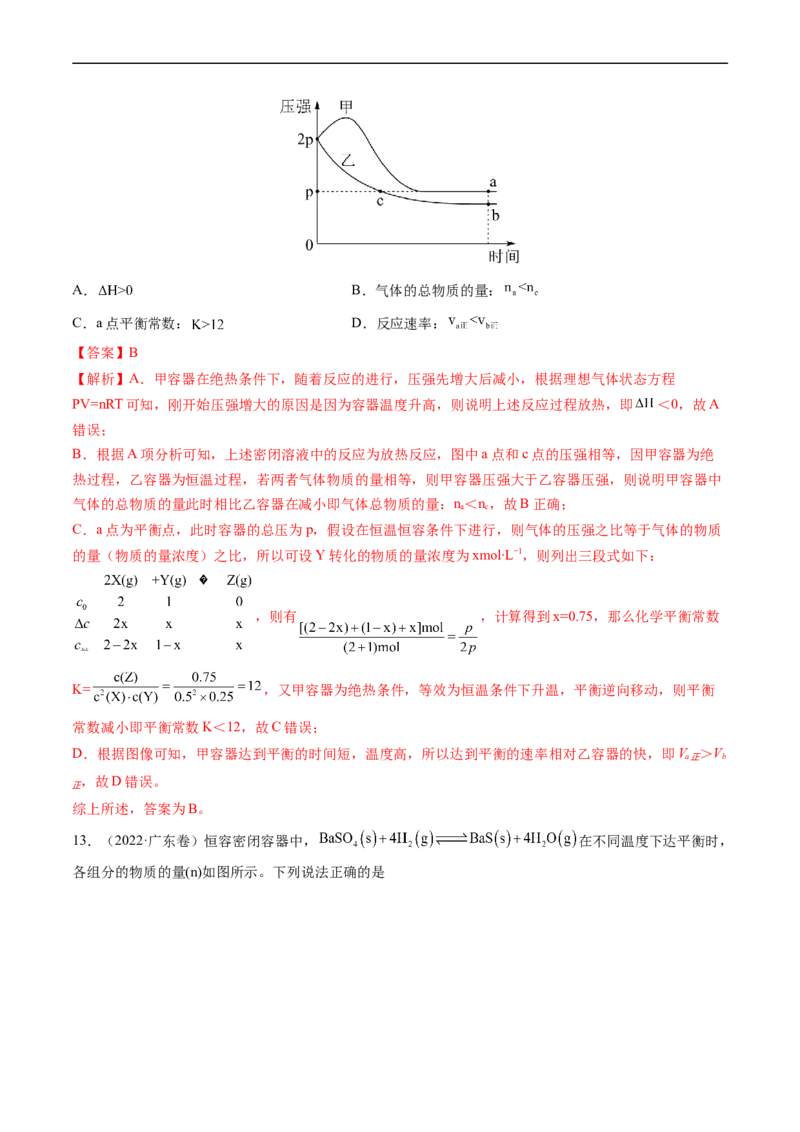
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08mol∙L-1
【答案】AC
【分析】一定条件下,化合物E和TFAA合成H的反应路径中,共发生三个反应:
①E+TFAA F ②F G ③G H+TFAA
t 之后的某时刻,H为0.02 mol∙L-1,此时TFAA的浓度仍为0,则表明0.10mol∙L-1E、起始时的
1
0.08mol∙L-1TFAA、G分解生成的0.02 mol∙L-1 TFAA全部参加反应,生成0.10mol∙L-1F;在t 时刻,H为
2
0.08mol∙L-1,TFAA为0.06mol∙L-1,G为0.01 mol∙L-1,则F为0.01 mol∙L-1。
【详解】A.t 时刻,H的浓度小于0.02 mol∙L-1,此时反应③生成F的浓度小于0.02 mol∙L-1,参加反应①
1
的H的浓度小于0.1 mol∙L-1,则参加反应E的浓度小于0.1 mol∙L-1,所以体系中有E存在,A正确;
B.由分析可知,t 时刻,H为0.08mol∙L-1,TFAA为0.06mol∙L-1,G为0.01 mol∙L-1,则F为0.01 mol∙L-1,
2
所以体系中有F存在,B不正确;
C.t 之后的某时刻,H为0.02 mol∙L-1,此时TFAA的浓度仍为0,表明此时E和TFAA完全反应生成F,
1所以E和TFAA生成F的反应速率快,反应的活化能很小,C正确;
D.在t 时刻,H为0.08mol∙L-1,TFAA为0.06mol∙L-1,G为0.01 mol∙L-1,F为0.01 mol∙L-1,只有F、G全
2
部转化为H和TFAA时,TFAA的浓度才能为0.08mol∙L-1,而G H+TFAA为可逆反应,所以反应达平衡
后,TFAA的浓度一定小于0.08mol∙L-1,D不正确;
故选AC。
考点二 化学平衡及其移动
2.(2023·北京卷)下列事实能用平衡移动原理解释的是
A. 溶液中加入少量 固体,促进 分解
B.密闭烧瓶内的 和 的混合气体,受热后颜色加深
C.铁钢放入浓 中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀 反应过程中,加入少量 固体,促进 的产生
【答案】B
【详解】A.MnO 会催化 HO 分解,与平衡移动无关,A项错误;
2 2 2
B.NO 转化为NO 的反应是放热反应,升温平衡逆向移动, NO 浓度增大,混合气体颜色加深,B项正
2 2 4 2
确;
C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动
无关,C项错误;
D.加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D项错误;
故选B。
考点三 化学反应速率、平衡图像分析
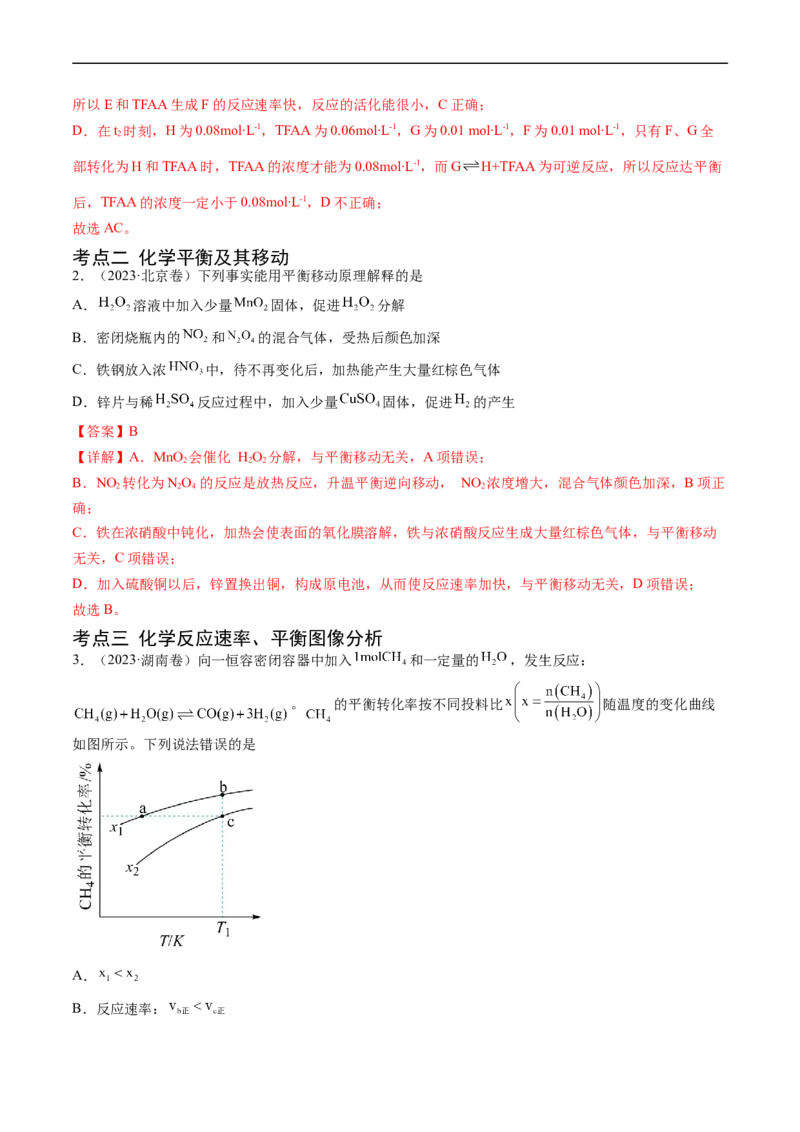
3.(2023·湖南卷)向一恒容密闭容器中加入 和一定量的 ,发生反应:
。 的平衡转化率按不同投料比 随温度的变化曲线
如图所示。下列说法错误的是
A.
B.反应速率:C.点a、b、c对应的平衡常数:
D.反应温度为 ,当容器内压强不变时,反应达到平衡状态
【答案】B
【详解】A.一定条件下,增大水的浓度,能提高CH 的转化率,即x值越小,CH 的转化率越大,则
4 4
,故A正确;
B.b点和c点温度相同,CH 的起始物质的量都为1mol,b点x值小于c点,则b点加水多,反应物浓度
4
大,则反应速率: ,故B错误;
C.由图像可知,x一定时,温度升高CH 的平衡转化率增大,说明正反应为吸热反应,温度升高平衡正向
4
移动,K增大;温度相同,K不变,则点a、b、c对应的平衡常数: ,故C正确;
D.该反应为气体分子数增大的反应,反应进行时压强发生改变,所以温度一定时,当容器内压强不变时,
反应达到平衡状态,故D正确;
答案选B。
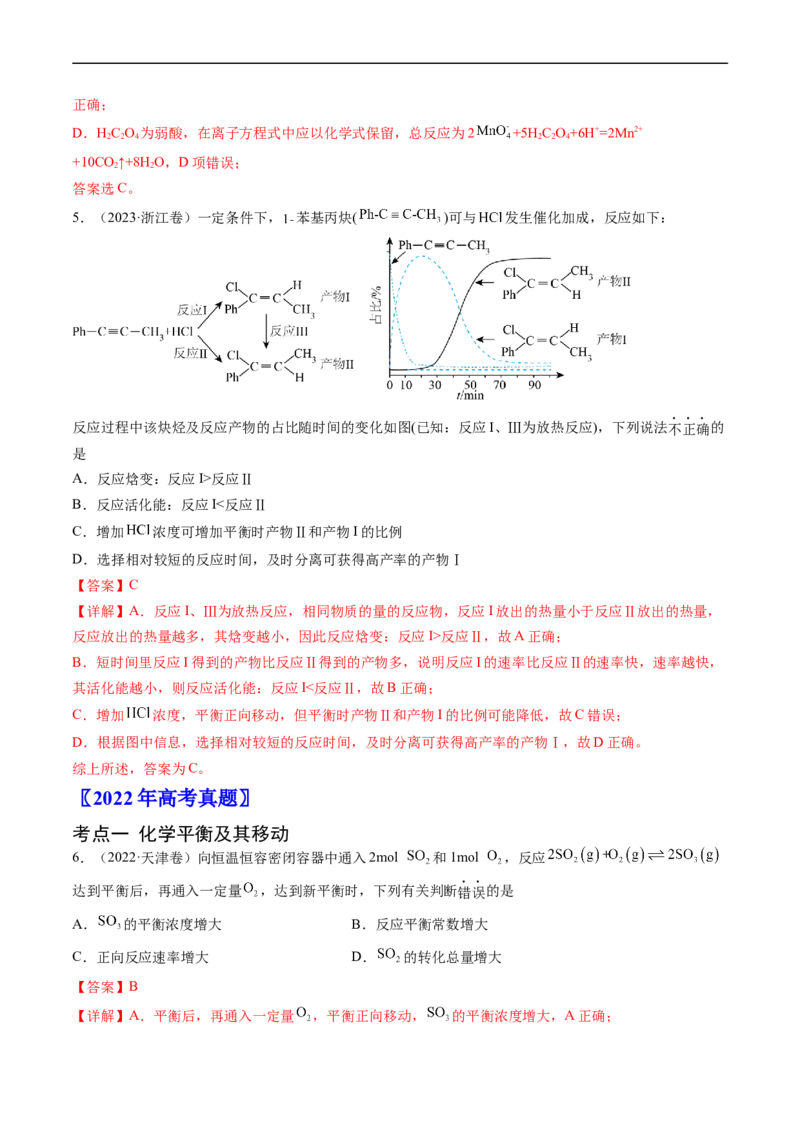
4.(2023·辽宁卷)一定条件下,酸性 溶液与 发生反应, (Ⅱ)起催化作用,过程中不同
价态含 粒子的浓度随时间变化如下图所示。下列说法正确的是
A. (Ⅲ)不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下, (Ⅱ)和 (Ⅶ)不能大量共存
D.总反应为:
【答案】C
【分析】开始一段时间(大约13min前)随着时间的推移Mn(Ⅶ)浓度减小直至为0,Mn(Ⅲ)浓度增大直至
达到最大值,结合图像,此时间段主要生成Mn(Ⅲ),同时先生成少量Mn(Ⅳ)后Mn(Ⅳ)被消耗;后来(大
约13min后)随着时间的推移Mn(Ⅲ)浓度减少,Mn(Ⅱ)的浓度增大;据此作答。
【详解】A.由图像可知,随着时间的推移Mn(Ⅲ)的浓度先增大后减小,说明开始反应生成Mn(Ⅲ),后
Mn(Ⅲ)被消耗生成Mn(Ⅱ),Mn(Ⅲ)能氧化HC O,A项错误;
2 2 4
B.随着反应物浓度的减小,到大约13min时开始生成Mn(Ⅱ),Mn(Ⅱ)对反应起催化作用,13min后反应速
率会增大,B项错误;
C.由图像可知,Mn(Ⅶ)的浓度为0后才开始生成Mn(Ⅱ),该条件下Mn(Ⅱ)和Mn(Ⅶ)不能大量共存,C项正确;
D.HC O 为弱酸,在离子方程式中应以化学式保留,总反应为2 +5H C O+6H+=2Mn2+
2 2 4 2 2 4
+10CO ↑+8H O,D项错误;
2 2
答案选C。
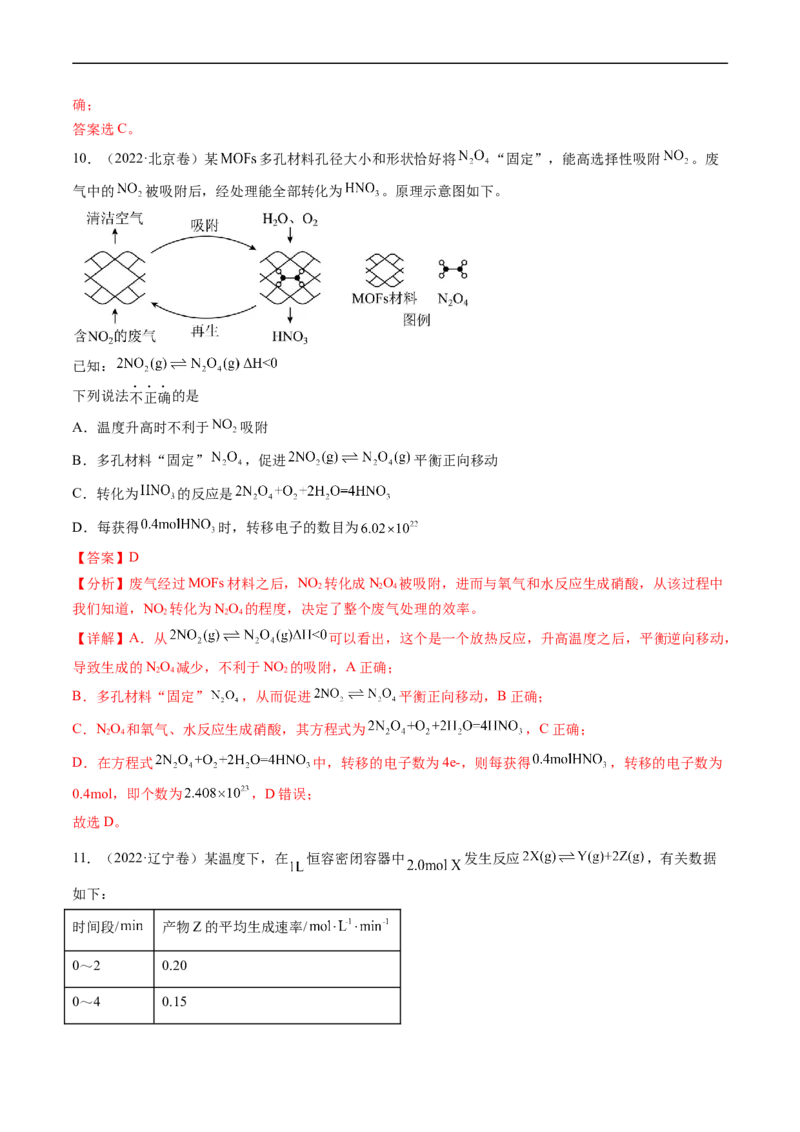
5.(2023·浙江卷)一定条件下, 苯基丙炔( )可与 发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的
是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加 浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
【答案】C
【详解】A.反应I、Ⅲ为放热反应,相同物质的量的反应物,反应I放出的热量小于反应Ⅱ放出的热量,
反应放出的热量越多,其焓变越小,因此反应焓变:反应I>反应Ⅱ,故A正确;
B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,
其活化能越小,则反应活化能:反应I<反应Ⅱ,故B正确;
C.增加 浓度,平衡正向移动,但平衡时产物Ⅱ和产物I的比例可能降低,故C错误;
D.根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,故D正确。
综上所述,答案为C。
〖2022年高考真题〗
考点一 化学平衡及其移动
6.(2022·天津卷)向恒温恒容密闭容器中通入2mol 和1mol ,反应
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是
A. 的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D. 的转化总量增大
【答案】B
【详解】A.平衡后,再通入一定量 ,平衡正向移动, 的平衡浓度增大,A正确;B.平衡常数是与温度有关的常数,温度不变,平衡常数不变,B错误;
C.通入一定量 ,反应物浓度增大,正向反应速率增大,C正确;
D.通入一定量 ,促进二氧化硫的转化, 的转化总量增大,D正确;
故选B。
7.(2022·重庆卷)两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
反应1:NH HCO (s) NH (g)+HO(g)+CO(g) p=3.6×104Pa
4 3 3 2 2 1
反应2:2NaHCO (s) NaCO(s)+HO(g)+CO(g) p=4×103Pa
3 2 3 2 2 2
该温度下,刚性密闭容器中放入NH HCO 和NaCO 固体,平衡后以上3种固体均大量存在。下列说法错
4 3 2 3
误的是
A.反应2的平衡常数为4×106Pa2 B.通入NH ,再次平衡后,总压强增大
3
C.平衡后总压强为4.36×105Pa D.缩小体积,再次平衡后总压强不变
【答案】B
【详解】A.反应2的平衡常数为 ,A正确;
B.刚性密闭容器,温度不变平衡常数不变,再次达平衡后,容器内各气体分压不变,总压强不变,B错
误;
C. , ,
, ,所以总压强为:
,C正确;
D.达平衡后,缩小体积,平衡逆向移动,温度不变,平衡常数不变,再次平衡后总压强不变,D正确;
故选B。
8.(2022·江苏卷)用尿素水解生成的 催化还原 ,是柴油机车辆尾气净化的主要方法。反应为
,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗 ,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
【答案】B
【详解】A.由方程式可知,该反应是一个气体分子数增大的反应,即熵增的反应,反应△S>0,故A错
误;B.由方程式可知,反应平衡常数 ,故B正确;
C.由方程式可知,反应每消耗4mol氨气,反应转移12mol电子,则反应中消耗1mol氨气转移电子的数
目为3mol×4× ×6.02×1023=3×6.02×1023,故C错误;
D.实际应用中,加入尿素的量越多,尿素水解生成的氨气过量,柴油机车辆排放的氨气对空气污染程度
增大,故D错误;
故选B。
9.(2022·浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:
,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下
列说法不正确的是
A.实验①, ,
B.实验②, 时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
【答案】C
【解析】A.实验①中,0~20min,氨气浓度变化量为2.40 10-3mol/L-2.00 10-3mol/L=4.00 10-4mol/L,
v(NH )= =2.00 10-5mol/(L·min),反应速率之比等于化学计量数之比,v(N )= v(NH )=1.00
3 2 3
10-5mol/(L·min),A正确;
B.催化剂表面积大小只影响反应速率,不影响平衡,实验③中氨气初始浓度与实验①中一样,实验③达
到平衡时氨气浓度为4.00 10-4mol/L,则实验①达平衡时氨气浓度也为4.00 10-4mol/L,而恒温恒容条件下,
实验②相对于实验①为减小压强,平衡正向移动,因此实验②60min时处于平衡状态,x<0.4,即x≠0.4,B
正确;
C.实验①、实验②中0~20min、20min~40min氨气浓度变化量都是4.00 10-4mol/L,实验②中60min时反
应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初始浓度是实验②中氨气初始浓度的
两倍,实验①60min时反应未达到平衡状态,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;
D.对比实验①和实验③,氨气浓度相同,实验③中催化剂表面积是实验①中催化剂表面积的2倍,实验
③先达到平衡状态,实验③的反应速率大,说明相同条件下,增加催化剂的表面积,反应速率增大,D正确;
答案选C。
10.(2022·北京卷)某 多孔材料孔径大小和形状恰好将 “固定”,能高选择性吸附 。废
气中的 被吸附后,经处理能全部转化为 。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于 吸附
B.多孔材料“固定” ,促进 平衡正向移动
C.转化为 的反应是
D.每获得 时,转移电子的数目为
【答案】D
【分析】废气经过MOFs材料之后,NO 转化成NO 被吸附,进而与氧气和水反应生成硝酸,从该过程中
2 2 4
我们知道,NO 转化为NO 的程度,决定了整个废气处理的效率。
2 2 4
【详解】A.从 可以看出,这个是一个放热反应,升高温度之后,平衡逆向移动,
导致生成的NO 减少,不利于NO 的吸附,A正确;
2 4 2
B.多孔材料“固定” ,从而促进 平衡正向移动,B正确;
C.NO 和氧气、水反应生成硝酸,其方程式为 ,C正确;
2 4
D.在方程式 中,转移的电子数为4e-,则每获得 ,转移的电子数为
0.4mol,即个数为 ,D错误;
故选D。
11.(2022·辽宁卷)某温度下,在 恒容密闭容器中 发生反应 ,有关数据
如下:
时间段/ 产物Z的平均生成速率/
0~2 0.20
0~4 0.150~6 0.10
下列说法错误的是
A. 时,Z的浓度大于
B. 时,加入 ,此时
C. 时,Y的体积分数约为33.3%
D. 时,X的物质的量为
【答案】B
【详解】A.反应开始一段时间,随着时间的延长,反应物浓度逐渐减小,产物Z的平均生成速率逐渐减
小,则 内Z的平均生成速率大于 内的,故 时,Z的浓度大于 ,A正确;
B. 时生成的Z的物质的量为 , 时生成的Z的物质的量为
,故反应在 时已达到平衡,设达到平衡时生了 ,列三段
式:
根据 ,得 ,则Y的平衡浓度为 ,Z的平衡浓度为 ,平衡常数
, 时Y的浓度为 ,Z的浓度为 ,加入 后Z的浓
度变为 , ,反应正向进行,故 ,B错误;
C.反应生成的Y与Z的物质的量之比恒等于1∶2,反应体系中只有Y和Z为气体,相同条件下,体积之
比等于物质的量之比, ,故Y的体积分数始终约为33.3%,C正确;
D.由B项分析可知 时反应处于平衡状态,此时生成Z为 ,则X的转化量为 ,初始X
的物质的量为 ,剩余X的物质的量为 ,D正确;
故答案选B。
考点三 化学反应速率、平衡图像分析
12.(2022·湖南卷)向体积均为1L的两恒容容器中分别充入 和 发生反应:
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所
示。下列说法正确的是A. B.气体的总物质的量:
C.a点平衡常数: D.反应速率:
【答案】B
【解析】A.甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程
PV=nRT可知,刚开始压强增大的原因是因为容器温度升高,则说明上述反应过程放热,即 <0,故A
错误;
B.根据A项分析可知,上述密闭溶液中的反应为放热反应,图中a点和c点的压强相等,因甲容器为绝
热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中
气体的总物质的量此时相比乙容器在减小即气体总物质的量:n<n,故B正确;
a c
C.a点为平衡点,此时容器的总压为p,假设在恒温恒容条件下进行,则气体的压强之比等于气体的物质
的量(物质的量浓度)之比,所以可设Y转化的物质的量浓度为xmol∙L−1,则列出三段式如下:
,则有 ,计算得到x=0.75,那么化学平衡常数
K= ,又甲容器为绝热条件,等效为恒温条件下升温,平衡逆向移动,则平衡
常数减小即平衡常数K<12,故C错误;
D.根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即V >V
a正 b
,故D错误。
正
综上所述,答案为B。
13.(2022·广东卷)恒容密闭容器中, 在不同温度下达平衡时,
各组分的物质的量(n)如图所示。下列说法正确的是A.该反应的
B.a为 随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入 ,H 的平衡转化率增大
2
【答案】C
【解析】A.从图示可以看出,平衡时升高温度,氢气的物质的量减少,则平衡正向移动,说明该反应的
正反应是吸热反应,即ΔH>0,故A错误;
B.从图示可以看出,在恒容密闭容器中,随着温度升高氢气的平衡时的物质的量减少,则平衡随着温度
升高正向移动,水蒸气的物质的量增加,而a曲线表示的是物质的量不随温度变化而变化,故B错误;
C.容器体积固定,向容器中充入惰性气体,没有改变各物质的浓度,平衡不移动,故C正确;
D.BaSO 是固体,向平衡体系中加入BaSO,不能改变其浓度,因此平衡不移动,氢气的转化率不变,故
4 4
D错误;
故选C。
14.(2022·广东卷)在相同条件下研究催化剂I、Ⅱ对反应 的影响,各物质浓度c随反应时间t的
部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时, 内,
【答案】D
【解析】A.由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故A错误;B.由图可知,催化剂I比催化剂II催化效果好,说明催化剂I使反应活化能更低,反应更快,故B错误;
C.由图可知,使用催化剂II时,在0~2min 内Y的浓度变化了2.0mol/L,而a曲线表示的X的浓度变化
了2.0mol/L,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂II时X浓度随时间t
的变化,故C错误;
D.使用催化剂I时,在0~2min 内,Y的浓度变化了4.0mol/L,则 (Y) = = =2.0
, (X) = (Y) = 2.0 =1.0 ,故D正确;
答案选D。
15.(2022·北京卷)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之
后,以N 为载气,以恒定组成的N、CH 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物
2 2 4
质的量随反应时间变化如图2所示。反应过程中始终未检测到CO,在催化剂上有积碳。
2
下列说法不正确的是
A.反应①为CaO+CO =CaCO ;反应②为CaCO +CH CaO+2CO+2H
2 3 3 4 2
B.t~t,n(H )比n(CO)多,且生成H 速率不变,可能有副反应CH C+2H
1 3 2 2 4 2
C.t 时刻,副反应生成H 的速率大于反应②生成H 速率
2 2 2
D.t 之后,生成CO的速率为0,是因为反应②不再发生
3
【答案】C
【详解】A.由题干图1所示信息可知,反应①为CaO+CO =CaCO ,结合氧化还原反应配平可得反应②为
2 3
,A正确;
B.由题干图2信息可知,t~t,n(H )比n(CO)多,且生成H 速率不变,且反应过程中始终未检测到CO,
1 3 2 2 2
在催化剂上有积碳,故可能有副反应 ,反应②和副反应中CH 和H 的系数比均为1:2,
4 2
B正确;
C.由题干反应②方程式可知,H 和CO的反应速率相等,而t 时刻信息可知,H 的反应速率未变,仍然
2 2 2
为2mmol/min,而CO变为1~2mmol/min之间,故能够说明副反应生成H 的速率小于反应②生成H 速率,
2 2C错误;
D.由题干图2信息可知,t 之后,CO的速率为0,CH 的速率逐渐增大,最终恢复到1,说明生成CO的
3 4
速率为0,是因为反应②不再发生,而后副反应逐渐停止反应,D正确;
答案选C。
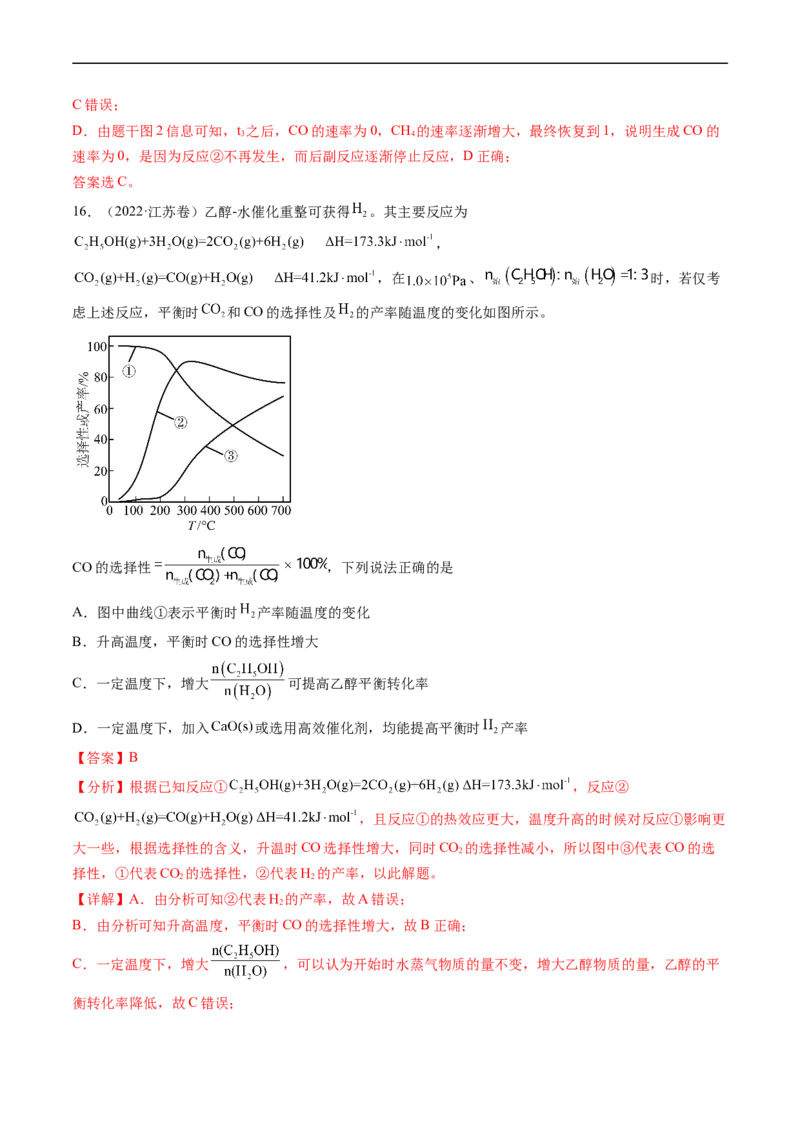
16.(2022·江苏卷)乙醇-水催化重整可获得 。其主要反应为
,
,在 、 时,若仅考
虑上述反应,平衡时 和CO的选择性及 的产率随温度的变化如图所示。
CO的选择性 ,下列说法正确的是
A.图中曲线①表示平衡时 产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大 可提高乙醇平衡转化率
D.一定温度下,加入 或选用高效催化剂,均能提高平衡时 产率
【答案】B
【分析】根据已知反应① ,反应②
,且反应①的热效应更大,温度升高的时候对反应①影响更
大一些,根据选择性的含义,升温时CO选择性增大,同时CO 的选择性减小,所以图中③代表CO的选
2
择性,①代表CO 的选择性,②代表H 的产率,以此解题。
2 2
【详解】A.由分析可知②代表H 的产率,故A错误;
2
B.由分析可知升高温度,平衡时CO的选择性增大,故B正确;
C.一定温度下,增大 ,可以认为开始时水蒸气物质的量不变,增大乙醇物质的量,乙醇的平
衡转化率降低,故C错误;D.加入 或者选用高效催化剂,不会影响平衡时 产率,故D错误;
故选B。
〖2021年高考真题〗
考点一 化学反应速率计算与影响因素分析
17.(2021·湖南)铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情
况如图所示:
下
列说法错误的是
A.该过程的总反应为
B. 浓度过大或者过小,均导致反应速率降低
C.该催化循环中 元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
【答案】D
【详解】
A.由反应机理可知,HCOOH电离出氢离子后,HCOO-与催化剂结合,放出二氧化碳,然后又结合氢离
子转化为氢气,所以化学方程式为HCOOH CO↑+H ↑,故A正确;
2 2
B.若氢离子浓度过低,则反应Ⅲ→Ⅳ的反应物浓度降低,反应速率减慢,若氢离子浓度过高,则会抑制
加酸的电离,使甲酸根浓度降低,反应Ⅰ→Ⅱ速率减慢,所以氢离子浓度过高或过低,均导致反应速率减慢,
故B正确;
C.由反应机理可知,Fe在反应过程中,化学键数目发生变化,则化合价也发生变化,故C正确;
D.由反应进程可知,反应Ⅳ→Ⅰ能垒最大,反应速率最慢,对该过程的总反应起决定作用,故D错误;故选D。
考点二 化学平衡及其移动
18.(2021·浙江)一定温度下:在 的四氯化碳溶液( )中发生分解反应:
。在不同时刻测量放出的 体积,换算成 浓度如下表:
171 282
0 600 1200 2220 x
0 0
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是
A. ,生成 的平均速率为
B.反应 时,放出的 体积为 (标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
【答案】D
【详解】
A. , 的变化量为(0.96-0.66) ==0.3 ,在此时间段内 的变化量为
其2倍,即0.6 ,因此,生成 的平均速率为 ,A说法不
正确;
B.由表中数据可知,反应 时, 的变化量为(1.40-0.35) ==1.05 ,其物质的量
的变化量为1.05 0.1L=0.105mol, 的变化量是其 ,即0.0525mol,因此,放出的 在标准
状况下的体积为0.0525mol 22.4L/mol= ,B说法不正确;
C.反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化
学计量数之比, ,C说法不正确;
D.分析表中数据可知,该反应经过1110s(600-1710,1710-2820)后 的浓度会变为原来的 ,因此,
的浓度由0.24 变为0.12 时,可以推测上表中的x为(2820+1110)=3930,D说法正确。
综上所述,本题选D。
考点三 化学反应速率、平衡图像分析
19.(2021·广东)反应 经历两步:① ;② 。反应体系中 、 、 的浓度c随
时间t的变化曲线如图所示。下列说法不正确的是A.a为 随t的变化曲线
B. 时,
C. 时, 的消耗速率大于生成速率
D. 后,
【答案】D
【分析】
由题中信息可知,反应 经历两步:① ;② 。因此,图中呈不断减小趋势的a线为
X的浓度 随时间 的变化曲线,呈不断增加趋势的线为Z的浓度 随时间 的变化曲线,先增加后减小的
线为Y的浓度 随时间 的变化曲线。
【详解】
A.X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,由图可知, 为 随 的变化曲线,
A正确;
B.由图可知,分别代表3种不同物质的曲线相交于 时刻,因此, 时 ,B正确;
C.由图中信息可知, 时刻以后,Y的浓度仍在不断减小,说明 时刻反应两步仍在向正反应方向发生,
而且反应①生成Y的速率小于反应②消耗Y的速率,即 时 的消耗速率大于生成速率,C正确;
D.由图可知, 时刻反应①完成,X完全转化为Y,若无反应②发生,则 ,由于反应②
的发生, 时刻Y浓度的变化量为 ,变化量之比等于化学计量数之比,所以Z的浓度
的变化量为 ,这种关系在 后仍成立, 因此,D不正确。
综上所述,本题选D。
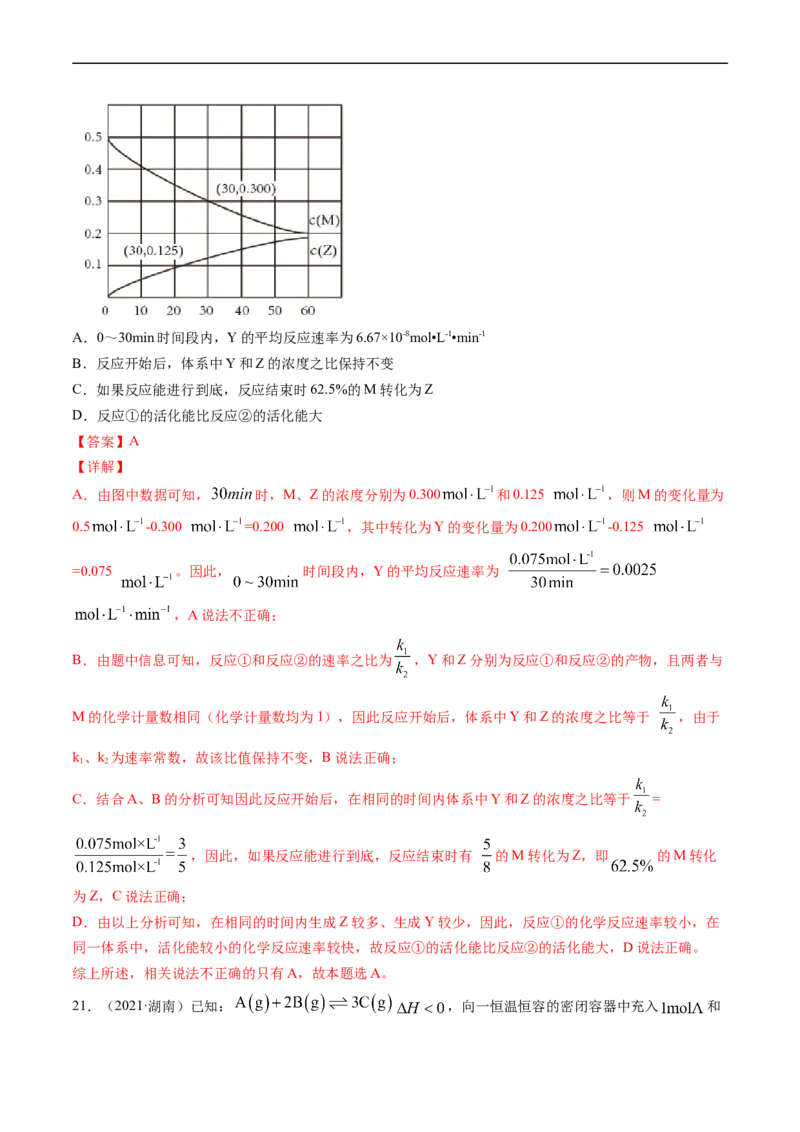
20.(2021·河北)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:
①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v=kc2(M),反应②的速率可表示为v=kc2(M) (k 、
1 1 2 2 1
k 为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
2A.0~30min时间段内,Y的平均反应速率为6.67×10-8mol•L-1•min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
【答案】A
【详解】
A.由图中数据可知, 时,M、Z的浓度分别为0.300 和0.125 ,则M的变化量为
0.5 -0.300 =0.200 ,其中转化为Y的变化量为0.200 -0.125
=0.075 。因此, 时间段内,Y的平均反应速率为
,A说法不正确;
B.由题中信息可知,反应①和反应②的速率之比为 ,Y和Z分别为反应①和反应②的产物,且两者与
M的化学计量数相同(化学计量数均为1),因此反应开始后,体系中Y和Z的浓度之比等于 ,由于
k、k 为速率常数,故该比值保持不变,B说法正确;
1 2
C.结合A、B的分析可知因此反应开始后,在相同的时间内体系中Y和Z的浓度之比等于 =
,因此,如果反应能进行到底,反应结束时有 的M转化为Z,即 的M转化
为Z,C说法正确;
D.由以上分析可知,在相同的时间内生成Z较多、生成Y较少,因此,反应①的化学反应速率较小,在
同一体系中,活化能较小的化学反应速率较快,故反应①的活化能比反应②的活化能大,D说法正确。
综上所述,相关说法不正确的只有A,故本题选A。
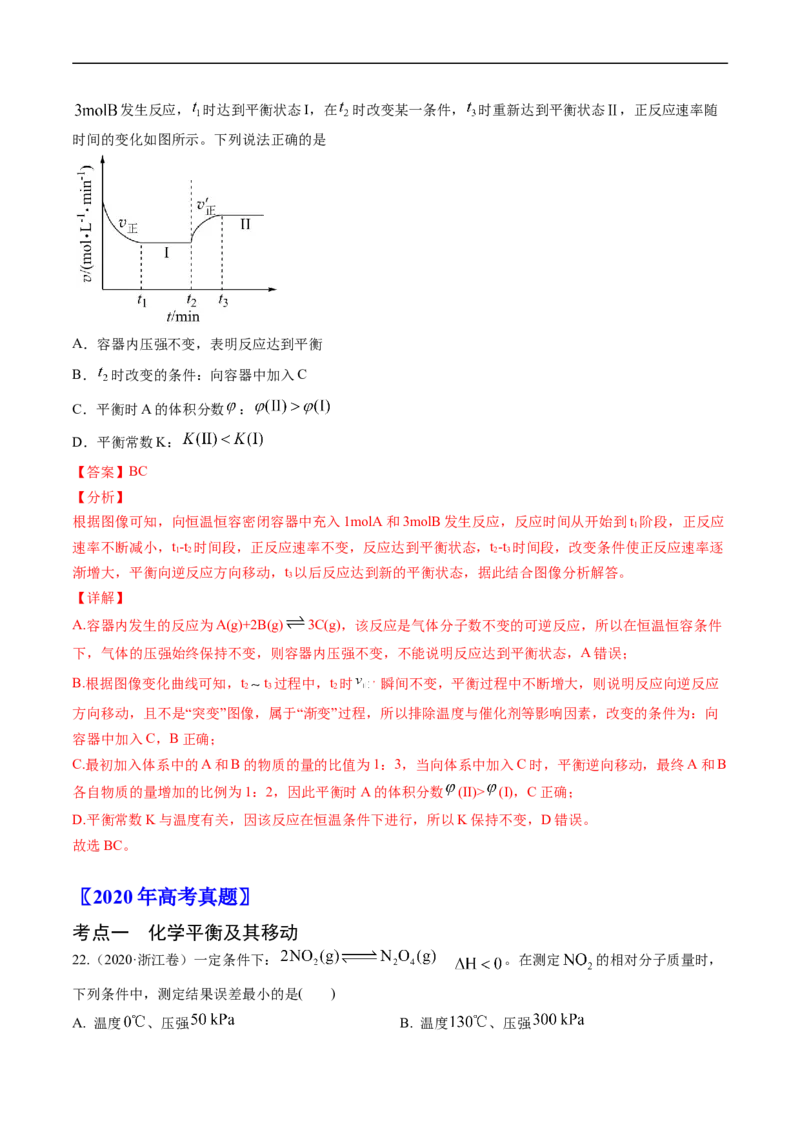
21.(2021·湖南)已知: ,向一恒温恒容的密闭容器中充入 和发生反应, 时达到平衡状态I,在 时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随
时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B. 时改变的条件:向容器中加入C
C.平衡时A的体积分数 :
D.平衡常数K:
【答案】BC
【分析】
根据图像可知,向恒温恒容密闭容器中充入1molA和3molB发生反应,反应时间从开始到t 阶段,正反应
1
速率不断减小,t-t 时间段,正反应速率不变,反应达到平衡状态,t-t 时间段,改变条件使正反应速率逐
1 2 2 3
渐增大,平衡向逆反应方向移动,t 以后反应达到新的平衡状态,据此结合图像分析解答。
3
【详解】
A.容器内发生的反应为A(g)+2B(g) 3C(g),该反应是气体分子数不变的可逆反应,所以在恒温恒容条件
下,气体的压强始终保持不变,则容器内压强不变,不能说明反应达到平衡状态,A错误;
B.根据图像变化曲线可知,t t 过程中,t 时 ,瞬间不变,平衡过程中不断增大,则说明反应向逆反应
2 3 2
方向移动,且不是“突变”图像,属于“渐变”过程,所以排除温度与催化剂等影响因素,改变的条件为:向
容器中加入C,B正确;
C.最初加入体系中的A和B的物质的量的比值为1:3,当向体系中加入C时,平衡逆向移动,最终A和B
各自物质的量增加的比例为1:2,因此平衡时A的体积分数 (II)> (I),C正确;
D.平衡常数K与温度有关,因该反应在恒温条件下进行,所以K保持不变,D错误。
故选BC。
〖2020年高考真题〗
考点一 化学平衡及其移动
22.(2020·浙江卷)一定条件下: 。在测定 的相对分子质量时,
下列条件中,测定结果误差最小的是( )
A. 温度 、压强 B. 温度 、压强C. 温度 、压强 D. 温度 、压强
【答案】D
【解析】测定二氧化氮的相对分子质量,要使测定结果误差最小,应该使混合气体中 NO 的含量越多越好,
2
为了实现该目的,应该改变条件使平衡尽可以地逆向移动。该反应是一个反应前后气体分子数减小的放热
反应,可以通过减小压强、升高温度使平衡逆向移动,则选项中,温度高的为130℃,压强低的为50kPa,
结合二者选D。答案为D。
23.(2020·浙江卷) 溶液与 溶液发生反应:
,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C. 加入 固体,平衡逆向移动
D. 该反应的平衡常数
【答案】D
【解析】加入苯振荡,苯将 I 萃取到苯层,水溶液中 c(I )减小,平衡正向移动,A 正确;将
2 2
5mL0.1mol/LKI溶液与1mL0.1mol/LFeCl 溶液混合,参与反应的Fe3+与I-物质的量之比为1:1,反应后I-一
3
定过量,经苯2次萃取分离后,在水溶液中加入KSCN溶液呈血红色,说明水溶液中仍含有Fe3+,即
Fe3+没有完全消耗,表明该化学反应存在限度,B正确;加入FeSO 固体溶于水电离出Fe2+,c(Fe2+)增大,
4
平衡逆向移动,C正确;该反应的平衡常数K= ,D错误;答案选D。
24.(2020·江苏卷)反应 可用于纯硅的制备。下列有关该反应的说法
正确的是
A. 该反应 、
B. 该反应的平衡常数
C. 高温下反应每生成1 mol Si需消耗
.
D 用E表示键能,该反应
【答案】B
【解析】SiCl 、H、HCl为气体,且反应前气体系数之和小于反应后气体系数之和,因此该反应为熵增,
4 2
即△S>0,故A错误;根据化学平衡常数的定义,该反应的平衡常数K= ,故B正确;
高温不是标准状况下,因此不能直接用22.4L·mol-1计算,故C错误;△H=反应物键能总和-生成物键能总和,即△H=4E(Si-Cl)+2E(H-H)-4E(H-Cl) -2E(Si-Si),故D错误;答案为B。
考点二 化学反应速率、平衡图像分析
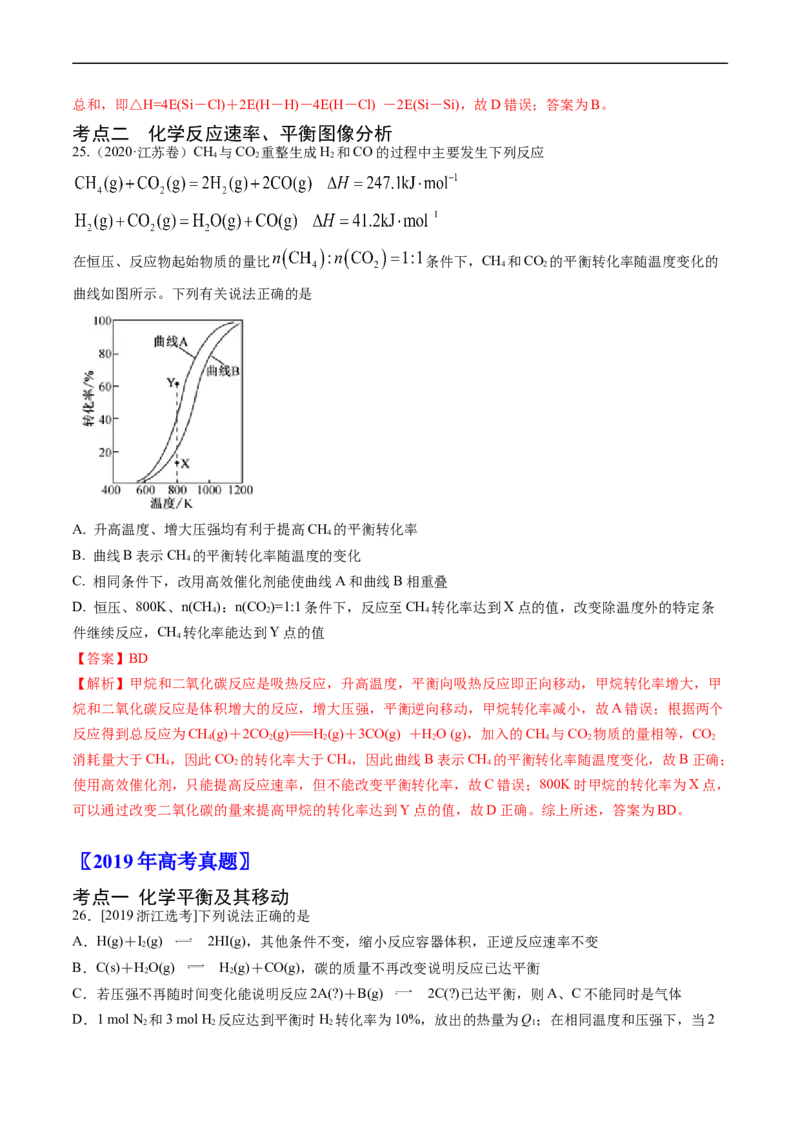
25.(2020·江苏卷)CH 与CO 重整生成H 和CO的过程中主要发生下列反应
4 2 2
在恒压、反应物起始物质的量比 条件下,CH 和CO 的平衡转化率随温度变化的
4 2
曲线如图所示。下列有关说法正确的是
A. 升高温度、增大压强均有利于提高CH 的平衡转化率
4
B. 曲线B表示CH 的平衡转化率随温度的变化
4
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800K、n(CH):n(CO)=1:1条件下,反应至CH 转化率达到X点的值,改变除温度外的特定条
4 2 4
件继续反应,CH 转化率能达到Y点的值
4
【答案】BD
【解析】甲烷和二氧化碳反应是吸热反应,升高温度,平衡向吸热反应即正向移动,甲烷转化率增大,甲
烷和二氧化碳反应是体积增大的反应,增大压强,平衡逆向移动,甲烷转化率减小,故A错误;根据两个
反应得到总反应为CH(g)+2CO(g)===H(g)+3CO(g) +HO (g),加入的CH 与CO 物质的量相等,CO
4 2 2 2 4 2 2
消耗量大于CH,因此CO 的转化率大于CH,因此曲线B表示CH 的平衡转化率随温度变化,故B正确;
4 2 4 4
使用高效催化剂,只能提高反应速率,但不能改变平衡转化率,故C错误;800K时甲烷的转化率为X点,
可以通过改变二氧化碳的量来提高甲烷的转化率达到Y点的值,故D正确。综上所述,答案为BD。
〖2019年高考真题〗
考点一 化学平衡及其移动
26.[2019浙江选考]下列说法正确的是
A.H(g)+I(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
2
B.C(s)+HO(g) H(g)+CO(g),碳的质量不再改变说明反应已达平衡
2 2
C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N 和3 mol H 反应达到平衡时H 转化率为10%,放出的热量为Q;在相同温度和压强下,当2
2 2 2 1mol NH 分解为N 和H 的转化率为10%时,吸收的热量为Q,Q 不等于Q
3 2 2 2 2 1
【答案】B
【解析】该可逆反应的反应前后气体计量数不发生变化,当缩小反应容器体积,相当于加压,正逆反应速
率同等程度增加,A项错误;在建立平衡前,碳的质量不断改变,达到平衡时,质量不变,因而碳的质量
不再改变说明反应已达平衡,B项正确;若压强不再改变说明反应达到平衡,表明反应前后气体的计量数
不等,故A、C不可能均为气体,C项错误;易知N(g)+3H(g) 2NH (g) ΔH,合成氨气实际参与反应
2 2 3
n(H )=3×10%=0.3mol,因而Q=0.3/3×|ΔH|=0.1|ΔH|,分解氨气时实际消耗的n(NH )=2×10%=0.2mol,
2 1 ⇌ 3
Q=0.2/2×|ΔH|=0.1|ΔH|,则Q=Q ,D项错误。
2 1 2
考点二 化学反应速率、平衡图像分析
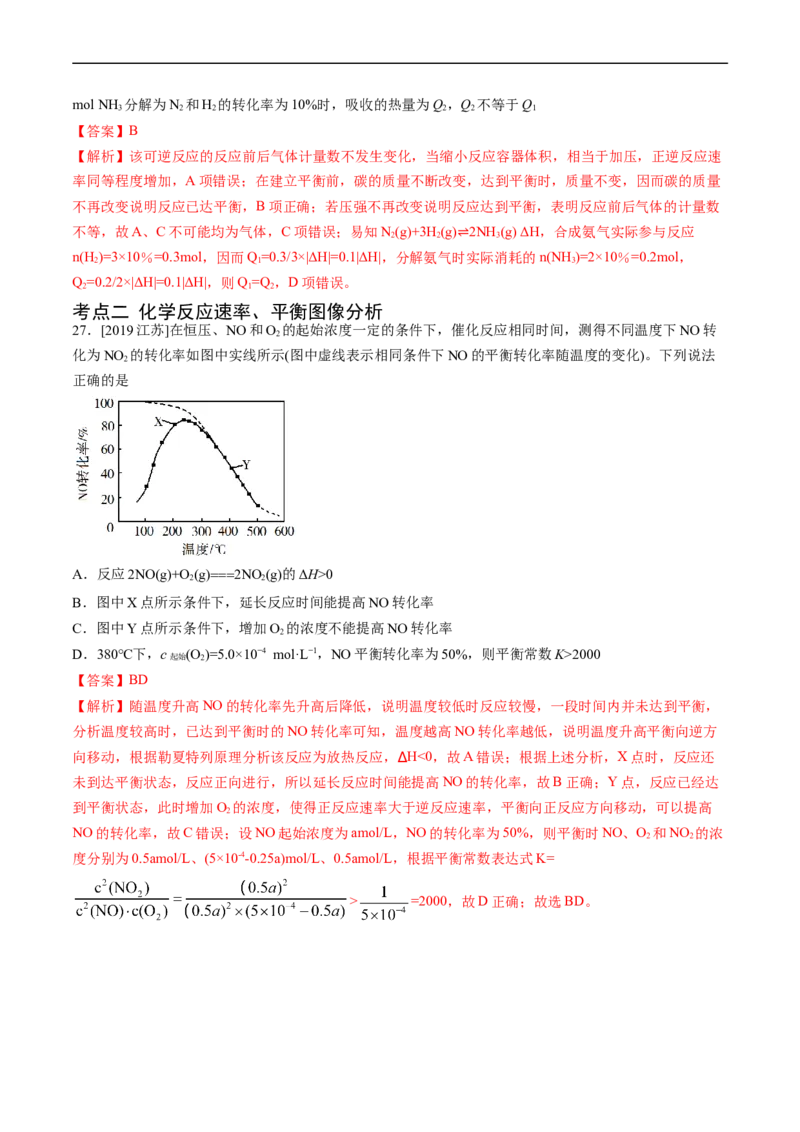
27.[2019江苏]在恒压、NO和O 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转
2
化为NO 的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法
2
正确的是
A.反应2NO(g)+O (g)===2NO (g)的ΔH>0
2 2
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O 的浓度不能提高NO转化率
2
D.380℃下,c (O )=5.0×10−4 mol·L−1,NO平衡转化率为50%,则平衡常数K>2000
起始 2
【答案】BD
【解析】随温度升高NO的转化率先升高后降低,说明温度较低时反应较慢,一段时间内并未达到平衡,
分析温度较高时,已达到平衡时的NO转化率可知,温度越高NO转化率越低,说明温度升高平衡向逆方
向移动,根据勒夏特列原理分析该反应为放热反应,∆H<0,故A错误;根据上述分析,X点时,反应还
未到达平衡状态,反应正向进行,所以延长反应时间能提高NO的转化率,故B正确;Y点,反应已经达
到平衡状态,此时增加O 的浓度,使得正反应速率大于逆反应速率,平衡向正反应方向移动,可以提高
2
NO的转化率,故C错误;设NO起始浓度为amol/L,NO的转化率为50%,则平衡时NO、O 和NO 的浓
2 2
度分别为0.5amol/L、(5×10-4-0.25a)mol/L、0.5amol/L,根据平衡常数表达式K=
> =2000,故D正确;故选BD。