文档内容
高三化学试题
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的
姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫
米黑色签字笔书写,字体工整,笔迹清晰。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、
试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 N 14 Cl 35.5 Fe 56 Co 59
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。
1.非物质文化遗产体现了古代劳动人民的智慧。下列说法错误的是
A.“烟台绒绣”用羊毛绒线绣制,不可用加酶洗涤剂清洗
B.“即墨老酒”由黍米酿制,其原理是淀粉水解可得乙醇
C.“硫熏”使“莱州草辫”色泽白净,兼有驱虫、防腐的功能
D.“胶东花饽饽”用酵母作膨松剂,使用过程中发生了化学变化
2.下列说法中不正确的是
A.NO 和碳氢化合物是造成光化学烟雾污染的主要原因
x
B.HSO 和CuCl 均可通过化合反应得到
2 4 2
C.侯氏制碱法的原理是将NH 通入含有CO 的饱和食盐水中制得NaHCO
3 2 3
D.工业接触法制备硫酸涉及到的转化为FeS→SO →SO →HSO
2 2 3 2 4
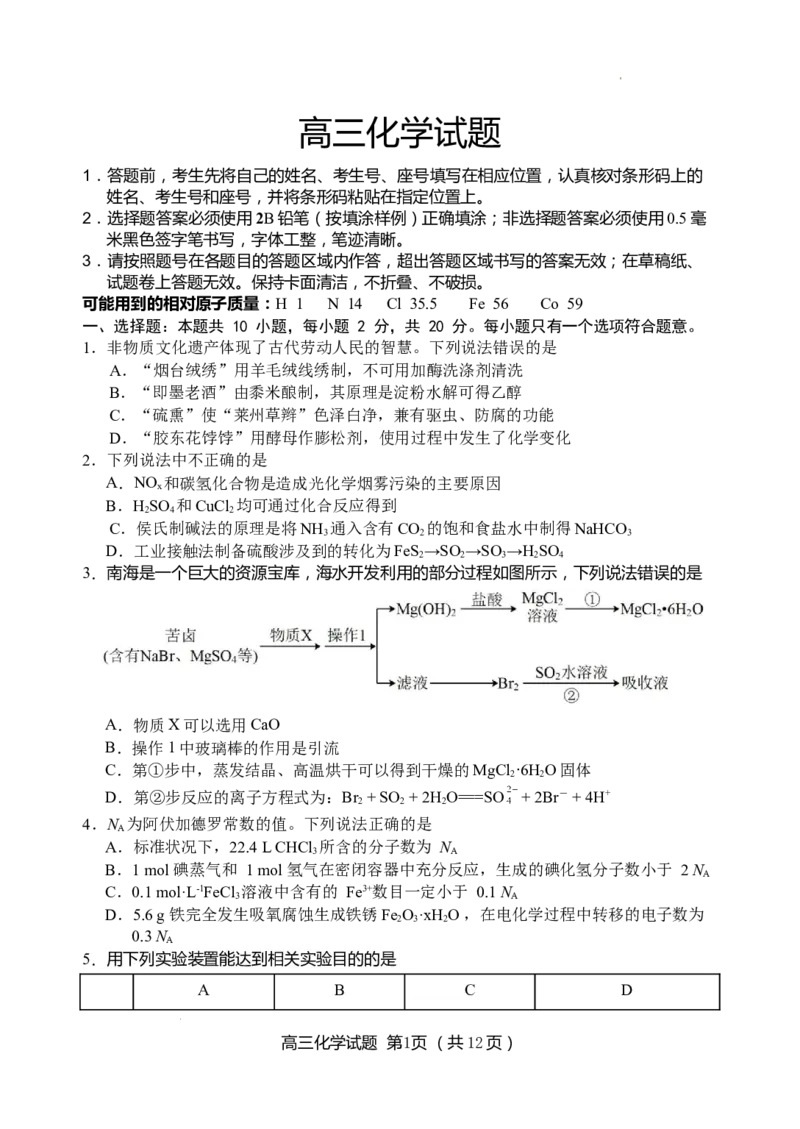
3.南海是一个巨大的资源宝库,海水开发利用的部分过程如图所示,下列说法错误的是
A.物质X可以选用CaO
B.操作1中玻璃棒的作用是引流
C.第①步中,蒸发结晶、高温烘干可以得到干燥的MgCl ·6HO固体
2 2
D.第②步反应的离子方程式为:Br + SO + 2H O===SO + 2Br- + 4H+
2 2 2
4.N 为阿伏加德罗常数的值。下列说法正确的是
A
A.标准状况下,22.4 L CHCl 所含的分子数为 N
3 A
B.1 mol 碘蒸气和 1 mol 氢气在密闭容器中充分反应,生成的碘化氢分子数小于 2 N
A
C.0.1 mol·L-1FeCl 溶液中含有的 Fe3+数目一定小于 0.1 N
3 A
D.5.6 g 铁完全发生吸氧腐蚀生成铁锈Fe O·xHO ,在电化学过程中转移的电子数为
2 3 2
0.3 N
A
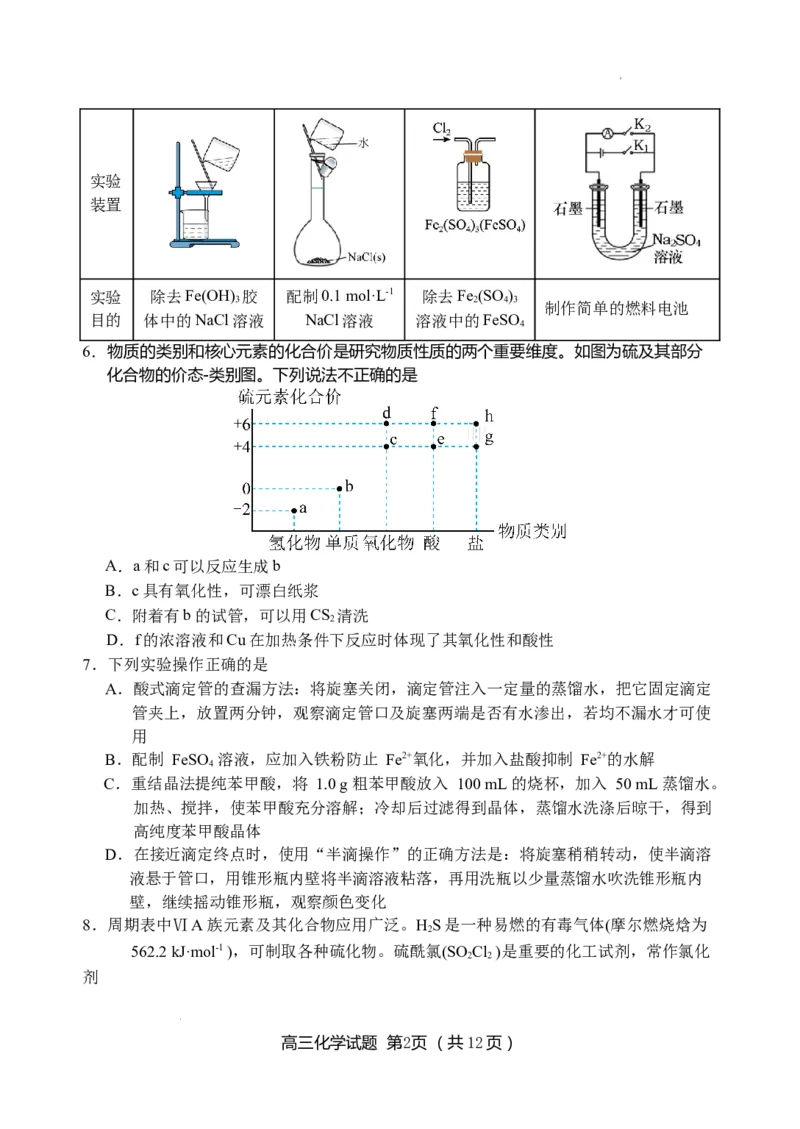
5.用下列实验装置能达到相关实验目的的是
A B C D
高三化学试题 第1页 (共12页)
学科网(北京)股份有限公司实验
装置
实验 除去Fe(OH) 胶 配制0.1 mol·L-1 除去Fe (SO )
3 2 4 3
制作简单的燃料电池
目的 体中的NaCl溶液 NaCl溶液 溶液中的FeSO
4
6.物质的类别和核心元素的化合价是研究物质性质的两个重要维度。如图为硫及其部分
化合物的价态-类别图。下列说法不正确的是
A.a和c可以反应生成b
B.c具有氧化性,可漂白纸浆
C.附着有b的试管,可以用CS 清洗
2
D.f的浓溶液和Cu在加热条件下反应时体现了其氧化性和酸性
7.下列实验操作正确的是
A.酸式滴定管的查漏方法:将旋塞关闭,滴定管注入一定量的蒸馏水,把它固定滴定
管夹上,放置两分钟,观察滴定管口及旋塞两端是否有水渗出,若均不漏水才可使
用
B.配制 FeSO 溶液,应加入铁粉防止 Fe2+氧化,并加入盐酸抑制 Fe2+的水解
4
C.重结晶法提纯苯甲酸,将 1.0 g 粗苯甲酸放入 100 mL 的烧杯,加入 50 mL 蒸馏水。
加热、搅拌,使苯甲酸充分溶解;冷却后过滤得到晶体,蒸馏水洗涤后晾干,得到
高纯度苯甲酸晶体
D.在接近滴定终点时,使用“半滴操作”的正确方法是:将旋塞稍稍转动,使半滴溶
液悬于管口,用锥形瓶内壁将半滴溶液粘落,再用洗瓶以少量蒸馏水吹洗锥形瓶内
壁,继续摇动锥形瓶,观察颜色变化
8.周期表中ⅥA 族元素及其化合物应用广泛。HS是一种易燃的有毒气体(摩尔燃烧焓为
2
562.2 kJ·mol-1 ),可制取各种硫化物。硫酰氯(SO Cl )是重要的化工试剂,常作氯化
2 2
剂
高三化学试题 第2页 (共12页)
学科网(北京)股份有限公司或氯磺化剂。工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性
NaTeO
2 3
溶液制备Te。下列化学反应表示正确的是
A.HS燃烧的热化学方程式:2HS(g) + 3O (g) ===2SO (g) + 2H O(l)
2 2 2 2 2
ΔH = -1124.4 kJ‧mol-1
B.CuSe和浓硫酸反应:CuSe + H SO ===CuSO + H Se ↑
2 4 4 2
C.电解强碱性NaTeO 溶液的阴极反应: + 4e- + 6H+===Te + 3H O
2 3 2
D.SO Cl 遇水强烈水解生成两种酸:SO Cl + 2H O ===4H++ + 2Cl-
2 2 2 2 2
9.用电解法对酸性含氯氨氮废水进行无害化处理的过程如图所示。下列说法正确的是
*
A.DSA电极与外接电源的负极连接
B. Cl-发生的电极反应式为:Cl-+ H O-2e-===ClO-+ 2H+
2
C.降解过程中应该控制条件避免发生反应②
D.1 mol HO* 和足量 反应,转移的电子数为
10.在恒温恒容的密闭容器中发生:2NH (g) + CO (g) CO(NH)(s) + H O(g) ΔH <0,
3 2 2 2 2
T℃时,平衡常数为K,下列说法正确的是
A.该反应在任何温度下都可自发进行
B.T℃时,若 < K时,则v < v
正 逆
C.选择高效催化剂可以提高活化分子百分数,提高CO(NH) 的平衡产率
2 2
D.若容器内气体压强保持不变,该可逆反应达到化学平衡状态
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题意,
全部选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
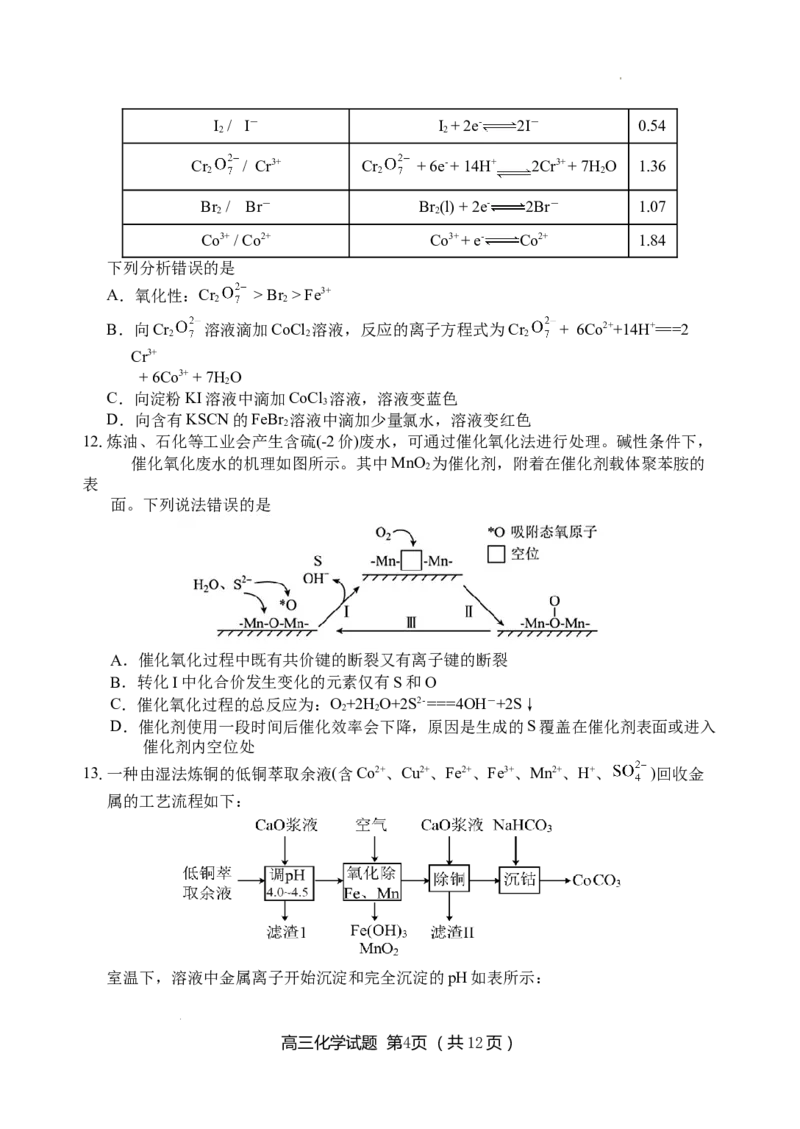
11.氧化还原电对的标准电极电势(φθ)可用来比较相应氧化剂的氧化性强弱,相关数据(酸性
条件)如下。
氧化还原电对(氧化剂/还原剂) 电极反应式 φθ/V
Fe3+ / Fe2+ Fe3+ + e- Fe2+ 0.77
高三化学试题 第3页 (共12页)
学科网(北京)股份有限公司I / I- I + 2e- 2I- 0.54
2 2
Cr / Cr3+ Cr + 6e- + 14H+ 2Cr3+ + 7HO 1.36
2 2 2
Br / Br- Br (l) + 2e- 2Br- 1.07
2 2
Co3+ / Co2+ Co3+ + e- Co2+ 1.84
下列分析错误的是
A.氧化性:Cr > Br > Fe3+
2 2
B.向Cr 溶液滴加CoCl 溶液,反应的离子方程式为Cr + 6Co2++14H+===2
2 2 2
Cr3+
+ 6Co3+ + 7H O
2
C.向淀粉KI溶液中滴加CoCl 溶液,溶液变蓝色
3
D.向含有KSCN的FeBr 溶液中滴加少量氯水,溶液变红色
2
12.炼油、石化等工业会产生含硫(-2价)废水,可通过催化氧化法进行处理。碱性条件下,
催化氧化废水的机理如图所示。其中MnO 为催化剂,附着在催化剂载体聚苯胺的
2
表
面。下列说法错误的是
A.催化氧化过程中既有共价键的断裂又有离子键的断裂
B.转化I中化合价发生变化的元素仅有S和O
C.催化氧化过程的总反应为:O+2H O+2S2- ===4OH-+2S↓
2 2
D.催化剂使用一段时间后催化效率会下降,原因是生成的S覆盖在催化剂表面或进入
催化剂内空位处
13.一种由湿法炼铜的低铜萃取余液(含Co2+、Cu2+、Fe2+、Fe3+、Mn2+、H+、 )回收金
属的工艺流程如下:
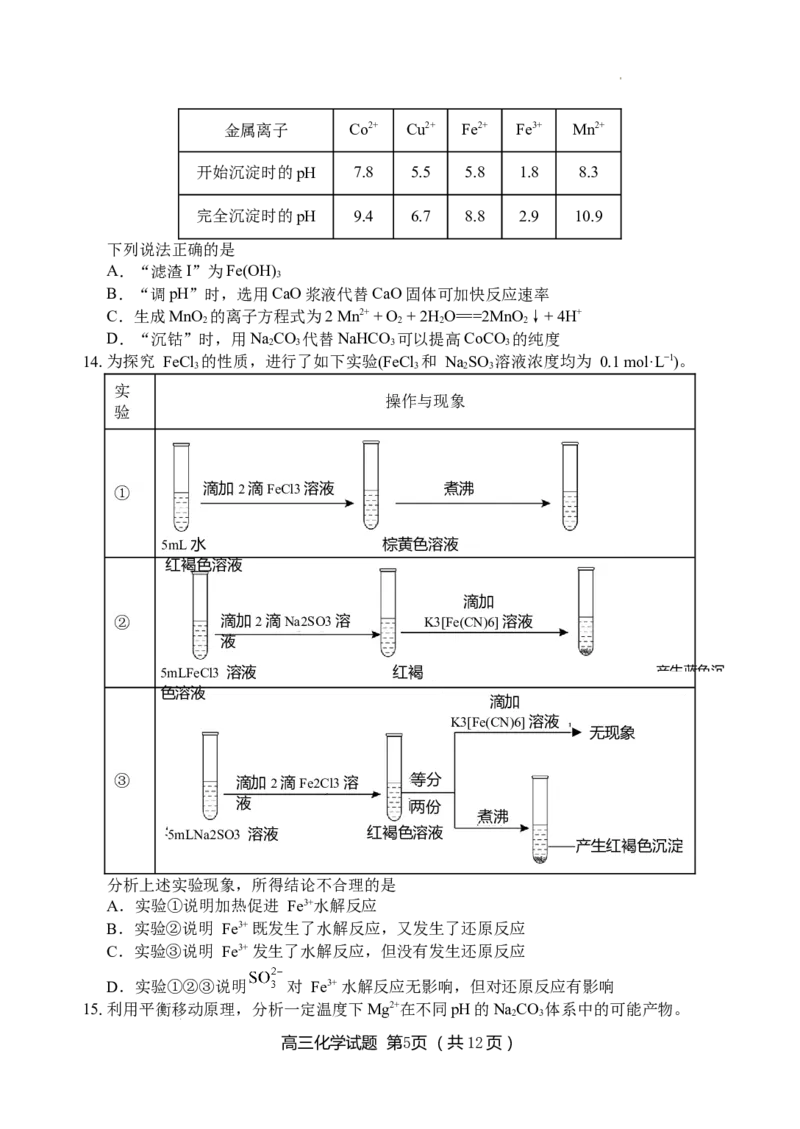
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
高三化学试题 第4页 (共12页)
学科网(北京)股份有限公司金属离子 Co2+ Cu2+ Fe2+ Fe3+ Mn2+
开始沉淀时的pH 7.8 5.5 5.8 1.8 8.3
完全沉淀时的pH 9.4 6.7 8.8 2.9 10.9
下列说法正确的是
A.“滤渣I”为Fe(OH)
3
B.“调pH”时,选用CaO浆液代替CaO固体可加快反应速率
C.生成MnO 的离子方程式为2 Mn2+ + O + 2H O===2MnO ↓+ 4H+
2 2 2 2
D.“沉钴”时,用NaCO 代替NaHCO 可以提高CoCO 的纯度
2 3 3 3
14.为探究 FeCl 的性质,进行了如下实验(FeCl 和 NaSO 溶液浓度均为 0.1 mol·L−1)。
3 3 2 3
实
操作与现象
验
① 滴加2滴FeCl3溶液 煮沸
5mL水 棕黄色溶液
红褐色溶液
滴加
② 滴加2滴Na2SO3溶 K3[Fe(CN)6]溶液
液
5mLFeCl3 溶液 红褐 产生蓝色沉
色溶液
滴加
K3[Fe(CN)6]溶液
无现象
③ 滴加2滴Fe2Cl3溶 等分
液 两 份
煮沸
5mLNa2SO3 溶液 红褐色 溶 液
产生红褐色沉淀
分析上述实验现象,所得结论不合理的是
A.实验①说明加热促进 Fe3+水解反应
B.实验②说明 Fe3+ 既发生了水解反应,又发生了还原反应
C.实验③说明 Fe3+ 发生了水解反应,但没有发生还原反应
D.实验①②③说明 对 Fe3+ 水解反应无影响,但对还原反应有影响
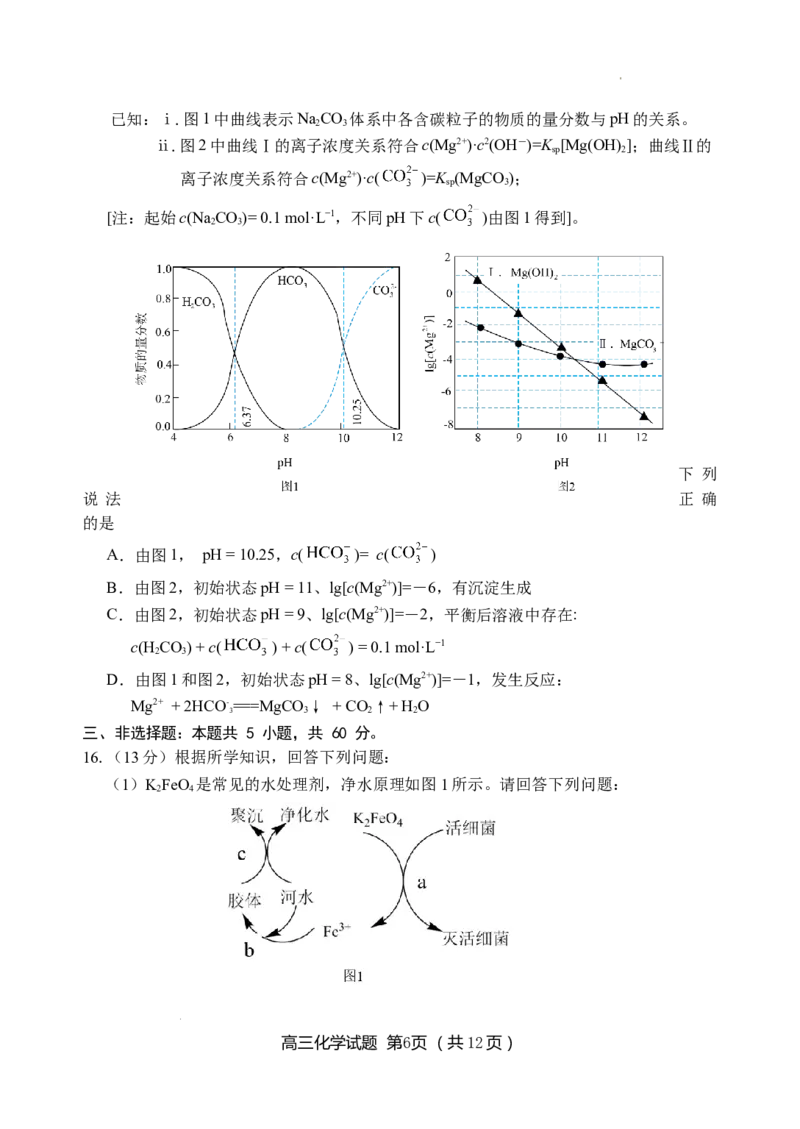
15.利用平衡移动原理,分析一定温度下Mg2+在不同pH的NaCO 体系中的可能产物。
2 3
高三化学试题 第5页 (共12页)
学科网(北京)股份有限公司已知:ⅰ.图1中曲线表示NaCO 体系中各含碳粒子的物质的量分数与pH的关系。
2 3
ⅱ.图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=K [Mg(OH)];曲线Ⅱ的
sp 2
离子浓度关系符合c(Mg2+)·c( )=K (MgCO );
sp 3
[注:起始c(NaCO)= 0.1 mol·L−1,不同pH下c( )由图1得到]。
2 3
下 列
说 法 正 确
的是
A.由图1, pH = 10.25,c( )= c( )
B.由图2,初始状态pH = 11、lg[c(Mg2+)]=-6,有沉淀生成
C.由图2,初始状态pH = 9、lg[c(Mg2+)]=-2,平衡后溶液中存在:
c(H CO) + c( ) + c( ) = 0.1 mol·L−1
2 3
D.由图1和图2,初始状态pH = 8、lg[c(Mg2+)]=-1,发生反应:
Mg2+ + 2HCO- ===MgCO ↓ + CO↑+ H O
3 3 2 2
三、非选择题:本题共 5 小题,共 60 分。
16.(13分)根据所学知识,回答下列问题:
(1)KFeO 是常见的水处理剂,净水原理如图1所示。请回答下列问题:
2 4
高三化学试题 第6页 (共12页)
学科网(北京)股份有限公司①高铁酸钾(K FeO)中铁元素的化合价为_______;
2 4
②过程 a 中 KFeO 体现__________(填“氧化”或“还原”)性,反应过程中转移
2 4
5.418×1022个电子,需要 _______mol KFeO。
2 4
(2)碱性条件下用 Fe(OH) 和 KClO 反应制备 KFeO。配平其反应的化学方程式:
3 2 4
Fe(OH) +KOH+KClO——KFeO+KCl+H O
3 2 4 2
(3)干法制备高铁酸钠的主要反应为 :
2FeSO +6Na O===2NaFeO+2Na O+2Na SO +O ↑,该反应中的还原剂是_____,
4 2 2 2 4 2 2 4 2
生产 1mol 的高铁酸钠,需要消耗氧化剂的物质的量是_______。
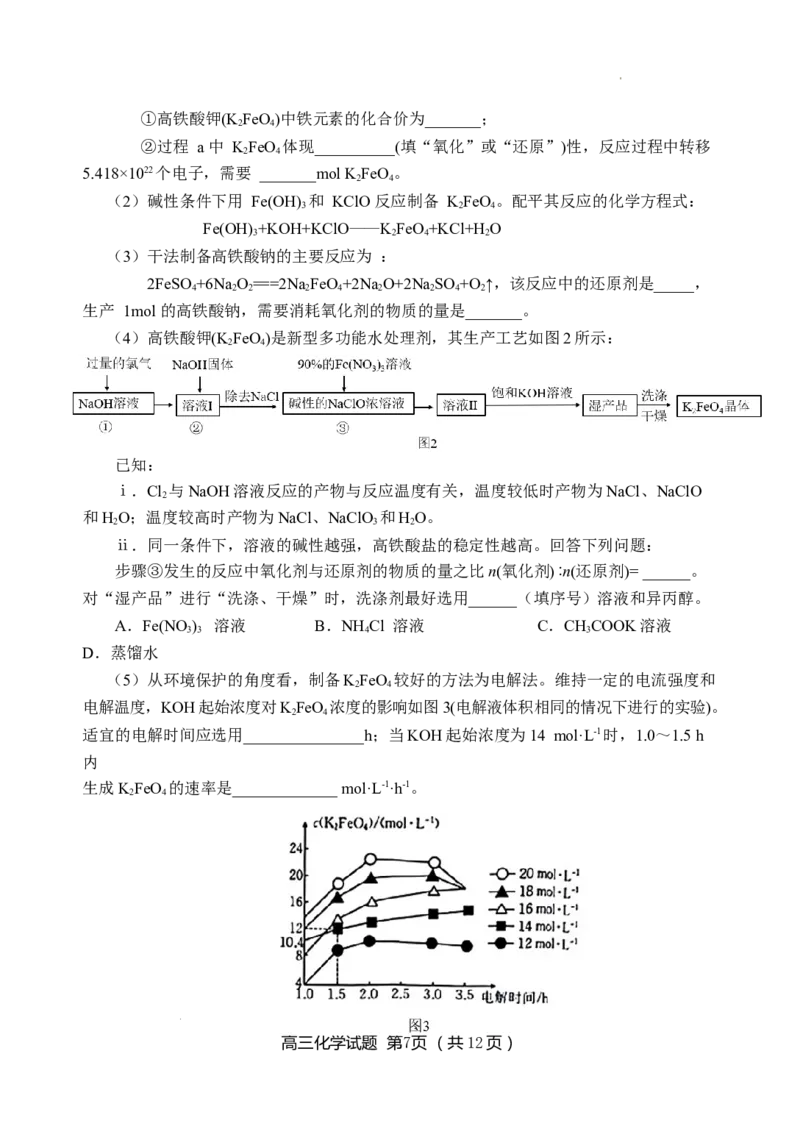
(4)高铁酸钾(K FeO)是新型多功能水处理剂,其生产工艺如图2所示:
2 4
已知:
ⅰ.Cl 与NaOH溶液反应的产物与反应温度有关,温度较低时产物为NaCl、NaClO
2
和HO;温度较高时产物为NaCl、NaClO 和HO。
2 3 2
ⅱ.同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。回答下列问题:
步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂) ∶n(还原剂)= ______。
对“湿产品”进行“洗涤、干燥”时,洗涤剂最好选用______(填序号)溶液和异丙醇。
A.Fe(NO ) 溶液 B.NH Cl 溶液 C.CHCOOK溶液
3 3 4 3
D.蒸馏水
(5)从环境保护的角度看,制备KFeO 较好的方法为电解法。维持一定的电流强度和
2 4
电解温度,KOH起始浓度对KFeO 浓度的影响如图3(电解液体积相同的情况下进行的实验)。
2 4
适宜的电解时间应选用_______________h;当KOH起始浓度为14 mol·L-1时,1.0~1.5 h
内
生成KFeO 的速率是_____________ mol·L-1·h-1。
2 4
高三化学试题 第7页 (共12页)
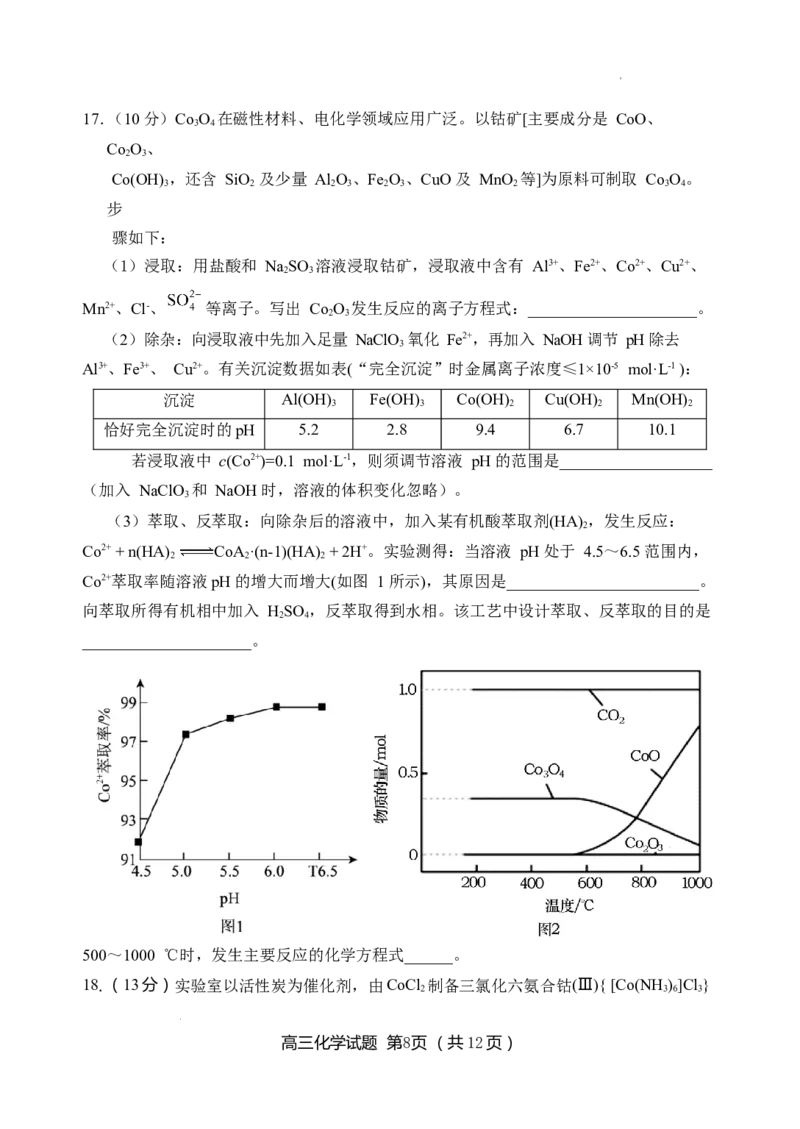
学科网(北京)股份有限公司17.(10分)Co O 在磁性材料、电化学领域应用广泛。以钴矿[主要成分是 CoO、
3 4
Co O、
2 3
Co(OH) ,还含 SiO 及少量 Al O、Fe O、CuO 及 MnO 等]为原料可制取 Co O。
3 2 2 3 2 3 2 3 4
步
骤如下:
(1)浸取:用盐酸和 NaSO 溶液浸取钴矿,浸取液中含有 Al3+、Fe2+、Co2+、Cu2+、
2 3
Mn2+、Cl-、 等离子。写出 Co O 发生反应的离子方程式:_____________________。
2 3
(2)除杂:向浸取液中先加入足量 NaClO 氧化 Fe2+,再加入 NaOH 调节 pH 除去
3
Al3+、Fe3+、 Cu2+。有关沉淀数据如表(“完全沉淀”时金属离子浓度≤1×10-5 mol·L-1 ):
沉淀 Al(OH) Fe(OH) Co(OH) Cu(OH) Mn(OH)
3 3 2 2 2
恰好完全沉淀时的pH 5.2 2.8 9.4 6.7 10.1
若浸取液中 c(Co2+)=0.1 mol·L-1,则须调节溶液 pH 的范围是___________________
(加入 NaClO 和 NaOH 时,溶液的体积变化忽略)。
3
(3)萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂(HA) ,发生反应:
2
Co2+ + n(HA) CoA·(n-1)(HA) + 2H+。实验测得:当溶液 pH 处于 4.5~6.5 范围内,
2 2 2
Co2+萃取率随溶液pH 的增大而增大(如图 1 所示),其原因是________________________。
向萃取所得有机相中加入 HSO ,反萃取得到水相。该工艺中设计萃取、反萃取的目的是
2 4
_____________________。
(4)沉钴、热分解:
向反萃取后得到的水相中
加入 NH HCO 溶液,过
4 3
滤、洗涤、干燥,得到
CoCO 固体,加热
3
CoCO 制备 Co O。1mol
3 3 4
CoCO 在空气中加热,反
3
应温度对反应产物的影响
如图 2 所示,请写出
500~1000 ℃时,发生主要反应的化学方程式______。
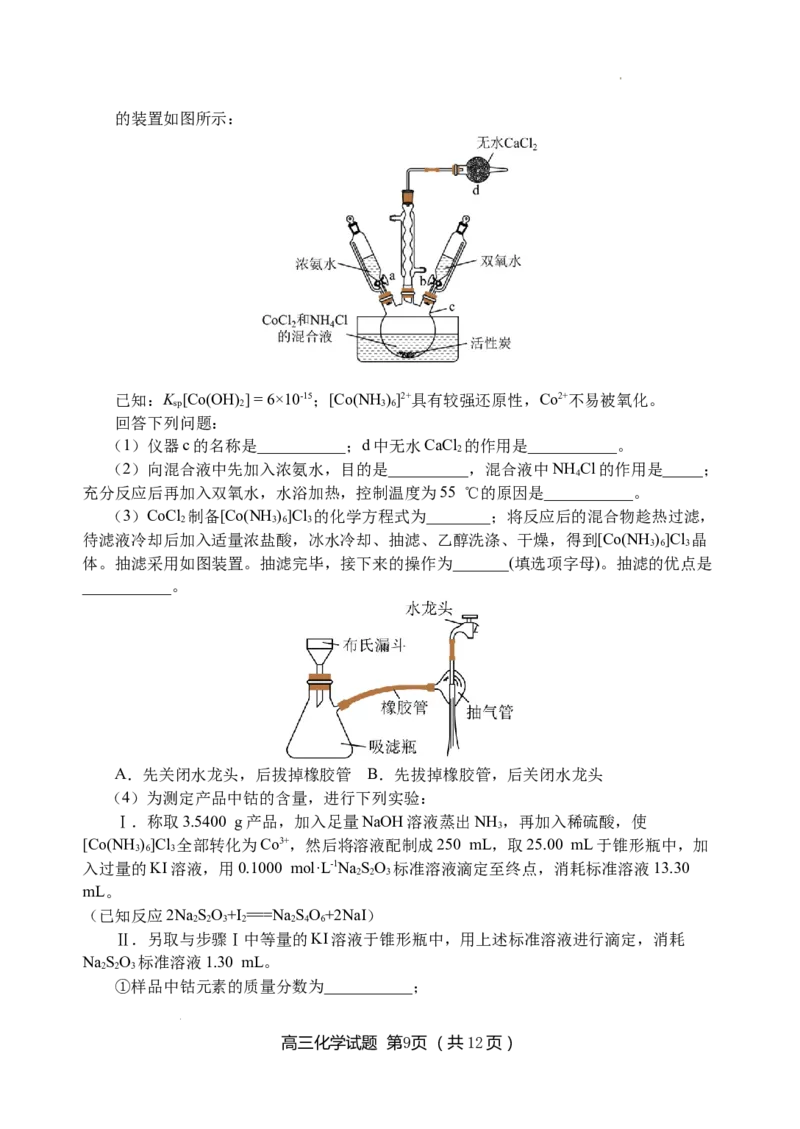
18.(13分)实验室以活性炭为催化剂,由CoCl 制备三氯化六氨合钴(Ⅲ){ [Co(NH )]Cl}
2 3 6 3
高三化学试题 第8页 (共12页)
学科网(北京)股份有限公司的装置如图所示:
已知:K [Co(OH)] = 6×10-15;[Co(NH )]2+具有较强还原性,Co2+不易被氧化。
sp 2 3 6
回答下列问题:
(1)仪器c的名称是___________;d中无水CaCl 的作用是___________。
2
(2)向混合液中先加入浓氨水,目的是__________,混合液中NH Cl的作用是_____;
4
充分反应后再加入双氧水,水浴加热,控制温度为55 ℃的原因是___________。
(3)CoCl 制备[Co(NH )]Cl 的化学方程式为________;将反应后的混合物趁热过滤,
2 3 6 3
待滤液冷却后加入适量浓盐酸,冰水冷却、抽滤、乙醇洗涤、干燥,得到[Co(NH )]Cl 晶
3 6 3
体。抽滤采用如图装置。抽滤完毕,接下来的操作为_______(填选项字母)。抽滤的优点是
___________。
A.先关闭水龙头,后拔掉橡胶管 B.先拔掉橡胶管,后关闭水龙头
(4)为测定产品中钴的含量,进行下列实验:
Ⅰ.称取3.5400 g产品,加入足量NaOH溶液蒸出NH ,再加入稀硫酸,使
3
[Co(NH )]Cl 全部转化为Co3+,然后将溶液配制成250 mL,取25.00 mL于锥形瓶中,加
3 6 3
入过量的KI溶液,用0.1000 mol·L-1NaSO 标准溶液滴定至终点,消耗标准溶液13.30
2 2 3
mL。
(已知反应2NaSO+I ===NaSO+2NaI)
2 2 3 2 2 4 6
Ⅱ.另取与步骤Ⅰ中等量的KI溶液于锥形瓶中,用上述标准溶液进行滴定,消耗
NaSO 标准溶液1.30 mL。
2 2 3
①样品中钴元素的质量分数为___________;
高三化学试题 第9页 (共12页)
学科网(北京)股份有限公司②若步骤Ⅱ滴定前滴定管内无气泡,滴定后有气泡,会使测定结果___________(填
“偏大”“偏小”或“不变”)。
19.(12分)CO和NO都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,
在人体内具有重要的生理作用,H 是高中阶段常见的气体。
2
回答下列问题:
(1)反应2NO(g) + 2H (g) N (g) + 2HO(g) ΔH = -664 kJ·mol-1是联合硝酸工业减
2 2 2
少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种
分子),前两步反应如下:
第1步:2NO(g) NO(g) ΔH = -103 kJ·mol-1
2 2
第2步:NO(g) + H(g) N O(g) + H O(g) ΔH = -17 kJ·mol-1
2 2 2 2 2
①写出第3步反应的热化学方程式:______________________________________;
②基元反应mA(g) +nB(g) pC(g) +qD(g),正反应速率v = kcm(A) · cn(B)。
正
2NO(g) + 2H (g) N (g) + 2H O(g)的正反应速率v = k ·c2(NO),总反应速率v = k ·
2 2 2 正 1 2
α
( -1)1.2 ·(1-nα´),α是平衡转化率,α´是瞬时转化率,k、k、k 均为速率常数,受温度
α´ 1 2
影响,温度升高,速率常数增大。
I.复杂反应分为多步进行时,决定反应速率的是最______(填“快”或“慢”)的一
步,3步基元反应中,活化能最高的一步是第______步。
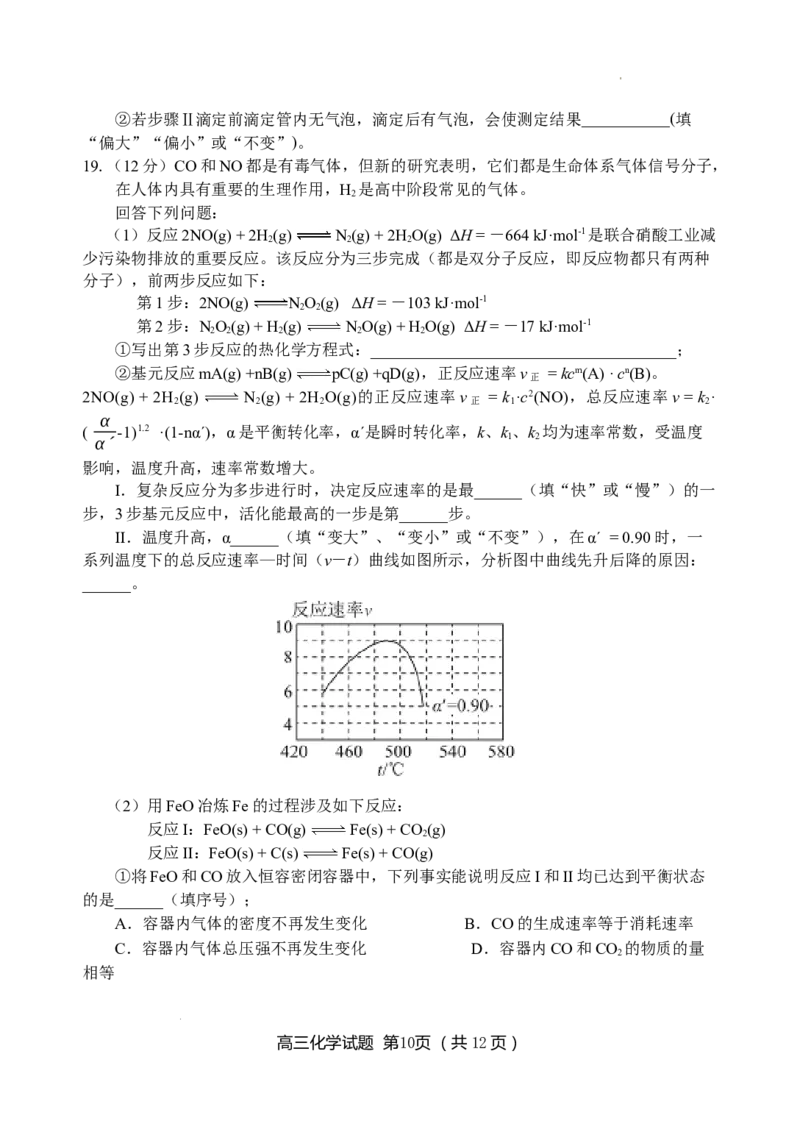
II.温度升高,α______(填“变大”、“变小”或“不变”),在α´ = 0.90 时,一
系列温度下的总反应速率—时间(v-t)曲线如图所示,分析图中曲线先升后降的原因:
______。
(2)用FeO冶炼Fe的过程涉及如下反应:
反应I:FeO(s) + CO(g) Fe(s) + CO (g)
2
反应II:FeO(s) + C(s) Fe(s) + CO(g)
①将FeO和CO放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态
的是______(填序号);
A.容器内气体的密度不再发生变化 B.CO的生成速率等于消耗速率
C.容器内气体总压强不再发生变化 D.容器内CO和CO 的物质的量
2
相等
高三化学试题 第10页 (共12页)
学科网(北京)股份有限公司②在一个体积可变的容器中,维持温度1200 K不变(此时反应I的分压平衡常数K
P1
=1.00)。压缩容器体积,达到新平衡时,CO的分压__________(填“变大”、“变小”
或“不变”);
③用压力传感器测得平衡时容器内压强为1200 KPa,计算反应II的分压平衡常数
K :________________________________________________(写出计算过程)。
P2
20.(12分)科学探究要实事求是、严谨细致。为检验溶液中是否含有Cl-,某同学向溶液
中先加HNO,再加AgNO,若有白色沉淀生成,则证明有Cl-。对此结论,有人提出
3 3
了质疑:溶液中可能有 ,并设计了如下探究性实验。
实验一:向NaSO 溶液中滴加AgNO 溶液
2 4 3
NaSO 溶液 AgNO 溶液 现象
2 4 3
编
体积 浓度 体积 浓度 混合后Ag+浓
号
/mL /(mol·L−1) /滴 /mol·L−1 度/(mol·L−1)
① 1 1 3 2 0.2 出现大量白色沉淀
② 1 1 3 0.5 0.05 出现少量白色沉淀
③ 1 1 3 0.1 0.01 有些许浑浊
④ 1 1 3 0.01 0.001 无明显变化
(1)实验一中产生沉淀的离子方程式为______________________________。
(2)已知:25℃时,K (Ag SO )=1.2×10-5,K (AgCI)=1.8×10-10。实验一中编号④无明
sp 2 4 sp
显变化,若要产生浑浊,溶液中c( )理论上至少需达到_____mol·L-1。若向 1 mL某浓
度的NaCl与NaSO 的混合溶液中加入 3 滴 0.1 mol‧L-1 AgNO 溶液,分析上面数据,下
2 4 3
列说法正确的是_____(填序号)。
A.混合液中c(( ) = 1 mol‧L-1时不会产生Ag SO 沉淀
2 4
B.混合液中c( ) = 0.1 mol‧L-1时不会产生Ag SO 沉淀
2 4
C.无论 浓度大小,都会产生Ag SO 沉淀
2 4
D.若使用 0.01 mol‧L-1AgNO 溶液,可基本排除 对Cl-检验构成的干扰
3
高三化学试题 第11页 (共12页)
学科网(北京)股份有限公司将实验一编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉
淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下
实验。
实验二:
AgNO 浓
3
编号 现象 滴加硝酸后的现象
度/mol·L−1
滴加稀硝酸,沉淀大量溶解;改加浓硝
① 2 出现大量白色沉淀
酸,沉淀较快消失
② 0.5 出现少量白色沉淀 滴加稀硝酸,沉淀基本消失
(3)对于Ag SO 溶于硝酸的原因提出了如下假设,请完成假设二。
2 4
假设一:NO -对Ag SO 溶解起作用。
3 2 4
假设二:________________________________。
(4)选择合适的试剂并设计实验方案,分别验证假设一和假设二是否成立。请补充完
整实验操作和现象。
步骤 操作 现象 结论
步骤 固体不溶
取少量Ag SO 于试管中,加入2mL水,振荡 ╲
2 4
① 解
步骤
将①的浊液分成两等份 ╲ ╲
②
步骤
向其中一份加入1mL0.1 mol·L−1的NaNO ,振荡 ① 假设一不成立
3
③
步骤
向另一份加入② ③ 假设二成立
④
(5)通过(4)的实验,请用平衡理论解释Ag SO 溶解的原因: _________________。
2 4
(已知:HSO === H+ + 、 H+ + )
2 4
高三化学试题 第12页 (共12页)
学科网(北京)股份有限公司