文档内容
玉溪师院附中 2025 届高三上学期开学考试
化 学 试 卷
满分:100分 时间:75分钟
注意事项:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓
名、准考证号填涂在答题卡上。
2. 答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号框涂黑,如
需改动,用橡皮擦干净后,再涂其他答案标号框,写在本试卷上无效。
3. 答第Ⅱ卷时,将答案写在答题卡上,写在本试卷上无效。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Mg—24 Cl—35.5
K—39 Mn—55
第 I 卷(选择题,共 42分)
一、选择题(共 14小题,每小题 3分,共 42分。每小题只有一个选项符合题意。)
1.(2024·湖北)劳动人民的发明创造是中华优秀传统文化的组成部分。下列化学原理描述错误的是( )
发明 关键操作 化学原理
A 制墨 松木在窑内焖烧 发生不完全燃烧
B 陶瓷 黏土高温烧结 形成新的化学键
C 造纸 草木灰水浸泡树皮 促进纤维素溶解
D 火药 硫黄、硝石和木炭混合,点燃 发生氧化还原反应
2. (2024·江苏)反应PbS+4H O =PbSO +4H O可用于壁画修复。下列说法正确的是( )
2 2 4 2
A.S2-的结构示意图为 B.H O 中既含离子键又含共价键
2 2
C.SO 2-中S元素的化合价为+6 D.H O的空间构型为直线形
4 2
∆
3. 在刚性容器中发生反应:MgO+C+Cl MgCl +CO。N 为阿伏加德罗常数的值,若消耗44.8L(标准状
2 2 A
况)Cl ,下列叙述错误的是( )
2
A.转移的电子数为4N B.生成的氧化产物分子数为2N
A A
C.反应后容器内气体密度减小 D.将标准状况下44.8LCl 溶于水,溶液中Cl—的数目为2N
2 A
4. (2024新课标)对于下列过程中发生的化学反应,相应离子方程式正确的是( )
第 1 页 共 8 页
学科网(北京)股份有限公司A.试管壁上的银镜用稀硝酸清洗:Ag+2H++NO —=Ag++NO ↑+H O
3 2 2
B.工业废水中的Pb2+用FeS去除:Pb2++S2—=PbS↓
C.海水提溴过程中将溴吹入SO 吸收塔:Br +SO +2H O=2Br—+SO 2-+4H+
2 2 2 2 4
D.用草酸标准溶液测定高锰酸钾溶液的浓度:2MnO —+5C O 2—+16H+=2Mn2++10CO ↑+8H O
4 2 4 2 2
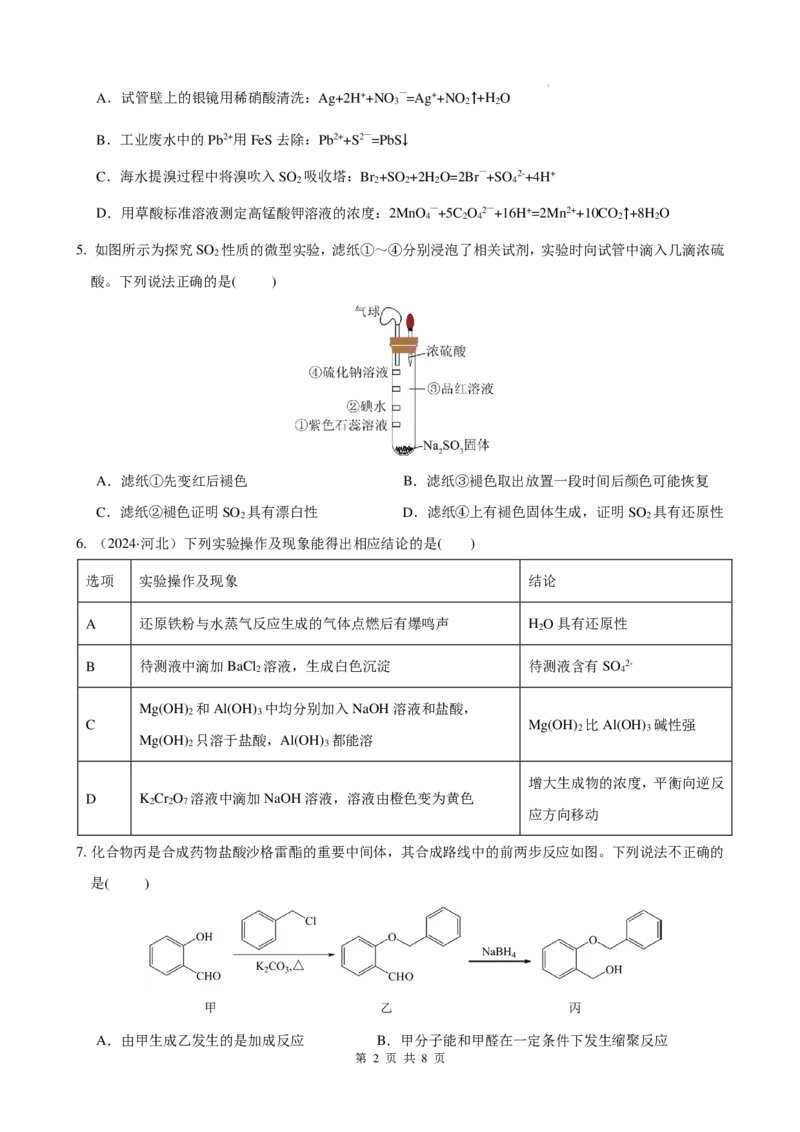
5. 如图所示为探究SO 性质的微型实验,滤纸①~④分别浸泡了相关试剂,实验时向试管中滴入几滴浓硫
2
酸。下列说法正确的是( )
A.滤纸①先变红后褪色 B.滤纸③褪色取出放置一段时间后颜色可能恢复
C.滤纸②褪色证明SO 具有漂白性 D.滤纸④上有褪色固体生成,证明SO 具有还原性
2 2
6. (2024·河北)下列实验操作及现象能得出相应结论的是( )
选项 实验操作及现象 结论
A 还原铁粉与水蒸气反应生成的气体点燃后有爆鸣声 H O具有还原性
2
B 待测液中滴加BaCl 溶液,生成白色沉淀 待测液含有SO 2-
2 4
Mg(OH) 和Al(OH) 中均分别加入NaOH溶液和盐酸,
2 3
C Mg(OH) 比Al(OH) 碱性强
2 3
Mg(OH) 只溶于盐酸,Al(OH) 都能溶
2 3
增大生成物的浓度,平衡向逆反
D K Cr O 溶液中滴加NaOH溶液,溶液由橙色变为黄色
2 2 7
应方向移动
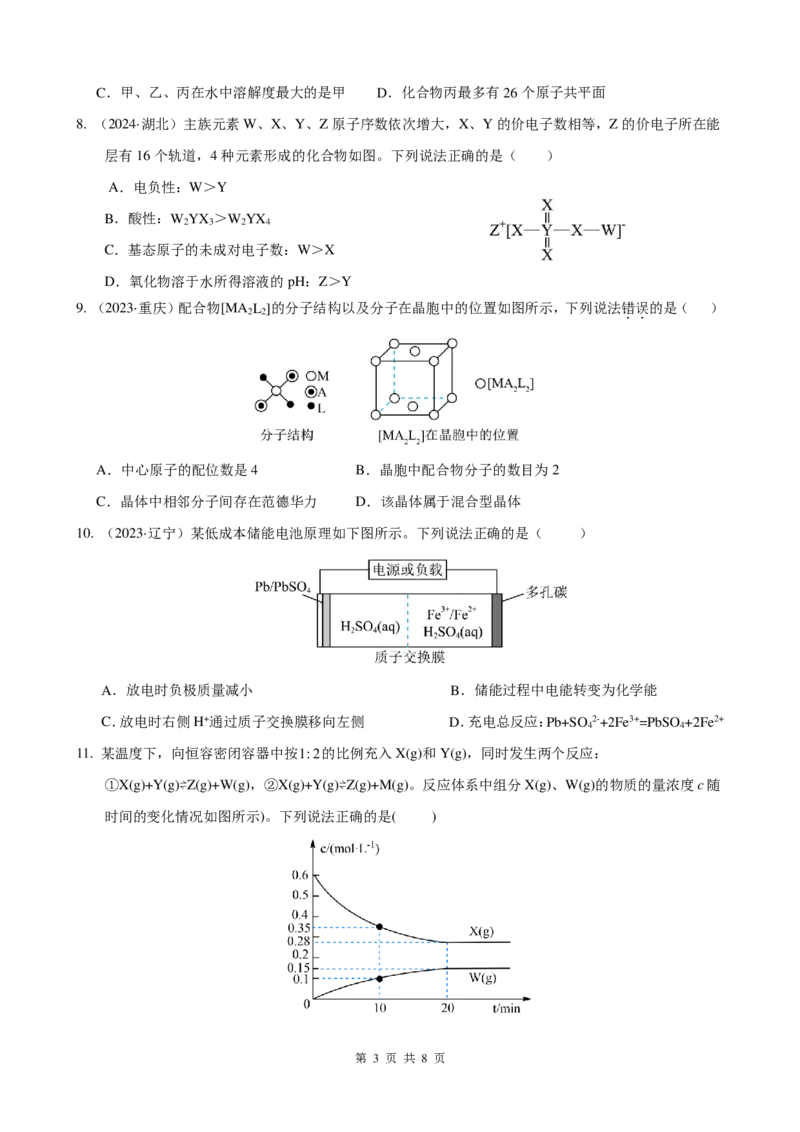
7. 化合物丙是合成药物盐酸沙格雷酯的重要中间体,其合成路线中的前两步反应如图。下列说法不正确的
是( )
A.由甲生成乙发生的是加成反应 B.甲分子能和甲醛在一定条件下发生缩聚反应
第 2 页 共 8 页
学科网(北京)股份有限公司C.甲、乙、丙在水中溶解度最大的是甲 D.化合物丙最多有26个原子共平面
8. (2024·湖北)主族元素W、X、Y、Z原子序数依次增大,X、Y的价电子数相等,Z的价电子所在能
层有16个轨道,4种元素形成的化合物如图。下列说法正确的是( )
A.电负性:W>Y
B.酸性:W YX >W YX
2 3 2 4
C.基态原子的未成对电子数:W>X
D.氧化物溶于水所得溶液的pH:Z>Y
9. (2023·重庆)配合物[MA 2 L 2 ]的分子结构以及分子在晶胞中的位置如图所示,下列说法错 . 误 . 的是( )
A.中心原子的配位数是4 B.晶胞中配合物分子的数目为2
C.晶体中相邻分子间存在范德华力 D.该晶体属于混合型晶体
10. (2023·辽宁)某低成本储能电池原理如下图所示。下列说法正确的是( )
A.放电时负极质量减小 B.储能过程中电能转变为化学能
C.放电时右侧H+通过质子交换膜移向左侧 D.充电总反应:Pb+SO 2-+2Fe3+=PbSO +2Fe2+
4 4
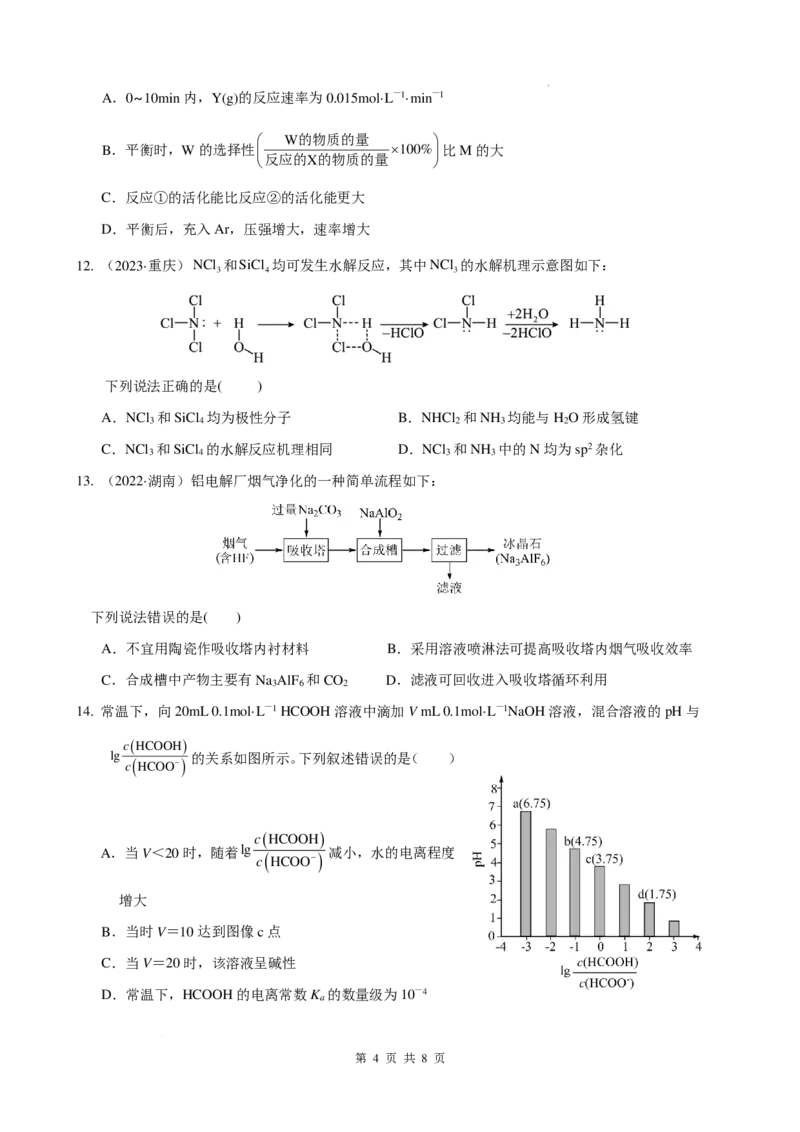
11. 某温度下,向恒容密闭容器中按1:2的比例充入X(g)和Y(g),同时发生两个反应:
①X(g)+Y(g)⇌Z(g)+W(g),②X(g)+Y(g)⇌Z(g)+M(g)。反应体系中组分X(g)、W(g)的物质的量浓度c随
时间的变化情况如图所示)。下列说法正确的是( )
第 3 页 共 8 页
学科网(北京)股份有限公司A.0~10min内,Y(g)的反应速率为0.015mol·L—1·min—1
W的物质的量
B.平衡时,W的选择性 ×100%比M的大
反应的X的物质的量
C.反应①的活化能比反应②的活化能更大
D.平衡后,充入Ar,压强增大,速率增大
12. (2023·重庆)NCl 和SiCl 均可发生水解反应,其中NCl 的水解机理示意图如下:
3 4 3
下列说法正确的是( )
A.NCl 和SiCl 均为极性分子 B.NHCl 和NH 均能与H O形成氢键
3 4 2 3 2
C.NCl 和SiCl 的水解反应机理相同 D.NCl 和NH 中的N均为sp2杂化
3 4 3 3
13. (2022·湖南)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A.不宜用陶瓷作吸收塔内衬材料 B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na AlF 和CO D.滤液可回收进入吸收塔循环利用
3 6 2
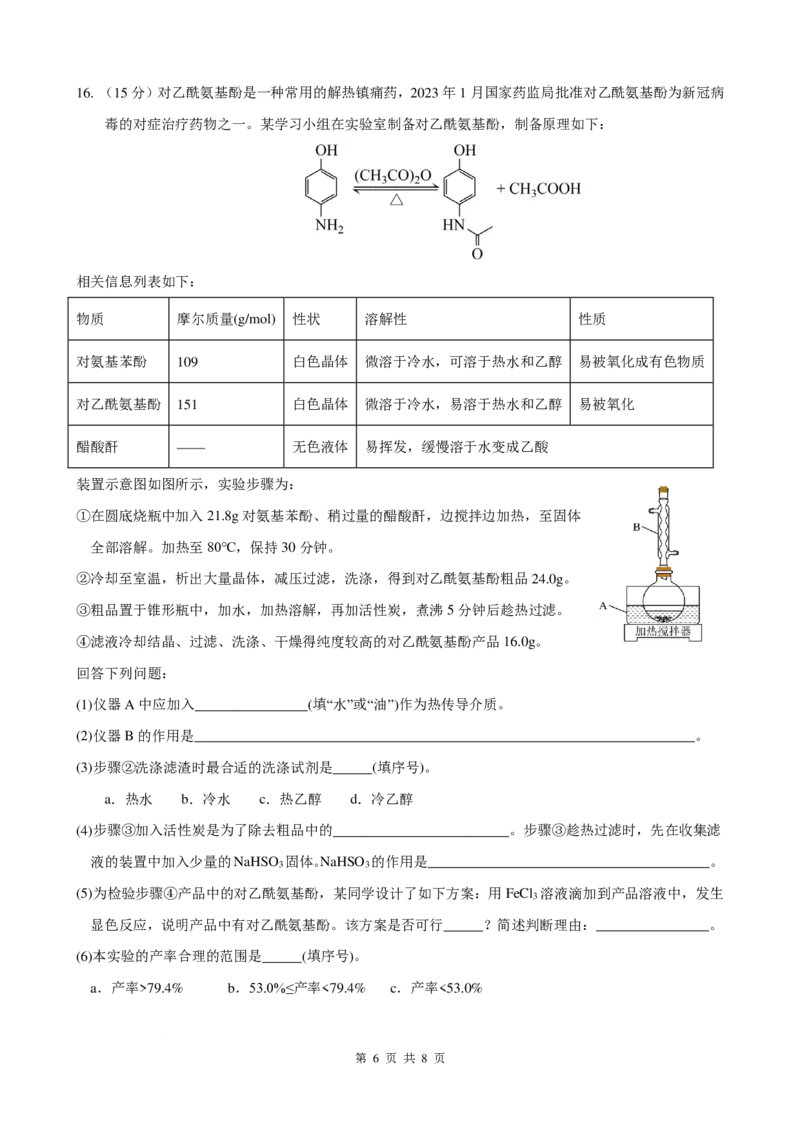
14. 常温下,向20mL 0.1mol·L—1 HCOOH溶液中滴加V mL 0.1mol·L—1NaOH溶液,混合溶液的pH与
c(HCOOH)
lg
c
( HCOO−)
的关系如图所示。下列叙述错误的是( )
c(HCOOH)
A.当V<20时,随着lg
c
( HCOO−)
减小,水的电离程度
增大
B.当时V=10达到图像c点
C.当V=20时,该溶液呈碱性
D.常温下,HCOOH的电离常数K 的数量级为10—4
a
第 4 页 共 8 页
学科网(北京)股份有限公司第Ⅱ卷(非选择题,共58分)
二、非选择题(共 4个题,共 58分。)
15.(14分)高铁酸钾(K FeO )是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能绿色净水剂,易
2 4
溶于水,难溶于有机溶剂。一种以Mn、Fe及MnO 制备高铁酸钾和活性MnO 的流程如图所示:
2 2
已知:部分金属离子在溶液中沉淀的pH如下表:
金属离子 Fe3+ Fe2+ Mn2+
开始沉淀的pH 1.9 7.0 8.1
完全沉淀的pH 3.2 9.0 10.1
回答下列问题:
(1)MnO 不溶于稀硫酸,加入过量FeSO 目的是在酸性条件下将MnO 还原成稳定的Mn2+,写出该反应的
2 4 2
离子方程式_________________________________________________________________________。
(2)“调pH”操作中,调节pH的范围是__________________________,“滤渣”的主要成分是 。
(3)“沉锰”操作中,温度过高会导致MnO 产率降低,原因是__________________________________________。
2
(4)某温度下,若要从10m3c(FeO2-)=2.0×10-4mol·L-1的溶液中沉淀FeO2-(浓度降至10-5mol·L-1),理论上需
4 4
加入Ca(OH) 固体的物质的量不少于 mol。(已知该温度下CaFeO 的K =4.5×10-9,不考虑水解
2 4 sp
和溶液体积变化)
(5)已知锰的某种氧化物的晶胞如图所示,其中锰的化合价为 ,配位数为
第 5 页 共 8 页
学科网(北京)股份有限公司16. (15分)对乙酰氨基酚是一种常用的解热镇痛药,2023年1月国家药监局批准对乙酰氨基酚为新冠病
毒的对症治疗药物之一。某学习小组在实验室制备对乙酰氨基酚,制备原理如下:
相关信息列表如下:
物质 摩尔质量(g/mol) 性状 溶解性 性质
对氨基苯酚 109 白色晶体 微溶于冷水,可溶于热水和乙醇 易被氧化成有色物质
对乙酰氨基酚 151 白色晶体 微溶于冷水,易溶于热水和乙醇 易被氧化
醋酸酐 —— 无色液体 易挥发,缓慢溶于水变成乙酸
装置示意图如图所示,实验步骤为:
①在圆底烧瓶中加入21.8g对氨基苯酚、稍过量的醋酸酐,边搅拌边加热,至固体
全部溶解。加热至80℃,保持30分钟。
②冷却至室温,析出大量晶体,减压过滤,洗涤,得到对乙酰氨基酚粗品24.0g。
③粗品置于锥形瓶中,加水,加热溶解,再加活性炭,煮沸5分钟后趁热过滤。
④滤液冷却结晶、过滤、洗涤、干燥得纯度较高的对乙酰氨基酚产品16.0g。
回答下列问题:
(1)仪器A中应加入________________(填“水”或“油”)作为热传导介质。
(2)仪器B的作用是_______________________________________________________________________。
(3)步骤②洗涤滤渣时最合适的洗涤试剂是 (填序号)。
a.热水 b.冷水 c.热乙醇 d.冷乙醇
(4)步骤③加入活性炭是为了除去粗品中的_________________________。步骤③趁热过滤时,先在收集滤
液的装置中加入少量的NaHSO 固体。NaHSO 的作用是________________________________________。
3 3
(5)为检验步骤④产品中的对乙酰氨基酚,某同学设计了如下方案:用FeCl 溶液滴加到产品溶液中,发生
3
显色反应,说明产品中有对乙酰氨基酚。该方案是否可行 ?简述判断理由:________________。
(6)本实验的产率合理的范围是 (填序号)。
a.产率>79.4% b.53.0%≤产率<79.4% c.产率<53.0%
第 6 页 共 8 页
学科网(北京)股份有限公司17. (14分)低碳烯烃(乙烯、丙烯、丁烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举
足轻重的作用。研究其合成方法受到科学家的青睐。回答下列问题:
(1)乙烷直接脱氢制乙烯法
298K时,乙烷的裂解反应历程如右图所示:
①图中基元反应b_______________(填“是”或“不是”)该反应的决速步骤。
已知:乙烷的燃烧热 H =—1559.8kJmol—1,H 的燃烧热 H =—285.8kJmol—1,计算乙烯的燃烧热
1 2 2
H =________△______________⋅。 △ ⋅
3
②对于△该反应,一定温度下,当总压恒定为100kPa,往甲密闭容器中通入amolC H ,往乙密闭容器
2 6
中通入amolC H 和N 的混合气体(N 不参与反应),达到平衡时,C H 的转化率:甲 乙(填“>”“=”
2 6 2 2 2 6
或“<”)。
1
③在乙烷裂解制乙烯的过程中,可能发生多个反应,反应的平衡常数对数值(lgK)与温度的倒数( )的
T
关系如图所示。工业上一般选择温度在1000K左右的可能原因是______________________________。
(2)一定条件下,碘甲烷(CH I)热裂解制低碳烯烃的主要反应有:
3
反应ⅰ:2CH I(g)⇌C H (g)+2HI(g) H >0
3 2 4 1
反应ⅱ:3C H (g)⇌2C H (g) H <△0
2 4 3 6 2
反应ⅲ:2C H (g)⇌C H (g) △H <0
2 4 4 8 3
①结合题给信息,请推测有利于△提高乙烯产率的措施有_______________________________(至少答两点)。
②其他条件不变,起始压强为0.1aMPa,向容积为1L的恒容密闭容器中投入1molCH I(g),只发生反应
3
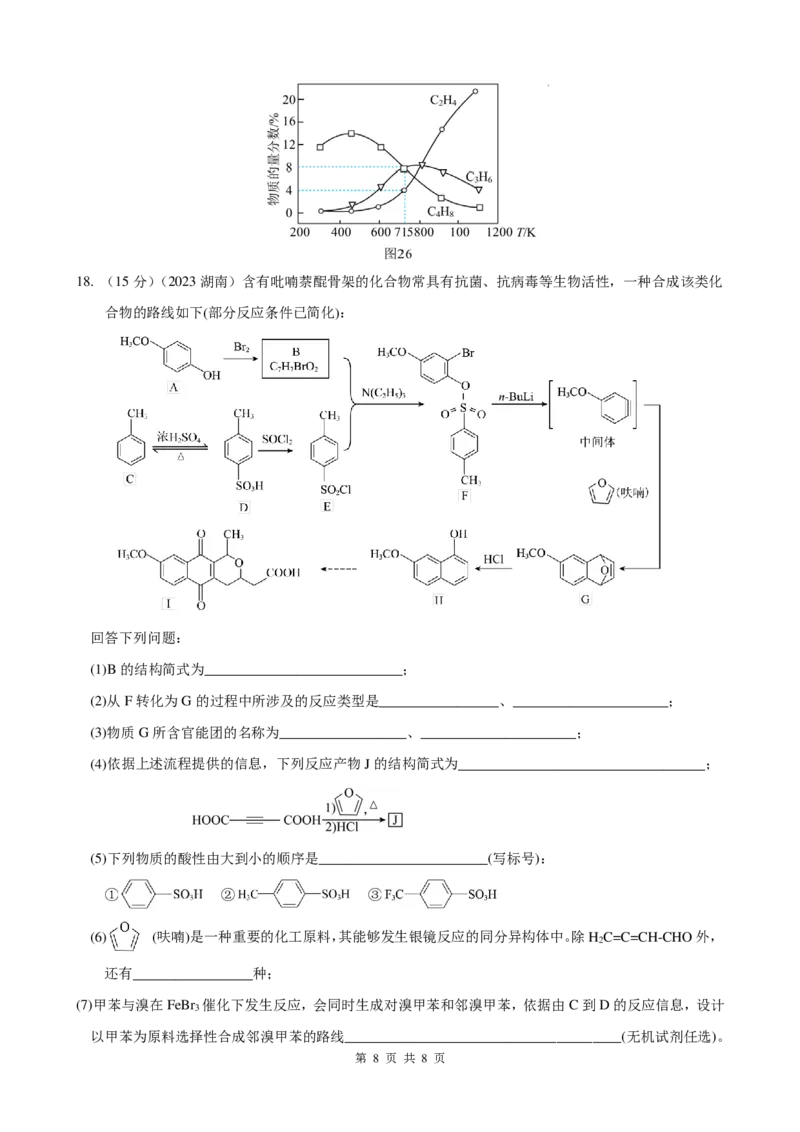
ⅰ、ⅱ、ⅲ,反应温度对平衡体系中乙烯、丙烯和丁烯所占气体组分物质的量分数的影响如图26所示。
当混合气体的平均摩尔质量不再发生变化时,____________________(填“能”或“不能”)说明该体系达
到平衡状态。715K条件下,平衡时反应ⅰ的压强平衡常数K =_________________MPa.
p
第 7 页 共 8 页
学科网(北京)股份有限公司18. (15分)(2023湖南)含有吡喃萘醌骨架的化合物常具有抗菌、抗病毒等生物活性,一种合成该类化
合物的路线如下(部分反应条件已简化):
回答下列问题:
(1)B的结构简式为____________________________;
(2)从F转化为G的过程中所涉及的反应类型是_________________、______________________;
(3)物质G所含官能团的名称为__________________、______________________;
(4)依据上述流程提供的信息,下列反应产物J的结构简式为___________________________________;
(5)下列物质的酸性由大到小的顺序是________________________(写标号):
① ② ③
(6) (呋喃)是一种重要的化工原料,其能够发生银镜反应的同分异构体中。除H C=C=CH-CHO外,
2
还有_________________种;
(7)甲苯与溴在FeBr 催化下发生反应,会同时生成对溴甲苯和邻溴甲苯,依据由C到D的反应信息,设计
3
以甲苯为原料选择性合成邻溴甲苯的路线_______________________________________(无机试剂任选)。
第 8 页 共 8 页
学科网(北京)股份有限公司玉溪师院附中 2025 届高三上学期开学考试
化学参考答案
一、选择题(共 14小题,每小题 3分,共 42分。每小题只有一个选项符合意。)
1~5 CCDCB 6~10 CADDB 11~14 CBCB
二、非选择题(共 4个题,共 58分。)
15.(14分,每空2分)
(1)MnO +2Fe2++4H+=Mn2++2Fe3++2H O
2 2
(2) 3.2≤pH<8.l Fe(OH)
3
(3)温度过高时,NH HCO 的分解速率加快,浓度降低,不利于沉锰
4 3
(4)6.4 (5) +2 6
16. (15分,除标记外,每空2分)
(1)水(1分) (2)冷凝回流 (3)b
(4)有色物质 防止对乙酰氨基酚被氧化
(5)不可行 产品中混有对氨基苯酚,也能与FeCl 溶液发生显色反应 (6)c
3
17.(14分,每空2分)
(1)①不是 -1411kJ·mol −1 ②<
③反应温度太低,反应速率太慢,乙烷裂解制乙烯反应的化学平衡常数K太小;反应温度太高,副反
应增多,容易产生积碳。
(2)①较高的温度、较低的压强和使用对反应ⅰ选择性更高的催化剂(任答2点) ②能 0.08a
18. (15分,除标注外,每空2分)
(1) (2)消去反应(1分) 加成反应(1分) (3)碳碳双键(1分) 醚键(1分)
学科网(北京)股份有限公司(4) (5)③>①>② (6)4
(7)
浓H
∆
2S O4
F
B
eB
r2
r3
→ H2O
∆
/H+→
(3分,写对一步得1分)
学科网(北京)股份有限公司