文档内容
年哈三中高三学年
2024
第四次模拟考试 化学 试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间75分钟。
第Ⅰ卷 (选择题 共45分)
可能用到的相对原子质量:H1 C12 N14 O16 Na23 K39 Mn55
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只
有一项符合题目要求。
1.材料是人类赖以生存和发展的物质基础。下列说法错误的是
A.硅晶片是生产芯片的基础材料
B.棉花、羊毛、蚕丝、涤纶都属于天然纤维
C.硫化后的橡胶适合制造轮胎,加入炭黑可提高轮胎的耐磨性
D.离子液体是熔点不高的仅有离子组成的的液体物质
2.下列化学用语或表述正确的是
A.NaOH的电子式: B.基态Cr的价层电子排布式:3d44s2
C.HClO的结构式:H―O―Cl D.CO 2-的空间结构:三角锥形
3
3.下列所示物质的制备方法正确的是
A.从海带中制取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏
B.从海水中提金属镁:浓缩海水 Mg(OH) MgCl (aq) Mg
2 2
C.实验室制氨气:加热氯化铵固体
D.铜的电解精炼:粗铜为阳极
4.下列实验不能达到实验目的的是
A.用酸性KMnO 鉴别苯和甲苯
4
B.用水鉴别NO 和溴蒸气
2
C.用饱和NaOH 溶液除去乙酸乙酯中的乙酸和乙醇
D.用湿润红色石蕊试纸检验NH
3
5.N 代表阿伏加德罗常数的值。下列说法正确的是
A
A.常温常压下,1.8g 甲基(-12CD )中含有的中子数为 0.9N
3 A
B.1mol 纯净Cl 通入水中,转移电子数为N
2 A
C.11.2L甲烷和乙烯混合物中含氢原子数目为2N
A
D.1L0.01mol/LKAl(SO ) 溶液中含有的阳离子数为0.02N
4 2 A
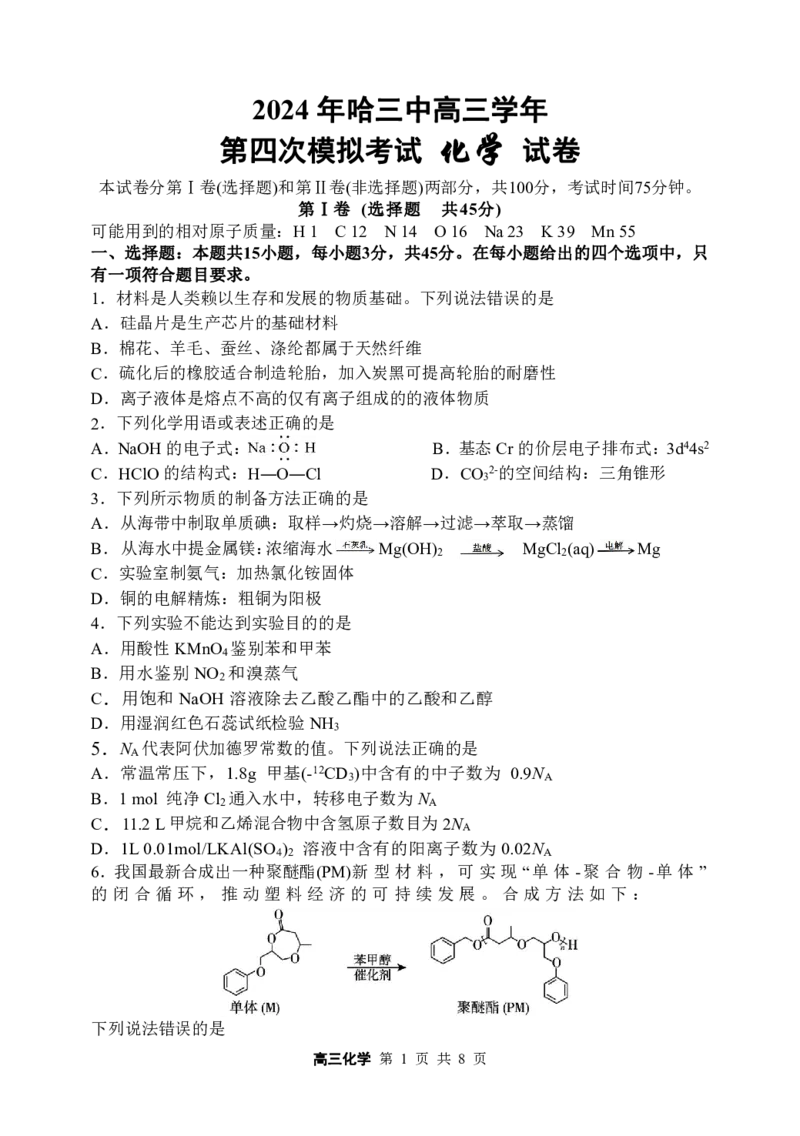
6.我国最新合成出一种聚醚酯(PM)新型 材料 ,可实 现“单体 -聚合 物 -单体 ”
的闭 合循 环, 推动 塑料 经济 的可 持续 发展 。合 成方 法如 下 :
下列说法错误的是
高三化学 第 1 页 共 8 页
{#{QQABDYQAogAoAIBAABgCAwVCCgMQkBEAACoOwBAEIAAACBNABAA=}#}A.M分子中含有2个手性碳原子
B.M在酸性条件下水解开环得到
C.PM中含有酯基、醚键和羟基三种官能团
D.合成1molPM,理论上需要 nmolM 和nmol苯甲醇
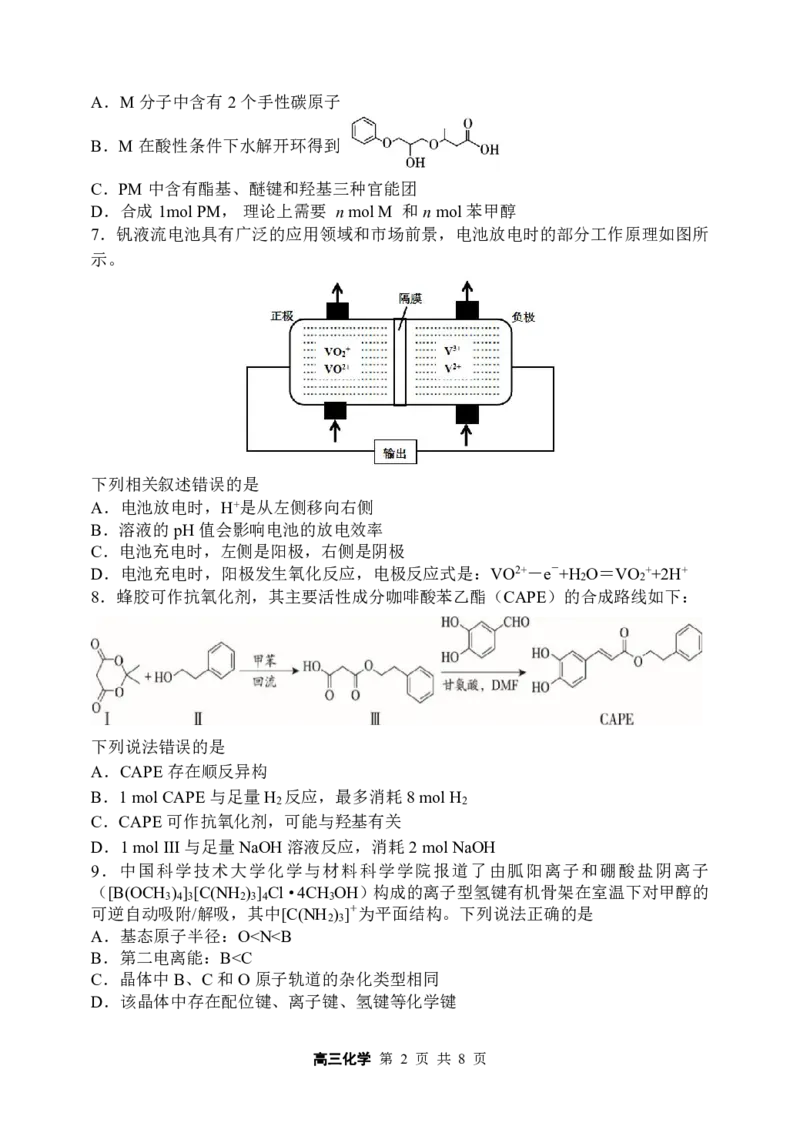
7.钒液流电池具有广泛的应用领域和市场前景,电池放电时的部分工作原理如图所
示。
下列相关叙述错误的是
A.电池放电时,H+是从左侧移向右侧
B.溶液的pH值会影响电池的放电效率
C.电池充电时,左侧是阳极,右侧是阴极
D.电池充电时,阳极发生氧化反应,电极反应式是:VO2+-e-+H O=VO ++2H+
2 2
8.蜂胶可作抗氧化剂,其主要活性成分咖啡酸苯乙酯(CAPE)的合成路线如下:
下列说法错误的是
A.CAPE存在顺反异构
B.1molCAPE与足量H 反应,最多消耗8molH
2 2
C.CAPE可作抗氧化剂,可能与羟基有关
D.1molIII与足量NaOH溶液反应,消耗2molNaOH
9.中国科学技术大学化学与材料科学学院报道了由胍阳离子和硼酸盐阴离子
([B(OCH ) ] [C(NH ) ] Cl·4CH OH)构成的离子型氢键有机骨架在室温下对甲醇的
3 4 3 2 3 4 3
可逆自动吸附/解吸,其中[C(NH ) ]+为平面结构。下列说法正确的是
2 3
A.基态原子半径:OC
2 3
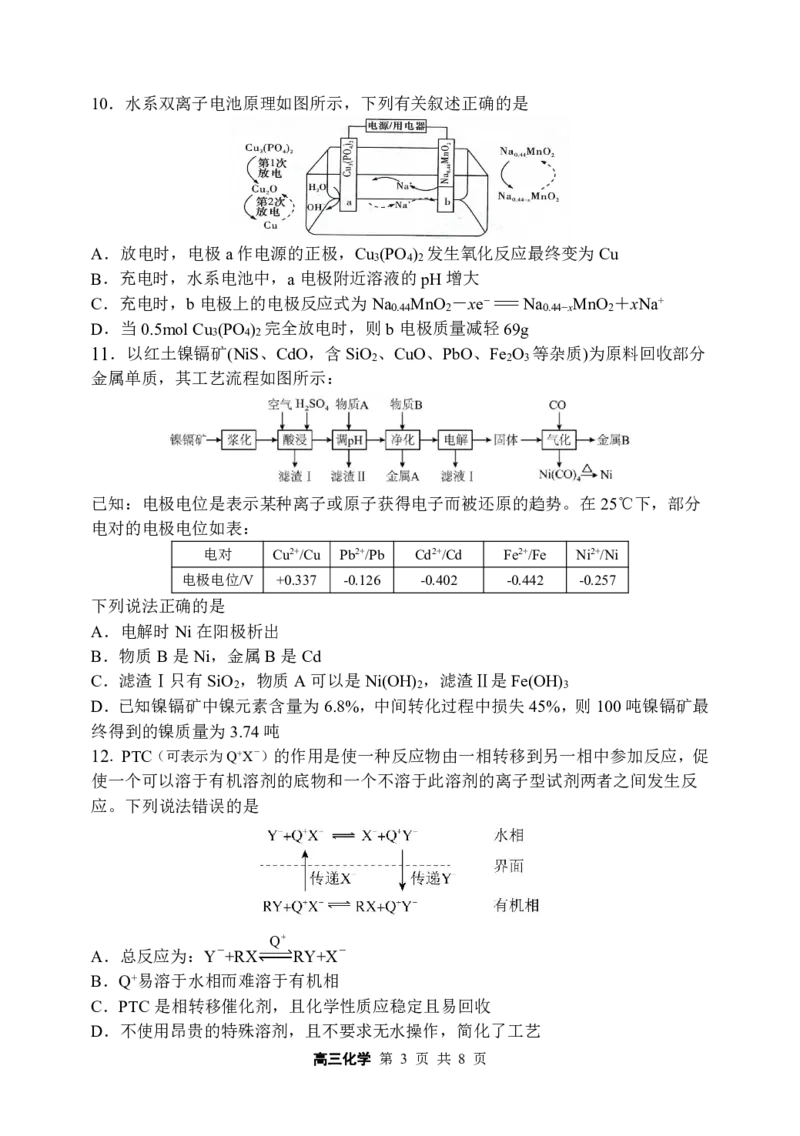
将盛有相同浓度的CuCl 溶液的两支试 冷水中溶液呈蓝色, Cu2+在不同温
2
B
管分别置于冷水和热水中 热水中溶液为黄色 度下颜色不同
其他条件相
两支试管各盛4mL0.1mol·L-1酸性高锰 加入0.2mol·L-1草酸
同,反应物浓
C 酸钾溶液,分别加入2mL0.1mol·L-1草 溶液的试管中溶液
度越大,反应
酸溶液和2mL0.2mol·L-1草酸溶液 紫色消失更快
速率越快
在试管中放入少量脱脂棉,加入几滴蒸 纤维素在酸的
馏水和几滴浓硫酸,用玻璃棒将混合物 催化下可水
D 产生砖红色沉淀
搅拌成糊状,加入过量NaOH溶液中和 解,水解产物
至碱性,再滴入3滴5%CuSO 溶液加热 中含醛基
4
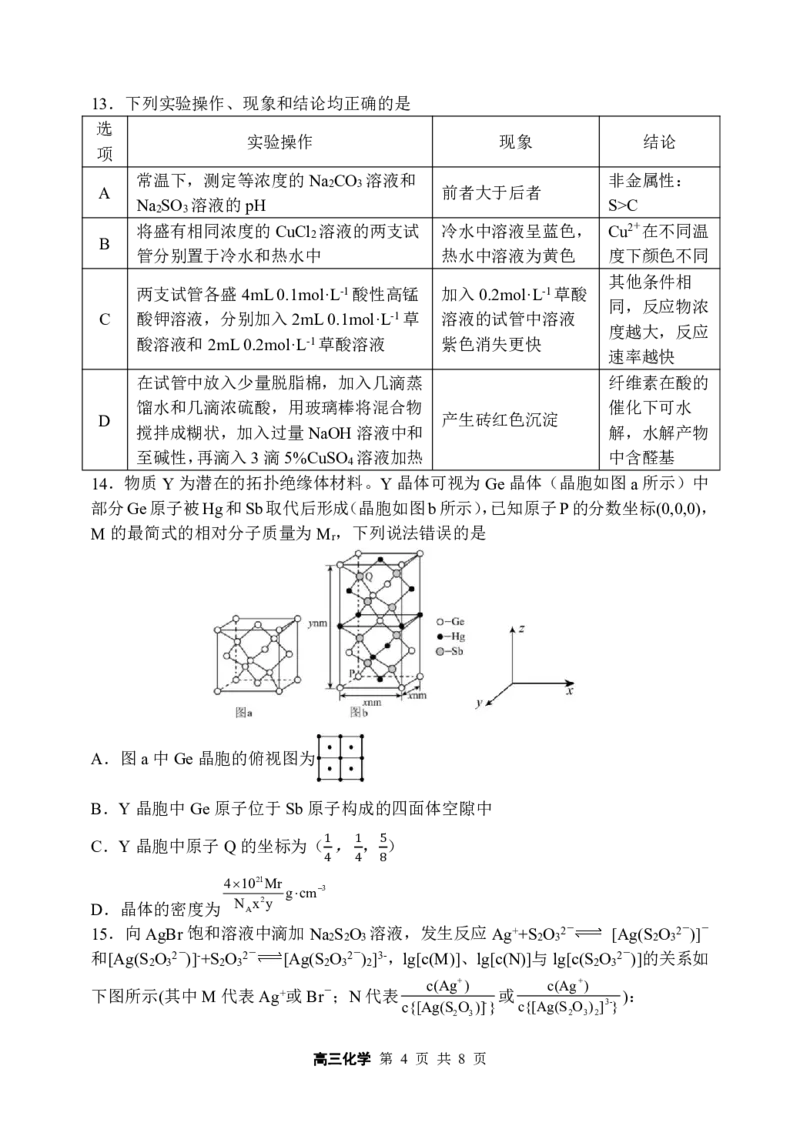
14.物质Y为潜在的拓扑绝缘体材料。Y晶体可视为Ge晶体(晶胞如图a所示)中
部分Ge原子被Hg和Sb取代后形成(晶胞如图b所示),已知原子P的分数坐标(0,0,0),
M的最简式的相对分子质量为M,下列说法错误的是
r
A.图a中Ge晶胞的俯视图为
B.Y晶胞中Ge原子位于Sb原子构成的四面体空隙中
C.Y晶胞中原子Q的坐标为( , , )
1 1 5
41021Mr gcm3 4 4 8
D.晶体的密度为 N
A
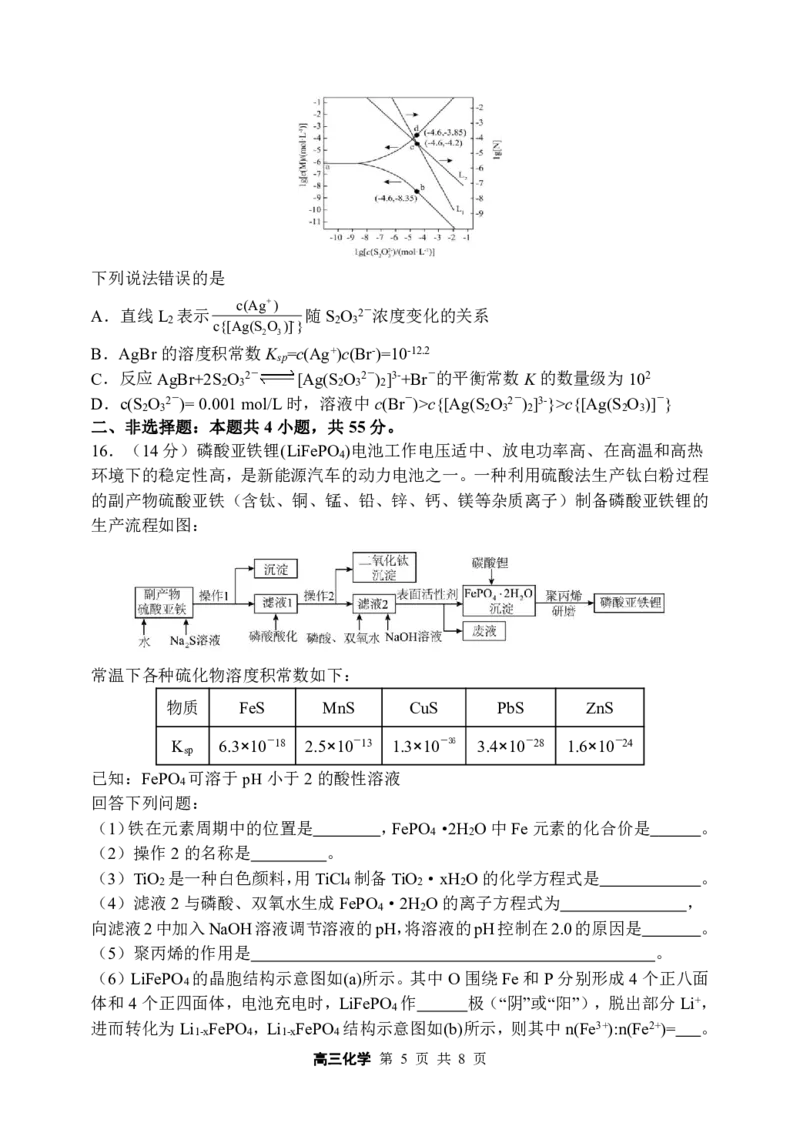
x2y
15.向AgBr饱和溶液中滴加Na S O 溶液,发生反应Ag++S O 2- [Ag(S O 2-)]-
2 2 3 2 3 2 3
和[Ag(S O 2-)]-+S O 2- [Ag(S O 2-) ]3-,lg[c(M)]、lg[c(N)]与lg[c(S O 2-)]的关系如
2 3 2 3 2 3 2 2 3
c(Ag+) c(Ag+)
下图所示(其中M代表Ag+或Br-;N代表 或 ):
c{[Ag(SO )]-} c{[Ag(SO ) ]3-}
2 3 2 3 2
高三化学 第 4 页 共 8 页
{#{QQABDYQAogAoAIBAABgCAwVCCgMQkBEAACoOwBAEIAAACBNABAA=}#}下列说法错误的是
c(Ag+)
A.直线L 表示 随S O 2-浓度变化的关系
2 c{[Ag(SO )]-} 2 3
2 3
B.AgBr的溶度积常数K =c(Ag+)c(Br-)=10-12.2
sp
C.反应AgBr+2S O 2- [Ag(S O 2-) ]3-+Br-的平衡常数K的数量级为102
2 3 2 3 2
D.c(S O 2-)=0.001mol/L时,溶液中c(Br-)>c{[Ag(S O 2-) ]3-}>c{[Ag(S O )]-}
2 3 2 3 2 2 3
二、非选择题:本题共4小题,共55分。
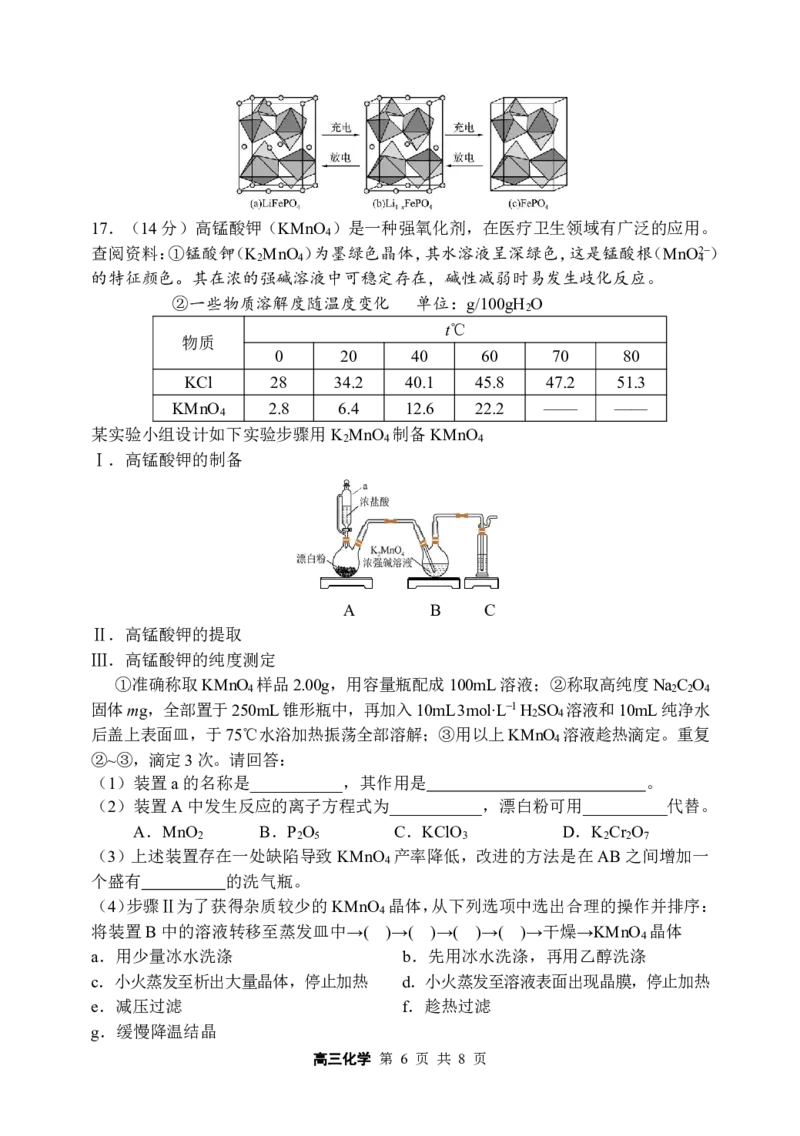
16.(14分)磷酸亚铁锂(LiFePO )电池工作电压适中、放电功率高、在高温和高热
4
环境下的稳定性高,是新能源汽车的动力电池之一。一种利用硫酸法生产钛白粉过程
的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的
生产流程如图:
常温下各种硫化物溶度积常数如下:
物质 FeS MnS CuS PbS ZnS
K 6.3×10-18 2.5×10-13 1.3×10-36 3.4×10-28 1.6×10-24
sp
已知:FePO
4
可溶于pH小于2的酸性溶液
回答下列问题:
(1)铁在元素周期中的位置是 ,FePO ·2H O中Fe元素的化合价是 。
4 2
(2)操作2的名称是 。
(3)TiO 是一种白色颜料,用TiCl 制备TiO ·xH O的化学方程式是 。
2 4 2 2
(4)滤液2与磷酸、双氧水生成FePO ·2H O的离子方程式为 ,
4 2
向滤液2中加入NaOH溶液调节溶液的pH,将溶液的pH控制在2.0的原因是 。
(5)聚丙烯的作用是 。
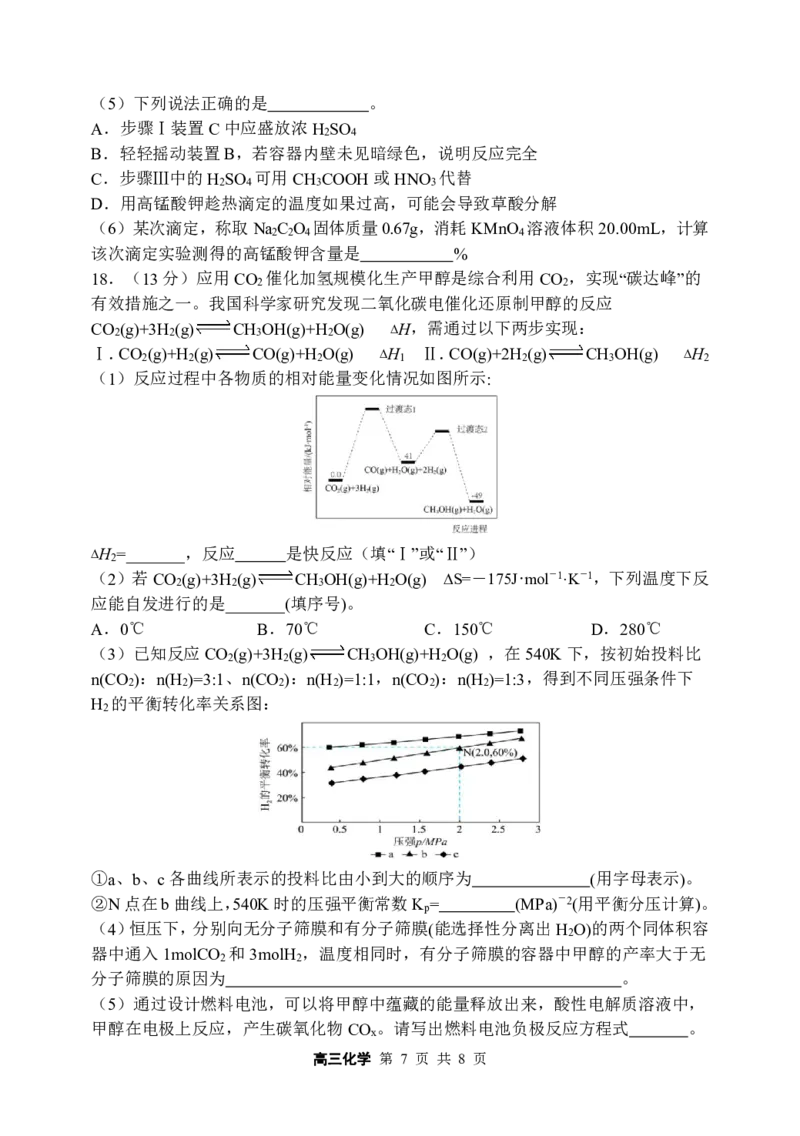
(6)LiFePO 的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面
4
体和4个正四面体,电池充电时,LiFePO 作 极(“阴”或“阳”),脱出部分Li+,
4
进而转化为Li FePO ,Li FePO 结构示意图如(b)所示,则其中n(Fe3+):n(Fe2+)= 。
1-x 4 1-x 4
高三化学 第 5 页 共 8 页
{#{QQABDYQAogAoAIBAABgCAwVCCgMQkBEAACoOwBAEIAAACBNABAA=}#}17.(14分)高锰酸钾(KMnO )是一种强氧化剂,在医疗卫生领域有广泛的应用。
4
查阅资料:①锰酸钾(K MnO )为墨绿色晶体,其水溶液呈深绿色,这是锰酸根(MnO2−)
2 4 4
的特征颜色。其在浓的强碱溶液中可稳定存在,碱性减弱时易发生歧化反应。
②一些物质溶解度随温度变化 单位:g/100gH O
2
t℃
物质
0 20 40 60 70 80
KCl 28 34.2 40.1 45.8 47.2 51.3
KMnO 2.8 6.4 12.6 22.2 —— ——
4
某实验小组设计如下实验步骤用K MnO 制备KMnO
2 4 4
Ⅰ.高锰酸钾的制备
A B C
Ⅱ.高锰酸钾的提取
Ⅲ.高锰酸钾的纯度测定
①准确称取KMnO 样品2.00g,用容量瓶配成100mL溶液;②称取高纯度NaCO
4 2 2 4
固体mg,全部置于250mL锥形瓶中,再加入10mL3mol·L−1H SO 溶液和10mL纯净水
2 4
后盖上表面皿,于75℃水浴加热振荡全部溶解;③用以上KMnO 溶液趁热滴定。重复
4
②~③,滴定3次。请回答:
(1)装置a的名称是___________,其作用是 。
(2)装置A中发生反应的离子方程式为___________,漂白粉可用__________代替。
A.MnO B.P O C.KClO D.K Cr O
2 2 5 3 2 2 7
(3)上述装置存在一处缺陷导致KMnO 产率降低,改进的方法是在AB之间增加一
4
个盛有 的洗气瓶。
(4)步骤Ⅱ为了获得杂质较少的KMnO 晶体,从下列选项中选出合理的操作并排序:
4
将装置B中的溶液转移至蒸发皿中→( )→( )→( )→( )→干燥→KMnO 晶体
4
a.用少量冰水洗涤 b.先用冰水洗涤,再用乙醇洗涤
c.小火蒸发至析出大量晶体,停止加热 d.小火蒸发至溶液表面出现晶膜,停止加热
e.减压过滤 f.趁热过滤
g.缓慢降温结晶
高三化学 第 6 页 共 8 页
{#{QQABDYQAogAoAIBAABgCAwVCCgMQkBEAACoOwBAEIAAACBNABAA=}#}(5)下列说法正确的是 。
A.步骤Ⅰ装置C中应盛放浓H SO
2 4
B.轻轻摇动装置B,若容器内壁未见暗绿色,说明反应完全
C.步骤Ⅲ中的H SO 可用CH COOH或HNO 代替
2 4 3 3
D.用高锰酸钾趁热滴定的温度如果过高,可能会导致草酸分解
(6)某次滴定,称取NaCO 固体质量0.67g,消耗KMnO 溶液体积20.00mL,计算
2 2 4 4
该次滴定实验测得的高锰酸钾含量是 %
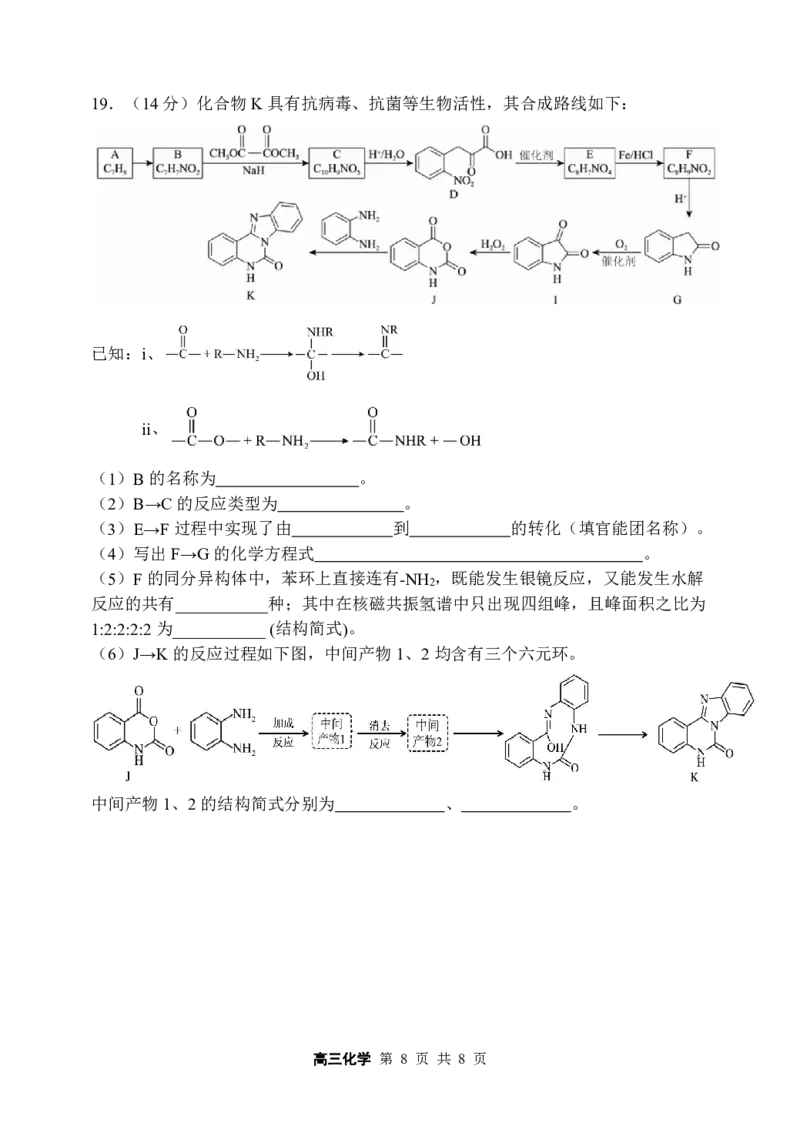
18.(13分)应用CO 催化加氢规模化生产甲醇是综合利用CO ,实现“碳达峰”的
2 2
有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应
CO
2
(g)+3H
2
(g) CH
3
OH(g)+H
2
O(g) ∆H,需通过以下两步实现:
Ⅰ.CO
2
(g)+H
2
(g) CO(g)+H
2
O(g) ∆H
1
Ⅱ.CO(g)+2H
2
(g) CH
3
OH(g) ∆H
2
(1)反应过程中各物质的相对能量变化情况如图所示:
∆H
2
=_______,反应 是快反应(填“Ⅰ”或“Ⅱ”)
(2)若CO (g)+3H (g) CH OH(g)+H O(g) ∆S=-175J·mol-1·K-1,下列温度下反
2 2 3 2
应能自发进行的是_______(填序号)。
A.0℃ B.70℃ C.150℃ D.280℃
(3)已知反应CO (g)+3H (g) CH OH(g)+H O(g) ,在540K下,按初始投料比
2 2 3 2
n(CO ):n(H )=3:1、n(CO ):n(H )=1:1,n(CO ):n(H )=1:3,得到不同压强条件下
2 2 2 2 2 2
H 的平衡转化率关系图:
2
①a、b、c各曲线所表示的投料比由小到大的顺序为 (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数K = (MPa)-2(用平衡分压计算)。
p
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出H O)的两个同体积容
2
器中通入1molCO 和3molH ,温度相同时,有分子筛膜的容器中甲醇的产率大于无
2 2
分子筛膜的原因为 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,
甲醇在电极上反应,产生碳氧化物CO 。请写出燃料电池负极反应方程式 。
x
高三化学 第 7 页 共 8 页
{#{QQABDYQAogAoAIBAABgCAwVCCgMQkBEAACoOwBAEIAAACBNABAA=}#}19.(14分)化合物K具有抗病毒、抗菌等生物活性,其合成路线如下:
已知:i、
ii、
(1)B的名称为 。
(2)B→C的反应类型为 。
(3)E→F过程中实现了由 到 的转化(填官能团名称)。
(4)写出F→G的化学方程式 。
(5)F的同分异构体中,苯环上直接连有-NH ,既能发生银镜反应,又能发生水解
2
反应的共有___________种;其中在核磁共振氢谱中只出现四组峰,且峰面积之比为
1:2:2:2:2为___________(结构简式)。
(6)J→K的反应过程如下图,中间产物1、2均含有三个六元环。
中间产物1、2的结构简式分别为 、 。
高三化学 第 8 页 共 8 页
{#{QQABDYQAogAoAIBAABgCAwVCCgMQkBEAACoOwBAEIAAACBNABAA=}#}