文档内容
湖南省常德市一中 2023-2024 学年下期期末试卷
高二化学
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改
动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本
试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回
一、选择题:(每小题3分,共14题42分。每小题只有一个选项符合题目要求)
1.《中国能源矿产地质调查报告》显示我国天然气水合物超千亿吨油当量。天然气主要成分为( )
A.H2 B.CO C.CH4 D.C2H4
2.下列说法不正确的是
A.除去水垢中的 常用试剂有碳酸钠和盐酸
B.煤干馏可以得到焦炉气、粗氨水、芳香族化合物、焦炭等物质
C.用碘水检验淀粉是否水解完全
D.天然纤维、合成纤维和人造纤维组成元素完全相同
3.下列表达方式正确的是
A.聚丙烯结构简式:
B.乙烷结构式:CH3CH3
C.基态碳原子的价电子的轨道表示式为
D.N2 的电子式:
4.化合物R是一种新型锅炉水除氧剂,其结构式如图所示。下列说法正确的是
A.电负性:N>O>C
B.R分子中氮原子与碳原子均采取sp3 杂化
C.R分子中所含σ键与π键的数目之比为11:1
D.R分子中的所有原子可能共平面
5.Fe3+ 的配位化合物较稳定且应用广泛。Fe3+ 可与H2O、SCN- 、F- 等配体形成使溶液呈浅紫色的
[Fe(H2O)6]3+ 、红色的[Fe(SCN)6]3- 、无色的[FeF6]3- 配离子。某同学按如下步骤完成实验:
已知:向Co2+ 的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2- 配离子;Co2+ 不能与F- 形成配离子。下列
说法不正确的是
A.Fe第四电离能(I4)大于其第三电离能(I3)
B.Ⅰ中溶液呈黄色可能是由Fe3+ 水解产物的颜色造成
C.可用NaF和KSCN溶液检验FeCl3 溶液中是否含有Co2+
D.[Fe(H2O)6]3+ 中H-O-H的键角与H2O分子中H-O-H的键角相等
6.向密闭容器中充入物质A和B,发生反应aA(g)+bB(g) cC(g),反应过程中,物质A的体积分
数和C的体积分数随温度(T)的变化曲线所示。下列说法正确的是A.该反应在T1 、T3 温度时达到化学平衡
B.该反应的逆反应是放热反应
C.该反应在T2 温度时达到化学平衡
D.升高温度,平衡会向正反应方向移动
7.下列离子方程式能用来解释相应实验现象的是
选项 实验现象 离子方程式
A 向AgCl悬浊液中滴加氨水,沉淀溶解
AgCl+NH3=Ag(NH3)+
+Cl-
Fe3+
B 向沸水中滴加饱和氯化铁溶液得到红褐色液体
+3H2O=Fe(OH)3↓+3H+
C
向Na2S2O3 溶液中滴入稀硫酸溶液观察到有乳白色浑浊产生,并有无
S2O +2H+=S↓+S
色气体生成 O2↑+H2O
D 将FeCl3 溶液滴入H2O2 中观察到有气泡冒出
H
+O
2O
2↑
2+
+
2
2
F
H
e
+
3+=2Fe2+
A.A B.B C.C D.D
8.下列用于解释事实的方程式书写正确的是
A.葡萄糖提供人体所需的能量:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)ΔH>0
B.用饱和Na2CO3 溶液处理锅炉水垢中的CaSO4 :Ca2++CO =CaCO3↓
C.缠有铜丝的铁钉放入滴有酚酞的NaCl溶液,铜丝附近溶液变红:O2+4e−+2H2O=4OH−
D.惰性电极电解NaCl溶液,两极均产生气体:2Cl−+2H+ H2↑+Cl2↑
9.在C+CO2 2CO的反应中,现采取下列措施,其中能够使反应速率增大的措施是
缩小体积 增加碳的量 通入CO2 移出CO 恒压下充入N2
A. B. C. D.
①10.物质M②的组成为CoCl③ 3·4NH3 ,以④强碱处理并⑤没有NH3 放出;向1molM中加入足量AgNO3 溶液生成
1mol 白①色沉④淀。下列说法正②确③的⑤是 ①②④ ①③
A.该配合物的配体只有 NH3
B.该配合物可表示为[Co(NH3)4Cl2 ]Cl
C.M 中的配离子可能是平面正方形
D.该配合物中心离子的正电荷数和配位数均为 6
11.基态铜离子配合物的结构如图所示。下列说法正确的是
A.基态 的价电子排布式是 B.元素的电负性:
C. 键角大于 键角 D.第一电离能:
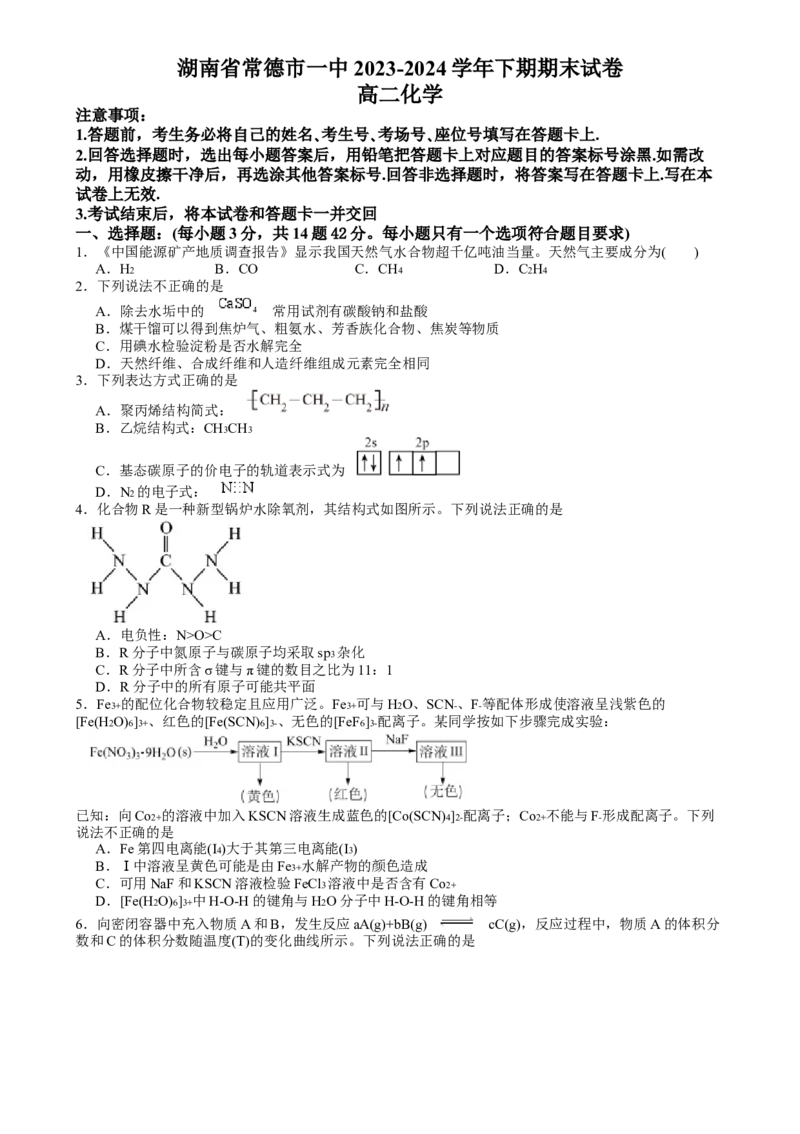
12.向Na2CO3 和NaHCO3 的混合溶液中加入少量CaCl2 溶液,测得溶液中离子浓度的关系如图所示,下
列说法不正确的是A.该溶液中存在:c(H2CO3) c(CO )>c2(HCO )
B.a、b两点对应的溶液中pH较大的为a点
C.向b点溶液中通入CO2 可使b点溶液向c点溶液转化
D.b点对应的溶液中存在:2c(Ca2+)+c(Na+)+c(H+)=3c(CO )+c(OH-)+c(Cl-)
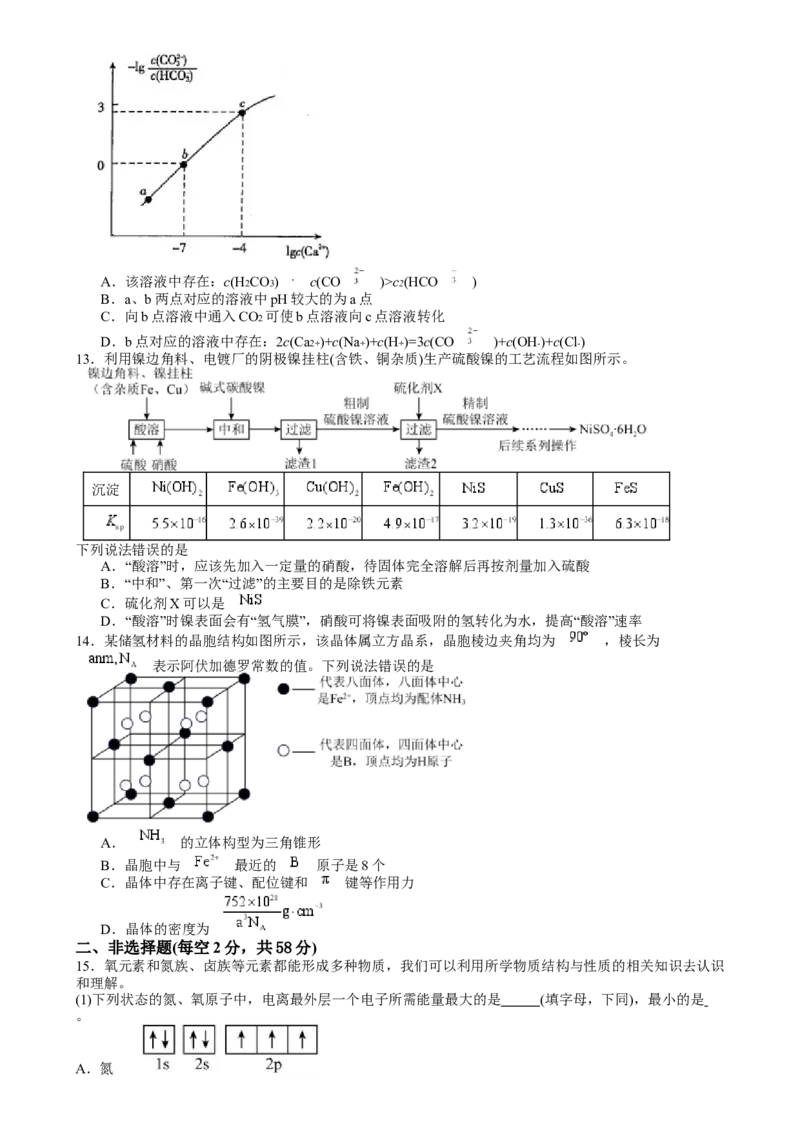
13.利用镍边角料、电镀厂的阴极镍挂柱(含铁、铜杂质)生产硫酸镍的工艺流程如图所示。
沉淀
下列说法错误的是
A.“酸溶”时,应该先加入一定量的硝酸,待固体完全溶解后再按剂量加入硫酸
B.“中和”、第一次“过滤”的主要目的是除铁元素
C.硫化剂X可以是
D.“酸溶”时镍表面会有“氢气膜”,硝酸可将镍表面吸附的氢转化为水,提高“酸溶”速率
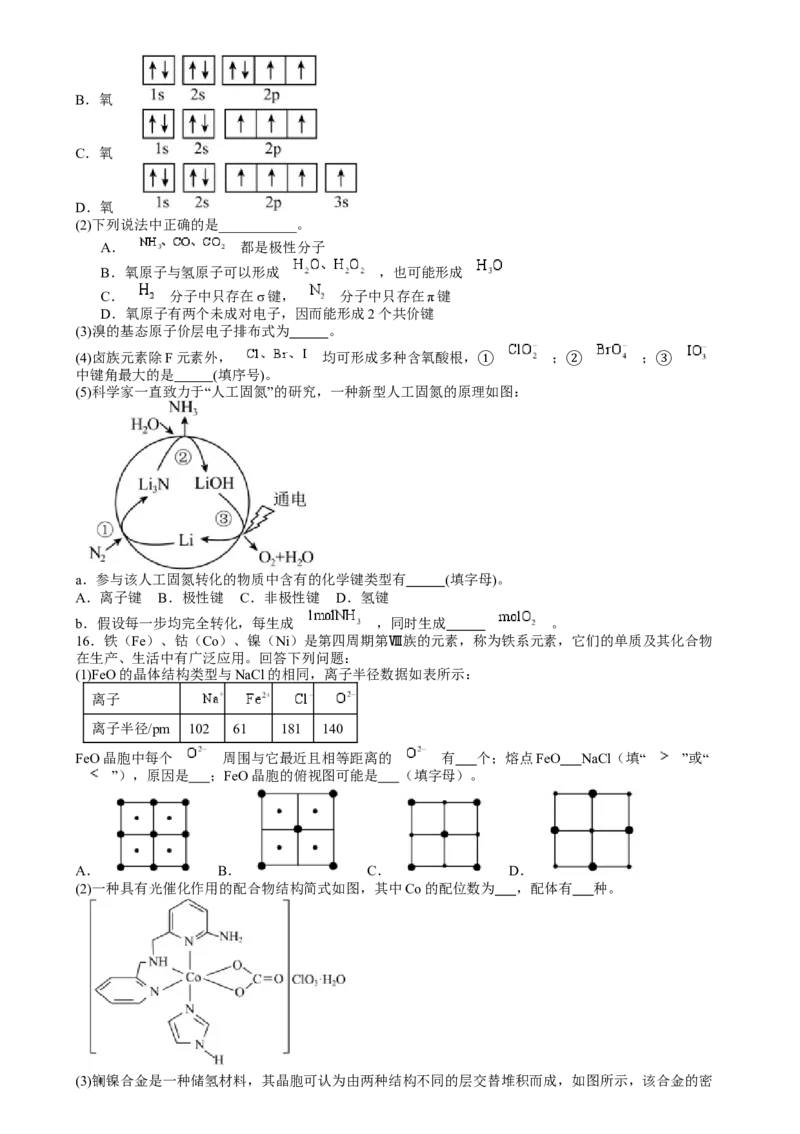
14.某储氢材料的晶胞结构如图所示,该晶体属立方晶系,晶胞棱边夹角均为 ,棱长为
表示阿伏加德罗常数的值。下列说法错误的是
A. 的立体构型为三角锥形
B.晶胞中与 最近的 原子是8个
C.晶体中存在离子键、配位键和 键等作用力
D.晶体的密度为
二、非选择题(每空2分,共58分)
15.氧元素和氮族、卤族等元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识
和理解。
(1)下列状态的氮、氧原子中,电离最外层一个电子所需能量最大的是 (填字母,下同),最小的是
。
A.氮B.氧
C.氧
D.氧
(2)下列说法中正确的是___________。
A. 都是极性分子
B.氧原子与氢原子可以形成 ,也可能形成
C. 分子中只存在σ键, 分子中只存在π键
D.氧原子有两个未成对电子,因而能形成2个共价键
(3)溴的基态原子价层电子排布式为 。
(4)卤族元素除F元素外, 均可形成多种含氧酸根, ; ;
中键角最大的是 (填序号)。
(5)科学家一直致力于“人工固氮”的研究,一种新型人工固氮的原理①如图: ② ③
a.参与该人工固氮转化的物质中含有的化学键类型有 (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
b.假设每一步均完全转化,每生成 ,同时生成 。
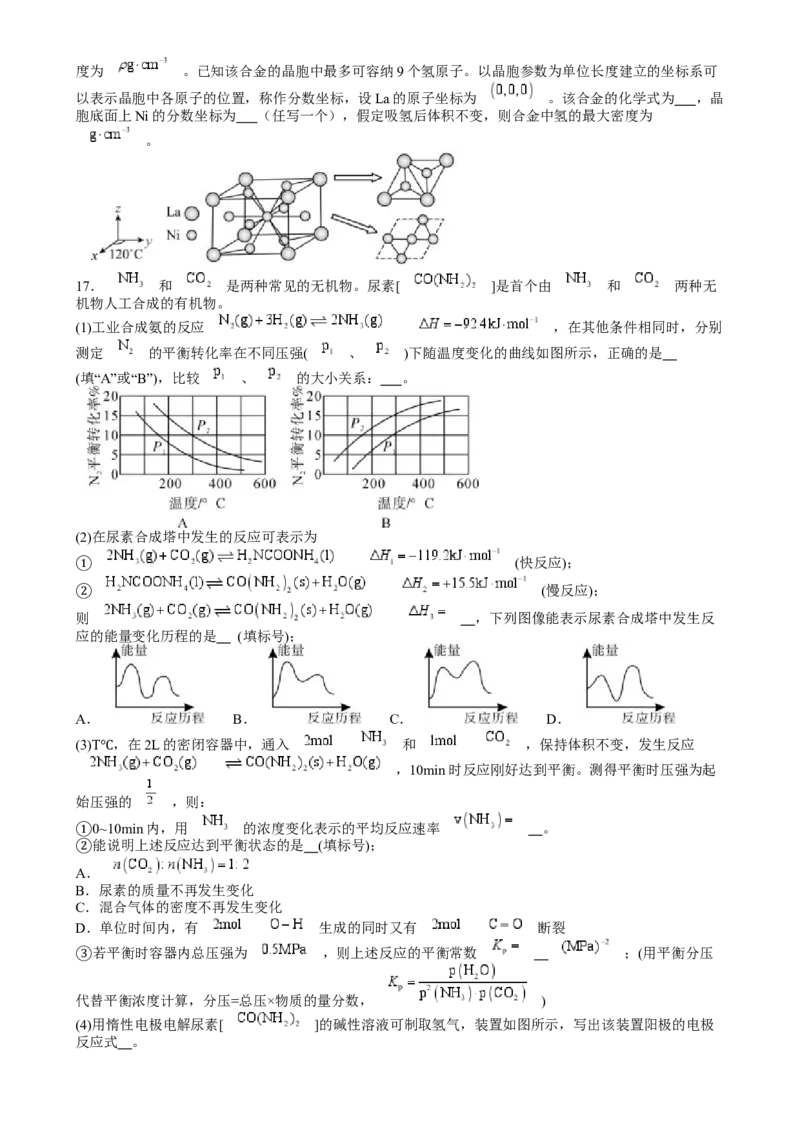
16.铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族的元素,称为铁系元素,它们的单质及其化合物
在生产、生活中有广泛应用。回答下列问题:
(1)FeO的晶体结构类型与NaCl的相同,离子半径数据如表所示:
离子
离子半径/pm 102 61 181 140
FeO晶胞中每个 周围与它最近且相等距离的 有 个;熔点FeO NaCl(填“ ”或“
”),原因是 ;FeO晶胞的俯视图可能是 (填字母)。
A. B. C. D.
(2)一种具有光催化作用的配合物结构简式如图,其中Co的配位数为 ,配体有 种。
(3)镧镍合金是一种储氢材料,其晶胞可认为由两种结构不同的层交替堆积而成,如图所示,该合金的密度为 。已知该合金的晶胞中最多可容纳9个氢原子。以晶胞参数为单位长度建立的坐标系可
以表示晶胞中各原子的位置,称作分数坐标,设La的原子坐标为 。该合金的化学式为 ,晶
胞底面上Ni的分数坐标为 (任写一个),假定吸氢后体积不变,则合金中氢的最大密度为
。
17. 和 是两种常见的无机物。尿素[ ]是首个由 和 两种无
机物人工合成的有机物。
(1)工业合成氨的反应 ,在其他条件相同时,分别
测定 的平衡转化率在不同压强( 、 )下随温度变化的曲线如图所示,正确的是
(填“A”或“B”),比较 、 的大小关系: 。
(2)在尿素合成塔中发生的反应可表示为
(快反应);
①
(慢反应);
②
则 ,下列图像能表示尿素合成塔中发生反
应的能量变化历程的是 (填标号);
A. B. C. D.
(3)T ,在2L的密闭容器中,通入 和 ,保持体积不变,发生反应
,10min时反应刚好达到平衡。测得平衡时压强为起
℃
始压强的 ,则:
0~10min内,用 的浓度变化表示的平均反应速率 。
能说明上述反应达到平衡状态的是 (填标号);
①
A.
②
B.尿素的质量不再发生变化
C.混合气体的密度不再发生变化
D.单位时间内,有 生成的同时又有 断裂
若平衡时容器内总压强为 ,则上述反应的平衡常数 ;(用平衡分压
③
代替平衡浓度计算,分压=总压×物质的量分数, )
(4)用惰性电极电解尿素[ ]的碱性溶液可制取氢气,装置如图所示,写出该装置阳极的电极
反应式 。18.肉桂酸是合成香料、化妆品、医药和感光树脂等的重要原料,其结构简式是
。
资料1:实验室可用下列反应制取肉桂酸。
资料2:相关物质数据表
苯甲醛 乙酸酐 肉桂酸 乙酸 氯化钠
溶解度( ,
0.3 遇水水解 0.04 互溶 36
水)
相对分子质量 106 102 148 60 58.5
i.合成粗品:向烧瓶中先后加入研细的无水醋酸钠、 苯甲醛和 乙酸酐,振荡使之混合均
匀。在 加热1小时,保持微沸状态。
ii.粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列步骤的操作:
回答下列问题:
(1)肉桂酸中所含的官能团名称为 。
(2)粗品精制检验粗产品中含有苯甲醛的实验方案是:取粗产品于试管中,加水溶解,滴 溶液将
溶液调至碱性, (填操作及现象)。
(3)粗品精制步骤 中肉桂酸与 溶液反应的化学方程式是 。
(4)粗品精制步骤 中操作a是 。
①
(5)若最后得到纯净的肉桂酸 ,则该反应中肉桂酸的产率是 。
②
(6)写出符合下列条件的肉桂酸的全部同分异构体的结构简式 。
苯环上含有两个取代基;
能与新制的 反应生成砖红色沉淀,且能发生水解反应;
①
苯环上存在四种不同环境的氢原子。
②
③
【高二化学答案】
1 2 3 4 5 6 7 8 9 10
C D C C D C C C D B
11 12 13 14
B A A C
15.(1) C D
(2)D(3)
(4)
(5) ABC 0.75
②
16.(1) 12 两者均为离子晶体,离子半径 , ,
, 所带电荷数分别大于 、 ,则FeO的离子键更强,熔点更高 CD
(2) 6 3
(3) 或
17.(1) A 或
(2) D
(3) BC 108
(4)
18.(1)碳碳双键,羧基
(2)加入银氨溶液共热,若有银镜出现,说明含有苯甲醛(或加入新制氢氧化铜悬浊液,加热,产生砖红色
沉淀,说明含有苯甲醛)
(3)
(4)蒸发浓缩、降温结晶(或冷却结晶)
(5)
(6)