文档内容
第三章 铁 金属材料
第一节 铁及其化合物
第2课时 铁的氧化物和氢氧化物
一、单选题
1.以下物质俗名与化学式对应正确的是( )
A.食盐—NaCl B.铁红—FeSO C.明矾CuSO ·5HO D.烧碱Ca(OH)
4 4 2 2
【答案】A
【解析】A. 食盐的化学式为NaCl,A正确;B. 铁红是氧化铁,化学式为Fe O,FeSO 是硫酸亚铁,B错
2 3 4
误;C. 明矾的化学式为KAl(SO )·12HO,CuSO ·5HO俗称胆矾,C错误;D. 烧碱的化学式为NaOH,
4 2 2 4 2
Ca(OH) 俗称熟石灰,D错误;答案选A。
2
2.(2019·河北路南唐山一中高一月考)下列物质的用途错误的是
A.镁铝合金:制作门窗 B.过氧化钠:供氧剂
C.四氧化三铁:红色油漆 D.硫酸亚铁:食品抗氧化剂
【答案】C
【解析】A.镁铝合金硬度大,密度小,适合做门框,故A正确;B.过氧化钠与水反应生成氧气,即
2NaO+2H O=4NaOH+O ↑,适合作供氧剂,故B正确;C.四氧化三铁为黑色物质,三氧化二铁为红棕色
2 2 2 2
物质,可以制造红色油漆,故C错误;D.硫酸亚铁中亚铁离子具有还原性,可以作为食品抗氧化剂,故
D正确;答案为C。
3.(2020·营口市第二高级中学高一期末)取少量FeCl 溶液,滴入NaOH溶液,观察到的现象是( )
3
A.产生白色沉淀 B.产生红褐色沉淀
C.形成红褐色溶液 D.形成无色溶液
【答案】B
【解析】取少量FeCl 溶液,滴入NaOH溶液,两者发生复分解反应的化学方程式为FeCl +
3 3
3NaOH=Fe(OH) ↓+3NaCl,FeCl 溶液呈黄色,Fe(OH) 是红褐色沉淀,故选B。
3 3 3
4.(2020·福建三元三明一中高一期中改编)下列有关 Al、Fe、Cu 的说法,正确的是
A.三者的氧化物均为碱性氧化物
B.三者的单质久置在空气中均只生成氧化物
C.Fe 与 Al O 能发生置换反应
2 3
D.三者分别浸入冷、浓硫酸中均无明显现象【答案】D
【解析】A.铝对应的氧化物Al O 是两性氧化物,故A错误;B.Fe还可以形成复杂的氢氧化物,Cu可
2 3
以形成碱式碳酸铜等,故B错误;C.铁的活泼性弱于铝,故Fe 与 Al O 不能发生置换反应,故C错误;
2 3
D.铝、铁常温下在浓硫酸中发生钝化,反应生成致密氧化物薄膜阻止反应进行,是浓硫酸的强氧化性,
而铜的活泼性弱,与浓硫酸反应但现象不明显,故D正确;答案选D。
5.向氯化亚铁溶液中滴入氢氧化钠溶液后,沉淀颜色变化顺序为
A.红褐色、灰绿色、白色 B.白色、红褐色、黑色
C.白色、灰绿色、红褐色 D.蓝色、灰绿色、绿色
【答案】C
【解析】向氯化亚铁溶液中滴入氢氧化钠溶液,发生如下反应:FeCl +2NaOH=Fe(OH) ↓+2NaCl、
2 2
4Fe(OH) +O +2H O=4Fe(OH) 。Fe(OH) 为白色,Fe(OH) 为红褐色。选项C. 白色、灰绿色、红褐色是
2 2 2 3 2 3
Fe(OH) →部分氧化→Fe(OH) ,故答案为C。
2 3
6.下列实验中能得到Fe O 的是( )
2 3
①铁丝在氧气中燃烧 ②煅烧硫铁矿 ③加热氢氧化铁 ④铁与高温水蒸气反应
A.①④ B.①③ C.②④ D.②③
【答案】D
【解析】①铁丝在氧气中燃烧生成Fe O;②煅烧硫铁矿生成Fe O 和二氧化硫;③加热氢氧化铁生成
3 4 2 3
Fe O 和水;④铁与高温水蒸气反应生成Fe O 和氢气;能得到Fe O 的是②③,选D。
2 3 3 4 2 3
7.(2020·江苏省白蒲高级中学高一期末)下列各图示中能较长时间看到Fe(OH) 白色沉淀的是
2
A.①②③ B.①②④ C.①②③④ D.②③④
【答案】B【解析】因为Fe(OH) 在空气中很容易被氧化为红褐色的Fe(OH) ,即发生4Fe(OH) +O+
2 3 2 2
2HO=4Fe(OH) 。因此要较长时间看到Fe(OH) 白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,
2 3 2
都是先用氢气将装置中的空气排尽,并使生成的Fe(OH) 处在氢气的保护中;③由于空气中的氧气能迅速
2
将Fe(OH) 氧化,因而不能较长时间看到白色沉淀;④中液面加苯阻止了空气进入,能较长时间看到白色
2
沉淀。答案选B。
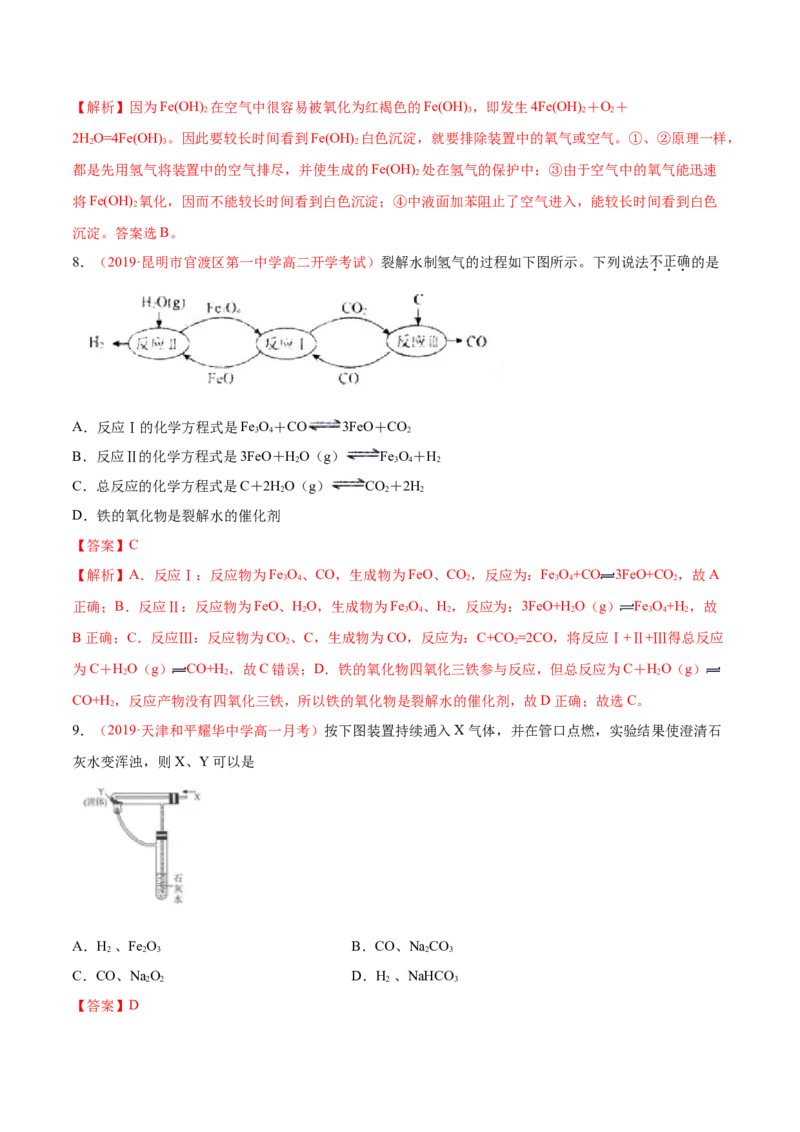
8.(2019·昆明市官渡区第一中学高二开学考试)裂解水制氢气的过程如下图所示。下列说法不正确的是
A.反应Ⅰ的化学方程式是Fe O+CO 3FeO+CO
3 4 2
B.反应Ⅱ的化学方程式是3FeO+HO(g) Fe O+H
2 3 4 2
C.总反应的化学方程式是C+2HO(g) CO+2H
2 2 2
D.铁的氧化物是裂解水的催化剂
【答案】C
【解析】A.反应Ⅰ:反应物为Fe O、CO,生成物为FeO、CO,反应为:Fe O+CO 3FeO+CO,故A
3 4 2 3 4 2
正确;B.反应Ⅱ:反应物为FeO、HO,生成物为Fe O、H,反应为:3FeO+HO(g) Fe O+H ,故
2 3 4 2 2 3 4 2
B正确;C.反应Ⅲ:反应物为CO、C,生成物为CO,反应为:C+CO =2CO,将反应Ⅰ+Ⅱ+Ⅲ得总反应
2 2
为C+HO(g) CO+H,故C错误;D.铁的氧化物四氧化三铁参与反应,但总反应为C+HO(g)
2 2 2
CO+H,反应产物没有四氧化三铁,所以铁的氧化物是裂解水的催化剂,故D正确;故选C。
2
9.(2019·天津和平耀华中学高一月考)按下图装置持续通入X 气体,并在管口点燃,实验结果使澄清石
灰水变浑浊,则 X、Y 可以是
A.H 、Fe O B.CO、NaCO
2 2 3 2 3
C.CO、NaO D.H 、NaHCO
2 2 2 3
【答案】D【解析】A.氢气能燃烧,氢气与氧化铁反应生成水,澄清石灰水不变浑浊,A错误;B.NaCO 受热不
2 3
分解,澄清石灰水不变浑浊,,B错误;C.在此条件下,CO不与NaO 反应,澄清石灰水不变浑浊,C
2 2
错误;D.NaHCO 受热分解生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,氢气能燃烧,故D正确;
3
答案选D。
10.(2020·兴城第三高级中学高一期中)现有一块铝铁合金,欲测定其铝的质量分数,切下Wg合金,溶
于盐酸中,再加入过量NaOH溶液,滤出沉淀,已知沉淀成分为氢氧化铁,把沉淀在空气中充分灼烧,最
后得到Wg红棕色粉末。则此合金中铝的质量分数约为( )
A.20% B.30% C.70% D.80%
【答案】B
【解析】由铝铁合金粉末溶于足量盐酸中,加入过量NaOH溶液,过滤,沉淀为氢氧化铁,经灼烧,得到
的固体粉末是氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的
质量,则合金中Al的质量分数=氧化铁中氧的质量分数= ×100%=30%。答案选B。
11.下列说法正确的是( )
①赤铁矿的主要成分是Fe O,Fe O 为红棕色粉末;
2 3 2 3
②NaO和NaO 投入到水中都能生成NaOH;
2 2 2
③质量相等的NaHCO 与NaCO 分别与相同浓度盐酸完全反应时,产生CO 的物质的量相等;
3 2 3 2
④取ag Na CO 和NaHCO 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定
2 3 3
NaCO 和NaHCO 混合物中NaCO 质量分数;
2 3 3 2 3
⑤制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁;
⑥NaHCO 固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
3
⑦NaHCO 粉末中混有NaCO,可配制成溶液通入过量的CO,再低温结晶得到提纯;
3 2 3 2
⑧NaO 与水反应,NaO 既是氧化剂,又是还原剂
2 2 2 2
A.②③④⑥ B.①②⑦⑧ C.②⑤⑦⑧ D.①③④⑥
【答案】B
【解析】①赤铁矿的主要成分为Fe O,Fe O 是红棕色粉末状晶体,故①正确;②NaO是碱性氧化物,
2 3 2 3 2
和水反应生成氢氧化钠,过氧化钠是过氧化物,和水反应生成氢氧化钠和氧气,所以NaO 和NaO 投入水
2 2 2
中都能生成NaOH,故②正确;③根据反应的方程式NaCO+2HCl=2NaCl+CO ↑+H O,
2 3 2 2
NaHCO +HCl=NaCl+CO ↑+H O可知,106g碳酸钠完全反应生成1mol二氧化碳,84g碳酸氢钠完全反应生
3 2 2
成1mol二氧化碳,所以等质量的NaHCO 和NaCO 与足量盐酸反应,在相同条件下NaHCO 产生的CO
3 2 3 3 2多,故③错误;④取ag NaCO 和NaHCO 混合物与足量稀硫酸充分反应,逸出气体主要为含有少量水蒸
2 3 3
气的二氧化碳,用碱石灰吸收,增重bg,bg为水蒸气和二氧化碳的总质量,因此不能测定NaCO 和
2 3
NaHCO 混合物中NaCO 质量分数,故④错误;⑤制备氢氧化亚铁时,向硫酸亚铁(FeSO )溶液中滴加氢氧
3 2 3 4
化钠溶液,边加边搅拌,生成的氢氧化亚铁易被空气中的氧气氧化生成红褐色的4Fe(OH) ,即
3
4Fe(OH) +O +2H O=4Fe(OH) ,故⑤错误;⑥NaHCO 不稳定,加热易分解,钠着火时生成过氧化钠,过
2 2 2 3 3
氧化钠可与二氧化碳反应生成氧气,不能用干粉灭火剂灭火,故⑥错误;⑦NaCO 可与过量的CO 反应生
2 3 2
成NaHCO ,可用于除杂,再低温结晶得到提纯,故⑦正确;⑧NaO 与水的反应中只有O元素化合价发
3 2 2
生变化,由-1价分别变化为0、-2价,因此NaO 既是氧化剂,又是还原剂,故⑧正确;正确的有
2 2
①②⑦⑧,故选B。
12.用下列装置不能达到实验目的的是( )
A.用甲图装置可证明ρ(煤油)< ρ(钠) < ρ(水) B.用乙图装置制备Fe(OH)
2
C.用丙图装置制取金属锰 D.用丁图装置制取氯气
【答案】D
【解析】由图可知,钠在水与煤油液面中间,则可知钠的密度比水的小,比煤油的大,故A正确;B.由
图可知,利用Fe和稀硫酸制FeSO 的同时除去液面上方空气,防止制备时氢氧化亚铁被氧化,故B正确;
4
C.由图可知,Al与二氧化锰发生铝热反应生成Mn,故C正确;D.MnO 和浓盐酸混合加热可制氯气,
2
不能用稀盐酸代替,故D错误;故选D。
13.(2020·瑞安市上海新纪元高级中学高一期末)某铁的“氧化物”样品,用5 mol·L-1盐酸140 mL恰好完全
溶解,所得溶液还能吸收标准状况下0.56 L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe O B.Fe O C.Fe O D.Fe O
5 7 2 3 3 4 4 5
【答案】A
【解析】氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成HO.由H
2
原子、O原子守恒可知n(O)=n(H O)= n(HCl)= ×0.14L×5mol/L=0.35mol,所得溶液再通入氯气使其中
2Fe2+全部转化为Fe3+,最后溶液成分为FeCl ,根据氯原子是可知n(FeCl )= [n(HCl)+2n(Cl )]=
3 3 2
×(0.14L×5mol/L+2× )=0.25mol,所以氧化物中n(Fe):n(O)=0.25mol:0.35mol=5:7,该氧化物的化
学式为Fe O,故答案为A。
5 7
14.下列实验方案合理的是( )
A.制取少量CO,可随 B.配制一定物质的量 C.可制得Fe(OH), D.干燥、收集NH ,并吸收
2 2 3
开随制,随关随停 浓度的稀硫酸 并观察其颜色 多余的尾气
【答案】C
【解析】A. 用碳酸钠和稀盐酸制取少量CO,但是,由于碳酸钠可溶于水,故不能做到可随开随制、随关
2
随停,A实验方案不合理; B. 配制一定物质的量浓度的稀硫酸时,不能将浓硫酸直接在容量瓶中稀释,B
实验方案不合理; C. 该实验中用苯隔绝了空气,这样硫酸亚铁与氢氧化钠反应生成的Fe(OH) 可以保持其
2
白色并防止被氧气氧化,因此,可制得Fe(OH) ,并观察其颜色 ,C实验方案合理; D. 碱石灰可以干燥
2
NH 、水可以吸收多余的尾气,氨气密度小于空气,不能用向上排空气法收集NH ,D 实验方案不合理。
3 3
综上所述,实验方案合理的是C,本题选C。
二、填空题
15.(2020·湖南开福长沙市第七中学高一开学考试)小熊同学在学习酸碱盐有关知识时,对一些沉淀物质
的颜色产生了兴趣。老师告诉他氢氧化铜是蓝色,氢氧化铁是红褐色,让他探究氢氧化亚铁的颜色。下面
请你和他一起探究。
(查阅资料)
(1)铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
(2)氢氧化亚铁在空气中立即被氧气氧化。
(3)硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色。
(提出猜想)氢氧化亚铁是浅绿色。
(实验过程)在2支试管里分别加入少量FeCl 和FeSO 溶液,然后滴入NaOH溶液,观察现象,请补充完
3 4成下表:
FeCl 溶液 FeSO 溶液
3 4
滴入NaOH溶液
先生成白色絮状沉淀,慢慢变化,最后变成红
生成红褐色沉淀
褐色沉淀
的现象
_______,基本反应类型属 FeSO +2NaOH=Fe(OH) ↓+NaSO ;_Fe(OH)
化学方程式 4 2 2 4 2
于_______反应 +_O+_HO=_______(完成并配平此方程式)
2 2
(学习交流)
(1)氢氧化亚铁是白色而不是浅绿色。
(2)小熊联系到CO 与C的化合反应,认为FeCl 溶液可以转化为FeCl 溶液,请模仿写出这个转化的化学方
2 3 2
程式:_______。
【答案】FeCl +3NaOH=Fe(OH) ↓+3NaCl 复分解反应 4Fe(OH) +O +2H O=4Fe(OH)
3 3 2 2 2 3
2FeCl +Fe=3FeCl
3 2
【解析】
(1) FeCl 溶液和NaOH溶液反应的方程式:FeCl +3NaOH=Fe(OH) ↓+3NaCl,此反应属于复分解反应;
3 3 3
(2) FeSO 溶液中滴入NaOH溶液,生成白色絮状沉淀是氢氧化亚铁沉淀,白色氢氧化亚铁在水中不稳定,
4
容易跟水中的氧气反应生成红棕色的氢氧化铁;由于氢氧化亚铁有少量溶于水中,亚铁离子显绿色,所以
溶液呈绿色,同时也会转化成黄色的铁离子,灰色就是白色、红棕、绿色、黄色的混合色;在加上这种转
化是有时间过程的,所以随着各种离子含量变化,颜色变化就由此而来了;最后变成红褐色沉淀是氢氧化
铁沉淀,根据质量守恒定律完成并配平反应的方程式,4Fe(OH) +O +2H O=4Fe(OH) ;
2 2 2 3
(3)根据CO 与C的反应,要让FeCl 溶液可以转化为FeCl 溶液,小熊的理由是:单质铁也可以将FeCl 还
2 3 2 3
原成FeCl ,化学方程式是2FeCl +Fe=3FeCl 。
2 3 2
16.(2019·山西迎泽太原五中高一期末节选)铁与空气接触时表面会形成氧化物,如一块低碳钢可以被三
种氧化物膜所覆盖:与金属接触的一侧是FeO,与空气接触的一侧是 ,而中间则是 。
(1)中国古代“四大发明”之一的“司南”,其主要成分是上述物质中的__________。
(2) 的一种用途是____________。
(3)FeO可作化妆品中的色素,它还能进行一系列转化: 。
① 时应加入的试剂是____________。② 的实验现象是___________________________。
【答案】 制红色油漆 稀硫酸 白色沉淀迅速变为灰绿色,最终变为红褐色
【解析】(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,化学式为
;
(2)氧化铁是红色固体难溶于水,可以作红色颜料或冶炼铁;
(3)①FeO→FeSO 时应加入的试剂是稀硫酸,发生FeO+HSO =FeSO+H O;
4 2 4 4 2
② 的实验现象是白色迅速变化为灰绿色最后变为红褐色,生成氢氧化铁红褐色沉淀。