文档内容
第三章 铁 金属材料
第一节 铁及其化合物
第3课时 铁盐与亚铁盐
一、单选题
1.能将溶液中的 转化成 的物质是( )
A. B.NaOH C. D.
2.工业盐酸常因混有杂质而呈黄色,该杂质是( )
A.NaCl B.MgCl C.FeCl D.ZnCl
2 3 2
3.关于铁及其化合物,下列说法正确的是( )
A.灼热的Fe与Cl 反应生成FeCl
2 2
B.FeO不能被任何还原剂还原
C.向溶液中滴加KSCN溶液可检验溶液中是否含有Fe3+
D.向FeSO 溶液中滴加NaOH溶液可得到纯净的Fe(OH) 沉淀
4 2
4.下列除杂方法或对应方程式错误的是
选项 物质(杂质) 除杂方法或试剂 方程式
A 溶液FeCl (CuCl ) 过量Fe,过滤 Fe + Cu2+= Fe2+ + Cu
2 2
B 固体NaHCO (Na CO) 水溶后通过量CO,结晶,过滤 NaCO+CO +H O= 2NaHCO
3 2 3 2 2 3 2 2 3
C 固体NaCO (NaHCO) 水溶后加入过量NaOH HCO - + OH- =H O+ CO2-
2 3 3 3 2 3
D FeCl (FeCl ) 过量Fe,过滤 Fe+2 Fe3+=3Fe2+
2 3
5.(2019山东师范大学附中高一月考改编)下列实验现象与氧化还原反应有关的是
A.向石灰石中加入盐酸,有气泡产生
B.向FeCl 溶液中滴加淀粉KI溶液,溶液变蓝
3
C.向Fe (SO ) 溶液中滴加NaOH溶液,生成红褐色沉淀
2 4 3
D.二氧化碳通入石灰水中变浑浊,继续通入又变澄清
6.(2015广东理综化学改编)水溶液中能大量共存的一组离子是( )
A.NH + 、Ba2+、Br-、CO2- B.Cl-、MnO -、Fe2+、H+
4 3 4
C.K+、Na+、SO 2-、MnO - D.Na+、H+、NO -、HCO -
4 4 3 37.检验硫酸亚铁中是否含有少量硫酸铁,选用的最佳试剂是( )
A.NaOH B.KMnO C.KSCN D.氯水
4
8.下列关于物质或离子检验的叙述正确的是
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO
2
9.(2020·调兵山市第二高级中学高一月考)要鉴定某溶液中所含的一种阳离子为Fe2+(且未被氧化),
最好的方法是()
A.加入NaOH溶液 B.先加入KSCN溶液再加氯水
C.先加氯水再加KSCN溶液 D.加入锌片
10.能正确表示下列反应的离子方程式是
A.在硫酸亚铁溶液中通入氧气:4Fe2++O +4H+=4Fe3++2H O
2 2
B.氯化铁溶液腐蚀铜电路板:Cu+Fe3+﹣═Fe2+ +Cu2+
C.氢氧化亚铁溶于稀硝酸中:Fe(OH) +2H+=Fe2++2H O
2 2
D.澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO-=CaCO ↓+H O
3 3 2
11.化学实验中常需对溶液进行酸化,下列酸化处理措施中,正确的是( )
A.检验溶液中是否含 Cl-时,用硫酸酸化后再加 AgNO 溶液
3
B.检验溶液中是否含 Fe2+时,用硝酸酸化后再加 KSCN溶液
C.检验溶液中是否含 SO 时,用盐酸酸化后再加 BaCl 溶液
2
D.为提高 MnO 的氧化性,向该溶液中加入盐酸酸化
12.下列关于铁及其化合物的性质叙述错误的是( )
A.补血剂中含有+3价铁元素
B.铁能被磁铁吸引可用于制作磁性材料
C.Fe O 常用于制造红色油漆和涂料
2 3
D.保存氯化亚铁溶液时,应加少量铁粉
13.硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )A.碱式硫酸铁水解能产生Fe(OH) 胶体,可用作净水剂
3
B.生产FeCO 需在较低温度下进行,避免FeCO 受热分解
3 3
C.可用KSCN溶液检验(NH )Fe(SO ) 是否被氧化
4 2 4 2
D.常温下,(NH )Fe(SO ) 在水中的溶解度比FeSO 小
4 2 4 2 4
14.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
实验 现象 结论
将浓硫酸加入过量铁粉中,加热,充
A 有气体生成,溶液呈血红色 浓硫酸将Fe氧化为Fe3+
分反应后滴加KSCN溶液
将铜粉加入1.0mol•L-1Fe (SO ) 溶
B 2 4 3 溶液变蓝、有黑色固体出现 金属铁比铜活泼
液中
C 将铁粉加入到FeCl 溶液中 溶液颜色由黄色变为浅绿色 Fe3+具有氧化性
3
出现白色沉淀,迅速变成灰绿
D 在氯化亚铁中滴入氢氧化钠 氢氧化亚铁为红褐色沉淀
色,最终变成红褐色沉淀
二、填空题
15.(2020·北京市朝阳区人大附中朝阳分校高一其他)长期放置的FeSO 溶液易被氧化而变质,某兴趣小
4
组进行了如下实验:
(1)设计实验检验FeSO 溶液的变质程度
4
实验方案 实验现象 实验结论
步骤1 取待检测液于试管中,向其中滴加KSCN溶液 ________
FeSO 溶液部分变质
4
步骤2 _____ _________
① 将上述方案补充完整
② 若要使部分变质的FeSO 复原,方法是__________。(写离子反应方程式)
4
(2)利用部分变质的FeSO 溶液制备Fe O
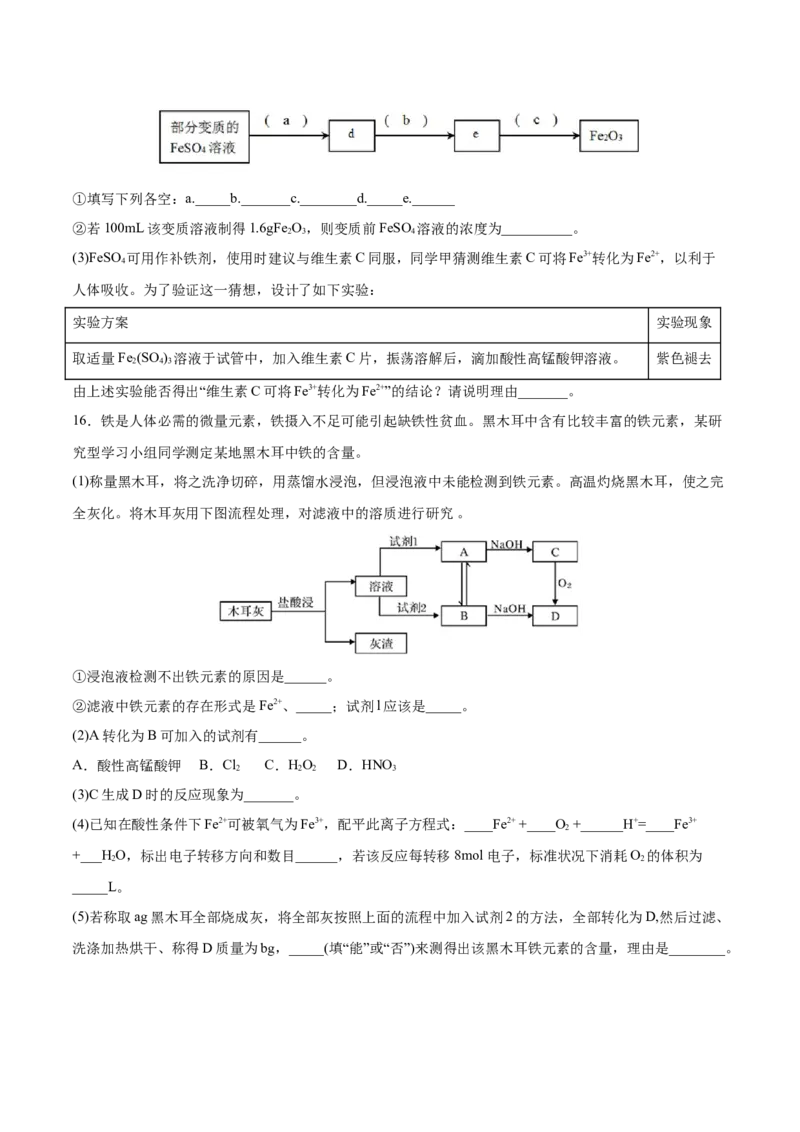
4 2 3①填写下列各空:a._____b._______c.________d._____e.______
②若100mL该变质溶液制得1.6gFe O,则变质前FeSO 溶液的浓度为__________。
2 3 4
(3)FeSO 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于
4
人体吸收。为了验证这一猜想,设计了如下实验:
实验方案 实验现象
取适量 Fe (SO ) 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 紫色褪去
2 4 3
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由_______。
16.铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研
究型学习小组同学测定某地黑木耳中铁的含量。
(1)称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。高温灼烧黑木耳,使之完
全灰化。将木耳灰用下图流程处理,对滤液中的溶质进行研究 。
①浸泡液检测不出铁元素的原因是______。
②滤液中铁元素的存在形式是 Fe2+、_____;试剂l应该是_____。
(2)A转化为 B可加入的试剂有______。
A.酸性高锰酸钾 B.Cl C.HO D.HNO
2 2 2 3
(3)C生成D时的反应现象为_______。
(4)已知在酸性条件下Fe2+可被氧气为Fe3+,配平此离子方程式:____Fe2+ +____O +______H+=____Fe3+
2
+___HO,标出电子转移方向和数目______,若该反应每转移 8mol 电子,标准状况下消耗O 的体积为
2 2
_____L。
(5)若称取ag黑木耳全部烧成灰,将全部灰按照上面的流程中加入试剂2的方法,全部转化为D,然后过滤、
洗涤加热烘干、称得D质量为bg,_____(填“能”或“否”)来测得出该黑木耳铁元素的含量,理由是________。