文档内容
2024年10月
绵阳南山中学高 级高一上期 月月考试题
2024 10
化学试题
命题人:刘文 审题人:曹瑞琴
注意事项:
1.本分第Ⅰ 卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间75分
钟。答题前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第I卷时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。写在本上无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5
第Ⅰ卷(选择题 共 42 分)
一、选择题(每小题 3分,共 42分,每小题只有一个选项符合题意)
1.下列物质中,属于电解质的是
A.蔗糖 B.氨水
C.稀盐酸 D.HNO
3
2.下列变化中,不涉及氧化还原反应的是
A.食物的腐败 B.电镀
C.钢铁的锈蚀 D.煅烧石灰石
3.下列反应不属于四种基本反应类型,但属于氧化还原反应的是
放电 △
A.3O ==== 2O B.CuO+CO === Cu+CO
2 3 2
点燃 高温
C.4P+5O ==== 2P O D.WO +3H ==== W+3H O
2 2 5 3 2 2
4.下列转化中,必须加入还原剂才能实现的是
A.H O →H O B.Fe3+→Fe2+
2 2 2
C.Zn→Zn(NO ) D.Na O→NaOH
3 2 2
5.当光束通过下列分散系时,能观察到丁达尔效应的是
A.石灰乳 B.CuSO 溶液
4
C.淀粉溶液 D.蔗糖溶液
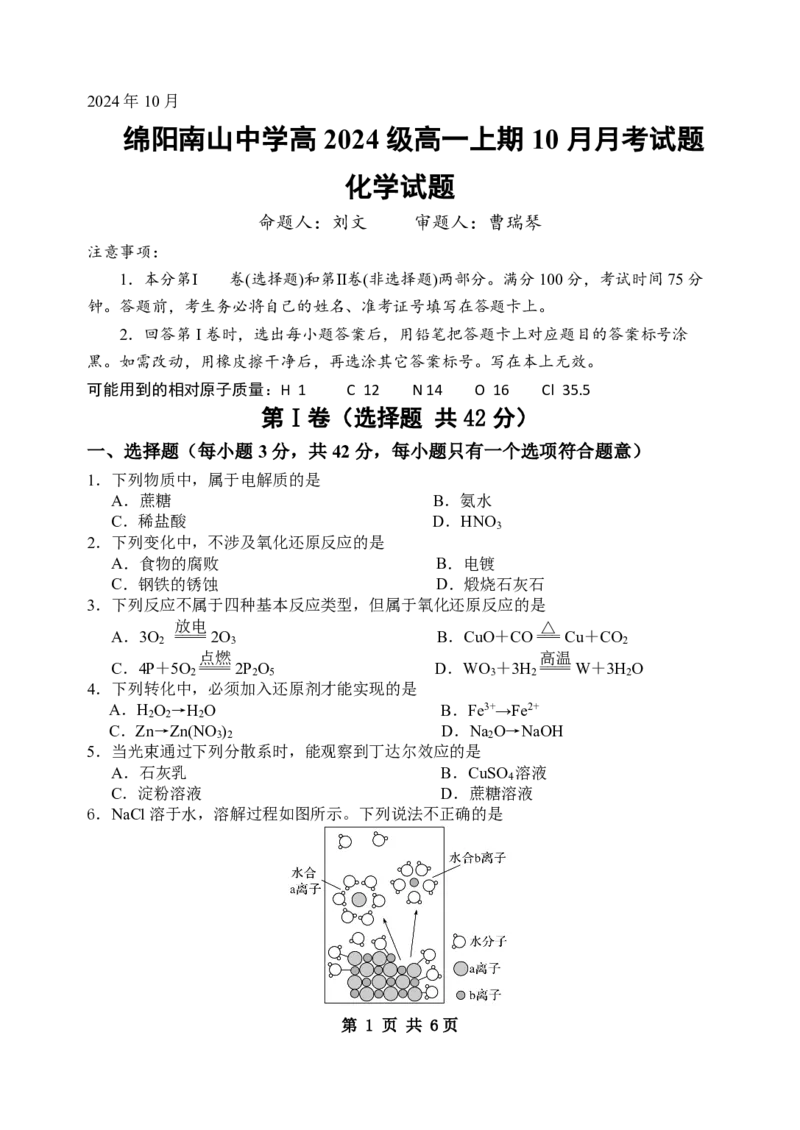
6.NaCl溶于水,溶解过程如图所示。下列说法不正确的是
第 1 页 共 6页A.a离子为Cl-,b离子为Na+
B.NaCl固体在水分子的作用下,Na+和Cl-脱离表面
C.通电后,NaCl发生电离
D.通电后,b离子向电源负极移动
7.将下列离子方程式改写成化学方程式,正确的是
A. H++OH-===H O CH COOH+NaOH===CHCOONa+H O
2 3 3 2
B. CO2-+2H+===CO ↑+H O BaCO +2HCl===BaCl +CO ↑+H O
3 2 2 3 2 2 2
C. Ca2++CO2-===CaCO↓ Ca(NO ) +Na CO ===CaCO ↓+2NaNO
3 3 3 2 2 3 3 3
D. Cu+2Ag+===Cu2++2Ag Cu+2AgCl===2Ag+CuCl
2
8.下列有关事实的证据不恰当的是
选项 事实 证据
A. BaSO 是电解质 熔融的BaSO 导电
4 4
B. 河水属于胶体 外观澄清透明
C. H PO (次磷酸)是一 H PO 与足量的NaOH反应只生成一种
3 2 3 2
元酸 盐NaH PO
2 2
D. CaO是碱性氧化物 CaO能与盐酸反应生成盐和水
9.下列离子方程式书写正确的是
A. 氢氧化钡与稀硫酸反应:Ba2++OH-+H++SO2-=== BaSO ↓+H O
4 4 2
B. Fe O 溶于盐酸中: Fe O +8H+ === 2Fe2++ Fe3++4H O
3 4 3 4 2
C. 碳酸镁中加入硝酸: MgCO +2H+=== Mg2++H O+ CO ↑
3 2 2
D. 铜和硝酸银溶液反应: Cu+Ag+=== Cu2++Ag
10. 下列说法正确的是
①只含有一种元素的物质一定是纯净物
②生石灰做干燥剂涉及化学变化
③酸性氧化物都能与碱反应
④非金属氢化物可能是电解质
⑤用鸡蛋壳膜(半透膜)和蒸馏水除去淀粉胶体中的食盐涉及化学变化
⑥两种盐反应一定生成两种新盐
A. ①③⑥ B. ②③⑤⑥
C. ②③④⑥ D. ②③④
高温
11. 火法炼铜发生的主要反应为Cu S+O ====2Cu+SO ,下列有关叙述不正确的是
2 2 2
A.O 与O 互为同素异形体 B.O 转化为O 不是氧化还原反应
2 3 2 3
C.该反应的氧化产物只有SO D.该反应中氧化剂只有O
2 2
12. 下列各组离子能大量共存的是
A. 使酚酞变红的溶液中: Na+、NO-、Cl-、Ba2+
3
B. 使石蕊试液变红的溶液中: Ca2+、Cl-、CH COO-、Na+
3
C. 无色透明的溶液中: K+、MnO-、 SO2-、 Mg2+
4 4
D. 含有Ca2+的溶液中: Cl-、 H+、HCO- 、 K+
3
第 2 页 共 6页13. 硫化氢(H S)是一种有毒、有害的不良气体。处理某废气中的H S,是将废气与空气
2 2
混合通入FeCl 、CuCl 、FeCl 的混合液中(CuS难溶于水),其转化的流程如图所示。
2 2 3
下列说法不正确的是
A. 过程Ⅱ中元素化合价没有变化
B. 过程Ⅲ中发生的反应为CuS+2Fe3+===S+2Fe2++Cu2+
C. 氧化性由强到弱的顺序: O >Fe3+>S
2
D. 该转化过程可以回收硫,反应一段时间后溶液中铜离子数目减少。
14. 某溶液中含有大量的下列离子:Fe3+、SO2-、Al3+和M离子,经测定Fe3+、SO2-、
4 4
Al3+和M离子的个数之比为2∶4∶1∶1,则M离子可能是下列中的
A. Na+ B. NO- C. Mg2+ D. OH-
3
第Ⅱ卷 (非选择题 共 58 分)
二、(本题包括 2小题,共 21分)
15. (10分)现有下列10种物质 : ①CH COOH ② Fe ③ CaO ④ CO
3
⑤KAl(SO ) ·12H O ⑥ Ba(OH) ⑦红褐色的氢氧化铁胶体 ⑧Na O ⑨稀硝酸
4 2 2 2 2 2
⑩ Cu (OH) CO 。
2 2 3
(1)按物质的分类法以上属于非电解质的是 。(填序号)
(2)上述10种物质中有物质之间可发生离子反应:H+ + OH-= H O ,该离子反应对
2
应的化学方程式为 。
(3)⑦与足量⑨混合的现象为 。
(4)⑤溶于水的电离方程式为 。该物质
在水中电离产生的Al3+与水反应生成胶体(与氢氧化铁胶体类似),请书写胶体生成的
离子方程式 。
(5)⑩是“铜绿”的主要成分,铜和空气中的水蒸气、CO 、O 共同作用产生铜绿,
2 2
书写对应化学方程式 。
16. (11分)准确掌握化学基本概念,按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
第 3 页 共 6页碱性 酸性
碱 酸 盐
氧化物 氧化物
第一组 Na CO H SO NaHCO CaO CO
2 3 2 4 3 2
第二组 NaOH HCl NaCl Na O NO
2
第三组 NaOH CH COOH CaSO Fe O SO
3 4 3 4 2
每组分类均有错误,其错误的物质分别是_______、________、_________(填化学式)。
(2)下列3个反应,按要求填写相关量。
① 2Na O + 2H O === 4NaOH + O ↑反应中,每生成1个O 转移____个电子;
2 2 2 2 2
② Fe + 4HNO (稀) === Fe(NO ) + NO↑ + 2H O ,该反应中硝酸表现的性质为 ;
3 3 3 2
氧化剂和还原剂的个数之比为 。
③ KIO + 5KI + 3H SO === 3K SO + 3I + 3H O反应中,氧化产物和还原产物的
3 2 4 2 4 2 2
个数之比为 ,每生成15个I ,转移________个电子。
2
三、(本题包括 3小题,共 37分)
17. (14分)
Ⅰ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有OH-、Mg2+、
Na+、CO2-、SO2-、HCO-、Cl-离子中的若干种。然后又作了如下分析,以确定这些
3 4 3
离子是否大量存在。
①用紫色石蕊试液检验,结果溶液变蓝色。
②取2 mL溶液用BaCl 溶液进行检验,生成白色沉淀,再继续加足量稀硝
2
酸,沉淀部分溶解。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO 溶液和稀
3
硝酸进行检验,结果又生成白色沉淀。
请回答下列问题:
(1)溶液中一定存在的离子是________,可能存在的离子是_______。(填离子符号)
(2)步骤②中加硝酸时发生的离子方程式有 ___________________________,
确定该实验中加BaCl 溶液沉淀已完全的方法是 。
2
第 4 页 共 6页(3)如果要继续确定可能的离子,可以选用的操作步骤为 。
Ⅱ.有一包白色固体粉末,其中可能含有NaCl、Ba(NO ) 、CuSO 、Na CO 中的一种
3 2 4 2 3
或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③另取①中过滤后的滤液加入足量AgNO 溶液,产生白色沉淀。
3
根据上述实验事实,回答下列问题:
(4)原固体粉末中一定含有的物质是___________________________(写化学式,下同),
可能含有的物质是_______________________。
(5)写出③中沉淀可能的成分: _______________________(填化学式)。
18. (12分)氧化还原反应在生产生活与科学实验中有重要作用,回答下列问题。
Ⅰ.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒的作用来清洗伤口。根据下列反
应回答问题:
A. Na O + 2HCl === 2NaCl+H O
2 2 2 2
B. 2KMnO + 3H SO + 5H O === K SO + 2MnSO + 5O ↑+ 8H O
4 2 4 2 2 2 4 4 2 2
C. 2H O 2H O + O ↑
2 2 2 2
D. H O + 2FeSO + H SO === Fe (SO ) + 2H O
2 2 4 2 4 2 4 3 2
(1)上述反应中,H O 仅体现氧化性的反应是________(填字母,下同),H O 既体
2 2 2 2
现氧化性又体现还原性的反应是________。
(2) H O 、KMnO 、Fe (SO ) 的氧化性由强到弱的顺序是____________________,
2 2 4 2 4 3
KMnO 溶液(用H SO 酸化)和FeSO 溶液混合能否反应? (填“能”或者“否”),
4 2 4 4
如果能反应,请书写对应的化学方程式 ,如果不能,则不需填写: 。
Ⅱ.工业上常用绿矾(FeSO ·7H O)处理酸性废水中含有的重铬酸根离子(Cr O2- )
4 2 2 7
(3)该反应的离子方程式为:
Fe2+ + Cr O2- + H+ == Fe3+ + Cr3+ + H O,配平
2 7 2
以上离子方程式,并用双线桥标出该反应电子转移的情况 ,其中还原产物是 (填
第 5 页 共 6页离子符号),每处理1×105个Cr O2- ,转移电子的数目为 。
2 7
19.(11分)借助现代科技手段研究化学反应原理能加深对知识本质的理解。
(1)右图是电解质导电性测试实验装置,A烧
杯内是 NaHSO 溶液,B 烧杯内是干燥的食盐固
4
体:NaHSO 的电离方程式为 ,
4
接通电源后,灯泡不亮,本质原因是 ,
要使灯泡发光,可采取的操作是 。灯泡发光后,将少量Ba(OH) 溶液逐滴加
2
入 A 烧杯,除生成沉淀外,还可观察到灯泡变化的现象是 ,该过程对应的离
子方程式为 。
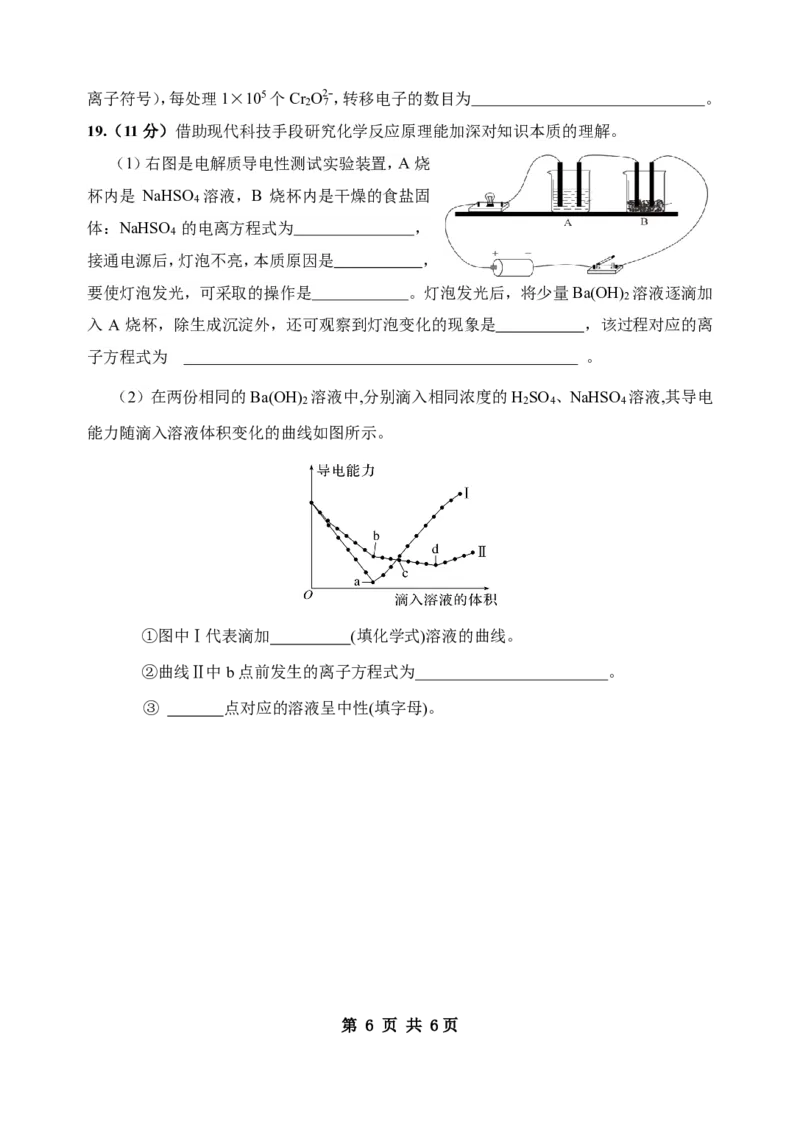
(2)在两份相同的Ba(OH) 溶液中,分别滴入相同浓度的H SO 、NaHSO 溶液,其导电
2 2 4 4
能力随滴入溶液体积变化的曲线如图所示。
①图中Ⅰ代表滴加 (填化学式)溶液的曲线。
②曲线Ⅱ中b点前发生的离子方程式为 。
③ 点对应的溶液呈中性(填字母)。
第 6 页 共 6页绵阳南山中学高 2024 级十月月考化学试题答案
一、选择题(共42 分)
1-14 DDBBC CCBCD DADB
15.(共10分)
(1)④ (1分) (2)Ba(OH) + 2HNO === Ba(NO ) + 2H O (1分)
2 3 3 2 2
(3)先生成红褐色沉淀,后沉淀溶解为黄色溶液 (2分,答到 1个现象给 1 分)
(4)KAl(SO ) === K+ + Al3++ 2 SO2-(2分)
4 2 4
Al3++ 3H 2 O === Al (OH) 3(胶体) + 3 H+(2分)
(5)2Cu + O + CO + H O === Cu (OH) CO (2分)
2 2 2 2 2 3
16.(共11分)
(1)Na CO (1分) NO (1分) Fe O (1分)
2 3 3 4
(2)①2(2分) ②氧化性和酸性(2分) 1:1 (1分)
③ 5:1 (2分) 25 (1分)
17.(共14分)
(1)OH-、SO2-、CO2-、Na+ (2分) Cl-(1分)
4 3
(2)BaCO +2H+=== Ba2++ H O + CO ↑ (2分) H+ + OH- === H O (1分)
3 2 2 2
沉淀后静置取少量上层清液,加BaCl 溶液观察,如果没有沉淀产生,说明已经沉
2
淀完全。(2分)
(3)另取原溶液少量,用AgNO 溶液和稀硝酸进行检验 。(1分)
3
(4)Ba(NO ) 、Na CO (2分) NaCl(1分)
3 2 2 3
(5)Ag CO AgCl (2分)
2 3
18.(共12分)
(1)D(1分) C(1分) (2)KMnO >H O >Fe (SO )(1分) 能(1分)
4 2 2 2 4 3
2KMnO + 10FeSO + 8H SO === K SO + 2MnSO + 5Fe (SO ) + 8H O (2分)
4 4 2 4 2 4 4 2 4 3 2
失去6×e-
(3)6Fe2++CrO2- +14H+ === 6Fe3++2Cr3++7HO (配平 2 分,双线桥 2 分)
2 7 2
得到2×3e-
Cr3+(1分) 6×105 (1分)
19. (共 11分)
(1)NaHSO == Na+ + H++ SO2-(1分) 固体NaCl未电离 (1分)
4 4
加水溶解B烧杯中NaCl固体(或加热熔化烧杯中NaCl固体) (1分)
灯泡变暗(1分)SO2-+Ba2+ + 2OH-+ 2H+=== BaSO ↓+ 2H O (2分)
4 4 2
(2)①BaSO (1分)②SO2-+Ba2++OH-+H+=== BaSO ↓+H O(2分)③ ad(2分)
4 4 4 2