文档内容
2022-2023 学年上学期期中考前必刷卷(基础卷) B.2H 2 (g)+O 2 (g)=2H 2 O(l); H=+571.6kJ/mol
C.CH(g)+2O(g)=CO (g)+2HO(g); H=-890.3kJ/mol
4 2 2 2
高二化学 △
D.1/2C H O(s)+3O(g)=3CO (g)+3HO(l); H=-1400 kJ/mol
6 12 6 2 2 2
△
7.已知下列热化学方程式:
(考试时间:75分钟 试卷满分:100分)
△
①Fe O(s)+3CO(g)=2Fe(s)+3CO (g) H=-24.8 kJ/mol
注意事项: 2 3 2 1
1 2 1
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考
②Fe O(s)+ CO(g)= Fe O(s)+ C△O(g) H=-15.73 kJ/mol
证号填写在答题卡上。 2 3 3 3 3 4 8 2 2
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动, ③Fe O(s)+CO(g)=3FeO(s)+CO (g) H=64△0.4 kJ/mol
3 4 2 3
用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。 则14 g CO气体还原足量FeO固体和CO 气体时对应的 H约为
2
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。 A.-218 kJ/mol B.-109 kJ/mol △ C.218 kJ/mol D.1.09 kJ/mol
4.测试范围:人教版2019选择性必修1第一单元、第二单元。 8.两种制备硫酸的途径(反应条件略)如图。下列说法正确的 △ 是
5.考试结束后,将本试卷和答题卡一并交回。
第Ⅰ卷
一、选择题:本题共18个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法不正确的是
A.需要加热才能发生的反应可能是放热反应
B.任何吸热反应在常温条件下都不能发生
C.反应物和生成物所具有的总能量的相对大小决定了反应是放热还是吸热
D.在稀溶液中,酸与碱发生中和反应生成1mol HO(l)时的反应热叫做中和热
2
2.下列实验事实可以用平衡移动原理解释的是 A.S和过量O 反应可直接生成SO
2 3
A.“NO ”球浸泡在热水中,颜色变深
2 B.含0.5 mol H SO 的稀溶液与足量BaOH 溶液反应,放出的热量即为中和热
2 4 2
B.H
2
(g)+ I
2
(g) 2HI(g),加压后颜色变深
C.SO 能使紫色石蕊试液先变红后褪色
2
C.过量铁和稀硝酸反应,溶液变成浅绿色
D.合成氨工业中使用铁触媒作催化剂 D.若ΔH 1 <ΔH 2 +ΔH 3 ,则2H 2 O 2 aq2H 2 OlO 2 g 为放热反应
高温 9.一定条件下,在2 L密闭容器中发生反应:2A(s)+3 B(g)=2 C(g)+4 D(g),测得5 min内,A的物质的量减
3.炼铁过程中发生的3CO+Fe O 3CO+2Fe为放热反应,下列说法正确的是 小了10 mol, 则0~5 min内该反应的平均速率为
2 3 2
A.v(A)=1.0 mol/(L·min) B.v(B)=1.5 mol(L·min )
A.断开C≡O键放出热量 B.形成C=O键吸收热量 C.v(C)=2.0 mol/( L·min) D.v(D)=0.5 ml(L·min)
C.放热反应都需要加热 D.有的吸热反应不需要加热 10.下列有关化学反应速率的说法中,正确的是
4.已知4NH (g)+3O(g)=2N(g)+6HO(g) H=-q kJ·mol-1,相关数据如下表,则下表中z的大小是 A.汽车尾气中的CO和NO可以缓慢反应生成N 和CO,减小压强,反应速率减慢
3 2 2 2 2 2
B.用铁片和稀硫酸反应制取H 时,改用铁片和浓硫酸可以加快产生H 的速率
物质 NH (g) O(g) N(g) HO(g) 2 2
△ 3 2 2 2
C.二氧化硫的催化氧化反应是一个放热反应,所以升高温度,反应速率减慢
1mol分子中的化学键断裂时需要吸收的能量/kJ a b z d D.100mL2mol·L-1的盐酸与锌反应时,加入适量的NaCl溶液,生成H 的速率不变
2
11.实验室利用下列实验方案探究影响化学反应速率的因素,有关说法错误的是
1 1
A. (q+4a+3b-6d) B. (q+12a+3b-12d) 实验编
2 2 温度℃ 酸性KMnO 溶液 H C O 溶液
号 4 2 2 4
1 1
C. (q-4a-3b+6d) D. (q+12a+6b-12d)
2 2 ① 25 4mL 0.01mol/L 2mL0.1mol/L
5.在同温同压下,下列各组热化学方程式中, H> H 的是
2 1
② 25 4mL 0.01mol/L 2mL0.2mol/L
A.2H(g)+O(g) =2H O(g) H;2H(g)+O(g) =2H O(l) H
2 2 2 1 2 2 2 2
△ △
B.S(g)+O(g)=SO(g) H; S(s) +O(g)=SO(g) H
2 2 1 2 2 2
△ △ ③ 50 4mL 0.01mol/L 2mL0.1mol/L
1
C.C(s)+ O(g)=CO(g△) H;C(s)+O(g)=CO (g) △ H
2 2 1 2 2 2 A.实验中要记录溶液褐色所需要的时间
B.对比实验①②探究的是浓度对化学反应速率的影响
D.H(g)+Cl (g) =2HC1(g)△ H;2H(g)+2Cl (g) =4H△C1(g), H
2 2 1 2 2 2
C.对比实验①③探究的是温度对化学反应速率的影响
6.25℃、101kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是 393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、
2800kJ/mol。下列热化学方 △ 程式中,正确的是 △ D.起始时向①中加入MnSO 4 固体,不影响其反应速率
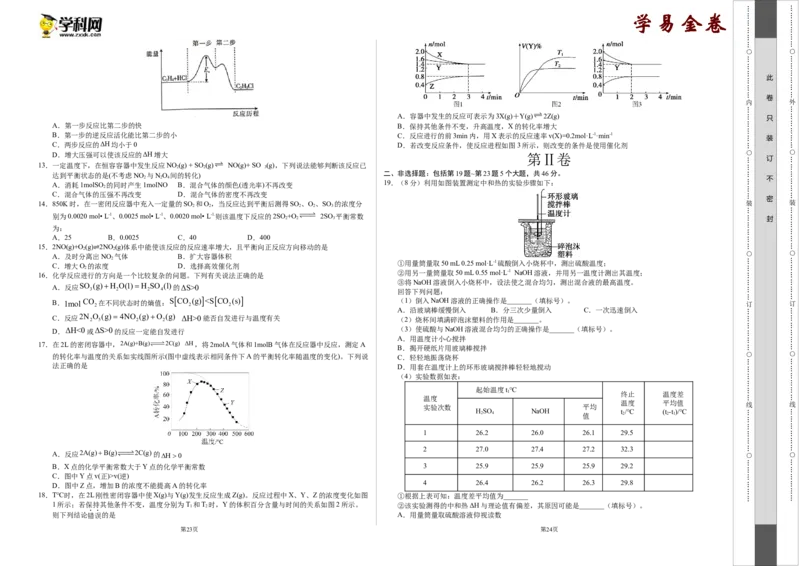
1 12.乙烯与HCl气体催化加成反应的能量与反应历程的关系如图所示,下列说法正确的是
A.C(s)+ O(g)=CO(g);△H=-393.5kJ/mol
2 2………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
此
卷
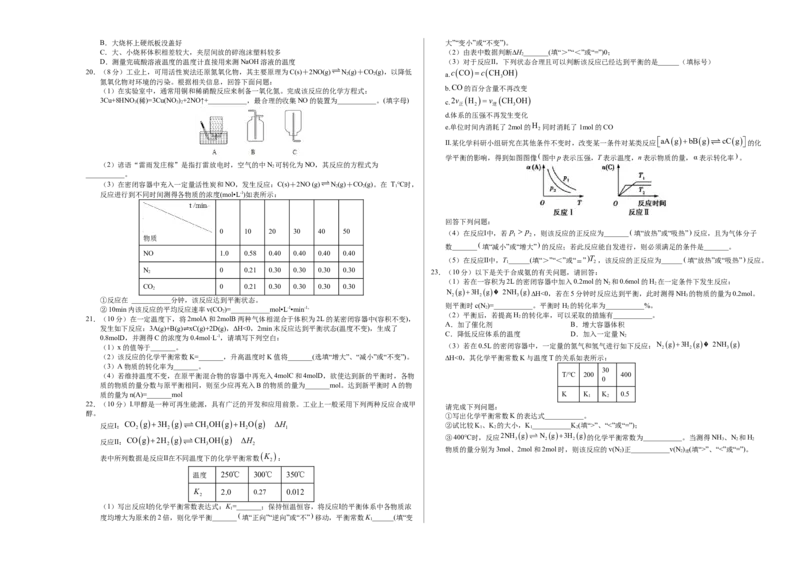
A.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
只
A.第一步反应比第二步的快 B.保持其他条件不变,升高温度,X的转化率增大
B.第一步的逆反应活化能比第二步的小 C.反应进行的前3min内,用X表示的反应速率v(X)=0.2mol·L-1·min-1
装
C.两步反应的ΔH均小于0 D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
D.增大压强可以使该反应的ΔH增大 第Ⅱ卷
订
13.一定温度下,在恒容容器中发生反应NO (g) + SO (g) NO(g)+ SO (g),下列说法能够判断该反应已
2 2 3
达到平衡状态的是(不考虑NO 与NO 间的转化)
二、非选择题:包括第19题~第23题5个大题,共46分。
2 2 4 不
19.(8分)利用如图装置测定中和热的实验步骤如下:
A.消耗1molSO 的同时产生1molNO B.混合气体的颜色(透光率)不再改变
2
C.混合气体的压强不再改变 D.混合气体的密度不再改变
密
14.850K时,在一密闭反应器中充入一定量的SO 和O,当反应达到平衡后测得SO 、O、SO 的浓度分
2 2 2 2 3
别为0.0020 mol• L-1、0.0025 mol• L-1、0.0020 mol• L-1.则该温度下反应的2SO
2
+O 2 2SO
3
平衡常数
封
为:
A.25 B.0.0025 C.40 D.400
15.2NO(g)+O (g) 2NO (g)体系中能使该反应的反应速率增大,且平衡向正反应方向移动的是
2 2
A.及时分离出NO 气体 B.扩大容器体积
2 ⇌ ①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
C.增大O 的浓度 D.选择高效催化剂
2
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
16.化学反应进行的方向是一个比较复杂的问题。下列有关说法正确的是
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
A.反应 SO (g)H O(1)H SO (l) 的ΔS>0
3 2 2 4 回答下列问题:
B.1mol CO 在不同状态时的熵值: SCO (g)0能否自发进行与温度有关 (2)烧杯间填满碎泡沫塑料的作用是_______。
D.ΔH<0或ΔS>0的反应一定能自发进行 (3)使硫酸与NaOH溶液混合均匀的正确操作是_______(填标号)。
A.用温度计小心搅拌
17.在2L的密闭容器中,2A(g)+B(g) 2C(g) ΔH,将2molA气体和1molB气体在反应器中反应,测定A
B.揭开硬纸片用玻璃棒搅拌
的转化率与温度的关系如实线图所示(图中虚线表示相同条件下A的平衡转化率随温度的变化)。下列说 C.轻轻地振荡烧杯
法正确的是 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如表:
起始温度t℃
1 终止 温度差
温度
温度 平均值 实验次数 平均
HSO NaOH t/℃ (t -t )/℃ 2 4 值 2 2 1
1 26.2 26.0 26.1 29.5
2 27.0 27.4 27.2 32.3
A.反应2A(g)B(g) 2C(g)的H0
B.X点的化学平衡常数大于Y点的化学平衡常数 3 25.9 25.9 25.9 29.2
C.图中Y点v(正)>v(逆)
4 26.4 26.2 26.3 29.8
D.图中Z点,增加B的浓度不能提高A的转化率
18.T℃时,在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图 ①根据上表可知:温度差平均值为_______
1所示;若保持其他条件不变,温度分别为T 和T 时,Y的体积百分含量与时间的关系如图2所示。 ②该实验测得的中和热ΔH与理论值有偏差,其原因可能是_______(填标号)。
1 2
则下列结论错误的是 A.用量筒量取硫酸溶液仰视读数
第23页 第24页B.大烧杯上硬纸板没盖好 大”“变小”或“不变”)。
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多 (2)由表中数据判断∆H_______(填“>”“<”或“=”)0;
2
D.测量完硫酸溶液温度的温度计直接用来测NaOH溶液的温度 (3)对于反应Ⅱ,下列状态合理且可以判断该反应已经达到平衡的是______(填标号)
20.(8分)工业上,可用活性炭法还原氮氧化物,其主要原理为C(s)+2NO(g)N
2
(g)+CO
2
(g),以降低
a.
cCOcCH OH
3
氮氧化物对环境的污染。根据相关信息,回答下面问题:
b.CO的百分含量不再改变
(1)在实验室中,通常用铜和稀硝酸反应来制备一氧化氮。完成该反应的化学方程式:
3Cu+8HNO 3 (稀)=3Cu(NO 3 ) 2 +2NO↑+___________,最合理的收集NO的装置为___________。(填字母) c. 2v 正 H 2 v 逆 CH 3 OH
d.体系的压强不再发生变化
H
e.单位时间内消耗了2mol的 同时消耗了1mol的CO
2
Ⅱ.某化学科研小组研究在其他条件不变时,改变某一条件对某类反应
aAgbBg
cCg
的化
学平衡的影响,得到如图图像(图中p表示压强,T表示温度,n表示物质的量,α表示转化率)。
(2)谚语“雷雨发庄稼”是指打雷放电时,空气的中N 可转化为NO,其反应的方程式为
2
___________。
(3)在密闭容器中充入一定量活性炭和NO,发生反应:C(s)+2NO (g)N(g)+CO(g)。在 T℃时,
2 2 1
反应进行到不同时间测得各物质的浓度(mol•L-1)如表所示:
回答下列问题:
0 10 20 30 40 50 (4)在反应Ⅰ中,若 p p ,则该反应的正反应为_______(填“放热”或“吸热”)反应,且为气体分子
1 2
物质
数_______(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是_______。
NO 1.0 0.58 0.40 0.40 0.40 0.40
(5)在反应Ⅱ中,T
1
______(填“>”“<”或“” )T
2
,该反应的正反应为______(填“放热”或“吸热”)反应。
N 0 0.21 0.30 0.30 0.30 0.30
2 23.(10分)以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N 和0.6mol的H 在一定条件下发生反应:
2 2
CO 0 0.21 0.30 0.30 0.30 0.30
2 N g3H g� 2NH g ∆H<0,若在5分钟时反应达到平衡,此时测得NH 的物质的量为0.2mol。
2 2 3 3
①反应在 ___________分钟,该反应达到平衡状态。
则平衡时c(N)=___________。平衡时H 的转化率为___________%。
②10min内该反应的平均反应速率v(CO)=___________mol•L-1•min-1。 2 2
2
(2)平衡后,若提高H 的转化率,可以采取的措施有___________。
21.(10分)在一定温度下,将2molA和2molB两种气体相混合于体积为2L的某密闭容器中(容积不变), 2
A.加了催化剂 B.增大容器体积
发生如下反应:3A(g)+B(g) xC(g)+2D(g),ΔH<0,2min末反应达到平衡状态(温度不变),生成了
C.降低反应体系的温度 D.加入一定量N
0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白: 2
(1)x的值等于_______。
⇌ (3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N
2
g3H
2
g� 2NH
3
g
(2)该反应的化学平衡常数K=_______,升高温度时K值将_______(选填“增大”、“减小”或“不变”)。 ∆H<0,其化学平衡常数K与温度T的关系如表所示:
(3)A物质的转化率为_______。
30
(4)若维持温度不变,在原平衡混合物的容器中再充入4molC和4molD,欲使达到新的平衡时,各物 T/℃ 200 400
0
质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为_______mol。达到新平衡时A的物
质的量为n(A)=_______mol K K K 0.5
1 2
22.(10分)Ⅰ.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲
请完成下列问题:
醇。
①写出化学平衡常数K的表达式___________。
反应Ⅰ: CO 2 g3H 2 g CH 3 OHgH 2 Og ΔH 1 ②试比较K 1 、K 2 的大小,K 1 ___________K 2 (填“>”、“<”或“=”);
反应Ⅱ: COg2H 2 g CH 3 OHg ΔH 2 ③400℃时,反应2NH 3 g N 2 g3H 2 g 的化学平衡常数为___________。当测得NH 3 、N 2 和H 2
物质的量分别为3mol、2mol和2mol时,则该反应的v(N )正___________v(N ) (填“>”、“<”或“=”)。
2 2 逆
K
表中所列数据是反应Ⅱ在不同温度下的化学平衡常数 :
2
温度 250℃ 300℃ 350℃
K 2.0 0.27 0.012
2
(1)写出反应Ⅰ的化学平衡常数表达式:K =_______;保持恒温恒容,将反应Ⅰ的平衡体系中各物质浓
1
度均增大为原来的2倍,则化学平衡_______(填“正向”“逆向”或“不”)移动,平衡常数K ______(填“变
1………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
此
卷
只
装
订
不
密
封
第43页 第44页