文档内容
哈三中 2023—2024 学年度下学期
高一学年期末考试化学(选考)试卷
可能用到的相对原子质量 H-1 C-12 N-14 O-16 V-51
I 卷(共 45 分)
一、单选题(本题共 15 个小题,每小题 3 分,共 45 分。在每小题所给出的四个选
项中,只有一个选项符合题目要求。)
1.工业上常用赤铁矿为原料高炉炼铁,这种冶炼方法属于
A.物理方法 B.热分解法 C.热还原法 D.电解法
2.计时器的发展史铭刻着化学的贡献。下列说法错误的是
A.制作日晷圆盘的石材,属于无机非金属材料
B.机械表中由钼钴镍铬等元素组成的发条,其材质属于合金
C.基于石英晶体振荡特性计时的石英表,其中石英的成分为SiC
D.目前“北京时间”授时以铯原子钟为基准,135 Cs的质子数为55
55
3.下列化学用语或模型正确的是
A.甲基的电子式: B.乙醛的分子式:CH CHO
3
C.乙醇的球棍模型: D.乙烯的结构简式:CH CH
2 2
4.下列反应对应有机反应类型判断错误的是
A.乙烯使溴的四氯化碳溶液褪色是加成反应
B.乙醇和乙酸生成乙酸乙酯是取代反应
C.乙醇与钠的反应是氧化反应
D.由氯乙烯制聚氯乙烯是加聚反应
5.下列说法错误的是
A.煤的气化是化学变化
B.脂肪酸的饱和程度对油脂的熔点影响很大
C.非处方药包装上印有“OTC”标识
D.蛋白质与浓硫酸作用时呈黄色,可用于蛋白质的检验
高一化学 第1页 共7页
{#{QQABaYQUoggAAoAAAAgCQQn4CAAQkAEAASgOBBAMsAAAARNABAA=}#}6.为提纯下列物质(括号内的物质为杂质),所选的除杂试剂和分离方法都正确的是
选项 被提纯物质 除杂试剂 分离方法
A 乙烷(乙烯) 酸性高锰酸钾溶液 洗气
B 酒精(水) 生石灰 蒸馏
C 乙酸乙酯(乙酸) 饱和碳酸钠溶液 过滤
D 二氧化硫(乙烯) 溴水 洗气
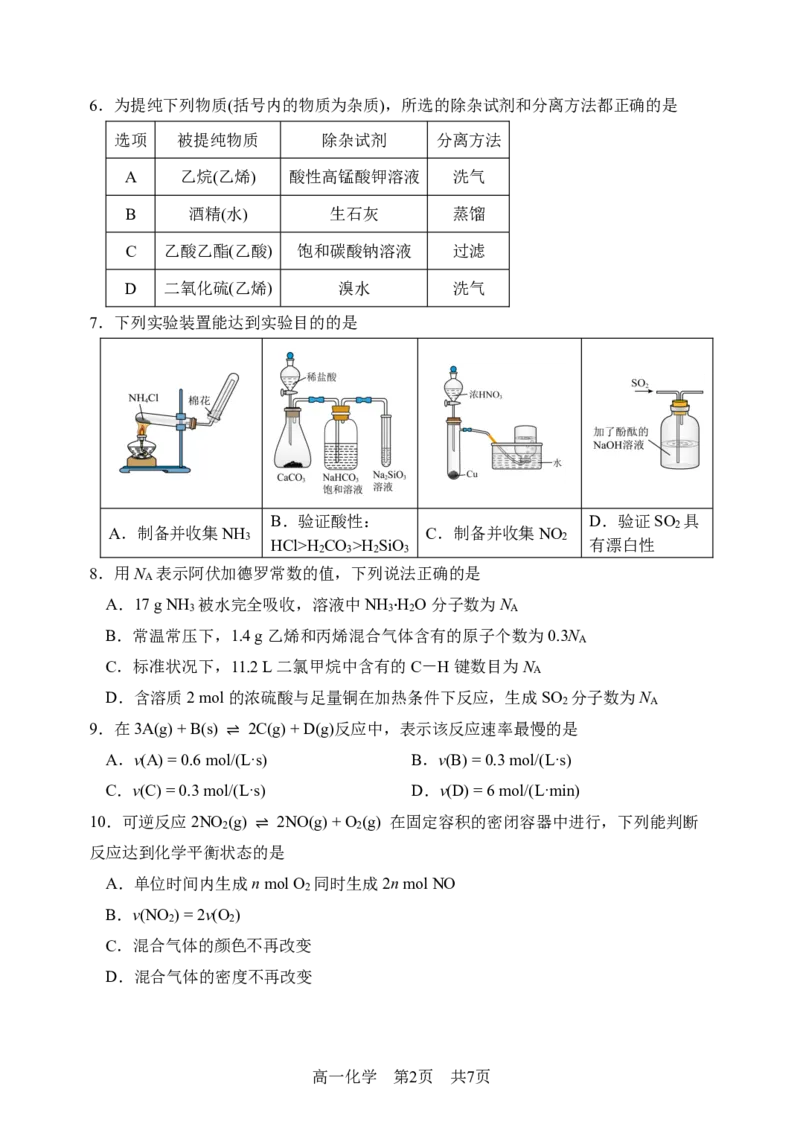
7.下列实验装置能达到实验目的的是
B.验证酸性: D.验证SO 具
2
A.制备并收集NH C.制备并收集NO
3 2
HCl>H CO >H SiO 有漂白性
2 3 2 3
8.用N 表示阿伏加德罗常数的值,下列说法正确的是
A
A.17 g NH 被水完全吸收,溶液中NH ∙H O分子数为N
3 3 2 A
B.常温常压下,1.4 g乙烯和丙烯混合气体含有的原子个数为0.3N
A
C.标准状况下,11.2 L二氯甲烷中含有的C-H键数目为N
A
D.含溶质2 mol的浓硫酸与足量铜在加热条件下反应,生成SO 分子数为N
2 A
9.在3A(g) + B(s) ⇌ 2C(g) + D(g)反应中,表示该反应速率最慢的是
A.v(A) = 0.6 mol/(L·s) B.v(B) = 0.3 mol/(L·s)
C.v(C) = 0.3 mol/(L·s) D.v(D) = 6 mol/(L·min)
10.可逆反应2NO (g) ⇌ 2NO(g) + O (g) 在固定容积的密闭容器中进行,下列能判断
2 2
反应达到化学平衡状态的是
A.单位时间内生成n mol O 同时生成2n mol NO
2
B.v(NO ) = 2v(O )
2 2
C.混合气体的颜色不再改变
D.混合气体的密度不再改变
高一化学 第2页 共7页
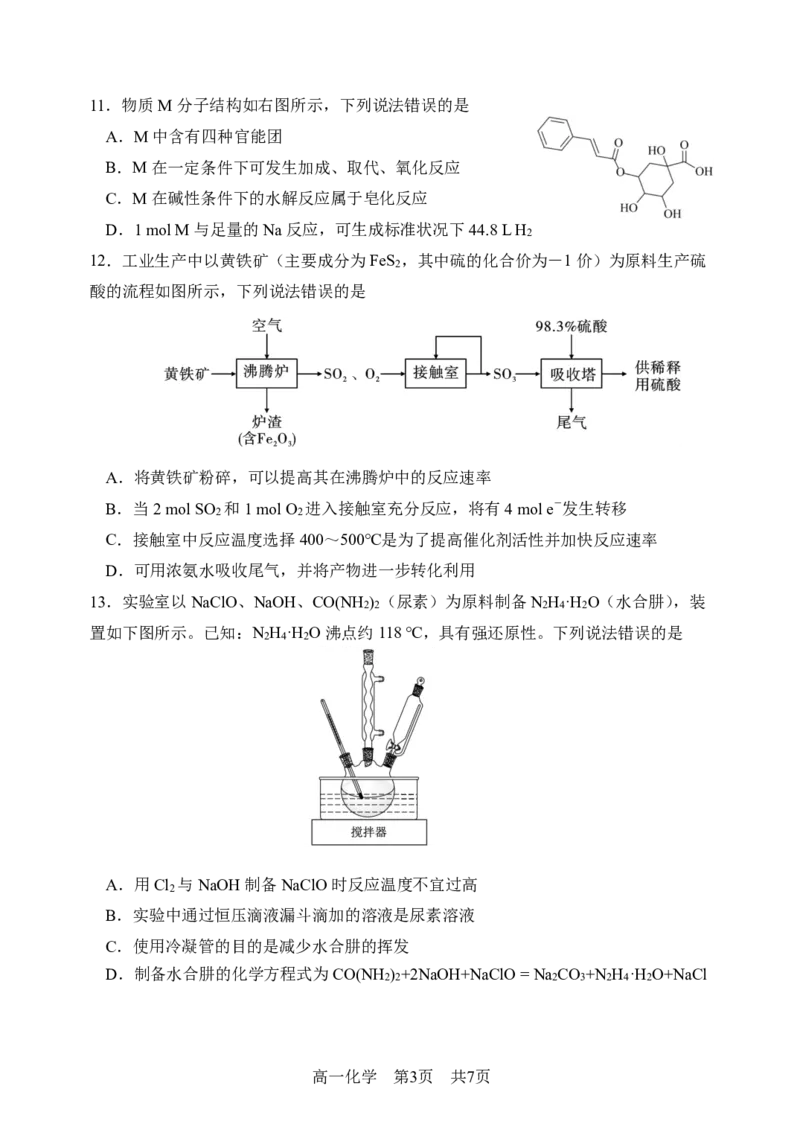
{#{QQABaYQUoggAAoAAAAgCQQn4CAAQkAEAASgOBBAMsAAAARNABAA=}#}11.物质M分子结构如右图所示,下列说法错误的是
A.M中含有四种官能团
B.M在一定条件下可发生加成、取代、氧化反应
C.M在碱性条件下的水解反应属于皂化反应
D.1 mol M与足量的Na反应,可生成标准状况下44.8 L H
2
12.工业生产中以黄铁矿(主要成分为FeS ,其中硫的化合价为-1价)为原料生产硫
2
酸的流程如图所示,下列说法错误的是
A.将黄铁矿粉碎,可以提高其在沸腾炉中的反应速率
B.当2 mol SO 和1 mol O 进入接触室充分反应,将有4 mol e-发生转移
2 2
C.接触室中反应温度选择400~500℃是为了提高催化剂活性并加快反应速率
D.可用浓氨水吸收尾气,并将产物进一步转化利用
13.实验室以NaClO、NaOH、CO(NH ) (尿素)为原料制备N H ·H O(水合肼),装
2 2 2 4 2
置如下图所示。已知:N H ·H O沸点约118 ℃,具有强还原性。下列说法错误的是
2 4 2
A.用Cl 与NaOH制备NaClO时反应温度不宜过高
2
B.实验中通过恒压滴液漏斗滴加的溶液是尿素溶液
C.使用冷凝管的目的是减少水合肼的挥发
D.制备水合肼的化学方程式为CO(NH ) +2NaOH+NaClO = Na CO +N H ·H O+NaCl
2 2 2 3 2 4 2
高一化学 第3页 共7页
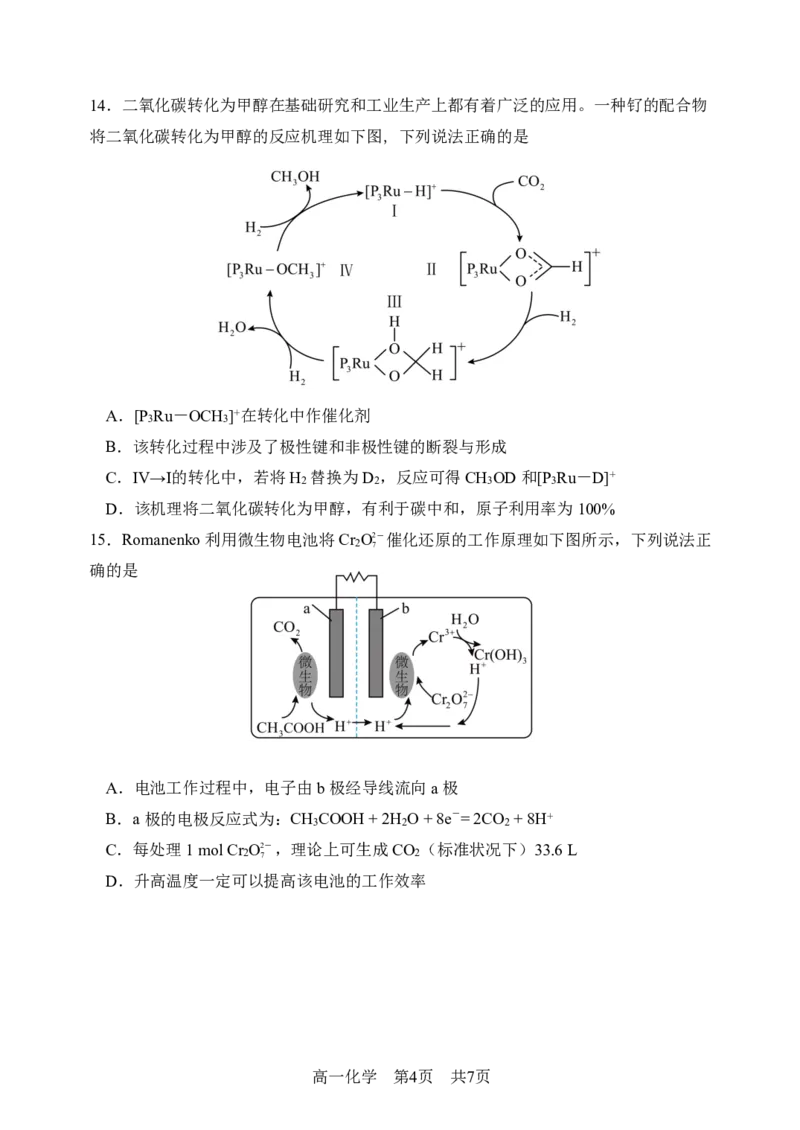
{#{QQABaYQUoggAAoAAAAgCQQn4CAAQkAEAASgOBBAMsAAAARNABAA=}#}14.二氧化碳转化为甲醇在基础研究和工业生产上都有着广泛的应用。一种钌的配合物
将二氧化碳转化为甲醇的反应机理如下图,下列说法正确的是
A.[P Ru-OCH ]+在转化中作催化剂
3 3
B.该转化过程中涉及了极性键和非极性键的断裂与形成
C.Ⅳ→Ⅰ的转化中,若将H 替换为D ,反应可得CH OD和[P Ru-D]+
2 2 3 3
D.该机理将二氧化碳转化为甲醇,有利于碳中和,原子利用率为100%
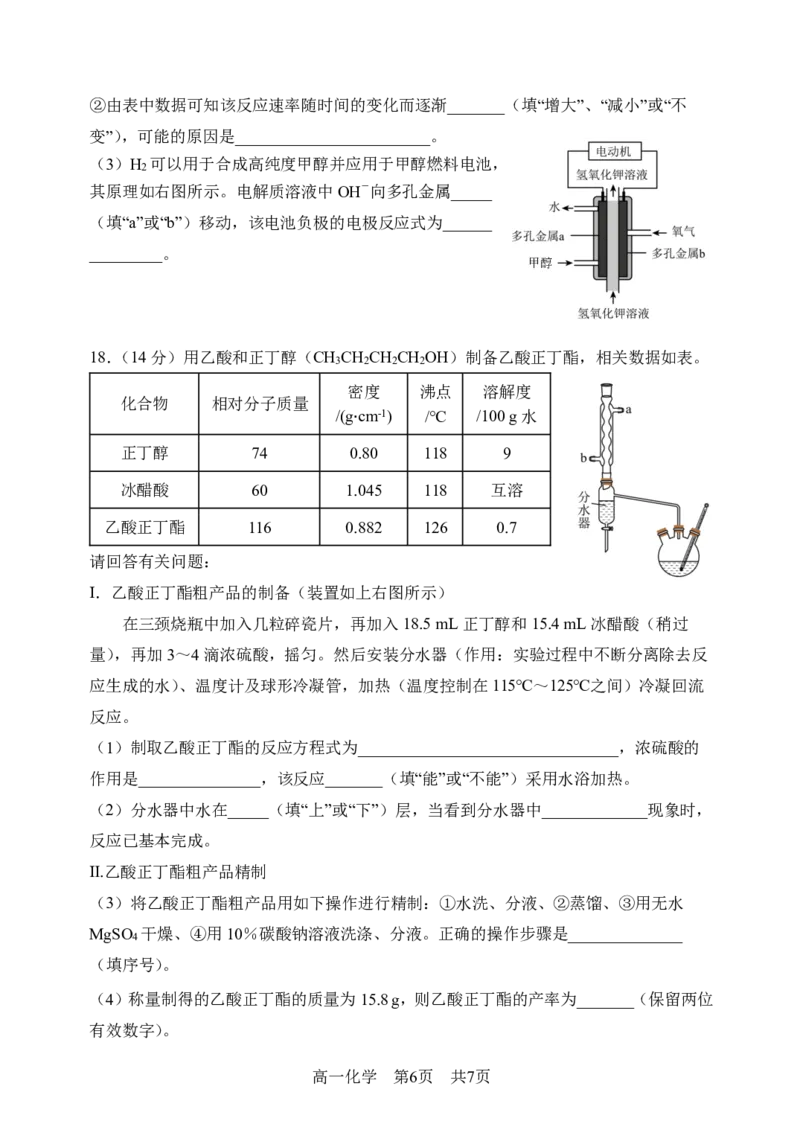
15.Romanenko利用微生物电池将Cr O2- 催化还原的工作原理如下图所示,下列说法正
2 7
确的是
A.电池工作过程中,电子由b极经导线流向a极
B.a极的电极反应式为:CH COOH + 2H O + 8e-= 2CO + 8H+
3 2 2
C.每处理1 mol Cr O2- ,理论上可生成CO (标准状况下)33.6 L
2 7 2
D.升高温度一定可以提高该电池的工作效率
高一化学 第4页 共7页
{#{QQABaYQUoggAAoAAAAgCQQn4CAAQkAEAASgOBBAMsAAAARNABAA=}#}II 卷(共 55 分)
二、填空题
16.(16分)以石油产品为原料生产有机化工产品,相关物质转化关系如下:
③ 有机物A
乙烯
C H O
2 6
裂化 ② 催化剂
石油 汽油 丙烯酸乙酯
① △
CH CH=CH 有机物B
3 2
丙烯 催化剂 C 3 H 4 O 2
催化剂 ④
塑料PP
(1)石油是多种碳氢化合物组成的混合物,利用石油中组分的沸点不同进行分离的方
法是_______(填序号),通过石油裂化和________(填序号)可以得到乙烯、丙烯、甲
烷等重要的基本化工原料。
a.分馏 b.萃取 c.催化裂化 d.催化裂解 e.催化重整
(2)B中的官能团的名称为______、_______,丙烯酸乙酯的结构简式为__________。
(3)反应③的反应类型为_____________________。
(4)反应④的化学方程式为___________________________________。
(5)有机物A也可以用生物质中的纤维素水解后发酵制得,写出纤维素水解的化学方
程式____________________。
(6)丙烯的二氯代物有________种(不考虑立体异构)。
17.(13分)氢能是一种极具发展潜力的清洁能源。
(1)以下生成氢气的反应属于放热反应的是___________(填序号)。
A.铝与盐酸反应 B.煤气化制氢 C.水分解制氢
(2)甲烷、水蒸气催化重整是制备高纯氢的反应之一,反应为:
CH (g) + 2H O(g) ⇌ 4H (g) + CO (g)
4 2 2 2
一定温度下,向体积为1 L的恒容密闭容器中充入1 mol CH (g)和2 mol H O(g),反
4 2
应过程中测得CO 的浓度与反应时间的关系如下表所示:
2
时间/s 0 1 2 3 4 5
c(CO )mol∙L-1 0.0 0.05 0.09 0.12 0.14 0.15
2
①0~3 s内用H 表示该反应的速率v(H ) = _______ mol∙L-1∙s-1,反应到5 s时,CH 的转
2 2 4
化率为______。
高一化学 第5页 共7页
{#{QQABaYQUoggAAoAAAAgCQQn4CAAQkAEAASgOBBAMsAAAARNABAA=}#}②由表中数据可知该反应速率随时间的变化而逐渐_______(填“增大”、“减小”或“不
变”),可能的原 因 _是_______________________。
(3)H 可以用于合成高纯度甲醇并应用于甲醇燃料电池,
2
其原理如右图所示。电解质溶液中OH-向多孔金属_____
(填“a”或“b”)移动,该电池负极的电极反应式为______
_________。
甲醇
18.(14分)用乙酸和正丁醇(CH CH CH CH OH)制备乙酸正丁酯,相关数据如表。
3 2 2 2
密度 沸点 溶解度
化合物 相对分子质量
/(g∙cm-1) /℃ /100 g水
正丁醇 74 0.80 118 9
冰醋酸 60 1.045 118 互溶
乙酸正丁酯 116 0.882 126 0.7
请回答有关问题:
I.乙酸正丁酯粗产品的制备(装置如上右图所示)
在三颈烧瓶中加入几粒碎瓷片,再加入18.5 mL正丁醇和15.4 mL冰醋酸(稍过
量),再加3~4滴浓硫酸,摇匀。然后安装分水器(作用:实验过程中不断分离除去反
应生成的水)、温度计及球形冷凝管,加热(温度控制在115℃~125℃之间)冷凝回流
反应。
(1)制取乙酸正丁酯的反应方程式为________________________________,浓硫酸的
作用是_______________,该反应_______(填“能”或“不能”)采用水浴加热。
(2)分水器中水在_____(填“上”或“下”)层,当看到分水器中_____________现象时,
反应已基本完成。
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下操作进行精制:①水洗、分液、②蒸馏、③用无水
MgSO 干燥、④用10%碳酸钠溶液洗涤、分液。正确的操作步骤是______________
4
(填序号)。
(4)称量制得的乙酸正丁酯的质量为15.8 g,则乙酸正丁酯的产率为_______(保留两位
有效数字)。
高一化学 第6页 共7页
{#{QQABaYQUoggAAoAAAAgCQQn4CAAQkAEAASgOBBAMsAAAARNABAA=}#}19.(12分)工业上用含三价钒(V O )为主的某石煤为原料(含有Al O 、CaO等杂
2 3 2 3
质),钙化法焙烧制备V O ,其流程如下:
2 5
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系见下表:
pH 4~6 6~8 8~10 10~12
主要离子 VO+ VO- V O4- VO3-
2 3 2 7 4
(1)焙烧:向石煤中加生石灰焙烧,利用空气中的氧气将V O 转化为Ca(VO ) 。在该
2 3 3 2
过程中,V O 与O 的物质的量之比为_______。
2 3 2
(2)酸浸:已知Ca(VO ) 难溶于水,可溶于盐酸。焙砂酸浸时溶液的pH约为4,此时
3 2
Ca(VO ) 溶于盐酸的离子方程式是_______________________________。
3 2
(3)转沉时加入铵盐,并控制溶液的pH在_______,使NH VO 沉淀析出。
4 3
(4)煅烧:高温煅烧时生成V O 的化学方程式是__________________________。
2 5
(5)测定产品中V O 的纯度:
2 5
a.准确称取a g产品。
b.用足量的硫酸溶液溶解,得到(VO ) SO 溶液,再加入b mL c mol∙L-1
2 2 4 1 1
(NH ) Fe(SO ) 溶液,发生反应:VO+ + 2H+ + Fe2+ = VO2+ + Fe3+ + H O。
4 2 4 2 2 2
c.过量的(NH ) Fe(SO ) 恰好能与b mL c mol∙L-1 KMnO 溶液完全反应,该反应的
4 2 4 2 2 2 4
离子方程式为_____________________________________。
假设杂质不参与反应,则产品中V O 的质量分数是___________(用代数式表示)。
2 5
高一化学 第7页 共7页
{#{QQABaYQUoggAAoAAAAgCQQn4CAAQkAEAASgOBBAMsAAAARNABAA=}#}