文档内容
宣城市 2023——2024 学年度第二学期期末调研测试
高一化学试题
注意事项:
本试卷分选择题和非选择题两部分,满分100分,考试时间75分钟。
1.答题前,考生务必将自己的姓名、考号填写在答题卷上并将条形码粘贴在指定区域。
2.回答选择题时,选出每小题答案后,用 2B铅笔把答题卷上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卷上,写
在本试卷上无效。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 I-127
一、选择题:本题共15小题,共50分。第1~10小题,每小题3分;第11~15小题,每小题
4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下图是我国自主研制的“飞天"舱外航天服。下列有关航天服涉及的材料中,不属于有机高分子材料的是
A. 羊毛 B. 玻璃纤维 C. 聚氯乙烯 D. 聚四氟乙烯
2. 宣城美食享誉省内外。下列叙述错误的是
A. 水阳鸭脚包中的鸭掌含有蛋白质
B. 绩溪一品锅中的冬笋含有纤维素
C. 泾县发糕使用的糯米主要成分是淀粉
D. 宁国粑粑使用的植物油主要成分为饱和高级脂肪酸甘油酯
3. 利用4个碳原子,以碳碳单键相连,拼插合理的链状碳骨架有
A. 2种 B. 3种 C. 4种 D. 5种
的
4. 日常生活中 下列措施,与调控反应速率无关的是
A. 疫苗冷藏储存 B. 食品抽真空包装
C. 门窗合页里注润滑油 D. 铁制品表面刷油漆
第1页/共10页
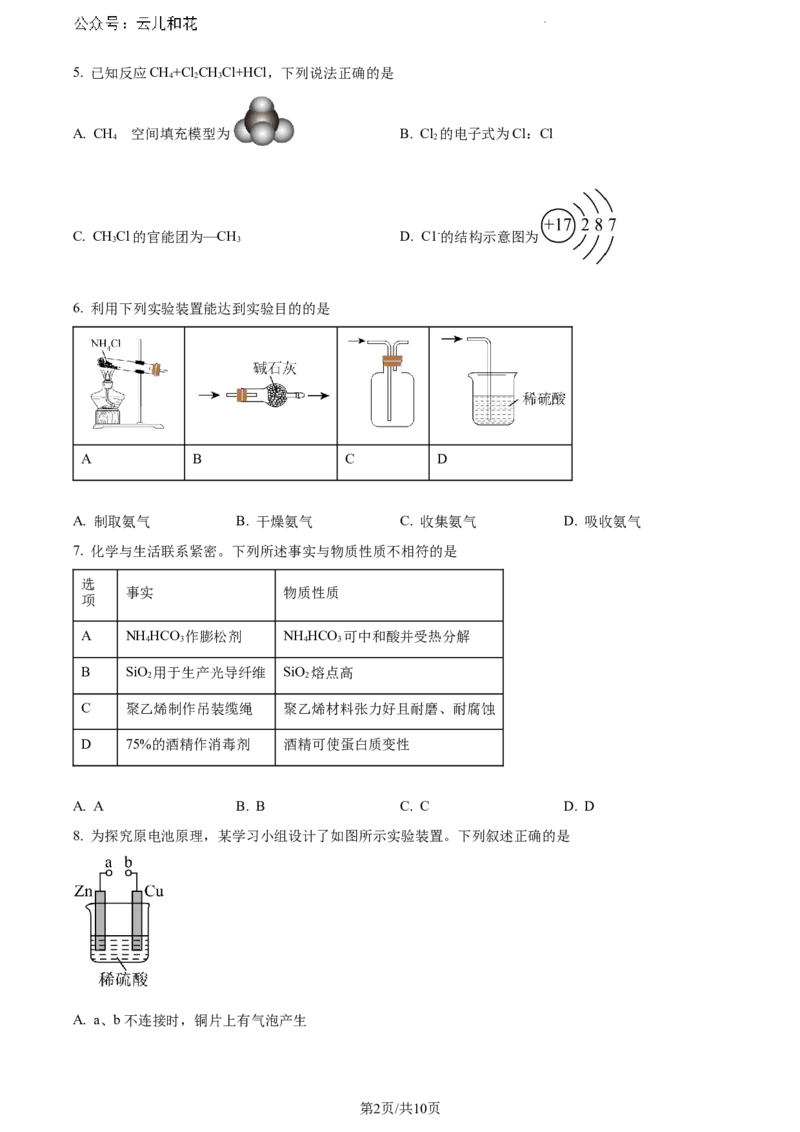
学科网(北京)股份有限公司5. 已知反应CH+ClCHCl+HCl,下列说法正确的是
4 2 3
A. CH 空间填充模型为 B. Cl 的电子式为Cl:Cl
4 的 2
C. CHCl的官能团为—CH D. C1-的结构示意图为
3 3
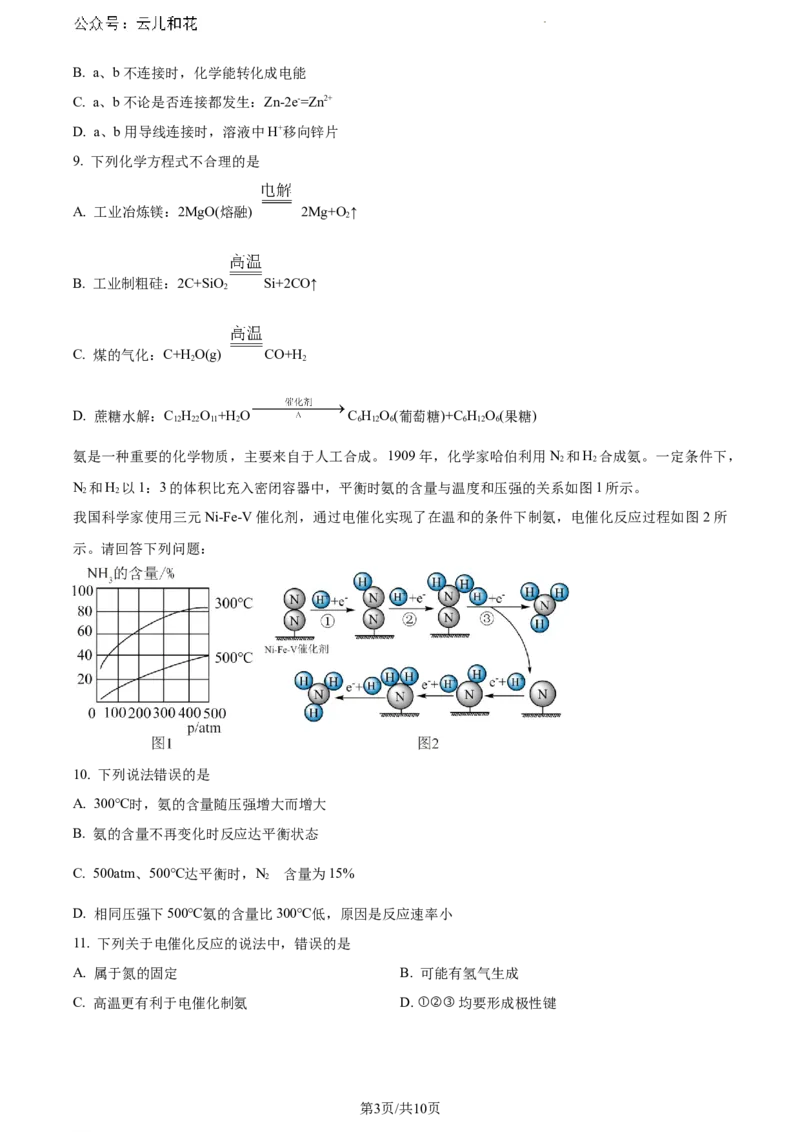
6. 利用下列实验装置能达到实验目的的是
A B C D
A. 制取氨气 B. 干燥氨气 C. 收集氨气 D. 吸收氨气
7. 化学与生活联系紧密。下列所述事实与物质性质不相符的是
选
事实 物质性质
项
A NH HCO 作膨松剂 NH HCO 可中和酸并受热分解
4 3 4 3
B SiO 用于生产光导纤维 SiO 熔点高
2 2
C 聚乙烯制作吊装缆绳 聚乙烯材料张力好且耐磨、耐腐蚀
D 75%的酒精作消毒剂 酒精可使蛋白质变性
A. A B. B C. C D. D
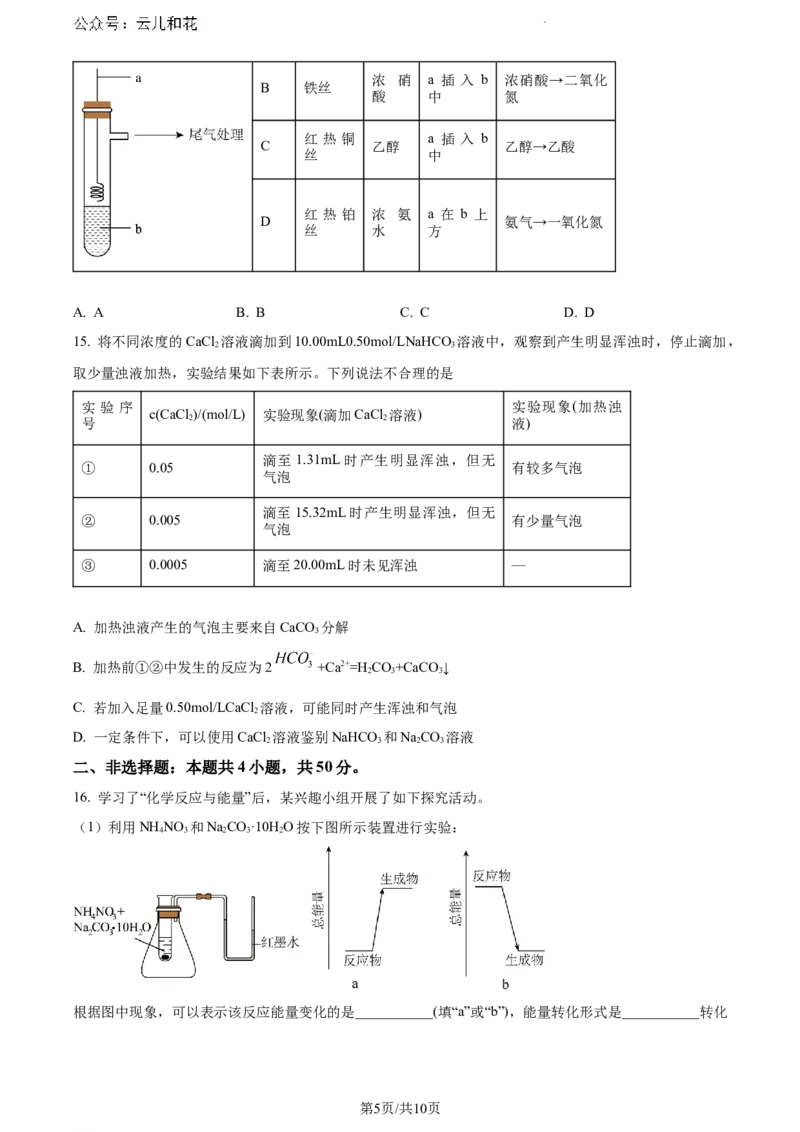
8. 为探究原电池原理,某学习小组设计了如图所示实验装置。下列叙述正确的是
A. a、b不连接时,铜片上有气泡产生
第2页/共10页
学科网(北京)股份有限公司B. a、b不连接时,化学能转化成电能
C. a、b不论是否连接都发生:Zn-2e-=Zn2+
D. a、b用导线连接时,溶液中H+移向锌片
9. 下列化学方程式不合理的是
A. 工业冶炼镁:2MgO(熔融) 2Mg+O↑
2
B. 工业制粗硅:2C+SiO Si+2CO↑
2
C. 煤的气化:C+H O(g) CO+H
2 2
D. 蔗糖水解:C H O +H O C H O(葡萄糖)+C H O(果糖)
12 22 11 2 6 12 6 6 12 6
氨是一种重要的化学物质,主要来自于人工合成。1909年,化学家哈伯利用N 和H 合成氨。一定条件下,
2 2
N 和H 以1:3的体积比充入密闭容器中,平衡时氨的含量与温度和压强的关系如图1所示。
2 2
我国科学家使用三元Ni-Fe-V催化剂,通过电催化实现了在温和的条件下制氨,电催化反应过程如图 2所
示。请回答下列问题:
10. 下列说法错误的是
A. 300℃时,氨的含量随压强增大而增大
B. 氨的含量不再变化时反应达平衡状态
的
C. 500atm、500℃达平衡时,N 含量为15%
2
D. 相同压强下500℃氨的含量比300℃低,原因是反应速率小
11. 下列关于电催化反应的说法中,错误的是
A. 属于氮的固定 B. 可能有氢气生成
C. 高温更有利于电催化制氨 D. ①②③均要形成极性键
第3页/共10页
学科网(北京)股份有限公司12. 我国科学家研究的载人航天器中的物质循环如图所示,实现了空间站中氧气的再生。 为阿伏加德罗
常数的值,下列说法正确的是
A. 中含质子数为
B. 反应②生成 转移电子数为
C. 太阳能可作为反应①和②的能量来源
D. 用于循环的氢原子利用率为
13. 材料组成和结构的变化可以引起性能的变化,下列推测不合理的是
选
材料 组成和结构的变化 性能变化
项
A 普通玻璃 加入某些金属氧化物 呈现不同的颜色
B 半导体硅 用碳原子取代部分硅原子 导电性增强
C 植物油 催化加氢 不易变质
D 橡胶 硫化使其结构由线型变为网状 强度提高
A. A B. B C. C D. D
14. 常温下利用下列装置和试剂按照规定操作进行实验,能实现相应物质转化的是
选
装置 试剂a 试剂b 操作 物质转化
项
浓 硫 a 插 入 b 浓硫酸→二氧化
A 铜丝
酸 中 硫
第4页/共10页
学科网(北京)股份有限公司浓 硝 a 插 入 b 浓硝酸→二氧化
B 铁丝
酸 中 氮
红 热 铜 a 插 入 b
C 乙醇 乙醇→乙酸
丝 中
红 热 铂 浓 氨 a 在 b 上
D 氨气→一氧化氮
丝 水 方
A. A B. B C. C D. D
15. 将不同浓度的CaCl 溶液滴加到10.00mL0.50mol/LNaHCO 溶液中,观察到产生明显浑浊时,停止滴加,
2 3
取少量浊液加热,实验结果如下表所示。下列说法不合理的是
实 验 序 实验现象(加热浊
c(CaCl )/(mol/L) 实验现象(滴加CaCl 溶液)
号 2 2 液)
滴至1.31mL时产生明显浑浊,但无
① 0.05 有较多气泡
气泡
滴至15.32mL时产生明显浑浊,但无
② 0.005 有少量气泡
气泡
③ 0.0005 滴至20.00mL时未见浑浊 —
A. 加热浊液产生的气泡主要来自CaCO 分解
3
B. 加热前①②中发生的反应为2 +Ca2+=H CO+CaCO ↓
2 3 3
C. 若加入足量0.50mol/LCaCl 溶液,可能同时产生浑浊和气泡
2
D. 一定条件下,可以使用CaCl 溶液鉴别NaHCO 和NaCO 溶液
2 3 2 3
二、非选择题:本题共4小题,共50分。
16. 学习了“化学反应与能量”后,某兴趣小组开展了如下探究活动。
(1)利用NH NO 和NaCO·10H O按下图所示装置进行实验:
4 3 2 3 2
根据图中现象,可以表示该反应能量变化的是___________(填“a”或“b”),能量转化形式是___________转化
第5页/共10页
学科网(北京)股份有限公司为化学能。
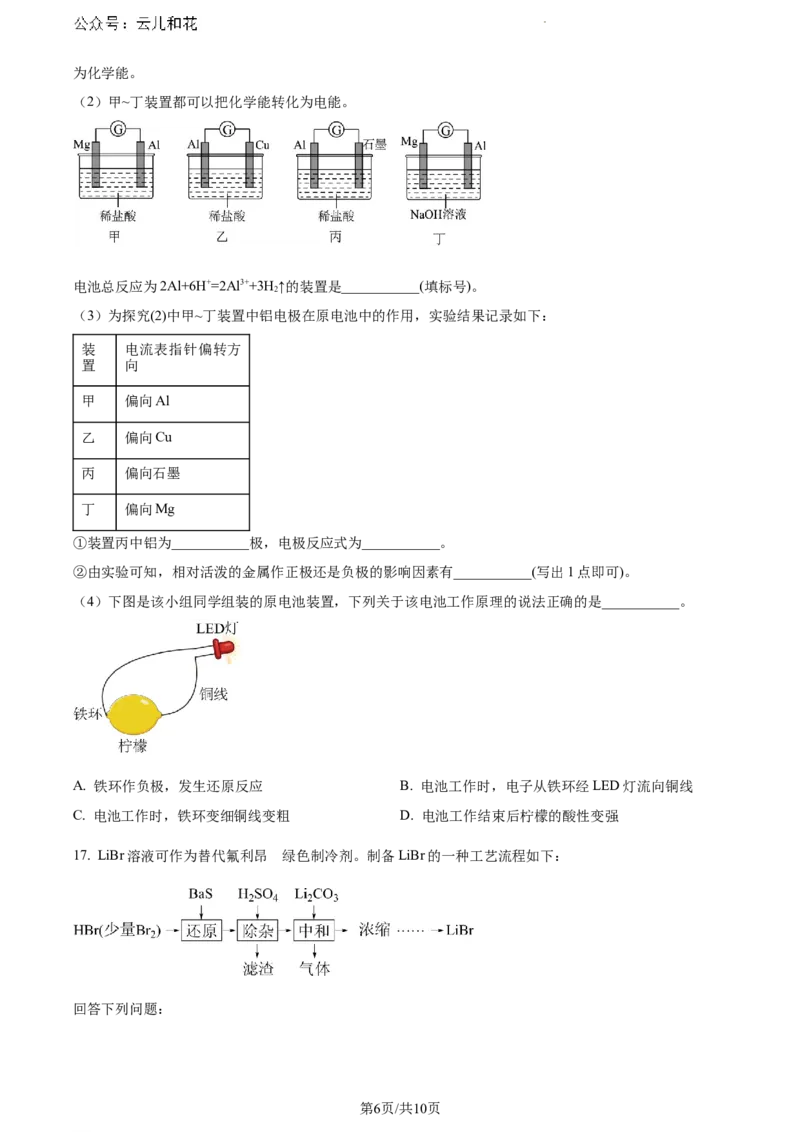
(2)甲~丁装置都可以把化学能转化为电能。
电池总反应为2Al+6H+=2Al3++3H ↑的装置是___________(填标号)。
2
(3)为探究(2)中甲~丁装置中铝电极在原电池中的作用,实验结果记录如下:
装 电流表指针偏转方
置 向
甲 偏向Al
乙 偏向Cu
丙 偏向石墨
丁 偏向Mg
①装置丙中铝为___________极,电极反应式为___________。
②由实验可知,相对活泼的金属作正极还是负极的影响因素有___________(写出1点即可)。
(4)下图是该小组同学组装的原电池装置,下列关于该电池工作原理的说法正确的是___________。
A. 铁环作负极,发生还原反应 B. 电池工作时,电子从铁环经LED灯流向铜线
C. 电池工作时,铁环变细铜线变粗 D. 电池工作结束后柠檬的酸性变强
的
17. LiBr溶液可作为替代氟利昂 绿色制冷剂。制备LiBr的一种工艺流程如下:
回答下列问题:
第6页/共10页
学科网(北京)股份有限公司(1)“还原”工序加入BaS溶液可以除去Br ,反应的离子方程式为___________。
2
(2)若“还原”工序用NaOH溶液吸收Br ,吸收液___________(填“可以”或“不可以”)直接返回“还原”工序,
2
原因是___________。
(3)滤渣中除硫外,还有___________(填化学式),可选用___________(填标号)作溶剂溶解后进行分离。
A.水 B.酒精 C.二硫化碳
(4)参与反应的n(Br) ∶n(BaS) ∶n(H SO )为___________。
2 2 4
(5)“中和”工序反应的化学方程式为___________。
18. 有机物A的相对分子质量为28,其产量可以用来衡量一个国家石油化学工业的发展水平。一定条件下
相关物质能发生如下图所示的转化(部分反应条件和生成物已略去)。
回答下列问题:
(1)A的结构简式为___________,A和B互为___________。
(2)B转化为H的反应类型为___________。
的
(3)E中官能团 名称为___________,E在生活中的一种用途为___________。
(4)C与F反应生成G的化学方程式为___________。
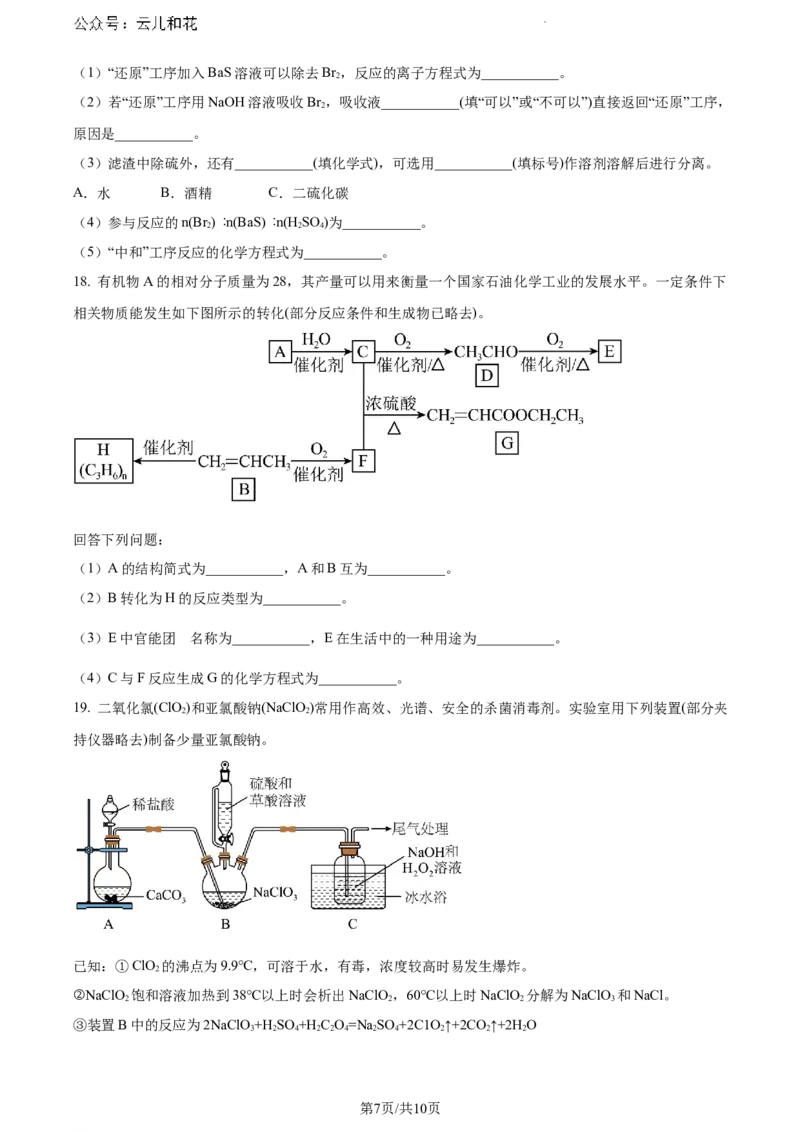
19. 二氧化氯(ClO )和亚氯酸钠(NaClO)常用作高效、光谱、安全的杀菌消毒剂。实验室用下列装置(部分夹
2 2
持仪器略去)制备少量亚氯酸钠。
已知:①ClO 的沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
2
②NaClO 饱和溶液加热到38℃以上时会析出NaClO,60℃以上时NaClO 分解为NaClO 和NaCl。
2 2 2 3
③装置B中的反应为2NaClO+H SO +H C O=Na SO +2C1O ↑+2CO ↑+2H O
3 2 4 2 2 4 2 4 2 2 2
第7页/共10页
学科网(北京)股份有限公司回答下列问题:
(1)实验过程中需持续通入一定量的CO,原因是___________,反应结束后仍需通入一定量的CO,原
2 2
因是___________。
(2)装置C中生成NaClO 的化学方程式为___________。
2
(3)要从反应后的溶液中得到NaClO 固体,操作方法是:在___________(填温度范围)蒸发浓缩、冷却结
2
晶、___________、洗涤、干燥。
(4)水样用ClO 处理后,有少量ClO 残留,可用下列方法检测残留浓度:取50.00mL水样,加入过量KI
2 2
和稀硫酸(2ClO +10KI+4H SO =2KCl+4K SO +5I +4H O),再加入淀粉溶液,溶液变蓝色。将溶液调节为弱
2 2 4 2 4 2 2
酸性后滴加5.00×10-4mol/LNa SO 溶液,恰好反应时消耗NaSO 溶液
2 2 3 2 2 3
20.00mL(2Na SO+I =Na SO+2NaI)。计算该水样中ClO 的残留浓度___________ (mg/L,要求写出计算
2 2 3 2 2 4 6 2
过程)。
第8页/共10页
学科网(北京)股份有限公司宣城市 2023——2024 学年度第二学期期末调研测试
高一化学试题
注意事项:
本试卷分选择题和非选择题两部分,满分100分,考试时间75分钟。
1.答题前,考生务必将自己的姓名、考号填写在答题卷上并将条形码粘贴在指定区域。
2.回答选择题时,选出每小题答案后,用 2B铅笔把答题卷上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卷上,写
在本试卷上无效。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 I-127
一、选择题:本题共15小题,共50分。第1~10小题,每小题3分;第11~15小题,每小题
4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【1题答案】
【答案】B
【2题答案】
【答案】D
【3题答案】
【答案】A
【4题答案】
【答案】C
【5题答案】
【答案】A
【6题答案】
【答案】B
【7题答案】
【答案】B
【8题答案】
【答案】C
【9题答案】
【答案】A
【10~11题答案】
【答案】10. D 11. C
第9页/共10页
学科网(北京)股份有限公司【12题答案】
【答案】C
【13题答案】
【答案】B
【14题答案】
【答案】D
【15题答案】
【答案】A
二、非选择题:本题共4小题,共50分。
【16题答案】
【答案】(1) ①. a ②. 热能
(2)乙、丙 (3) ①. 负 ②. Al-3e-=Al3+ ③. 金属本身的还原性或电解质溶液成分
(4)B
【17题答案】
【答案】(1)Br +S2-=2Br- +S↓
2
(2) ①. 不可以 ②. 返回还原工序会引入Na+,导致产品的纯度降低
(3) ①. BaSO ②. C
4
(4)1 1 1 (5)2HBr+Li CO=2LiBr+H O+CO↑
2 3 2 2
【18题∶答∶案】
【答案】(1) ①. CH=CH ②. 同系物
2 2
(2)聚合反应或加聚反应
(3) ①. 羧基 ②. 作调味品或清除水壶中的少量水垢
(4)CHCHOH+CH =CHCOOHCH CHCOOCH CH+ H O
3 2 2 2 2 3 2
【19题答案】
【答案】(1) ①. 降低ClO 的浓度,防止发生爆炸 ②. 将装置中残留的ClO 排尽,防止污染
2 2
(2)2ClO +H O+2NaOH=2NaClO +O ↑+2H O
2 2 2 2 2 2
(3) ①. 38 ~60℃ ②. 过滤
(4)2.70
第10页/共10页
学科网(北京)股份有限公司