文档内容
3.1.2 铁的化合物 练习(原卷版)
1.下列物质的颜色按淡黄色、黑色、红棕色、蓝色顺序排列的是( )
A.Cl、Fe O、NaO、CuSO ·5H O
2 2 3 2 2 4 2
B.NaO、Fe O、Fe O、CuSO ·5H O
2 2 3 4 2 3 4 2
C.Fe O、Fe O、NaO、CuSO ·5H O
2 3 3 4 2 2 4 2
D.CuSO ·5H O、Fe O、FeO、NaO
4 2 2 3 2 2
2.在一些高档茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可以看到灰黑色粉末,其中
有些已变成棕褐色。将上述粉末溶于稀盐酸,取上层清液,滴入几滴氯水,再滴加 KSCN溶液,马上出现
红色。以下结论不正确的是( )
A.该灰黑色粉末用作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
3.已知硝酸能将Fe2+氧化为Fe3+。下列物质反应后一定能使KSCN溶液变红的是( )
①Fe与Cl 反应
2
②Fe与过量稀硫酸反应
③FeCl 溶液中通入少量Cl
2 2
④Fe和Fe O 的混合物溶于盐酸中
2 3
⑤向Fe(NO ) 溶液中加入过量稀硫酸
3 2
A.只有① B.只有①③⑤
C.只有①②③ D.全部
4.在Fe (SO ) 溶液中,加入a g铜,完全溶解后,再加入b g 铁,充分反应后得到c g残余固体,
2 4 3
已知a>c,则下列说法正确的是( )
A.残余固体是铜和铁
B.最后得到的溶液一定含有Cu2+
C.将残余固体加入稀硫酸中一定有气泡产生
D.最后得到的溶液中可能含有Fe3+
5.将a g铁和氧化铁的混合物加入足量的盐酸中,充分反应,固体无剩余。测得参加反应的 HCl为
0.08 mol,放出标准状况下的气体为0.224 L。则下列判断中正确的是( )
A.原混合物中n(Fe)∶n(Fe O)=2∶1
2 3B.向溶液中滴入KSCN溶液,显红色
C.无法计算原混合物的质量
D.溶液中Fe2+和Fe3+的物质的量之比为3∶1
6.有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯
气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为( )
A.Fe O B.Fe O
2 3 3 4
C.Fe O D.Fe O
4 5 5 7
7.在FeCl 、CuCl 、FeCl 的混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量
3 2 2
铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量
之比为( )
A.2∶1 B.1∶2 C.1∶3 D.1∶4
8.印刷铜制线路板的“腐蚀液”为FeCl 溶液。已知铜、铁均能与FeCl 溶液反应,反应方程式分别
3 3
为:Cu+2FeCl ===2FeCl +CuCl ,Fe+2FeCl ===3FeCl 。现将一铜、铁混合粉末加入到盛有FeCl 溶液的
3 2 2 3 2 3
烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是( )
A.溶液中一定含FeCl ,固体一定是铁和铜
3
B.溶液中一定含FeCl ,固体一定含铜
2
C.溶液中一定含FeCl 、CuCl ,固体一定含铜
2 2
D.溶液中一定含FeCl ,固体一定是铁和铜
2
9.用一定量的铁与足量的稀硫酸及足量的CuO制取单质铜,有人设计了以下两种方案:
①Fe――→H――→Cu ②CuO――→CuSO ――→Cu
2 4
若按实验原则进行操作,则两者制得单质铜的量为( )
A.一样多 B.①多
C.②多 D.无法判断
10.下列说法不正确的是( )
A.将水蒸气通过灼热的铁粉,粉末变红
B.FeCl 溶液能与Cu反应,可用于蚀刻印刷电路
3
C.取少量溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+
D.小苏打是面包发酵粉的主要成分之一
11.(1)合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe O。
2 3
①某FeO、Fe O 混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe O 的物质的量之
2 3 2 3
比为________。②当催化剂中+2价铁与+3价铁的物质的量之比为1∶2 时,其催化活性最高,此时铁的氧化物的混
合物中铁的质量分数为________(用小数表示,保留两位小数)。
(2)电子工业常用30%的FeCl 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
3
①用 FeO、Fe O 和稀盐酸、氯气制取 FeCl 溶液的离子方程式为__________________、
2 3 3
__________________、____________________,检验溶液中Fe3+存在的试剂是________。
②写出FeCl 溶液与金属铜发生反应的化学方程式:______________________________,当转移电子
3
数为6.02×1024时,被氧化的物质的质量为________。
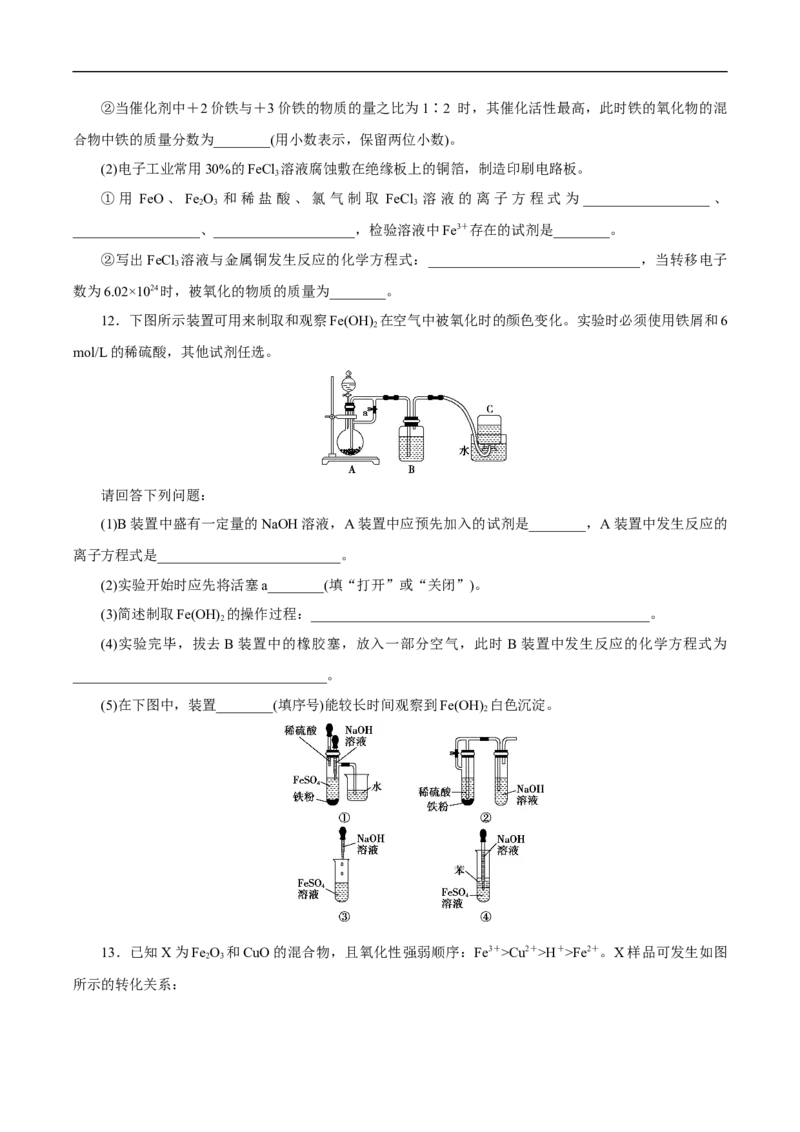
12.下图所示装置可用来制取和观察Fe(OH) 在空气中被氧化时的颜色变化。实验时必须使用铁屑和6
2
mol/L的稀硫酸,其他试剂任选。
请回答下列问题:
(1)B装置中盛有一定量的NaOH溶液,A装置中应预先加入的试剂是________,A装置中发生反应的
离子方程式是__________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述制取Fe(OH) 的操作过程:________________________________________________。
2
(4)实验完毕,拔去B装置中的橡胶塞,放入一部分空气,此时 B装置中发生反应的化学方程式为
____________________________________。
(5)在下图中,装置________(填序号)能较长时间观察到Fe(OH) 白色沉淀。
2
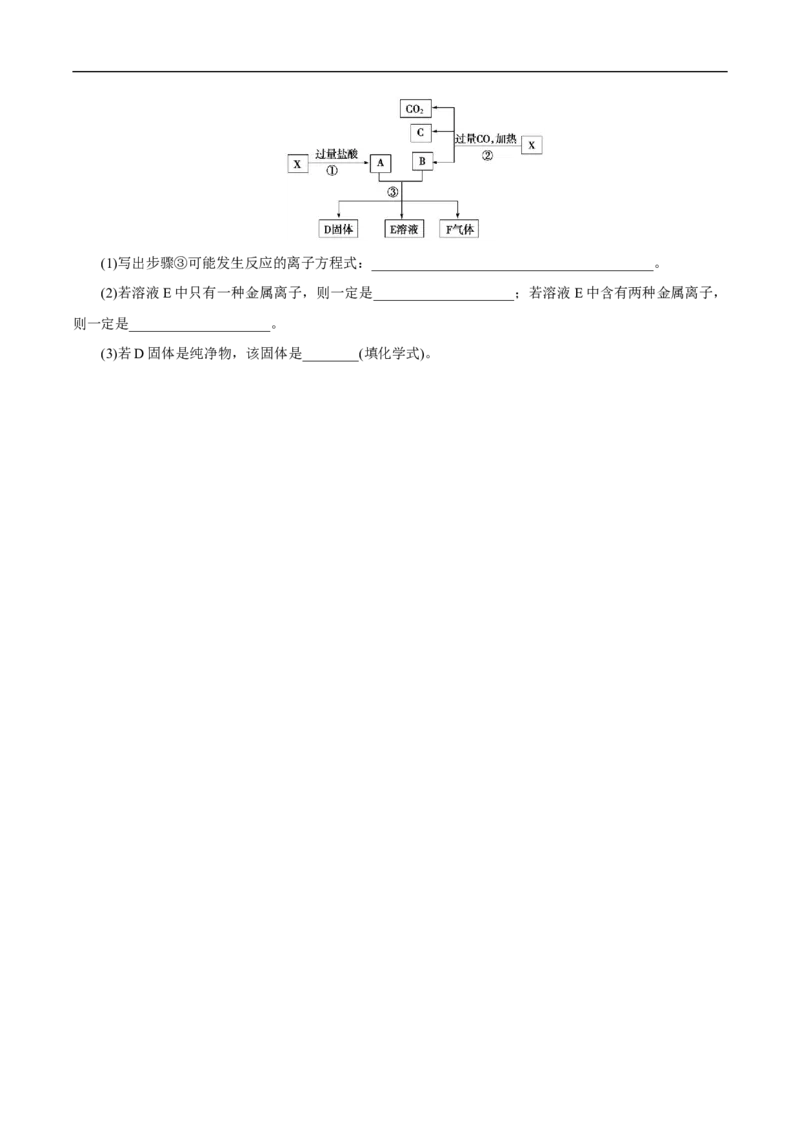
13.已知X为Fe O 和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图
2 3
所示的转化关系:(1)写出步骤③可能发生反应的离子方程式:________________________________________。
(2)若溶液E中只有一种金属离子,则一定是____________________;若溶液E中含有两种金属离子,
则一定是____________________。
(3)若D固体是纯净物,该固体是________(填化学式)。