文档内容
天津市 2024-2025 学年度高一下学期期中考试
C.丙烷的空间填充模型:
化学试卷
D.乙烯的结构简式:CH CH
2 2
满分:100分;考试范围:必修一
3.物质的性质决定用途,下列两者对应关系不正确的是
注意事项:
A.氨气易液化,且液氨汽化时要吸收大量热,因此可用作制冷剂
1.答题前填写好自己的姓名、班级、考号等信息
B.纯铝具有很强的抗腐蚀能力,因此可用作制造飞机的材料
2.请将答案正确填写在答题卡上
第I卷(选择题)
C. 可中和酸和受热分解,并产生气体,因此可用作食物膨松剂
请点击修改第I卷的文字说明
D. 难溶于水和酸,且不容易被X射线透射,因此可用作“钡餐”
4.下列离子方程式书写正确的是
一、单选题
1.“逐梦苍穹之上,拥抱星辰大海”,航天科技的发展与化学密切相关。下列选项正 A.铜与浓硝酸反应:
确的是
B. 气体与 反应:
C.实验室用 和 两固体加热制 :
A.“北斗三号”导航卫星搭载计时铷原子钟,铷是第ⅠA族元素
D.向氯化钡溶液中通入 气体:
B.“嫦娥五号”探测器配置砷化镓太阳能电池,太阳能电池将化学能直接转化为电
能
5.设N 为阿伏加德罗常数的值,下列说法正确的是
A
C.“祝融号”火星车利用正十一烷储能,正十一烷属于不饱和烃
A.2.8gFe与足量稀硝酸充分反应,转移电子数为0.1N
A
D.“神舟十三号”航天员使用塑料航天面窗,塑料属于无机非金属材料
B.常温常压下,3.4 g NH 中含有的电子对数目为N
3 A
2.下列有关化学用语使用正确的是
C.利用石英砂制备粗硅时,生成28 g Si的同时得到CO 分子数为N
2 A
D.由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成2.24L H ,则电路通过
2
A.CCl 的电子式: 电子数为0.2N
4 A
6.下列说法正确的是
B.乙酸的分子式:C H O
2 4 2
第11页 共24页 ◎ 第12页 共24页A.用装置A验证SO 的漂白性
2
B.用装置B制取干燥纯净的NH
3
C.用装置C检验电流的方向
D.用装置D比较MnO 和Fe O 的催化效果
2 2 3
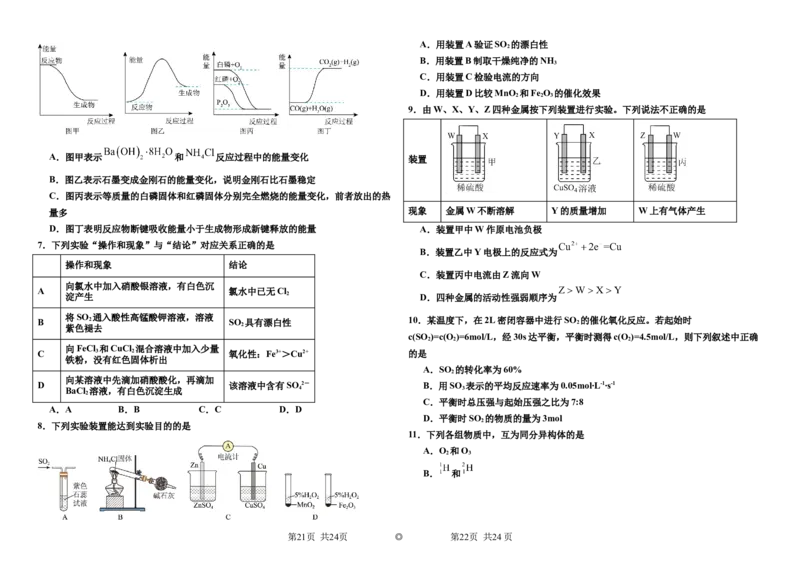
9.由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
A.图甲表示 和 反应过程中的能量变化 装置
B.图乙表示石墨变成金刚石的能量变化,说明金刚石比石墨稳定
C.图丙表示等质量的白磷固体和红磷固体分别完全燃烧的能量变化,前者放出的热
量多 现象 金属W不断溶解 Y的质量增加 W上有气体产生
D.图丁表明反应物断键吸收能量小于生成物形成新键释放的能量 A.装置甲中W作原电池负极
7.下列实验“操作和现象”与“结论”对应关系正确的是
B.装置乙中Y电极上的反应式为
操作和现象 结论
C.装置丙中电流由Z流向W
向氯水中加入硝酸银溶液,有白色沉
A 氯水中已无Cl
淀产生 2 D.四种金属的活动性强弱顺序为
将SO 通入酸性高锰酸钾溶液,溶液
B 2 SO 具有漂白性 10.某温度下,在2L密闭容器中进行SO 2 的催化氧化反应。若起始时
紫色褪去 2
c(SO )=c(O )=6mol/L,经30s达平衡,平衡时测得c(O )=4.5mol/L,则下列叙述中正确
2 2 2
向FeCl 和CuCl 混合溶液中加入少量
C 3 2 氧化性:Fe3+>Cu2+ 的是
铁粉,没有红色固体析出
A.SO 的转化率为60%
2
向某溶液中先滴加硝酸酸化,再滴加
D 该溶液中含有SO 2- B.用SO 表示的平均反应速率为0.05mol∙L-1∙s-1
BaCl 溶液,有白色沉淀生成 4 3
2
C.平衡时总压强与起始压强之比为7:8
A.A B.B C.C D.D
D.平衡时SO 的物质的量为3mol
2
8.下列实验装置能达到实验目的的是
11.下列各组物质中,互为同分异构体的是
A.O 和O
2 3
B. 和
第21页 共24页 ◎ 第22页 共24页D.浓 可用于干燥 气体
C. 和CH —CH —CH —CH —CH —CH
3 2 2 2 2 3
15.将一定质量的铜溶于 的浓硝酸中,待铜完全溶解后,生成标况
D.CH —CH —CH 和CH —CH —CH —CH
3 2 3 3 2 2 3
12.下列属于取代反应的是
下 和 的混合气体(标况下不考虑 转化为 ),测得反应后的溶液
A.
中 的浓度为2mol/L。假设反应后溶液的体积仍为100mL,则气体产物中的 在标
B.
准状况下的体积是
C.
A.1.12L B.2.24L C.3.36L D.4.48L
16.某小组探究 的催化氧化,实验装置图如下(夹持装置省略)。③中气体颜色无明
D.
显变化,④中收集到红棕色气体,一段时间后,④中产生大量白烟。下列分析正确的是
13.可逆反应2NO 2NO+O 在体积不变的密闭容器中反应,达到平衡状态的标志是
2 2
①单位时间内生成n molO 的同时生成2n mol NO
2 2
②用NO 、NO、O 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
2 2
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②③⑤ C.①③④ D.①②③④⑤
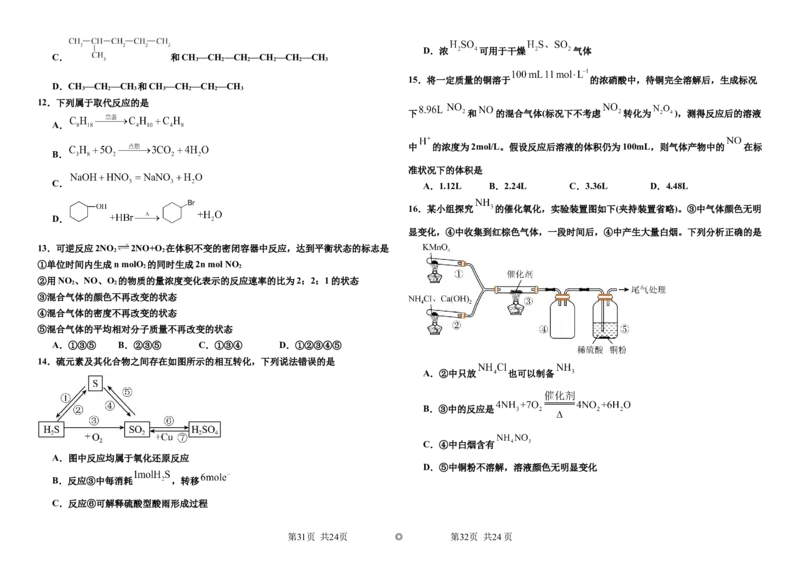
14.硫元素及其化合物之间存在如图所示的相互转化,下列说法错误的是
A.②中只放 也可以制备
B.③中的反应是
C.④中白烟含有
A.图中反应均属于氧化还原反应
D.⑤中铜粉不溶解,溶液颜色无明显变化
B.反应③中每消耗 ,转移
C.反应⑥可解释硫酸型酸雨形成过程
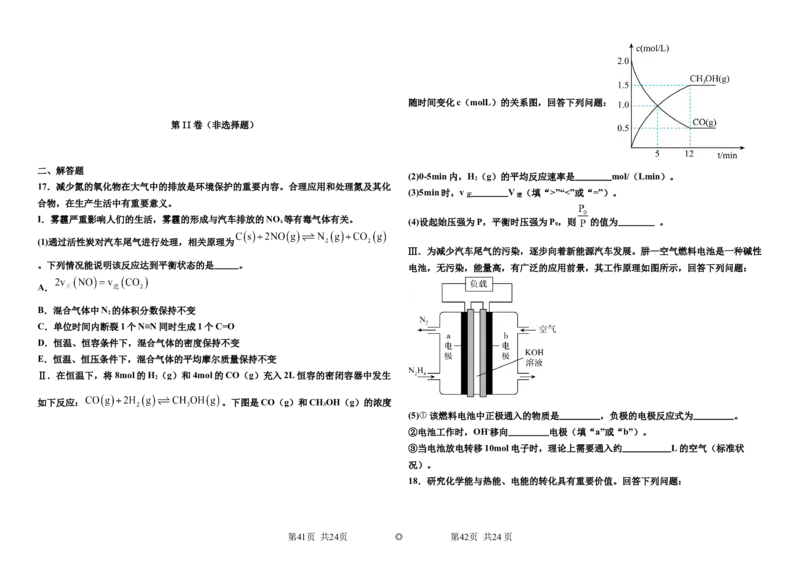
第31页 共24页 ◎ 第32页 共24页随时间变化c(molL)的关系图,回答下列问题:
第II卷(非选择题)
二、解答题
(2)0-5min内,H (g)的平均反应速率是 mol/(Lmin)。
2
17.减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化
(3)5min时,v V (填“>”“<”或“=”)。
正 逆
合物,在生产生活中有重要意义。
I.雾霾严重影响人们的生活,雾霾的形成与汽车排放的NO 等有毒气体有关。
x (4)设起始压强为P,平衡时压强为P ,则 的值为 。
0
(1)通过活性炭对汽车尾气进行处理,相关原理为
Ⅲ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性
。下列情况能说明该反应达到平衡状态的是 。
电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,回答下列问题:
A.
B.混合气体中N 的体积分数保持不变
2
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒容条件下,混合气体的密度保持不变
E.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
Ⅱ.在恒温下,将8mol的H (g)和4mol的CO(g)充入2L恒容的密闭容器中发生
2
如下反应: 。下图是CO(g)和CH OH(g)的浓度
3
(5)①该燃料电池中正极通入的物质是 ,负极的电极反应式为 。
②电池工作时,OH-移向 电极(填“a”或“b”)。
③当电池放电转移10mol电子时,理论上需要通入约 L的空气(标准状
况)。
18.研究化学能与热能、电能的转化具有重要价值。回答下列问题:
第41页 共24页 ◎ 第42页 共24页(1)下列化学反应过程中的能量变化符合图示的是 (填序号)。 电池工作时导线中电子的移动方向是 (填“a→b”或“b→a”),通入H 的一极电
2
①酸碱中和反应②碳酸钙分解 ③金属钠与水反应 ④酒精燃烧 极反应式为 。
⑤灼热的碳与二氧化碳反应 ⑥ 与 反应
19.某温度下CO
2
加氢制甲醇的总反应为CO
2
(g)+3H
2
(g)⇌CH
3
OH(g)+H
2
O(g),该反
应为放热反应,在固定容积为2.0 L的密闭容器中充入0.8 mol CO 和2.4 molH ,测得
2 2
(2)汽车尾气中NO生成过程的能量变化如图所示。该反应中生成1 mol NO会 (填
CO 和CH OH的物质的量随时间变化如图。
2 3
“吸收”或“放出”) kJ能量。
请回答:
(3)下列反应能通过原电池实现化学能直接转化为电能的是 (填序号)。
(1)对于该反应,反应物的化学键断裂要吸收的能量 (填“大于”、“小于”或
① ② ③ “等于”)生成物的化学键形成要放出的能量。
(2)下列措施能加快反应速率的是_______(填序号,下同)。
(4)Mg-H O 电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如
2 2
A.往容器中充入He B.往容器充入CO
2
下。请回答下列问题:
C.扩大容器体积 D.选择高效的催化剂
(3)2 min内H 的平均反应速率为 ,2 min末时v v (填“<”“>”或
2 正 逆
“=”)。
(4)反应过程中容器内气体的平均相对分子质量的变化趋势是 (填”“增大”、
“减小”或“不变”)
①H O 发生的电极反应式为 。
2 2
(5)恒温恒容条件下,能说明反应已达平衡状态的是_______。
②工作过程中每消耗4.8g Mg,外电路转移的电子数目为 N 。
A
A.CO (g)和CH OH(g)的物质的量之和保持不变
2 3
(5)下图是氢氧燃料电池的装置图。请回答下列问题:
B.容器中气体压强保持不变
C.混合气体的密度保持不变
D.单位时间内断裂nmolH-H键同时形成nmolO-H键
第51页 共24页 ◎ 第52页 共24页(6)该反应平衡时H 的转化率为 。
2 积/ 积/ 积/ 度/
(mol/L) (mol/L)
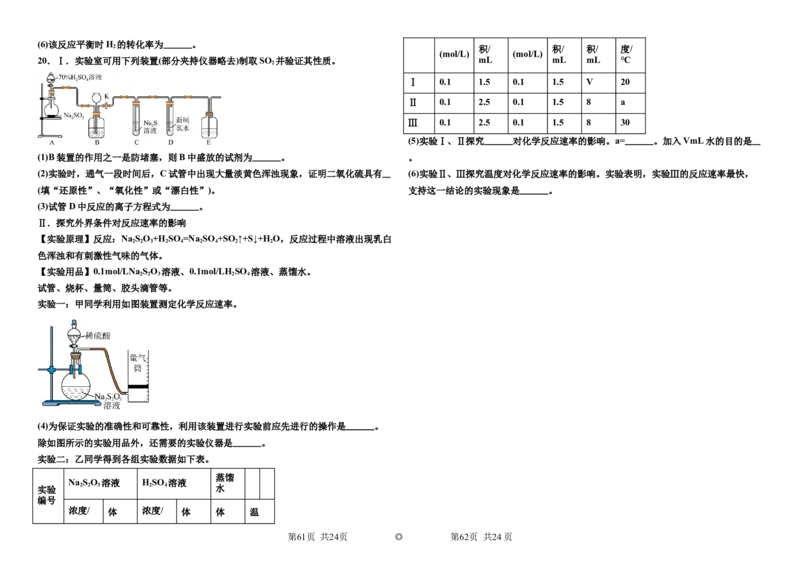
20.Ⅰ.实验室可用下列装置(部分夹持仪器略去)制取SO 并验证其性质。 mL mL mL ℃
2
Ⅰ 0.1 1.5 0.1 1.5 V 20
Ⅱ 0.1 2.5 0.1 1.5 8 a
Ⅲ 0.1 2.5 0.1 1.5 8 30
(5)实验Ⅰ、Ⅱ探究 对化学反应速率的影响。a= 。加入VmL水的目的是
(1)B装置的作用之一是防堵塞,则B中盛放的试剂为 。 。
(2)实验时,通气一段时间后,C试管中出现大量淡黄色浑浊现象,证明二氧化硫具有 (6)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,
(填“还原性”、“氧化性”或“漂白性”)。 支持这一结论的实验现象是 。
(3)试管D中反应的离子方程式为 。
Ⅱ.探究外界条件对反应速率的影响
【实验原理】反应:Na S O +H SO =Na SO +SO ↑+S↓+H O,反应过程中溶液出现乳白
2 2 3 2 4 2 4 2 2
色浑浊和有刺激性气味的气体。
【实验用品】0.1mol/LNa S O 溶液、0.1mol/LH SO 溶液、蒸馏水。
2 2 3 2 4
试管、烧杯、量筒、胶头滴管等。
实验一:甲同学利用如图装置测定化学反应速率。
(4)为保证实验的准确性和可靠性,利用该装置进行实验前应先进行的操作是 。
除如图所示的实验用品外,还需要的实验仪器是 。
实验二:乙同学得到各组实验数据如下表。
蒸馏
Na S O 溶液 H SO 溶液
实验 2 2 3 2 4 水
编号
浓度/ 体 浓度/ 体 体 温
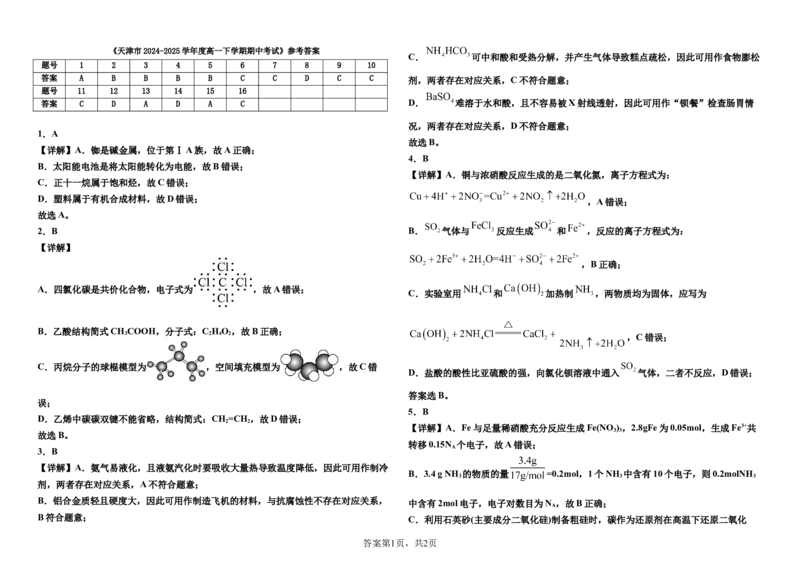
第61页 共24页 ◎ 第62页 共24页《天津市2024-2025学年度高一下学期期中考试》参考答案
C. 可中和酸和受热分解,并产生气体导致糕点疏松,因此可用作食物膨松
题号 1 2 3 4 5 6 7 8 9 10
答案 A B B B B C C D C C 剂,两者存在对应关系,C不符合题意;
题号 11 12 13 14 15 16
答案 C D A D A C D. 难溶于水和酸,且不容易被X射线透射,因此可用作“钡餐”检查肠胃情
况,两者存在对应关系,D不符合题意;
1.A
故选B。
【详解】A.铷是碱金属,位于第ⅠA族,故A正确;
4.B
B.太阳能电池是将太阳能转化为电能,故B错误;
【详解】A.铜与浓硝酸反应生成的是二氧化氮,离子方程式为:
C.正十一烷属于饱和烃,故C错误;
D.塑料属于有机合成材料,故D错误;
,A错误;
故选A。
2.B B. 气体与 反应生成 和 ,反应的离子方程式为:
【详解】
,B正确;
A.四氯化碳是共价化合物,电子式为 ,故A错误;
C.实验室用 和 加热制 ,两物质均为固体,应写为
B.乙酸结构简式CH COOH,分子式:C H O ,故B正确;
3 2 4 2 ,C错误;
C.丙烷分子的球棍模型为 ,空间填充模型为 ,故C错
D.盐酸的酸性比亚硫酸的强,向氯化钡溶液中通入 气体,二者不反应,D错误;
答案选B。
误;
5.B
D.乙烯中碳碳双键不能省略,结构简式:CH =CH ,故D错误;
2 2
【详解】A.Fe与足量稀硝酸充分反应生成Fe(NO ) ,2.8gFe为0.05mol,生成Fe3+共
3 3
故选B。
转移0.15N 个电子,故A错误;
A
3.B
【详解】A.氨气易液化,且液氨汽化时要吸收大量热导致温度降低,因此可用作制冷
B.3.4 g NH 的物质的量 =0.2mol,1个NH 中含有10个电子,则0.2molNH
3 3 3
剂,两者存在对应关系,A不符合题意;
B.铝合金质轻且硬度大,因此可用作制造飞机的材料,与抗腐蚀性不存在对应关系,
中含有2mol电子,电子对数目为N ,故B正确;
A
B符合题意; C.利用石英砂(主要成分二氧化硅)制备粗硅时,碳作为还原剂在高温下还原二氧化
答案第1页,共2页硅, 生成硅和一氧化碳,而不是CO ,故C错误;
2
色,如要用装置A验证 的漂白性,可用品红溶液,A项错误;
D.没有给出温度和压强,无法计算物质的量,故D错误;
故选B。
B. 受热分解生成 和 , 和 在试管口又可反应生成 ,
6.C
故不能用该装置制备纯净的 ,B项错误;
【详解】A. 和 的反应为吸热反应,与图甲过程中的能量变化
C.装置C没有形成闭合回路,不属于原电池装置,故不能检验电流的方向,C项错
不相符,故A错误;
误;
B.能量越低越稳定,则石墨更稳定,故B错误;
C.白磷比红磷能量高,生成物都是五氧化二磷,则等质量的白磷固体和红磷固体分别
D.利用不同的催化剂催化分解等浓度的 ,根据生成气泡的速度的快慢可判断催
完全燃烧,白磷放出的热量多,故C正确;
化剂的催化效果,D项正确;
D.图丁为吸热反应,则反应物断键吸收能量大于生成物形成新键释放的能量,故D错
答案选D。
误;
9.C
故选C。
【详解】A.甲装置中金属W不断溶解,说明W失电子生成金属阳离子,则W作负
7.C
极,故A正确;
【详解】A、向氯水中加入硝酸银溶液,有白色沉淀产生,只能说明溶液中存在氯离
B.装置乙中Y的质量增加,可知铜离子在Y极得电子生成Cu单质,电极反应为:
子,故A错误;
B、将SO 通入酸性高锰酸钾溶液,溶液紫色褪去,说明二氧化硫的还原性,而不是漂
2 ,故B正确;
白性,故B错误;
C、向FeCl 、CuCl 混合溶液加铁粉,先发生Fe与铁离子的反应生成亚铁离子,再发 C.装置丙中W上有气体产生,则W电极上发生反应: ,W作正
3 2
生Fe与氯化铜反应,则说明氧化性:Fe3+>Cu2+,故C正确;
极,Z作负极,原电池中电流由正极流向负极,即由W流向Z,故C错误;
D、向某溶液中先滴加硝酸酸化,硝酸具有强氧化性,溶液中若是亚硫酸根离子,被硝
D.原电池中负极金属比正极活泼,甲中W为负极,X为正极,则W>X;乙中X作负
酸氧化为硫酸根离子,再滴加BaCl 溶液,有白色沉淀生成,溶液中不一定含有SO 2-
2 4
极,Y作正极,则X>Y,丙中Z作负极,W作正极,则Z>W,四种金属的活动性强弱
离子,故D错误;
故选C。 顺序为 ,故D正确;
【点睛】本题考查化学实验方案的评价,涉及氯水、还原性、氧化还原反应、离子检验
故选:C。
等,侧重反应原理及物质性质的考查,为高频考点,明确物质性质是解本题关键。本题
10.C
的易错点是D,注意硝酸的氧化性。
【分析】根据已知条件,列三段式可得:
8.D
【详解】A.SO 为酸性氧化物, 溶于水后生成 ,使紫色石蕊显红色,不褪
2
答案第2页,共2页C.氢氧化钠与硝酸反应属于酸碱中和反应,故C错误;
D.环己醇与溴化氢生成溴代己烷和水,该反应中羟基被溴原子代替,属于取代反应,
。
故D正确;
故选D。
13.A
【详解】A. 的转化率为 ,A项错误; 【详解】①单位时间内生成n molO 的同时生成2n mol NO ,表示正逆反应速率相等,
2 2
正确;
②速率之比和系数成正比;该反应在任何状态时,NO 、NO、O 的反应速率之比都是
2 2
B. 的平均反应速率 ,B项错误;
2:2:1,不能判断平衡是否到达平衡状态,错误;
③二氧化氮有颜色,当达平衡时二氧化氮的浓度不变,则混合气体的颜色不再变化,反
C. ,C项正确; 应达到平衡状态,正确;
④该容器的体积不变,混合气体的质量不变,所以气体的密度始终不变,不能判断平衡
是否到达平衡状态,错误;
D.根据三段式可知,平衡时 的物质的量为 ,D项错误;
⑤该反应是反应前后气体的物质的量发生改变的可逆反应,气体的总质量不变,所以气
答案选C。
体的平均相对分子质量在变化,当平均相对分子质量不变时,说明已达平衡状态,正
11.C
确;
【分析】化学式相同而结构不同的两种物质互称同分异构体。
答案选A。
【详解】A.二者是同种元素组成的不同种物质,二者互为同素异形体,A不符合题
14.D
意;
【详解】A.图示转化中硫元素化合价均发生了改变,均为氧化还原反应,故A正确;
B.二者质子数相同而中子数不同,二者互为同位素,B不符合题意;
C.二者的结构不同,分子式相同,互为同分异构体,C符合题意;
B.反应③为 ,其中硫元素化合价由-2价升高至+4价,
D.二者结构相似,分子组成相差1个CH ,互为同系物,D不符合题意;
2
答案选C。
每消耗 ,转移 ,故B正确;
【点睛】运用“四同”概念进行物质判断时,常出现概念混淆的情况。因此要注意用对
比的方法来区分“四同”。同位素指的是同种元素的不同原子;同素异形体指的是同种
C.反应⑥若为 ,可解释硫酸型酸雨形成过程,故C正
元素形成的不同单质;同分异构体指的是分子式相同、结构不同的化合物;同一物质指
确;
的是分子构成和结构都相同的物质。
12.D
D.浓硫酸能干燥SO ,但会与 发生氧化还原反应,不能干燥 ,故D错误;
2
【详解】A.辛烷高温条件下生成丁烷和丁烯,该反应属于裂解反应,故A错误;
答案选D。
B.丙烷燃烧属于氧化反应,故B错误;
答案第3页,共2页15.A
,故B错误;
【详解】将一定质量的铜溶于 的浓硝酸中,铜和硝酸反应生成
C.④中二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵,白烟含有
、 、 和 ,待铜完全溶解后,生成标况下 和
,故C正确;
的混合气体(即0.4mol),并测得溶液中 的浓度为 ,说明反应剩余硝酸的物 D.⑤中二氧化氮和水反应生成硝酸,铜和硝酸反应生成硝酸铜、一氧化氮、水,所以
铜粉溶解,溶液颜色变为蓝色,故D错误;
质的量为 ,根据 元素守恒,反应生成硝酸铜的物质的量为 选C。
17.(1)BDE
(2)0.4
,设生成的 为 ,生成的
(3)>
(4)0.5
为 ,则 ,根据得失电子守恒可得: ,联立 (5) 空气 a 280
【详解】(1)A.由反应方程式知当 时反应达到平衡,故A不
两式解得 , ,则气体产物中的 在标准状况下的体积是
符合题意;
,故选A。
B.混合气体中的体积分数保持不变时,说明消耗的氮气和生成的氮气相等,反应达到
平衡状态,故B符合题意;
16.C
C.由方程式知单位时间内断裂1个N≡N同时生成2个C=O,说明正逆反应速率相
【详解】①制备氧气、②制备氨气、③中氨气发生催化氧化生成NO、④中NO和氧气
等,反应达到平衡,故C不符合题意;
反应生成NO ,⑤NO 二氧化氮和水反应生成硝酸,铜和硝酸反应生成硝酸铜、一氧化
2 2
D.由方程式知,反应有固体参加,恒温、恒容条件下,混合气体的密度保持不变时,
氮、水。
混合气体的质量不再变化,说明反应达到平衡,故D符合题意;
A. 加热分解为氨气和氯化氢,氨气和氯化氢在试管口化合生成 ,②中
E.由方程式知,反应前后气体的总物质的量不变,当混合气体的平均摩尔质量保持不
变时,说明气体的总质量不再变化,反应达到了平衡,故E符合题意;
只放 不能制备 ,故A错误;
故答案为:BDE;
B.③中气体颜色无明显变化,说明③中生成NO,反应方程式为是
(2)0-5min内, ,由速率之比等于系数
答案第4页,共2页比,H (g)的平均反应速率是 ; 钙的分解、⑤灼热的碳与二氧化碳反应、⑥ 与 反应都是吸热
2
(3)5min后CO的浓度仍在减小,说明反应向正反应方向进行,5min时,v >v ; 反应,故选②⑤⑥;
正 逆
(4)起始气体的总物质的量为n=8+4=12mol,由图可知,平衡时n(CH OH)=1.5mol/ (2)由能量变化可知,1mol N 和1mol O 反应生成2mol NO,断键需要吸收的总能量
3 2 2
L×2L=3mol,n(CO)=0.5mol/L×2L=1mol,消耗6molH ,平衡时n(H )=8-6=2mol,平衡
2 2
为 ,成键释放出的总能量为
时气体的总物质的量为n =3+1+2=6mol,恒温恒容下,物质的量与压强成正比,则
0
,故生成1mol NO会吸收 的能
量;
的值为 ;
(3)原电池发生的是氧化还原反应,其中反应①②涉及元素化合价变化,为氧化还原
(5)①肼—空气燃料电池中肼中氮元素为-2价升高到氮气中的0价,发生氧化反应, 反应;
(4)①依题可知Mg为负极,H O 通入正极发生还原反应,海水呈弱碱性,故电极反
2 2
所以通入肼的一极为负极,电极反应式为 ,通入空
应式为H O +2e- =2OH-;
2 2
气的一极为正极; ②根据得失电子情况,存在如下计量关系:Mg~2e-,故当消耗4.8g Mg时,转移的电子
②根据①分析a极为负极,b极为正极,对于原电池来说,阴离子移向负极,所以电池
工作时,OH-移向a电极;
数为 ;
③正极的电极反应式为O +2H O+4e-=4OH-,当电池放电转移10mol电子时,消耗
2 2
(5)对于氢氧燃料电池,H 通入负极,故a为负极,b为正极;原电池外电路的电子
2
由负极经导线流向正极,即a→b;H 在负极发生氧化反应,电极反应为H -2e- +2OH-
2.5mol氧气,标准状况氧气的体积为2.5mol×22.4L/mol=56L,氧气约占空气体积的 2 2
= 2H O。
2
,理论上需要通入约56L×5=280L空气。 19.(1)小于
18.(1)②⑤⑥ (2)BD
(2) 吸收 90 (3) 0.3 mol/(L·min) >
(3)①② (4)增大
(4) H O +2e- =2OH- 0.4 (5)BD
2 2
(5) a→b H -2e- +2OH-= 2H O (6)75%
2 2
【详解】(1)由图可知,反应物的总能量低于生成物的总能量,反应吸热;而②碳酸 【详解】(1)反应物断键吸收的能量小于生成物形成键放出的能量时反应为放热,答
案为小于;
答案第5页,共2页(2)A.容器中充入He不改变反应体系各物质的浓度反应速率不变,A错误; (2)氧化性
B.充入CO ,反应物浓度增大速率加快,B正确;
2 (3)Cl +SO +2H O=4H++2Cl-+
2 2 2
C.增大容器体积,反应体系各物质浓度减小反应速率减慢,C错误;
(4) 检查装置的气密性 计时器(或秒表)
D.催化剂能加快反应速率,D正确;
(5) Na S O 溶液浓度 20 控制硫酸的起始浓度相同
故选BD; 2 2 3
(6)实验III观察到出现浑浊的时间更短
(3)从图看CH OH物质的量由0增加到0.4mol即 ,v(CH OH)=
3 3
【分析】装置A中,Na SO 固体与70%的H SO 溶液反应,制取SO 气体;装置B可
2 3 2 4 2
用于储存少量的SO 气体,或作安全瓶即B装置的作用之一是防堵塞;装置C用于检
2
验SO 的氧化性,装置D用于检验SO 的还原性,装置E用于处理尾气。
;v(H )=3v(CH OH)= 0.3 mol/(L·min);由图可 2 2
2 3
【详解】(1)由分析可知,装置B可用于储存少量的SO 气体,或作安全瓶即B装置
2
知,2 min末时甲醇在增加,二氧化碳在减小,则此时反应正向进行,故v > v ; 的作用之一是防堵塞,则B中盛放的试剂不能溶解二氧化硫,其中试剂为饱和亚硫酸氢
正 逆
(4)该反应过程中,气体总质量不变,气体总分子数减小,则反应过程中容器内气体 钠(NaHSO )溶液;
3
(2)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,说明SO 与
2
Na S反应生成S等,从而证明二氧化硫具有氧化性;
的平均相对分子质量= ,则其变化趋势是增大; 2
(3)试管D中二氧化硫和氯气反应生成盐酸和硫酸,离子方程式为:Cl +SO +
2 2
(5)A.根据碳守恒可知,反应过程中,CO (g)和CH OH(g)的物质的量之和保持不
2 3
2H O=4H++2Cl-+ ;
2
变,则当其不变时,不能证明反应达到平衡,A错误;
B.随着反应进行,体系中气体减少,恒容下压强降低,平衡时压强不变可判断平衡, (4)气体制备或性质探究实验,本实验是探究化学反应速率的影响因素,需保证气密
B正确; 性良好,否则会影响实验结果,故实验前需要检验装置的气密性。反应速率的计算公式
C.气体质量守恒,恒容所以反应中密度一直不发变化,密度不变无法判断平衡,C错
误;
v= ,测反应速率是在一定时间段内,故还需要秒表,故答案为:检查装置的气密
D.该反应中,氢气是反应物,甲醇和水是产物,则单位时间内断裂nmolH-H键同时
形成nmolO-H键,说明正、逆反应速率相等,反应平衡,D正确; 性;计时器(或秒表);
故选BD; (5)实验Ⅰ、Ⅱ硫酸用量不变,Na S O 溶液用量不同,则实验Ⅰ、Ⅱ探究Na S O 溶
2 2 3 2 2 3
(6)在反应开始时n(CO )=0.8 mol,反应达到平衡时n(CO )=0.2 mol,则该反应平衡 液浓度对化学反应速率的影响;实验I、II硫酸用量不变,所以控制总体积不变,加入
2 2
VmL水的目的是保证硫酸浓度不变,另外还需要控制温度不变,则a=20;故答案为:
Na S O 溶液的浓度;20;控制硫酸的起始浓度相同;
时CO 的转化率 =75%。 2 2 3
2
(6)探究实验II、III改变的是温度条件,其他条件不变时,升高反应温度,化学反应
20.(1)饱和亚硫酸氢钠(NaHSO )溶液 速率增大,因为反应中有S沉淀生成,故可以测定溶液变浑浊的快慢,故答案为:实验
3
答案第6页,共2页III观察到出现浑浊的时间更短。
答案第7页,共2页