文档内容
高一化学必修第一册同步单元AB卷(新教材人教版)
高一化学上学期期中模拟卷(二)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Mn 55
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 分类是科学研究的重要方法,下列物质分类不正确的是
选项 类别 物质
A 化合物 干冰、冰水混合物、烧碱
B 同素异形体 活性炭、C 、金刚石
60
C 非电解质 乙醇、四氯化碳、氯气
D 混合物 漂白粉、纯净矿泉水、盐酸
2. 下列关于胶体的说法中,正确的是
①蔗糖溶液、淀粉溶液属于溶液,烟、雾属于胶体
②溶液和胶体的本质区别是后者具有丁达尔效应,而前者无此现象
③制备Fe(OH) 胶体的方法是将饱和FeCl 溶液滴加到沸水中煮沸至溶液呈红褐色
3 3
④利用过滤的方法能将Fe(OH) 胶体从FeCl 溶液中分离出来
3 3
⑤由肾功能衰竭等疾病引起的血液中毒,可利用“血液透析”进行治疗
⑥葡萄糖注射液能产生丁达尔效应,属于胶体
⑦溶液是电中性的,胶体是带电的
⑧清晨,在茂密的树林中,常常可以看到从树叶间透过的一道道光柱,与胶体的性质有关
A.①②⑤ B.③⑤⑧
C.③⑤⑦⑧ D.②③⑧
3. 下列物质的用途或者制备中所涉及的离子方程式书写正确的是
选项 用途或者制备 离子方程式
A 用稀硫酸清洗铁锈
B 实验室用大理石与稀盐酸反应制备二氧化碳
C 用氢氧化钠溶液吸收氯气D 用氯化铁溶液刻蚀铜板
4. 某溶液中含有较大量的Cl-、CO、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离
子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO) 溶液;②过滤;③滴加AgNO 溶液;④滴加Ba(NO ) 溶液。
3 2 3 3 2
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
5. 某溶液遇石蕊溶液显红色,下列各组离子能在该溶液中大量共存的是
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
6. 有一包白色粉末,由BaCl 、KSO 、CaCO 、NaOH、CuSO 中的一种或几种组成,为了探究它的
2 2 4 3 4
成分,进行了如下实验。下列判断正确的是
A.BaCl 、CaCO 一定存在,NaOH可能存在
2 3
B.KSO 、CaSO 一定不存在
2 4 4
C.KSO 、NaOH、CaCO 、BaCl 一定存在,CuSO 可能存在
2 4 3 2 4
D.C为单一溶质溶液
7. 下列氧化还原反应中,水作为还原剂的是
A.3Fe+4HO=====Fe O+4H B.3NO +HO ===2HNO+ NO
2 3 4 2 2 2 3
C.2NaO+2HO===4NaOH+O↑ D.2F+2HO === 4HF+O
2 2 2 2 2 2 2
8. 实验室常用NaNO 和NH Cl反应制取N。下列有关说法正确的是
2 4 2
A.NaNO 是还原剂
2
B.NH Cl中N元素被还原
4
C.生成1 mol N 时转移6 mol电子
2
D.氧化剂和还原剂的物质的量之比是1∶19. 已知反应:
①Cl+2KBr===2KCl+Br ,
2 2
②KClO+6HCl===3Cl↑+KCl+3HO,
3 2 2
③2KBrO +Cl===Br +2KClO。
3 2 2 3
下列说法正确的是
A.氧化性由强到弱的顺序为KBrO >KClO>Cl>Br
3 3 2 2
B.①中KCl是氧化产物,KBr发生还原反应
C.③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
D.反应②中氧化剂与还原剂的物质的量之比为1∶6
10. 下列叙述正确的是
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O===NaO
2 2 2
B.一定条件下,2.3 g的Na完全与O 反应生成3.6 g产物,失去的电子数为0.2N
2 A
C.钠在空气中受热时,熔化为银白色的小球,产生黄色的火焰,生成白色粉末
D.钠在空气中长期放置,最终主要生成物为碳酸钠
11. 纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的
是
A.分别用砂锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.放入水中,能溶于水的为小苏打
C.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应, 前者产生二氧化碳少
D.先将两样品配成溶液,再分别加入石灰水,无白色沉淀生成的是小苏打
12. 两份体积相同、浓度未知的NaCO 和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强
2 3
下的体积之比为1∶3,则NaCO 和HCl溶液的浓度之比为
2 3
A. 5∶6 B. 2∶5 C. 3∶4 D. 5∶3
13. 有关Cl 的性质,下列说法不正确的是
2
A.Cl 有毒但可用于自来水消毒
2
B.能与Ca(OH) 溶液反应生成两种正盐
2
C.能与Fe反应生成FeCl
2
D.H 在Cl 中燃烧产生苍白色火焰,且集气瓶口有白雾
2 2
14. 在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl
2
B.向氯水中滴加硝酸酸化的AgNO 溶液,产生白色沉淀,说明氯水中含有Cl-
3
C.向氯水中加入NaHCO 粉末,有气泡产生,说明氯水中含有H+
3
D.向FeCl 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
2
15. 下列关于实验室制取氯气的说法正确的是
A.盛浓盐酸的分液漏斗可用长颈漏斗代替B.为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验
C.可用饱和食盐水吸收尾气
D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满
16. 下列说法不正确的是
A.温度相同、体积相同的O(g)和N(g)所含的分子数一定相同
2 2
B.等温等压下,SO 气体与CO 气体的密度之比等于16∶11
2 2
C.温度和容积相同的两容器中分别盛有5 mol O 和2 mol N ,则压强之比为5∶2
2 2
D.等温等压条件下,5 mol O (g)和2 mol H (g)的体积之比等于5∶2
2 2
17. 高温下用CO还原m g R O 得n g R,已知氧的相对原子质量为16,则R的相对原子质量为
2 3
A. B.
C. D.
18. 将15 mL 2 mol·L−1 Na CO 溶液逐滴加入到 40 mL 0.5 mol·L−1 MCl 盐溶液中,恰好将溶液中的
2 3 n
Mn+完全沉淀为碳酸盐,则MCl 中n值是
n
A.4 B.3 C.2 D.1
19. 用N 表示阿伏加德罗常数的值,下列叙述不正确的是
A
A.常温常压下,1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1N
A
B.0.1 mol HO中含有电子的数目为N
2 A
C.0.5 mol·L-1 CaCl 溶液中的Cl-的数目为N
2 A
D.标准状况下,11.2 L甲烷中含有分子的数目为0.5N
A
20. V mL Al (SO ) 溶液中含Al3+a g,取 mL溶液稀释到4V mL,则稀释后溶 的物质的量浓度是
2 4 3
A. mol·L−1 B. mol·L−1 C. mol·L−1 D. mol·L−1
二、非选择题:本题共5个题,共60分。
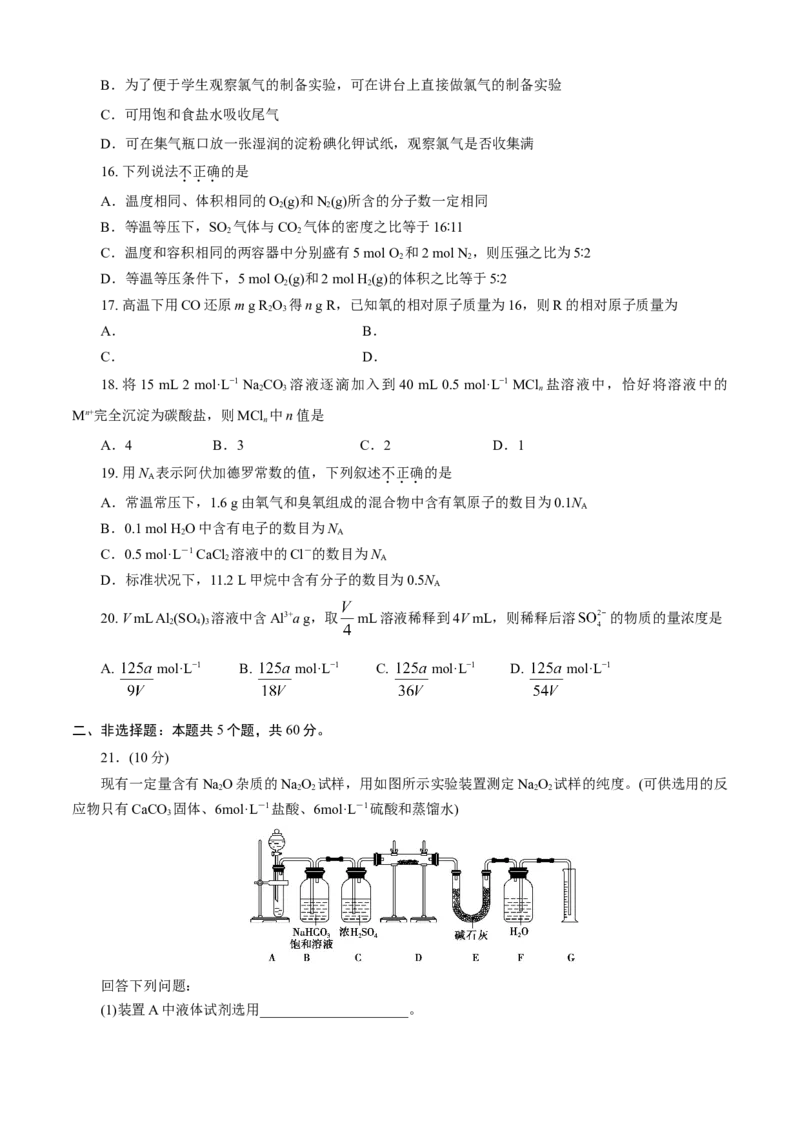
21.(10分)
现有一定量含有NaO杂质的NaO 试样,用如图所示实验装置测定NaO 试样的纯度。(可供选用的反
2 2 2 2 2
应物只有CaCO 固体、6mol·L-1盐酸、6mol·L-1硫酸和蒸馏水)
3
回答下列问题:
(1)装置A中液体试剂选用_____________________。(2)装置B的作用是_________________________,装置E中碱石灰的作用是___________________
__________________________________________________________________。
(3)装置D中发生反应的化学方程式为_________________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则NaO 试样的
2 2
纯度为_________。
22. (10分)
Ⅰ. 某反应为:4CuI + Hg === Cu HgI + 2Cu (反应前后的I均为-1价),试回答:
2 4
(1)上述反应产物Cu HgI 中,Hg元素显 价;
2 4
(2)CuI发生 反应(填氧化或还原)。
Ⅱ. 某反应为:3HO+Cr (SO ) +10KOH===2KCrO + 3K SO + 8H O,用单线桥表示出该反应中电子
2 2 2 4 3 2 4 2 4 2
转移的方向和数目: 。
Ⅲ. 有下列三个反应:
a. 2FeCl + 2KI===2FeCl + 2KCl + I
3 2 2
b. 2FeCl + Cl ===2FeCl
2 2 3
c. 2KMnO + 16HCl(浓)===2KCl + 2MnCl + 5Cl ↑+ 8H O
4 2 2 2
(1)上述三个反应中氧化剂氧化性强弱关系为 ;
(2) 在 反 应 c 中 , 若 被 氧 化 的 HCl 为 1.5mol, 则 转 移 的 电 子 数
是 个。
23. (14分)
实验室需要0.1 mol·L-1 NaOH溶液450 mL和 0.5 mol·L-1硫酸溶液450 mL。根据这两种溶液的配制
情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填字母)。仪器C的名称是________,本实验
所需玻璃仪器E的规格和名称是________。
(2)下列操作中,容量瓶所不具备的功能有__________(填字母)。
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取220 mL体积的液体
(3)在配制 NaOH 溶液的实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度
________(填“大于”“等于”或“小于”,下同)0.1 mol·L-1。若NaOH溶液未冷却即转移至容量瓶定容,
则所配制溶液浓度________0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果
保留一位小数)。如果实验室有10 mL、25 mL、50 mL量筒,应选用________mL规格的量筒最好。(5)如果定容时不小心超过刻度线,应如何操作:______________________________。
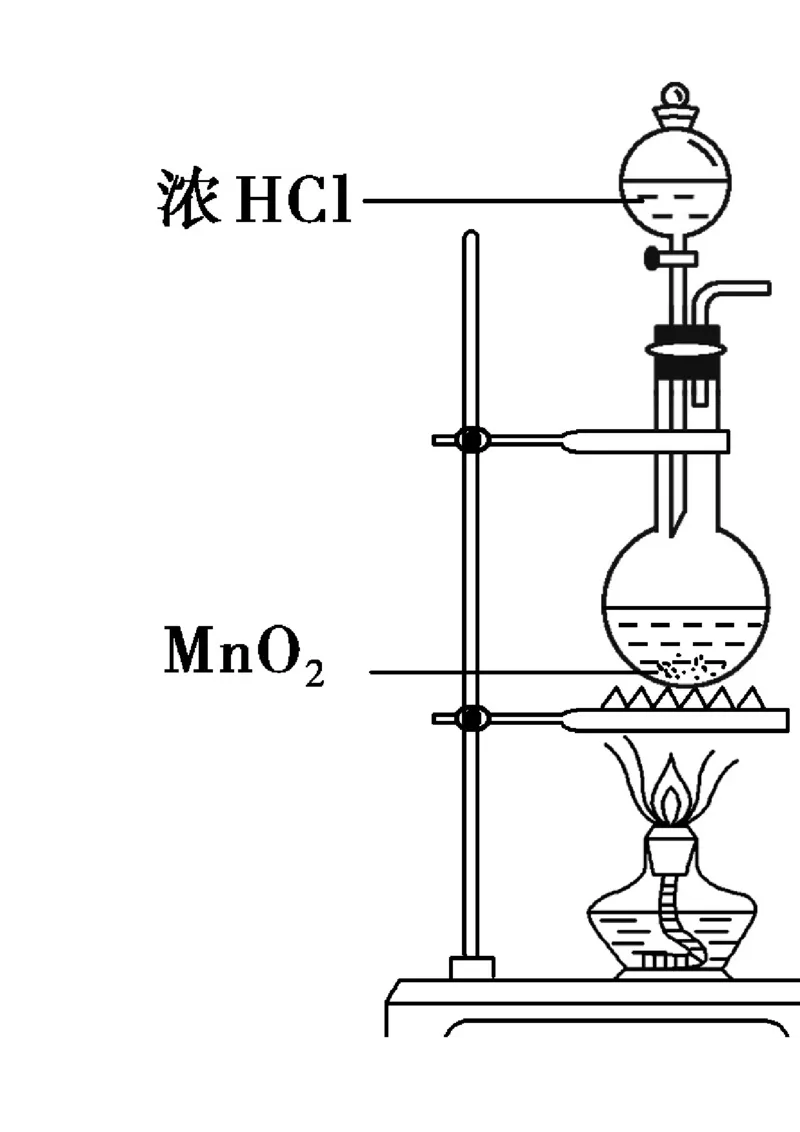
24. (16分)
某研究小组制备氯气并对产生氯气的条件进行探究。(1)装置A中用MnO 与浓盐酸反应制取Cl ,利用了浓HCl的___________(填“氧化性”或“还原
2 2
性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl,请完善装置B并用箭头标明进出气体方向。
2
(4)C用于吸收多余的Cl,C中发生反应的离子方程式是______________________________________。
2
(5)该小组欲研究盐酸的浓度对制Cl 的影响,设计实验进行如下探究。
2
实验 操作 现象
Ⅰ 常温下将MnO 和12 mol·L-1浓盐酸混合 溶液呈浅棕色,略有刺激性气味
2
Ⅱ 将Ⅰ中混合物过滤,加热滤液 生成大量黄绿色气体
Ⅲ 加热MnO 和4 mol·L-1稀盐酸混合物 无明显现象
2
①已知MnO 呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO 与浓盐酸发生了复分解反应,化学方程式是
2 2
___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是_
___________________________________________。
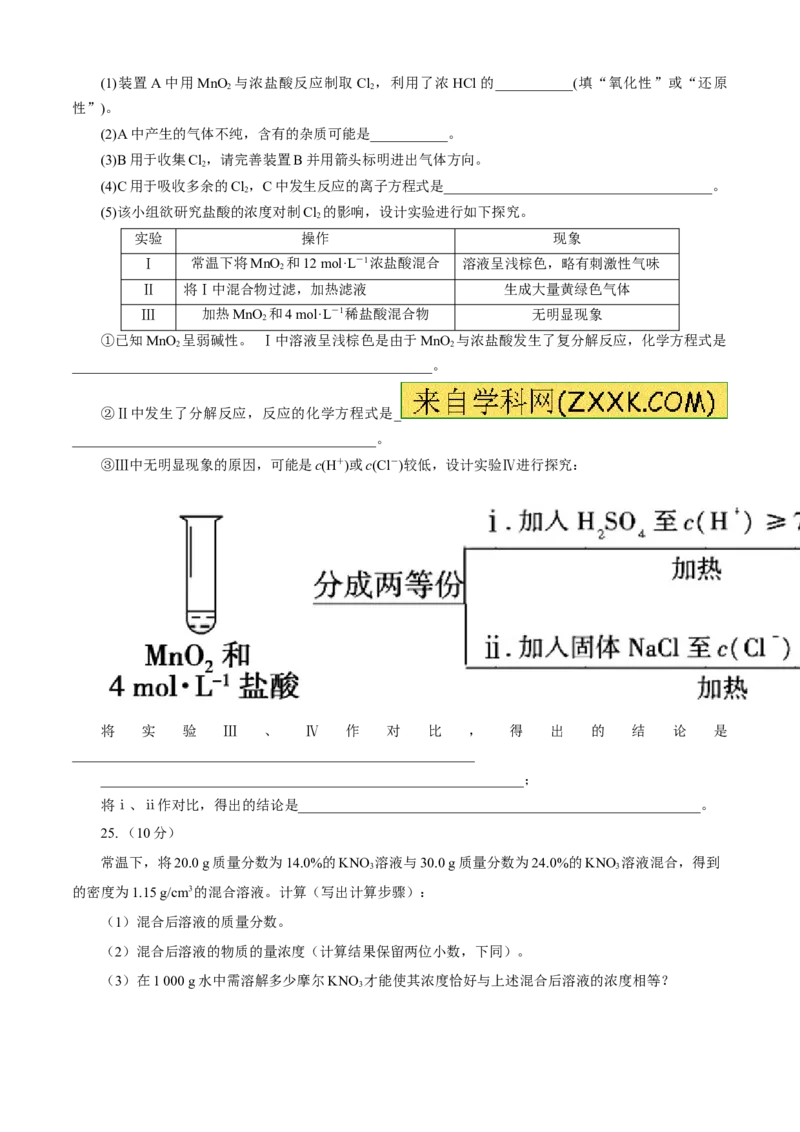
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
将 实 验 Ⅲ 、 Ⅳ 作 对 比 , 得 出 的 结 论 是
_________________________________________________________
____________________________________________________________;
将ⅰ、ⅱ作对比,得出的结论是_________________________________________________________。
25. (10分)
常温下,将20.0 g质量分数为14.0%的KNO 溶液与30.0 g质量分数为24.0%的KNO 溶液混合,得到
3 3
的密度为1.15 g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度(计算结果保留两位小数,下同)。
(3)在1 000 g水中需溶解多少摩尔KNO 才能使其浓度恰好与上述混合后溶液的浓度相等?
3