文档内容
高一化学下学期期中专项复习
综合检测卷 02
一.选择题(每小题3分,共48分,每题只有一个正确选项)
1.硅的化合物在材料领域中应用广泛。下列叙述错误的是
A.二氧化硅是制造光导纤维的材料
B.二氧化硅属于酸性氧化物,不能与任何酸反应
C.装碱性溶液的玻璃试剂瓶不能用玻璃塞
D.硅酸钠是制备木材防火剂的原料
2.下列说法中正确的是
A.不锈钢属于化合物
B.浓硫酸可以用铁罐运输,是因为铁不与浓硫酸反应
C. 能使氯水褪色,是因为 具有漂白性
D.浓硝酸用棕色瓶盛装,是因为硝酸见光易分解
3.下列有关浓硫酸的叙述正确的是
A.浓HSO 具有吸水性,能够使蔗糖等有机化合物发生炭化
2 4
B.浓HSO 与亚硫酸钠反应制取SO 时,浓HSO 表现出强氧化性
2 4 2 2 4
C.浓HSO 和铜片加热反应时,浓硫酸既能表现酸性,又表现出强氧化性
2 4
D.常温下,浓HSO 与铁、铝不反应,所以可用铁、铝质容器盛放浓HSO
2 4 2 4
4.溶液中常见离子的检验及结论正确的是
A.若加入淀粉溶液,溶液显蓝色,则一定有Iˉ
B.若加入AgNO 溶液有白色沉淀产生,则一定有Clˉ
3
C.若加入Ba(NO ) 溶液,有白色沉淀产生,则一定有SO
3 2
D.若加入NaOH溶液,微热,产生使润湿红色石蕊试纸变蓝的气体,则一定有NH
5.下列有关的说法正确的是
A.已知CO 能与HO反应生成HCO,则SO 能与HO反应也生成HSO
2 2 2 3 2 2 2 3
B.已知CO 通入Ba(NO ) 溶液中无沉淀生成,则SO 通入Ba(NO ) 溶液中也无沉淀生成
2 3 2 2 3 2
C.已知BaCO 能溶于盐酸,溶液变澄清,则BaCO 也能溶于硫酸,溶液变澄清
3 3
D.已知NaO 与CO 反应为: ,则NaO 与SO 反应也为:
2 2 2 2 2 2
6.Cl 和SO 的水溶液均具有漂白性,但是将二者等物质的量混合通入水中,所得溶液不具有漂白性,下
2 2
列说法错误的是
A.干燥的Cl 无漂白性
2
B.SO 漂白过的品红溶液加热时能恢复原色
2C.混合后所得溶液的酸性强于混合前
D.SO 有毒,不能用作食品添加剂
2
7.有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,外电路电流从b流向a;将
a、d分别投入等浓度盐酸中,d比a反应剧烈;将铜浸入b的盐溶液中,无明显变化;将铜浸入c的盐溶液
中,有金属c析出。据此判断它们金属活动性顺序是
A.d>c>a>b B.d>a>b>c C.d>b>a>c D.b>a>d>c
8.下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断正确的是
选项 陈述I 陈述II 判断
待测液先滴入足量氯水后滴入几滴KSCN,溶液变为血红 I对; II
A KSCN溶液可检验Fe3+
色,证明待测液含Fe2+ 对;无
I对; II
B SO 具有还原性 SO 通入溴水中,溴水褪色
2 2
对;有
NO 和溴蒸气都呈红棕 I对; II
2
C 用水可鉴别NO 和溴蒸气
2
色 错;无
反应物比例不同可导致 I对; II
D Na与O 反应可能生成NaO,也可能生成NaO
2 2 2 2
产物不同 对;有
9.下列有关化学反应速率的说法,正确的是
A.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
B.100mL 的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应减慢
D.汽车尾气中的 和 可以缓慢反应生成 和 ,减小压强,反应速率减小
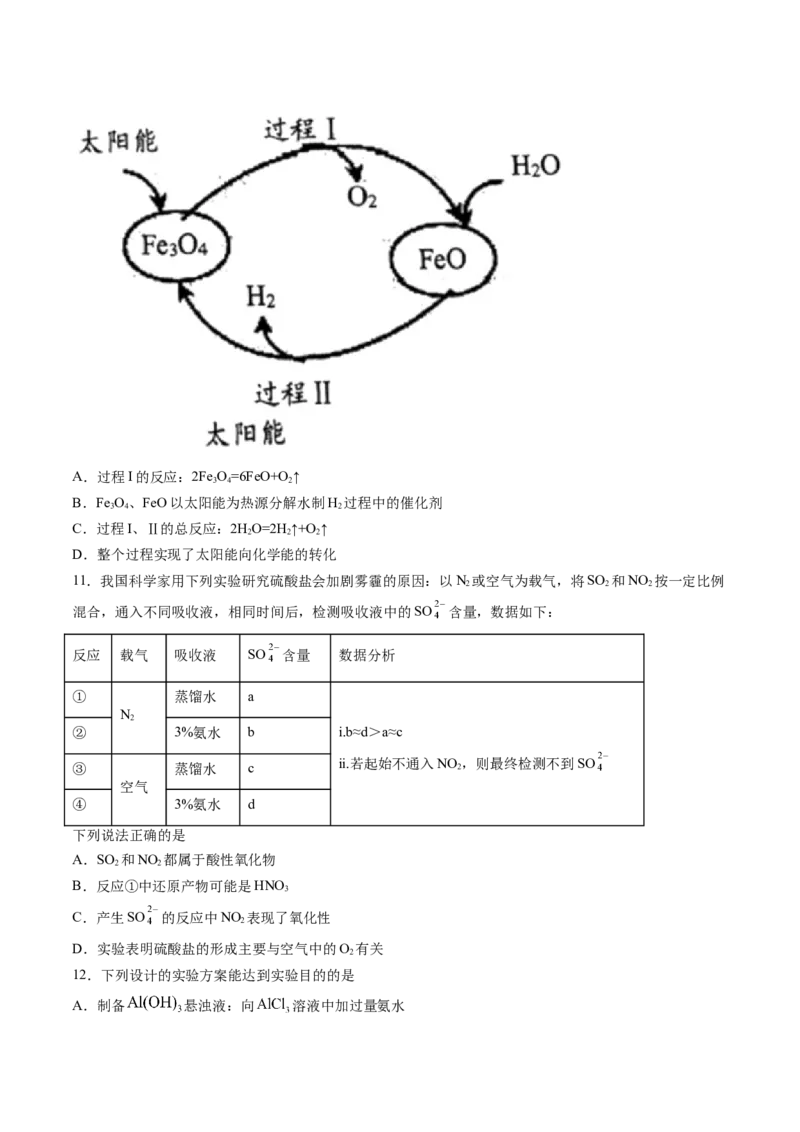
10.纳米级Fe O 可用于以太阳能为热源分解水制H,过程如图所示。下列说法中,不正确的是
3 4 2A.过程I的反应:2Fe O=6FeO+O ↑
3 4 2
B.Fe O、FeO以太阳能为热源分解水制H 过程中的催化剂
3 4 2
C.过程I、Ⅱ的总反应:2HO=2H↑+O ↑
2 2 2
D.整个过程实现了太阳能向化学能的转化
11.我国科学家用下列实验研究硫酸盐会加剧雾霾的原因:以N 或空气为载气,将SO 和NO 按一定比例
2 2 2
混合,通入不同吸收液,相同时间后,检测吸收液中的SO 含量,数据如下:
反应 载气 吸收液 SO 含量 数据分析
① 蒸馏水 a
N
2
② 3%氨水 b ⅰ.b≈d>a≈c
ⅱ.若起始不通入NO ,则最终检测不到SO
③ 蒸馏水 c 2
空气
④ 3%氨水 d
下列说法正确的是
A.SO 和NO 都属于酸性氧化物
2 2
B.反应①中还原产物可能是HNO
3
C.产生SO 的反应中NO 表现了氧化性
2
D.实验表明硫酸盐的形成主要与空气中的O 有关
2
12.下列设计的实验方案能达到实验目的的是
A.制备 悬浊液:向 溶液中加过量氨水B.制备 胶体:向饱和 溶液中滴加过量 溶液
C.验证 是否具有氧化性:向 溶液中滴加酸性 溶液,观察紫红色是否褪去
D.验证反应 是否可逆:向 溶液中加入
溶液,充分振荡,再滴加 溶液,观察溶液是否变红
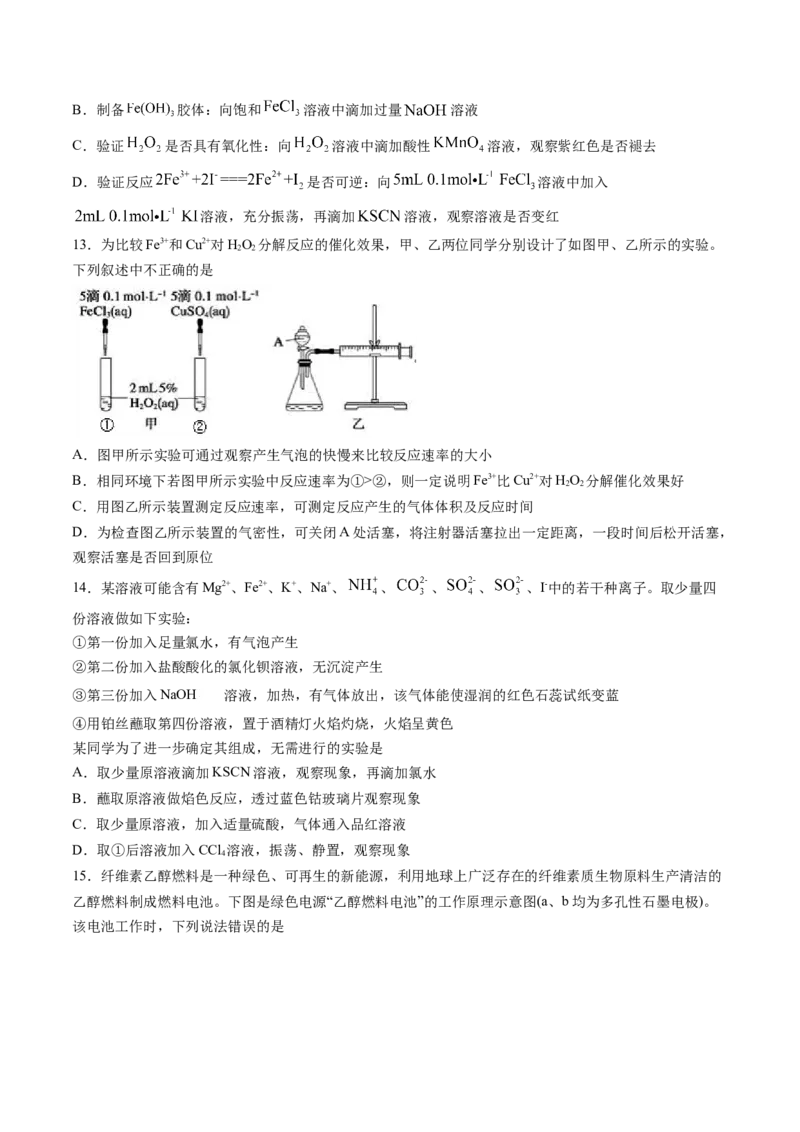
13.为比较Fe3+和Cu2+对HO 分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。
2 2
下列叙述中不正确的是
A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.相同环境下若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对HO 分解催化效果好
2 2
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,
观察活塞是否回到原位
14.某溶液可能含有Mg2+、Fe2+、K+、Na+、 、 、 、 、I-中的若干种离子。取少量四
份溶液做如下实验:
①第一份加入足量氯水,有气泡产生
②第二份加入盐酸酸化的氯化钡溶液,无沉淀产生
③第三份加入NaOH 溶液,加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝
④用铂丝蘸取第四份溶液,置于酒精灯火焰灼烧,火焰呈黄色
某同学为了进一步确定其组成,无需进行的实验是
A.取少量原溶液滴加KSCN溶液,观察现象,再滴加氯水
B.蘸取原溶液做焰色反应,透过蓝色钴玻璃片观察现象
C.取少量原溶液,加入适量硫酸,气体通入品红溶液
D.取①后溶液加入CCl 溶液,振荡、静置,观察现象
4
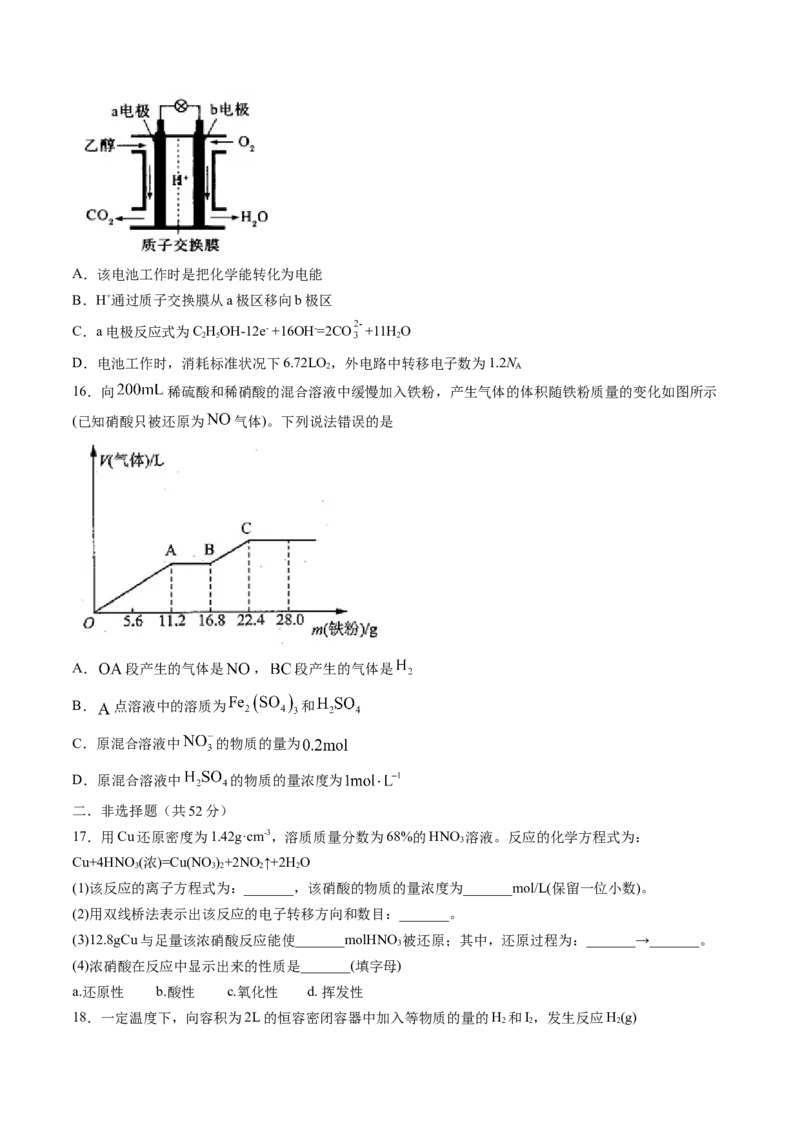
15.纤维素乙醇燃料是一种绿色、可再生的新能源,利用地球上广泛存在的纤维素质生物原料生产清洁的
乙醇燃料制成燃料电池。下图是绿色电源“乙醇燃料电池”的工作原理示意图(a、b均为多孔性石墨电极)。
该电池工作时,下列说法错误的是A.该电池工作时是把化学能转化为电能
B.H+通过质子交换膜从a极区移向b极区
C.a电极反应式为C HOH-12e- +16OH-=2CO +11H O
2 5 2
D.电池工作时,消耗标准状况下6.72LO ,外电路中转移电子数为1.2N
2 A
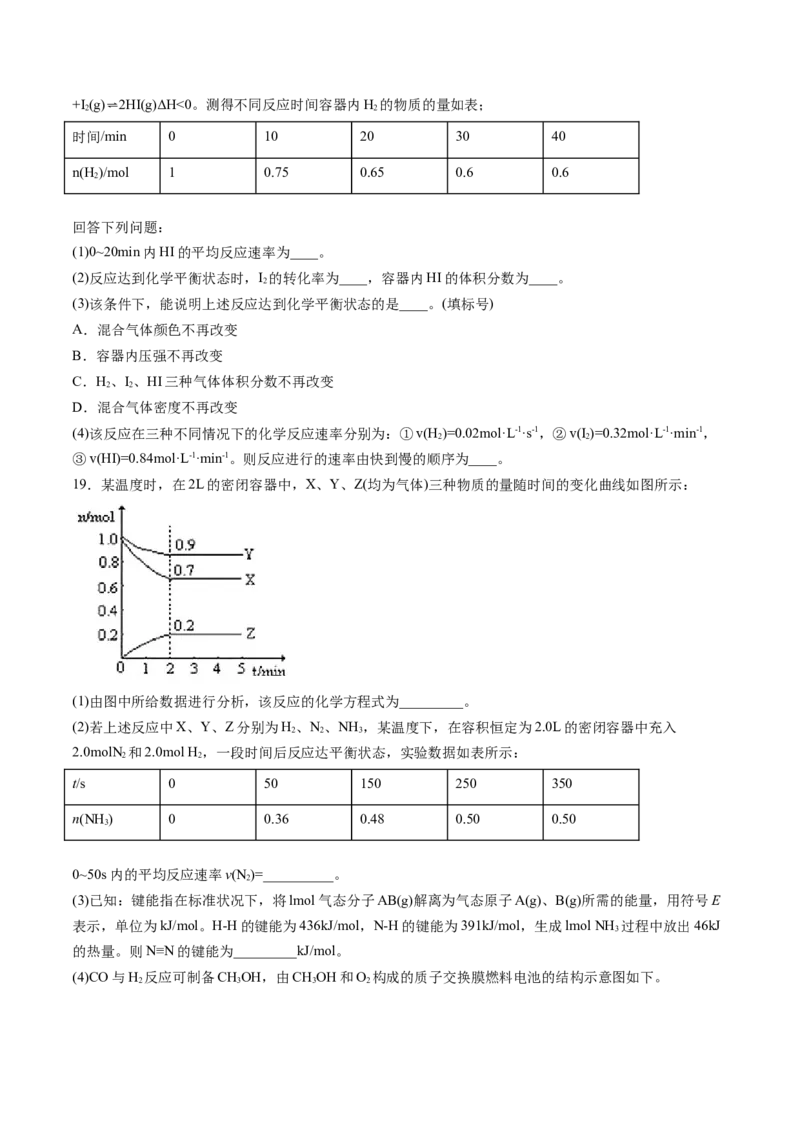
16.向 稀硫酸和稀硝酸的混合溶液中缓慢加入铁粉,产生气体的体积随铁粉质量的变化如图所示
(已知硝酸只被还原为 气体)。下列说法错误的是
A. 段产生的气体是 , 段产生的气体是
B. 点溶液中的溶质为 和
C.原混合溶液中 的物质的量为
D.原混合溶液中 的物质的量浓度为
二.非选择题(共52分)
17.用Cu还原密度为1.42g·cm-3,溶质质量分数为68%的HNO 溶液。反应的化学方程式为:
3
Cu+4HNO (浓)=Cu(NO)+2NO↑+2H O
3 3 2 2 2
(1)该反应的离子方程式为:_______,该硝酸的物质的量浓度为_______mol/L(保留一位小数)。
(2)用双线桥法表示出该反应的电子转移方向和数目:_______。
(3)12.8gCu与足量该浓硝酸反应能使_______molHNO 被还原;其中,还原过程为:_______→_______。
3
(4)浓硝酸在反应中显示出来的性质是_______(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
18.一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的H 和I,发生反应H(g)
2 2 2+I
2
(g)⇌2HI(g)ΔH<0。测得不同反应时间容器内H
2
的物质的量如表;
时间/min 0 10 20 30 40
n(H )/mol 1 0.75 0.65 0.6 0.6
2
回答下列问题:
(1)0~20min内HI的平均反应速率为____。
(2)反应达到化学平衡状态时,I 的转化率为____,容器内HI的体积分数为____。
2
(3)该条件下,能说明上述反应达到化学平衡状态的是____。(填标号)
A.混合气体颜色不再改变
B.容器内压强不再改变
C.H、I、HI三种气体体积分数不再改变
2 2
D.混合气体密度不再改变
(4)该反应在三种不同情况下的化学反应速率分别为:①v(H )=0.02mol·L-1·s-1,②v(I)=0.32mol·L-1·min-1,
2 2
③v(HI)=0.84mol·L-1·min-1。则反应进行的速率由快到慢的顺序为____。
19.某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:
(1)由图中所给数据进行分析,该反应的化学方程式为_________。
(2)若上述反应中X、Y、Z分别为H、N、NH ,某温度下,在容积恒定为2.0L的密闭容器中充入
2 2 3
2.0molN 和2.0mol H ,一段时间后反应达平衡状态,实验数据如表所示:
2 2
t/s 0 50 150 250 350
n(NH ) 0 0.36 0.48 0.50 0.50
3
0~50s内的平均反应速率v(N )=__________。
2
(3)已知:键能指在标准状况下,将lmol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E
表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH 过程中放出46kJ
3
的热量。则N≡N的键能为_________kJ/mol。
(4)CO与H 反应可制备CHOH,由CHOH和O 构成的质子交换膜燃料电池的结构示意图如下。
2 3 3 2电池总反应为2CHOH+3O =2CO +4H O,则c电极是________(填“正极”或“负极”),c电极的电极反应式为
3 2 2 2
___________。若外电路中转移2 mol电子,则上述燃料电池所消耗的O 在标准状况下的体积为______ L。
2
(5)下列反应中,属于吸热反应的是 __________(填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败
⑥Ba(OH) ·8H O与NH Cl反应 ⑦铁粉与稀盐酸反应
2 2 4
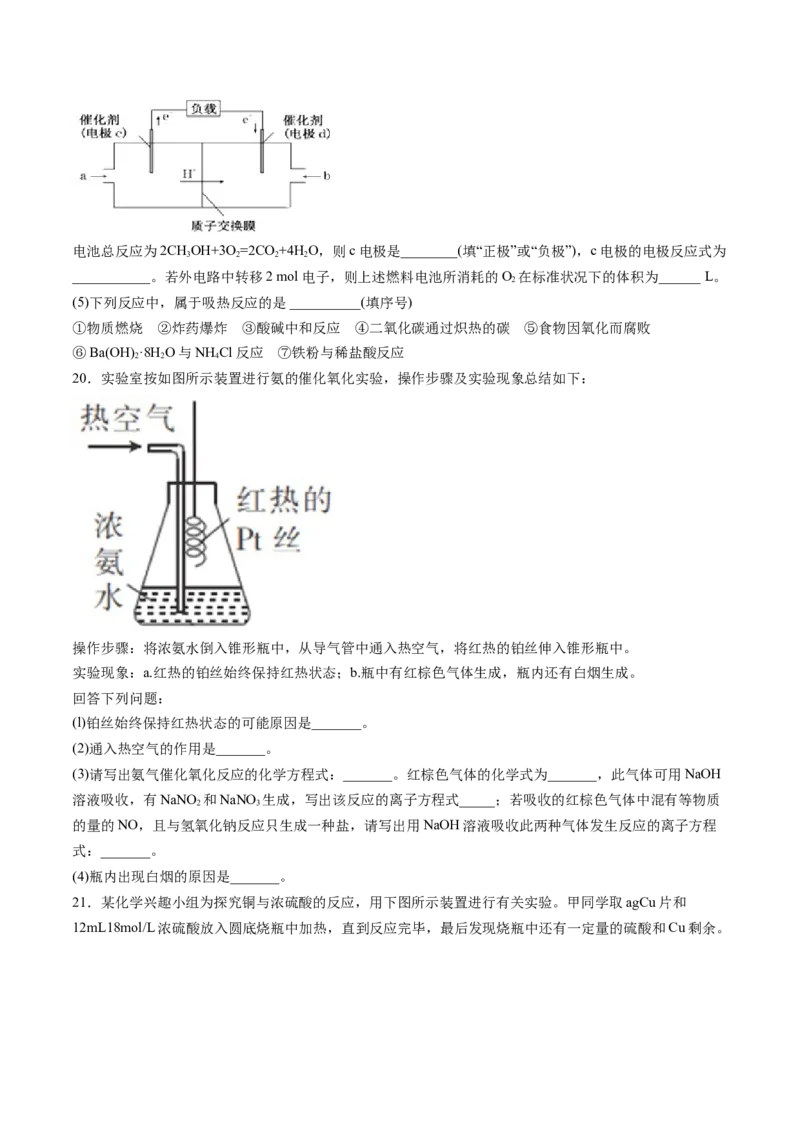
20.实验室按如图所示装置进行氨的催化氧化实验,操作步骤及实验现象总结如下:
操作步骤:将浓氨水倒入锥形瓶中,从导气管中通入热空气,将红热的铂丝伸入锥形瓶中。
实验现象:a.红热的铂丝始终保持红热状态;b.瓶中有红棕色气体生成,瓶内还有白烟生成。
回答下列问题:
(l)铂丝始终保持红热状态的可能原因是_______。
(2)通入热空气的作用是_______。
(3)请写出氨气催化氧化反应的化学方程式:_______。红棕色气体的化学式为_______,此气体可用NaOH
溶液吸收,有NaNO 和NaNO 生成,写出该反应的离子方程式_____;若吸收的红棕色气体中混有等物质
2 3
的量的NO,且与氢氧化钠反应只生成一种盐,请写出用NaOH溶液吸收此两种气体发生反应的离子方程
式:_______。
(4)瓶内出现白烟的原因是_______。
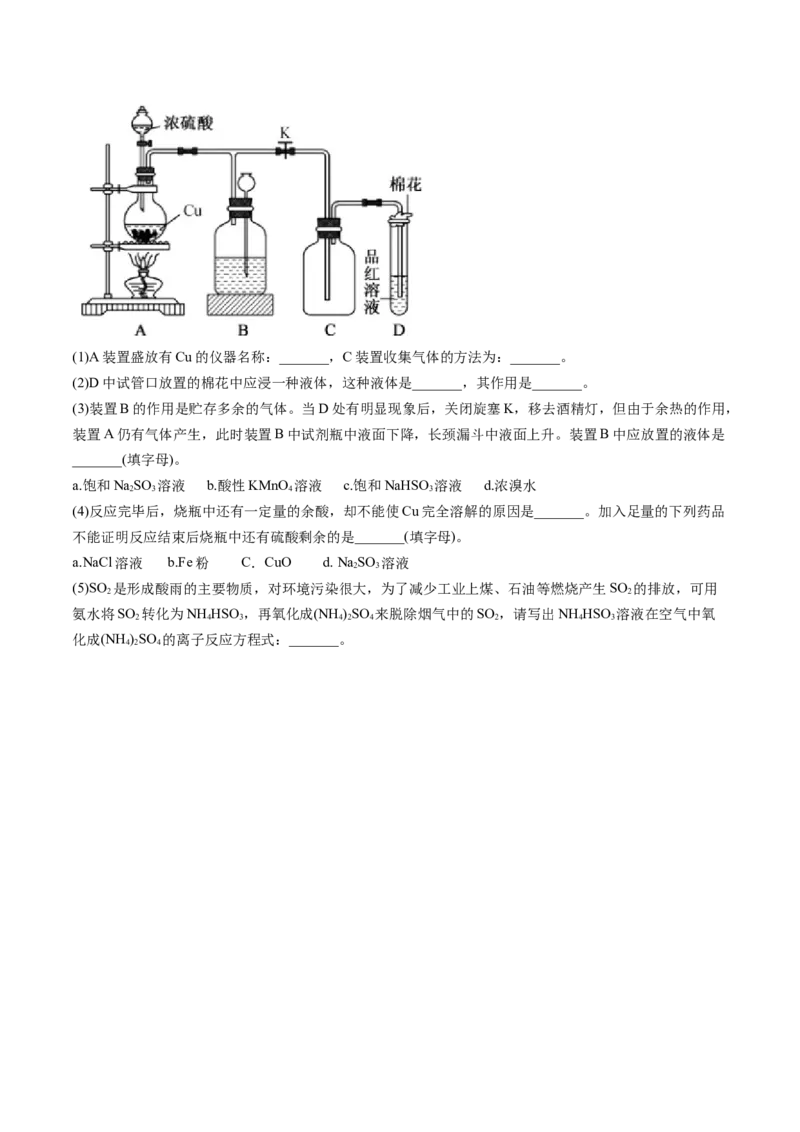
21.某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。甲同学取agCu片和
12mL18mol/L浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的硫酸和Cu剩余。(1)A装置盛放有Cu的仪器名称:_______,C装置收集气体的方法为:_______。
(2)D中试管口放置的棉花中应浸一种液体,这种液体是_______,其作用是_______。
(3)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,
装置A仍有气体产生,此时装置B中试剂瓶中液面下降,长颈漏斗中液面上升。装置B中应放置的液体是
_______(填字母)。
a.饱和NaSO 溶液 b.酸性KMnO 溶液 c.饱和NaHSO 溶液 d.浓溴水
2 3 4 3
(4)反应完毕后,烧瓶中还有一定量的余酸,却不能使Cu完全溶解的原因是_______。加入足量的下列药品
不能证明反应结束后烧瓶中还有硫酸剩余的是_______(填字母)。
a.NaCl溶液 b.Fe粉 C.CuO d. NaSO 溶液
2 3
(5)SO 是形成酸雨的主要物质,对环境污染很大,为了减少工业上煤、石油等燃烧产生SO 的排放,可用
2 2
氨水将SO 转化为NH HSO ,再氧化成(NH )SO 来脱除烟气中的SO ,请写出NH HSO 溶液在空气中氧
2 4 3 4 2 4 2 4 3
化成(NH )SO 的离子反应方程式:_______。
4 2 4