文档内容
大同市 2024-2025 学年度第一学期期中高一年级教学质量监测
化学
注意事项:
1.答题前,考生务必将自己的姓名、准考证号填写在答题卡相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5mm黑色笔迹
签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
5.本试卷共6页,满分100分,考试时间60分钟。
可能用到的相对原子质量:H1 C12 O16 Na23 P31 Cl35.5
一、选择题(本题共15个小题,每小题3分,共45分。每小题只有一个选项符合题目要
求。)
1.我国古代文化蕴藏了很多化学知识,下列有关说法错误的是( )
A.“美人首饰侯王印,尽是沙中浪底来”,此诗句内容涉及化学变化
B.“日照香炉生紫烟”的“烟”是瀑布的细小水珠形成的水雾,云、雾属于气溶胶
C.《准南万毕术》:“曾青得铁则化为铜”,该过程发生了氧化还原反应
D.“纷纷灿烂如星陨,赫赫喧雁似火攻”,五彩缤纷的烟花中能使火焰呈现黄绿色的元素是钡
2.现代生活需要人们有一定的科学素养,下列有关化学的科学常识正确的是( )
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.碳酸钠俗名小苏打,可用作糕点膨松剂
C.“84”消毒液(主要成分 )和洁厕剂(主要成分是盐酸)不可混用
D.现榨的苹果汁在空气中会由淡绿色 变为棕黄色 。若榨汁时加入维生素 ,可有效防止这
种现象发生,这说明维生素 具有氧化性
3.下列说法错误的是( )
A.实验室做钠的实验时,余下的钠放回原试剂瓶
B. 溶液、有色玻璃和空气均属于分散系
C. 溶于水在电流作用下电离成 和
D.胶体粒子直径介于
4.下列各组中的离子,能在溶液中大量共存的是( )
A. 、 、 、B. 、 、 、
C. 、 、 、
D. 、 、 、
5.宏观辨识与微观探析是化学学科核心素养之一。下列离子方程式书写完全正确的是( )
A.钠与水反应:
B.用大理石与稀盐酸制二氧化碳:
C.铁与稀盐酸反应:
D.氢氧化铜溶液与硫酸溶液的反应:
6.“践行能源革命,推动煤层气高效利用高质量发展”。山西省在世界首创煤层气(主要成分为 )生
产高端金刚石,以下有关分析正确的是( )
A. 中碳元素为+4价
B.该生产过程属于化合反应
C.金刚石、石墨和 都属于碳单质
D.金刚石与 、 互为同素异形体
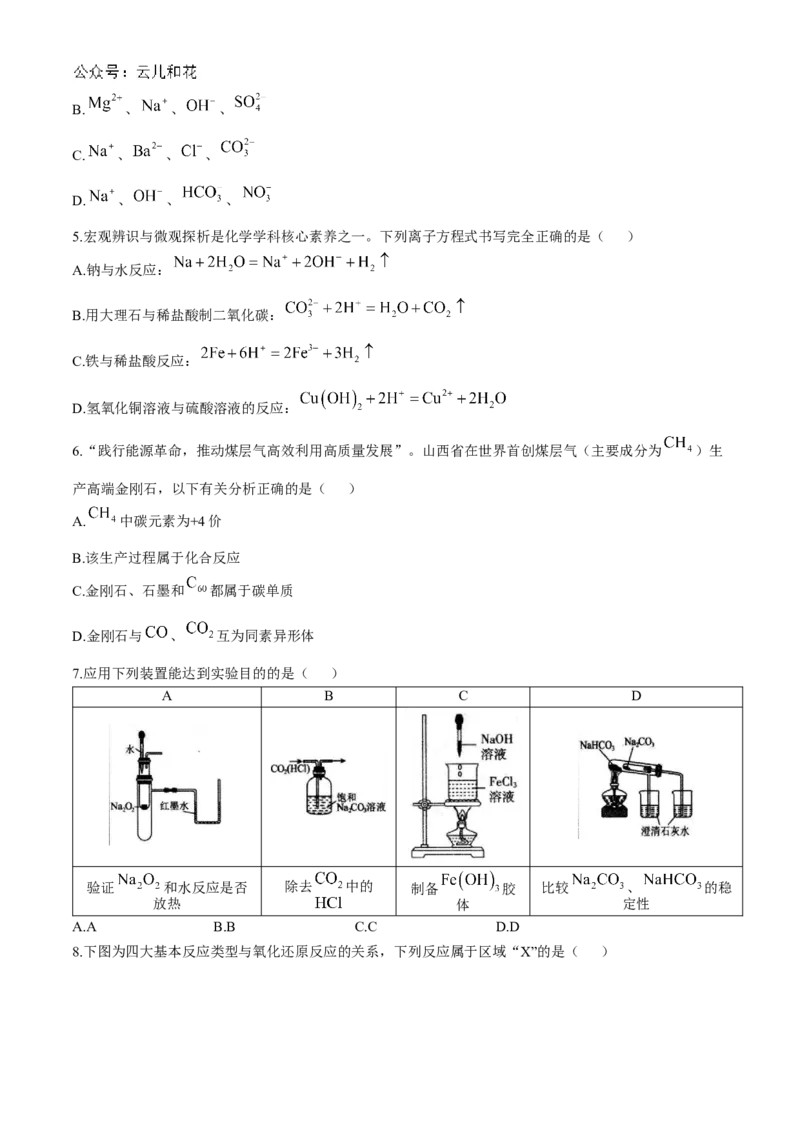
7.应用下列装置能达到实验目的的是( )
A B C D
验证 和水反应是否 除去 中的 制备 胶 比较 、 的稳
放热 体 定性
A.A B.B C.C D.D
8.下图为四大基本反应类型与氧化还原反应的关系,下列反应属于区域“X”的是( )A.
B.
C.
D.
9.实现下列物质之间的转化,必须加入氧化剂才能实现的是( )
A. B.
C. D.
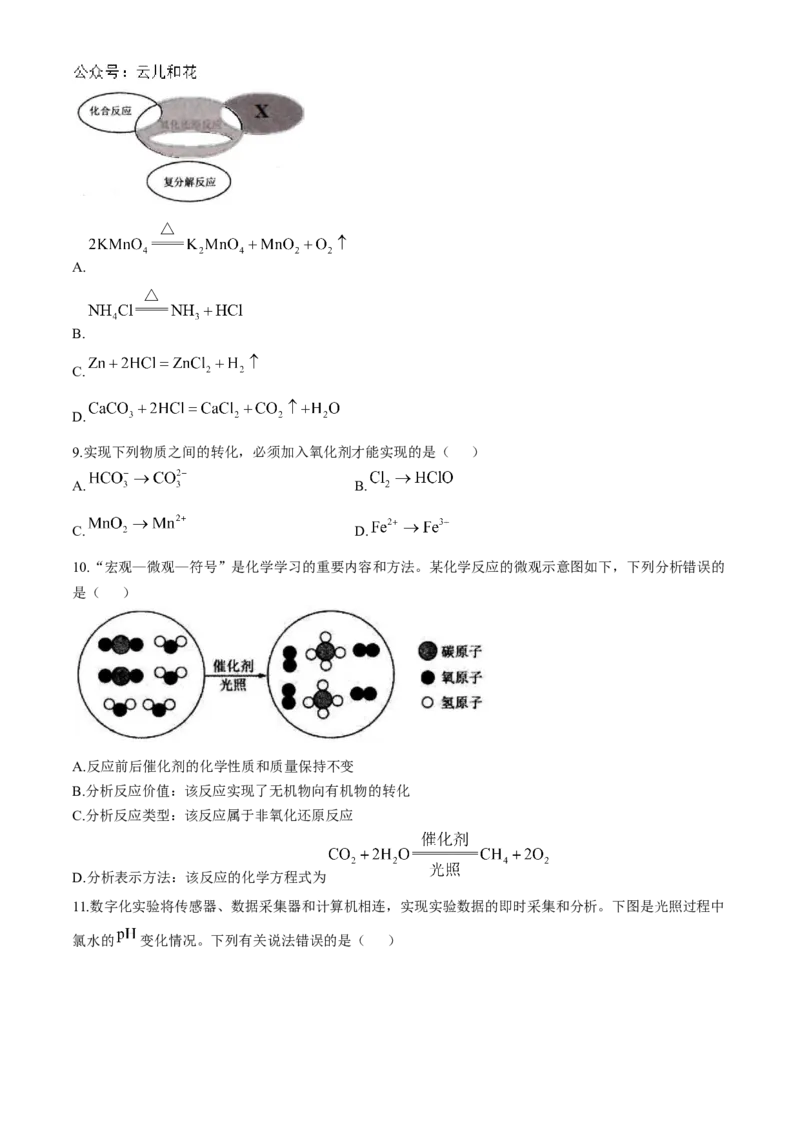
10.“宏观—微观—符号”是化学学习的重要内容和方法。某化学反应的微观示意图如下,下列分析错误的
是( )
A.反应前后催化剂的化学性质和质量保持不变
B.分析反应价值:该反应实现了无机物向有机物的转化
C.分析反应类型:该反应属于非氧化还原反应
D.分析表示方法:该反应的化学方程式为
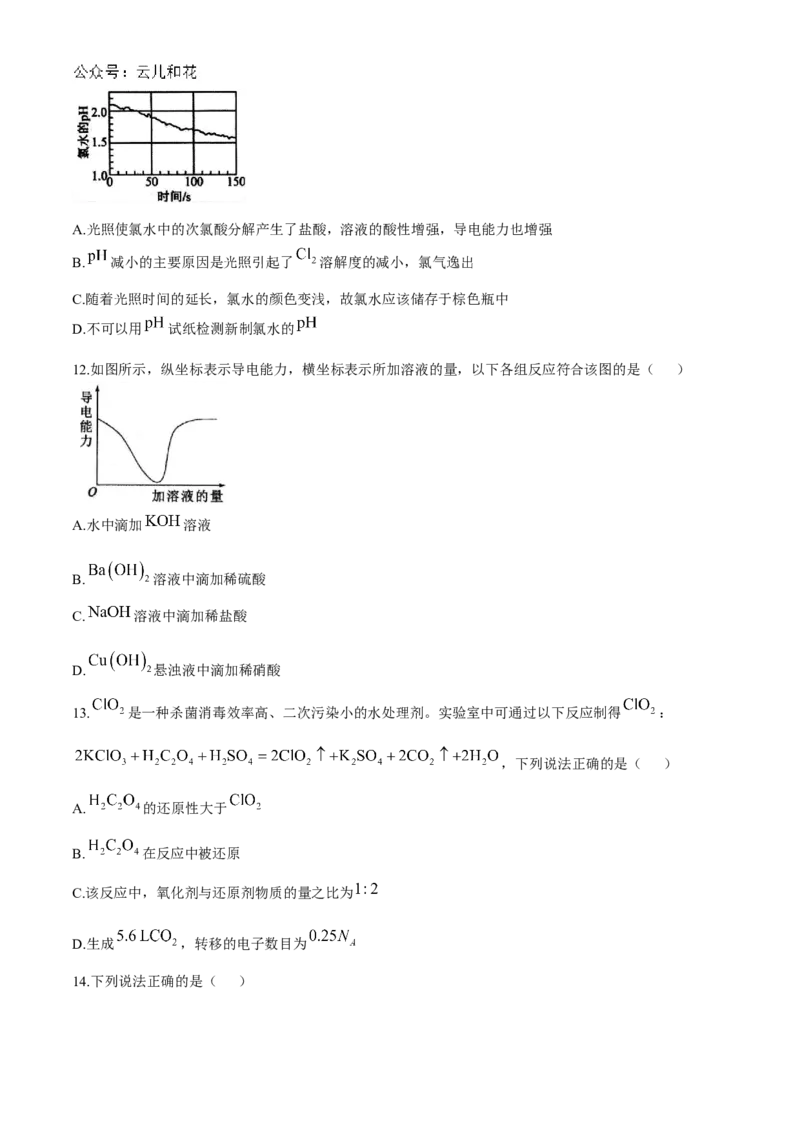
11.数字化实验将传感器、数据采集器和计算机相连,实现实验数据的即时采集和分析。下图是光照过程中
氯水的 变化情况。下列有关说法错误的是( )A.光照使氯水中的次氯酸分解产生了盐酸,溶液的酸性增强,导电能力也增强
B. 减小的主要原因是光照引起了 溶解度的减小,氯气逸出
C.随着光照时间的延长,氯水的颜色变浅,故氯水应该储存于棕色瓶中
D.不可以用 试纸检测新制氯水的
12.如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是( )
A.水中滴加 溶液
B. 溶液中滴加稀硫酸
C. 溶液中滴加稀盐酸
D. 悬浊液中滴加稀硝酸
13. 是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得 :
,下列说法正确的是( )
A. 的还原性大于
B. 在反应中被还原
C.该反应中,氧化剂与还原剂物质的量之比为
D.生成 ,转移的电子数目为
14.下列说法正确的是( )A.次磷酸 可用作金属表面的处理剂以及制造催化剂,它的摩尔质量是
B.标准状况下, 和 所含氧原子数目相等
C. 氢中含有 氢原子和 电子
D.25℃、 下, 的体积大于22.4L
15.设 表示阿伏伽德罗常数的值。下列说法正确的是( )
A. 中含有阴阳离子的总数目为
B. 与足量 反应,生成 和 的混合物,钠失去 个电子
C. 物质的量为
D. 和足量 充分反应,转移电子的数目为
二、非选择题(本题共4个小题,共55分。)
16.(14分)
I.现有下列8种物质:①石墨 ②钠 ③ 固体 ④氨气 ⑤液态氯气 ⑥熔融 ⑦
固体 ⑧漂白液。
(1)上述物质中能导电的是________(填标号,下同),属于电解质的是________。
(2)上述8种物质中有两种物质之间在溶液中可发生离子反应: ,该离子反应对应的
化学方程式为________。
II.已知二氧化碳、二氧化硫等都能与碱反应生成盐和水,这些氧化物为酸性氧化物;氧化铜、氧化镁等都
能与酸反应生成盐和水,这些氧化物为碱性氧化物。
(3)现有①三氧化铬( ) ②三氧化二铁 ③一氧化氮 ④二氧化硅 ⑤氧化钙5种氧化物,其中
三氧化铬、二氧化硅可与碱反应生成盐和水;三氧化二铁、氧化钙可与酸反应生成盐和水。这5种氧化物
中:属于酸性氧化物的是________(填标号,下同),属于碱性氧化物的是________。
(4)将三氧化铬加入过量氢氧化钠溶液中,可发生类似 与过量 的反应,则三氧化铬与氢氧化
钠反应的化学方程式为________。
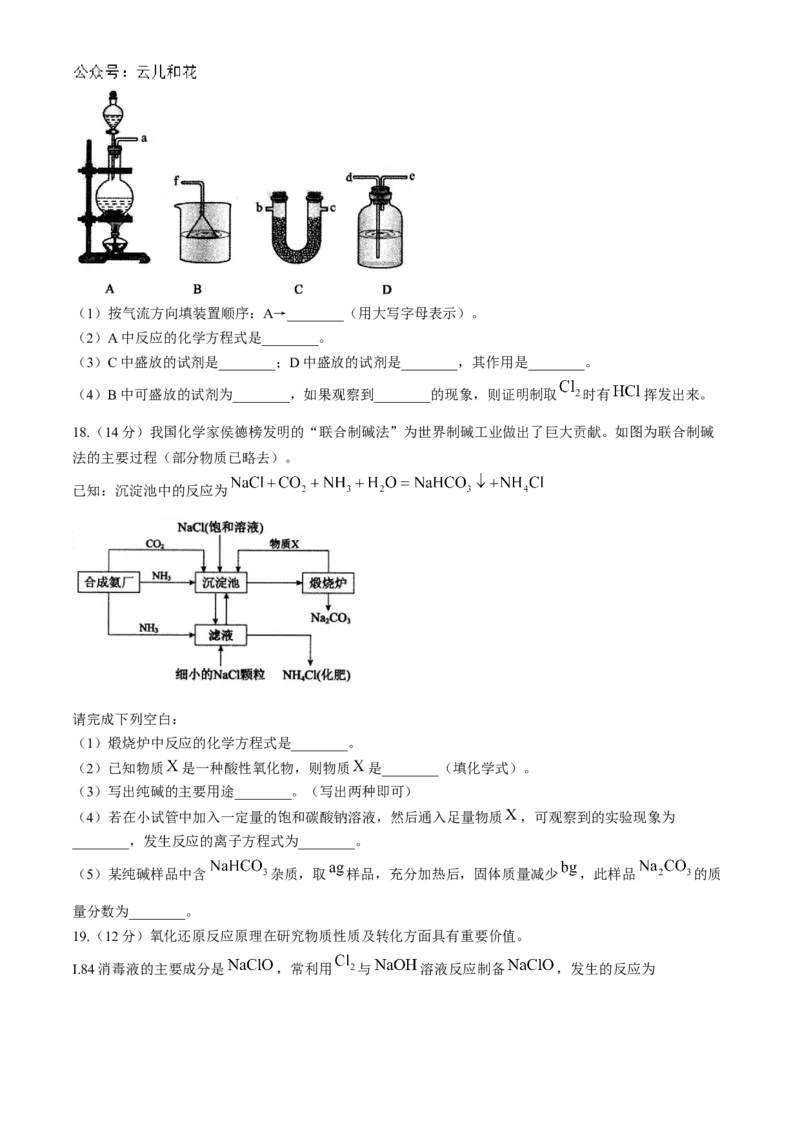
17.(15分)某同学用下列装置组装了一套可以证明实验室制取 的过程中有 和水蒸气挥发出来的
装置。已知氯气易溶于四氯化碳,而氯化氢不溶。回答下列问题:(1)按气流方向填装置顺序:A→________(用大写字母表示)。
(2)A中反应的化学方程式是________。
(3)C中盛放的试剂是________;D中盛放的试剂是________,其作用是________。
(4)B中可盛放的试剂为________,如果观察到________的现象,则证明制取 时有 挥发出来。
18.(14分)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱
法的主要过程(部分物质已略去)。
已知:沉淀池中的反应为
请完成下列空白:
(1)煅烧炉中反应的化学方程式是________。
(2)已知物质 是一种酸性氧化物,则物质 是________(填化学式)。
(3)写出纯碱的主要用途________。(写出两种即可)
(4)若在小试管中加入一定量的饱和碳酸钠溶液,然后通入足量物质 ,可观察到的实验现象为
________,发生反应的离子方程式为________。
(5)某纯碱样品中含 杂质,取 样品,充分加热后,固体质量减少 ,此样品 的质
量分数为________。
19.(12分)氧化还原反应原理在研究物质性质及转化方面具有重要价值。
I.84消毒液的主要成分是 ,常利用 与 溶液反应制备 ,发生的反应为(1)用双线桥标出该反应电子转移情况________。
(2)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,
请写出该反应的化学方程式________。
II.钴( )的常见化合价有+2价和+3价两种。 不溶于水和乙醇,溶于冷的浓酸,主要用于制
作钴盐, 与浓盐酸反应,生成可溶于水的钴盐,并有 生成。
(3)写出 与浓盐酸反应的离子方程式:________。
(4)推断 、 和 的氧化性由强到弱的顺序为________。2024—2025 学年度第一学期高一年级期中教学质量监测
化学参考答案
一、选择题(本题共15个小题,每小题3分,共45分。每小题只有一个选项符合题目要
求。)
题号 1 2 3 4 5 6 7 8
答案 A C C A D C A B
1 1 1
题号 9 11 13 15
0 2 4
答案 D C B B A D B
二、非选择题(本题共4个小题,共55分。)
所有方程式均3分,反应物、生成物全对得2分,反应条件、配平等全对得1分,沉淀、气体符号不写不
扣分。
16.(14分)
(1)①②⑥⑧;(全对2分,漏写得1分,多写错写0分) ③⑥⑦(2分,同上)
(2) (3分)
(3)①④(全对2分,漏写得1分,多写错写0分) ②⑤(2分,同上)
(4) (3分)
17.(15分)
本题所用试剂写名称或化学式都可以,合适即可。
(1)CDB(2分)
(2) (3分)
(3)无水硫酸铜(2分) (2分) 吸收 中的 (2分)
(4) 溶液(2分) 有白色沉淀产生(2分)(或者紫色石蕊试液紫色石蕊试液变红)
18.(14分)
(1) (3分)
(2) (2分)
(3)纺织、制皂、造纸、制玻璃、工业碱、食用碱(写出其中两种,合理即可,一种得1分,共2分)
(4)有白色晶体析出(2分) (3分)(5) 或 (2分)
19.(12分)
(1) (3分,标出电子转移即可)
(2) (3分)
(3) (3分)
(4) (3分)