文档内容
高二选择性必修二(人教版2019)期末复习培优与提升
(十)
一、单选题
1.具有下列电子层结构的原子或离子,其对应元素一定属于同一周期的是
A.两原子核外全部都是s电子
B.最外层电子排布为3s23p6的原子和最外层电子排布为3s23p6的离子
C.原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子
D.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
2.干冰气化时,下列各项中发生变化的是
A.分子间化学键 B.分子间距离 C.分子构型 D.分子大小
3.下列说法正确的是( )
A.s电子云是在空间各个方向上伸展程度相同的对称形状
B.p电子云是平面“8”字形的
C.2p能级有一个未成对电子的基态原子的电子排布式一定为1s22s22p5
D.2d能级包含5个原子轨道,最多容纳10个电子
4.下列各组微粒的空间构型和中心原子杂化方式均相同的是( )
①NH 和HO②NH +和HO+③NH 和HO+④O 和SO ⑤CO 和BeCl ⑥CO2-和SO 2-
3 2 4 3 3 3 3 2 2 2 3 4
⑦BF 和Al Cl
3 2 6
A.全部
B.④⑥⑦
C.③④⑤
D.②⑤⑥
5.已知钡的某种同位素是 ,由学过的知识无法推断出的信息是
A.钡元素的相对原子质量 B.钡元素在周期表中的位置
C.钡原子的核电荷数 D.钡原子的核外电子排布
6.下列说法中正确的是( )
A.HF、HCl、 、 的稳定性依次增强
B.按Mg、Si、N、F的顺序,原子半径由小变大
C.某主族元素的电离能 数据如下表所示 单位: ,可推测该元素位于
元素周期表第ⅤA族
试卷第1页,总3页I I I I I I I
578
D.在①P、S,② 、Ca,③ 、Si三组元素中,每组中第一电离能较大的元素的
原子序数之和为41
7.下列叙述错误的是( )
A. 分子中有 键
B. 的中心原子是 杂化
C.HCl和HI化学键的类型和分子的极性都相同
D.价电子构型为 的粒子其基态原子轨道表示式为:
8.下列各组晶体中化学键类型和晶体类型均相同的是( )
A.二氧化硅和二氧化碳 B.金刚石和石墨
C.氯化钠和过氧化钠 D.溴和白磷
9.下列说法不正确的是
A.同一原子中, ls、2s、3s电子的能量逐渐增多
B.同一原子中,2p、3p、4p能级的轨道数依次增多
C.任一原子的p能级电子云轮廓图形状均呈哑铃形
D.任一能层的能级数等于该能层序数
10.下列有关共价键和键参数的说法不正确的是
A.一个丙烯(C H)分子中含有8个σ 键和1个π 键
3 6
B.碳碳双键比碳碳单键键能更大,故碳碳双键更稳定
C.C-H键比Si-H键键长更短,故CH 比SiH 更稳定
4 4
D.由于孤电子对的存在,HO分子的键角小于109°28′
2
11.下列说法不正确的是
A.M 能层中的原子轨道数目为 9
B.各原子轨道的伸展方向种数按p、d、f的顺序分别为3、5、7
试卷第2页,总2页C.sp 2 杂化表示 s 轨道的 1 个电子和 p 轨道的 2 个电子进行杂化
D.氢原子光谱为线状光谱
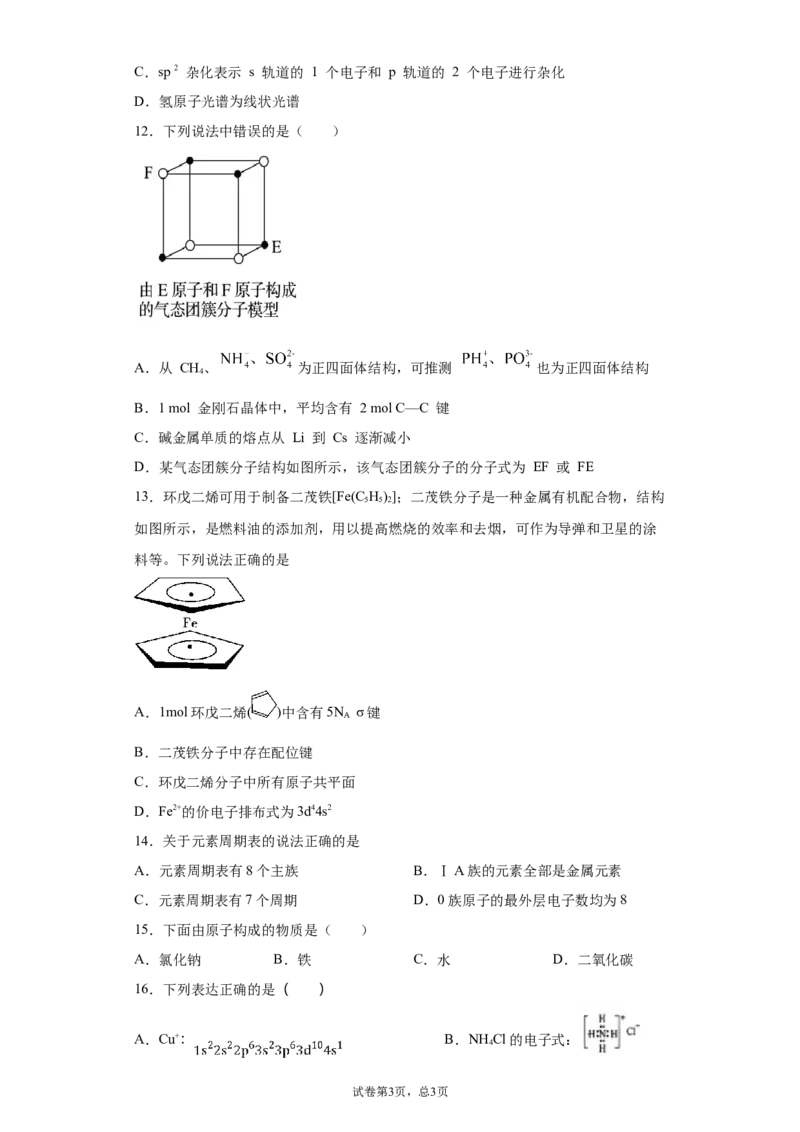
12.下列说法中错误的是( )
A.从 CH、 为正四面体结构,可推测 也为正四面体结构
4
B.1 mol 金刚石晶体中,平均含有 2 mol C—C 键
C.碱金属单质的熔点从 Li 到 Cs 逐渐减小
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为 EF 或 FE
13.环戊二烯可用于制备二茂铁[Fe(C H)];二茂铁分子是一种金属有机配合物,结构
5 5 2
如图所示,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂
料等。下列说法正确的是
A.1mol环戊二烯( )中含有5N σ键
A
B.二茂铁分子中存在配位键
C.环戊二烯分子中所有原子共平面
D.Fe2+的价电子排布式为3d44s2
14.关于元素周期表的说法正确的是
A.元素周期表有8个主族 B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期 D.0族原子的最外层电子数均为8
15.下面由原子构成的物质是( )
A.氯化钠 B.铁 C.水 D.二氧化碳
16.下列表达正确的是( )
A.Cu+: B.NH Cl的电子式:
4
试卷第3页,总3页C.As的简化电子排布式:[Ar] D.中子数为6,质子数为7的核素:
二、填空题
17.Q、X、Y、Z、W 五种元素的原子序数依次递增,W 为第四周期元素,其余均为
短周期主族元素,已知:
①Q原子的最外层电子数是次外层电子数的2 倍
②Y、Z同主族,Y原子价电子排布图为 ;
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)基态Q 原子中,电子运动状态有_____种,电子占据的最高能级符号为_____,
该能级含有的轨道数为________
(2)W的元素名称为_____,其基态原子的电子排布式为________
(3)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称
为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A 与Y、Z 形
成的化合物B 是等电子体物质,A、B分子式分别为______、_______。
(4)Q、X、Y三种元素的第一电离能数值最大的是_____(用元素符号作答),原因是
______________________________
18.A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―
在加热时相互反应可转化为C和D。则A+是______,B―是_______。
三、结构与性质
19.硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS SO SO HSO
2 2 3 2 4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
(2)组成HSO 的元素中,电负性由大到小的顺序是________,SO 分子的VSEPR模
2 4 2
型为________。
(3)固态SO 能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。
3
长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基
氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是
试卷第4页,总2页______________。
(4)绿矾是一种重要的硫酸盐,其组成可写成 [Fe(H O) ]2+[SO (H O)]2-,水合阴离子
2 6 4 2
中HO通过氢键与SO 2- 中的O原子相联结,按图示画出含氢键的水合阴离子:
2 4
______________。
(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正
方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ
g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
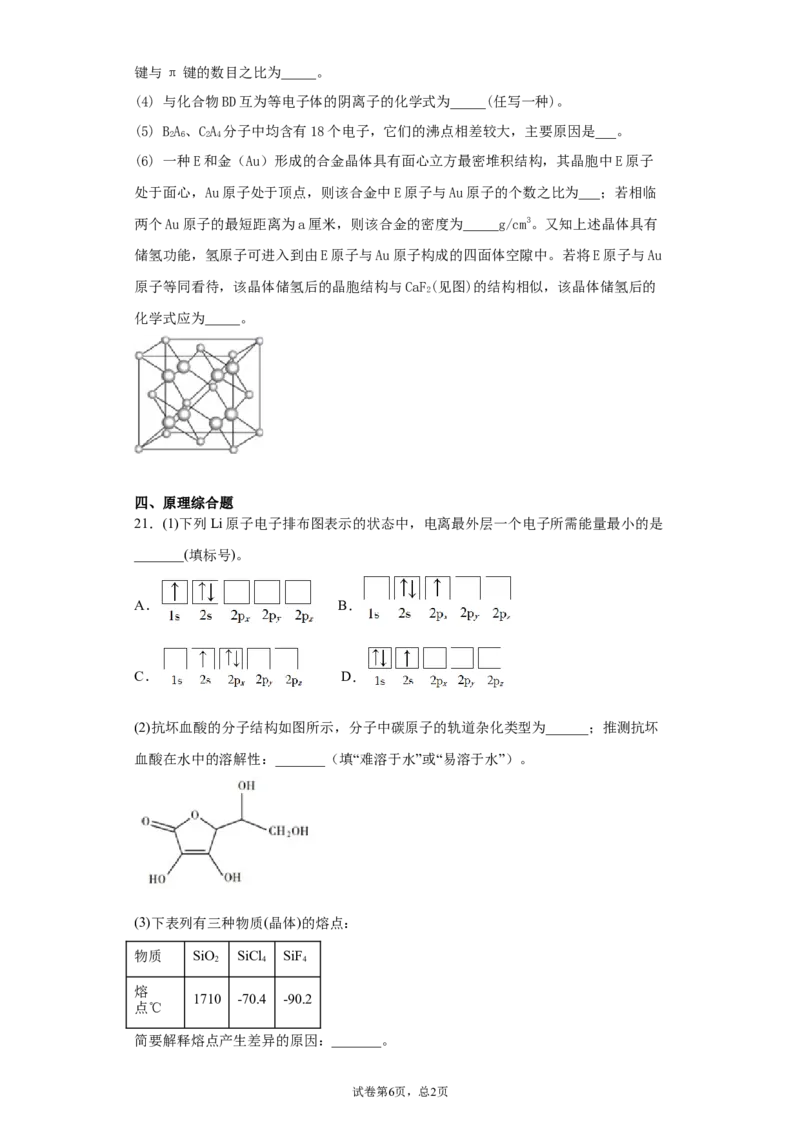
20.(化学一选修3:物质结构与性质)
某原料经测定主要含有A、B、C、D、E五种原子序数依次增大的前四周期元素,其相
关信息如下:
元素 元素性质或原子结构
A 周期表中原子半径最小的元素
B 原子核外有三种不同的能级且各个能级所填充的电子数相同
C 最外层p轨道半充满
D 位于短周期,其原子的核外成对电子数是未成对电子数的3倍
E 位于ds区且原子的最外层电子数与A的相同
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为_____。
(2) E的二价离子的电子排布式为_____。
(3) ABD 常用作除锈剂,该分子中B的杂化方式为_____;1 mol ABD 分子中含有σ
2 2 4 2 2 4
试卷第5页,总3页键与π键的数目之比为_____。
(4) 与化合物BD互为等电子体的阴离子的化学式为_____(任写一种)。
(5) BA、CA 分子中均含有18个电子,它们的沸点相差较大,主要原因是___。
2 6 2 4
(6) 一种E和金(Au)形成的合金晶体具有面心立方最密堆积结构,其晶胞中E原子
处于面心,Au原子处于顶点,则该合金中E原子与Au原子的个数之比为___;若相临
两个Au原子的最短距离为a厘米,则该合金的密度为_____g/cm3。又知上述晶体具有
储氢功能,氢原子可进入到由E原子与Au原子构成的四面体空隙中。若将E原子与Au
原子等同看待,该晶体储氢后的晶胞结构与CaF(见图)的结构相似,该晶体储氢后的
2
化学式应为_____。
四、原理综合题
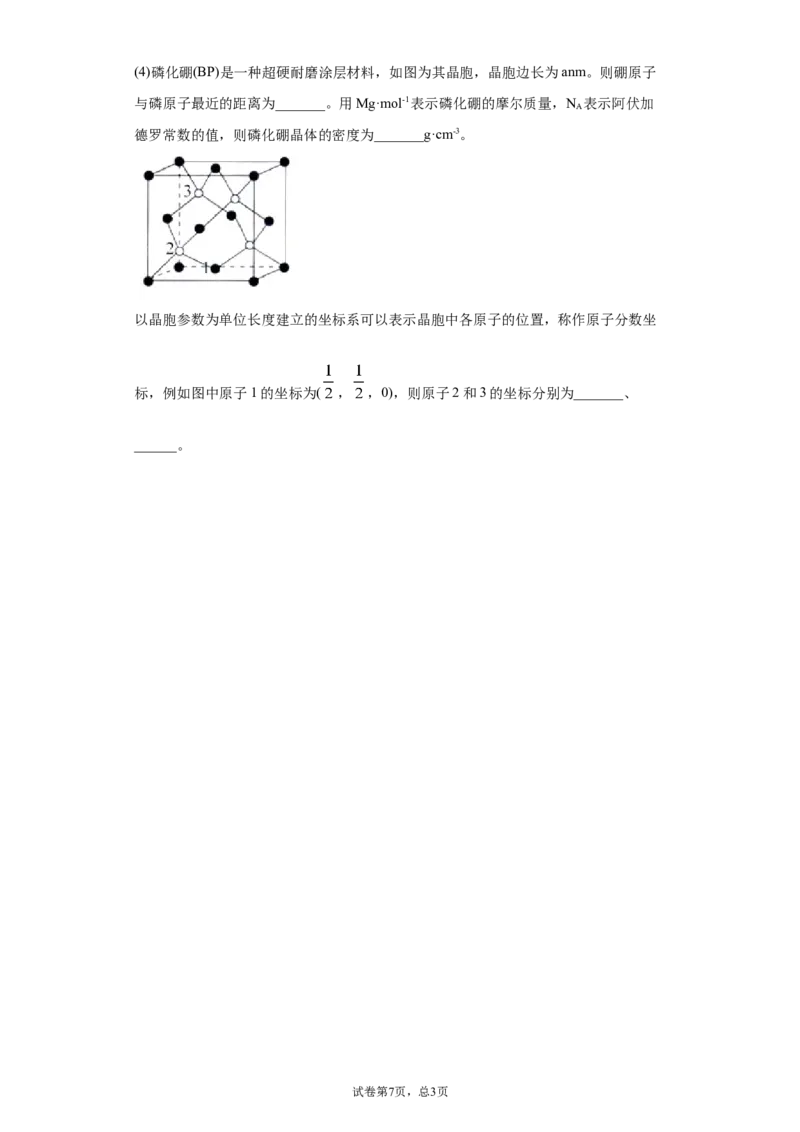
21.(1)下列Li原子电子排布图表示的状态中,电离最外层一个电子所需能量最小的是
_______(填标号)。
A. B.
C. D.
(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为______;推测抗坏
血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
(3)下表列有三种物质(晶体)的熔点:
物质 SiO SiCl SiF
2 4 4
熔
1710 -70.4 -90.2
点℃
简要解释熔点产生差异的原因:_______。
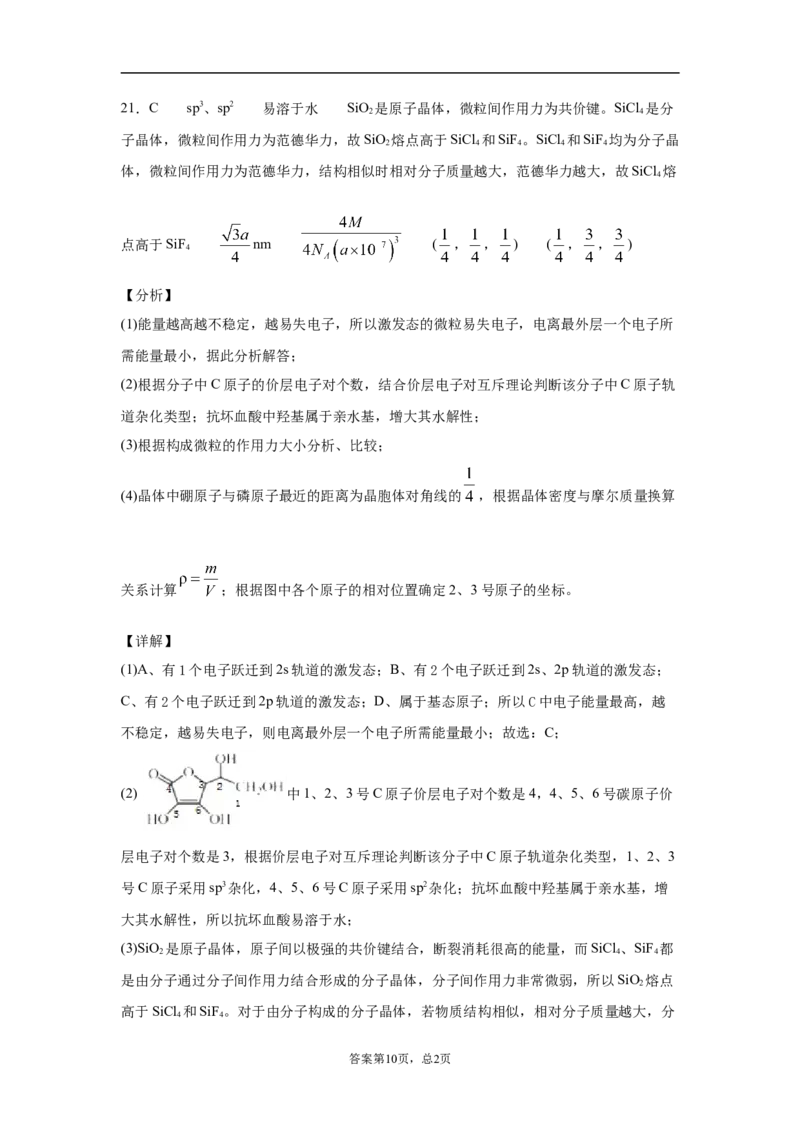
试卷第6页,总2页(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为anm。则硼原子
与磷原子最近的距离为_______。用Mg·mol-1表示磷化硼的摩尔质量,N 表示阿伏加
A
德罗常数的值,则磷化硼晶体的密度为_______g·cm-3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐
标,例如图中原子1的坐标为( , ,0),则原子2和3的坐标分别为_______、
______。
试卷第7页,总3页参考答案
1.D
【详解】
A.氢原子和锂原子都只有s电子但不在同一周期,A错误;
B.最外层电子排布为3s23p6的微粒可能是原子或离子,其核外电子数相等,但质子数可以
不同,例如Ar和K+,两者对应元素不在同一周期,B错误;
C.原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子,这里M层
可能是最外层,则该原子为Ar,若M为次外层,该原子可能是K,两者不在同一周期,C
错误;
D.3p能级上只有一个空轨道的原子,根据洪特规则可知该轨道电子为3p2,该原子可推知
为Si,3p能级上只有一个未成对电子的原子,根据洪特规则可知该轨道电子为3p5,该原
子可推知为Cl,两者处于同一周期,D正确。
故答案选D。
2.B
【详解】
干冰气化时,由固态变为气态,分子间作用力被破坏,而分子间作用力属于范德华力,不
是化学键;气化过程中,分子间的距离发生改变,但分子的大小和分子的构型并未改变,
故选B。
【点睛】
干冰气化的过程不是化学反应,化学键没有破坏。
3.A
【分析】
A.s电子云是球形;
B.p电子云是哑铃形,为立体结构;
C. 2p能级有一个未成对电子,则2p能级可能只有1个电子;
D.从第三电子层开始出现d能级。
【详解】
A.s电子云是球形,所以在空间各个方向上延展程度相同球形,故A正确;
答案第1页,总2页B.p电子云是哑铃形,为立体结构,“8”字形是平面结构,故B错误;
C. 2p能级有一个未成对电子,则2p能级可能只有1个电子,所以基态原子的电子排布式也
可能为1s22s22p1,故C错误;
D.从第三电子层开始出现d能级,即没有2d能级,d能级包含5个原子轨道,最多容纳10个
电子,故D错误;
综上所述,本题选A。
4.C
【详解】
①NH 中心原子为sp3杂化,有一对孤对电子,为三角锥形;HO分子中心原子为sp3杂化,
3 2
有2对孤对电子,为V形,故①不符合题意;
②NH +中心原子为sp3杂化,不含孤对电子,为正四面体构型;HO+中心原子为sp3杂化,
4 3
有一对孤对电子,为三角锥形,故②不符合题意;
③NH 中心原子为sp3杂化,有一对孤对电子,为三角锥形;HO+中心原子为sp3杂化,有
3 3
一对孤对电子,为三角锥形,故③符合题意;
④O 和SO 原子总数相同,价电子总数相同,互为等电子体,具有相同的空间构型和杂化
3 2
方式,故④符合题意;
⑤CO 和BeCl 原子总数相同,价电子总数相同,互为等电子体,具有相同的空间构型和杂
2 2
化方式,故⑤符合题意;
⑥CO2-和SO 2-原子总数不相,价电子总数不同,空间构型不同,故⑥不符合题意;
3 4
⑦BF 中B原子价层电子对数为3,为sp2杂化,Al Cl 中Al原子价层电子对数为4,为sp3
3 2 6
杂化,故⑦不符合题意;
故答案为C。
【点睛】
判断两种分子或离子杂化方式、空间构型是否相同,可以根据价层电子对互斥理论分别判
断各微粒的杂化方式、空间构型;也可以根据等电子体原理判断,原子总数相同,价电子
总数相同的分子或离子互为等电子体,等电子体具有相似的化学键特征、结构特征。
5.A
【分析】
在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数;质子数和中子数之
和是质量数,则根据 可知Ba的原子序数是56,质量数是130,中子数=130-56=74。
答案第2页,总2页【详解】
A.钡有多种同位素,则不能只根据该同位素计算钡元素的相对原子质量,A错误;
B.质子数为56,则钡原子核外电子数为56,根据原子核外电子排布规律,钡原子核外K、
L、M、N、O、P层依次排有2、8、18、18、8、2个电子,钡元素在元素周期表中的位置
为第6周期第IIA族,B正确;
C.质子数=核电荷数=56,C正确;
D.钡原子核外电子数是56,根据原子核外电子排布规律,钡原子核外K、L、M、N、O、P
层依次排有2、8、18、18、8、2个电子,D正确;
答案选A。
6.D
【详解】
A.F、Cl位于同一主族,同主族从上到下,非金属性减弱,非金属性:F>Cl,P、S、Cl
位于同一周期,同周期非金属性增强,非金属性:P<S<Cl,则非金属性F>Cl>S>P,
HF、HCl、HS、PH 的稳定性依次减弱,故A错误;
2 3
B.Mg、Si位于同一周期,同周期从左到右原子半径逐渐减小,Mg>Si,N、F位于同一周
期,同周期从左到右原子半径逐渐减小,N>F ,Mg、Si位于N、F的下一周期故半径Mg
>Si>N>F,原子半径是由大到小,故B错误;
C.表中电离能数据可知,突变在 到 ,其常见化合价为+3价,故C错误;
D.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族,第VA
族元素第一电离能大于其相邻元素,同一主族元素第一电离能随着原子序数增大而减小,
①P,S中第一电离能较大的是P,②Mg,Ca中第一电离能较大的是Mg,③ 、Si中第一
电离能较大的是Si,电离能较大的分别为P、Mg、Si,原子序数之和为 ,
故D正确;
答案选D。
7.D
【详解】
A.乙烯分子中两个C原子之间形成碳碳双键,为一个σ键和一个π键,故A正确;
B.甲烷分子中心碳原子价层电子对数为4,为sp3杂化,故B正确;
C.HCl和HI中的共价键均为极性共价键,且均为极性分子,故C正确;
答案第3页,总2页D.根据洪特规则,电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且
自旋方向相同,所以价电子构型为3s23p4的粒子的基态原子轨道表示式为
,故D错误;
故答案为D。
8.D
【解析】
【详解】
A.二氧化硅是原子晶体,存在共价键,二氧化碳是分子晶体,分子内为共价键,分子间
为范德华力,二者晶体类型和化学键类型不同,A项不符合题意;
B.金刚石是原子晶体,存在共价键,石墨为层状晶体,层内是共价键,层间是范德华力,
属混合晶体,二者化学键类型和晶体类型不同,B项不符合题意;
C.氯化钠是离子晶体,存在离子键,过氧化钠为离子晶体,但既存在离子键,也存在共
价键,二者化学键类型不相同,C项不符合题意;
D.溴是分子晶体,白磷是分子晶体,均存在共价键。二者化学键类型和晶体类型均相同,
D项符合题意;
本题答案选D。
【点睛】
考查化学键类型和晶体类型的判断,分清原子晶体,分子晶体,离子晶体等常见晶体的化
学键是解答的关键。
9.B
【详解】
A.同一原子中,ls、2s、3s电子的能量逐渐增多,选项A正确;
B.不同电子层中p轨道均为3个,则同一原子中,2p、3p、4p能级的轨道数相同,选项B
不正确;
C.任一原子的p能级电子云轮廓图形状均呈哑铃形,选项C正确;
D.任一能层的能级数等于该能层序数,选项D正确。
答案选B。
10.B
【解析】
【详解】
答案第4页,总2页A、丙烯的结构简式为CH=CHCH,成键原子之间只能形成一个σ键,因此丙烯中含有8
2 3
个σ键和1个π键,故A说法正确;B、碳碳双键中有一个σ键和一个π键,π键不稳
定,容易断裂,故B说法错误;C、C的半径小于Si,因此C-H键长比Si-H键长短,因
此CH 比SiH 稳定,故C说法正确;D、中心原子O含有孤电子对数为(6-2)/2=2,孤电子
4 4
对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,因此HO分子
2
中键角小于109°28′,故D说法正确。
11.C
【详解】
A.M能层中有1个s轨道、3个p轨道、5个d轨道,共9个轨道,A正确;
B.各原子轨道的伸展方向数按s、p、d、f的顺序分别为1、3、5、7,s轨道为球形,p轨
道为哑铃形,B正确;
C.sp2杂化轨道是指同一电子层内,1个s轨道和2个p轨道杂化,形成能量相等的三个
sp2杂化轨道,C错误;
D.原子光谱都是线状光谱,则氢原子光谱为线状光谱,D正确;
综上所述答案为C。
12.D
【详解】
A. 分别是 等的等电子体,所以根据等电子原理可知,这两种离
子均为正四面体结构,故A项正确;
B.金刚石晶体中,每个C原子与其它4个C原子形成共价键,且每2个C原子形成1个共
价键,则1mol金刚石晶体中,平均含有4mol× =2mol的C-C键,故B项正确;
C.碱金属的溶沸点随着原子序数的增大而减小,Li的原子序数比Cs大,故C项正确;
D.由图中的分子模型可以得出,团簇分子中含有4个E、4个F原子,分子式应为EF 或
4 4
FE,故D项错误;
4 4
故选D。
13.B
【详解】
A.环戊二烯中有3个碳碳单键为σ键,2个碳碳双键中有2个σ键,此外还有6个碳氢单
键为σ键,所以1 mol环戊二烯中含有11mol σ键,选项A错误;
答案第5页,总2页B.Fe2+含有空轨道,环戊二烯离子(C H-)含孤电子对,所以二茂铁中Fe2+与环戊二烯离子
5 5
(C H-)之间的化学键类型是配位键,选项B正确;
5 5
C.环戊二烯中有饱和碳原子,与饱和碳原子相连的4个原子形成四面体结构,不可能所有
原子共面,选项C错误;
D.Fe2+由Fe原子失去最外层二个电子形成,价电子排布式为3d6,选项D错误;
答案选B。
14.C
【详解】
A.元素周期表有7个主族,故A错误;
B.ⅠA族的元素除H元素外都是金属元素,故B错误;
C.元素周期表有7个周期,故C正确;
D.0族元素除He原子最外层电子数为2外,其余原子的最外层电子数均为8,故D错误;
故答案为C。
15.B
【详解】
A. 氯化钠由氯离子和钠离子构成,故A错误;
B. 铁单质是由铁原子构成,故B正确;
C. 水是由HO分子构成的,故C错误;
2
D. 二氧化碳是由CO 构成的,故D错误;
2
故答案为B。
16.D
【详解】
A.铜为29号元素,则其正确的电子排布式为:1s22s22p63s23p63d10,选项A错误;B.氯化
铵的电子式中,必须标出氯离子的最外层电子,氯化铵正确的电子式为:
,选项B错误;C、As的原子序数为33,属于主族元素,由构造原理可
知电子排布为1s22s22p63s23p63d104s24p3,所以As原子的简化电子排布式为:[Ar]3d104s24p3,
选项C错误;D、中子数为6,质子数为7的核素为: ,选项D正确;答案选D。
17. .6 2p 3 铜元素 [Ar]3d104s1 O SO N 非金属性越强,第一电离能越大,
3 2
答案第6页,总2页但由于N原子2p轨道电子半充满为稳定结构,比O原子更难失去电子,N原子的第一电离
能最大
【解析】Q原子的最外层电子数是次外层电子数的2倍,即Q为C,根据Y的价电子排布
图,推出Y为O,Y和Z属于同主族,则Z为S,W元素基态原子的M层全充满,N层没
有成对电子,只有一个未成对电子,即W为Cu,原子序数依次增大,则X为N,(1)考
查电子运动状态、能级、原子轨道,Q为C,核外有6个电子,即核外有6种运动状态不
同的电子,电子占据的最高能级符号是2p,p能级有3个原子轨道;(2)考查电子排布式
的书写,W为铜元素,电子排布式为 [Ar]3d104s1或1s22s22p63s23p63d104s1;(3)考查等电
子体,五种元素种电负性最强的元素是O,O形成的单质为O、O,Y和Z形成的化合物
2 3
是SO 、SO ,O 和SO 互为等电子体,因此A为O,B为SO ;(4)同周期从左向右,
2 3 3 2 3 2
第一电离能增大,但IIA>IIIA,VA>VIA,因此有N>O>C,原因是:非金属性越强,第一
电离能越大,但由于N原子2p轨道电子半充满为稳定结构,比O原子更难失去电子,N原
子的第一电离能最大。
18. NH+ OH-
4
【解析】分析:电子总数为10个的粒子一般在氖原子附近寻找,然后跟氢元素搭配,把含
10电子的元素都一一写出来,然后带入题目,结合溶液中的A+和B―在加热时相互反应可转
化为C和D,此反应应为NH+ +OH- =NH +H O,不难得出上述答案。
4 3 2
详解: A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在
加热时相互反应可转化为C和D,根据此信息可知,NH + 、OH-均为10电子的阴阳离子,
4
二者混合后加热反应:NH ++OH- =NH↑+H O,生成10电子的分子NH 和HO,因此A+是
4 3 2 3 2
NH+,B―是OH-。正确答案:NH+ ;OH-。
4 4
点睛:10电子的微粒:原子:Ne;分子:CH 、NH 、HO 、HF ;离子:NH + 、OH-、
4 3 2 4
HO+;掌握这些常见离子,易于问题的解决。
3
19.[Ar]3d34s2 4 O>S>H 平面三角形 sp3 桥氧 端基氧与硫原子形
成双键,桥氧为硫氧单键,硫氧单键键长比硫氧双键大 4
答案第7页,总2页【详解】
(1)V原子为23号元素,基态原子核外有23个电子,所以电子排布式为:[Ar]3d34s2;基态
Fe原子核外电子排布式为1s22s22p63s23p63d64s2,3d轨道有4个电子未成对;
(2)非金属性越强,电负性越大,所以H、S、O三种元素电负性由大到小为O>S>H;二
氧化硫分子中心原子价层电子对数为 =3,所以为sp2杂化,其VSEPR模型为平
面三角形;
(3)根据固体SO 的结构可知每个S原子形成4个σ键,价层电子对数为4,所以为sp3杂化;
3
端基氧与硫原子形成双键,桥氧为硫氧单键,硫氧单键键长比硫氧双键大,所以桥氧化学
键键长更大;
(4)氢键结合的情况可用X-H…Y表示,所以含氢键的水合阴离子为 ;
(5)根据晶胞示意图可知S2-连接两个亚铁离子和两个铜离子,所以S2-的配位数为4;根据均
摊法晶胞中S2-的个数为8,Fe2+的个数为 ,Cu2+个数为 =4,
所以晶胞的质量m= ,晶胞体积V=a2b pm3= a2b×10-30 cm3,所
以晶胞的密度ρ= ,可解得N = 。
A
【点睛】
氢键通常可用X-H…Y来表示,式中X和Y代表F,O,N等电负性大而原子半径较小的非
金属原子,其中X以共价键(或离子键)与氢相连, X和Y可以是两种相同的元素,也
可以是两种不同的元素。
20.N>O>C 1s22s22p63s23p63d9(或[Ar]3d9) sp2 7 :2 CN-(或 ) NH 分
2 4
答案第8页,总2页子间形成氢键 3∶1 389/(N.a3) HAuCu
A 8 3
【详解】
A、B、C、D、E五种前四周期元素,且原子序数依次增大;周期表中A元素原子半径最
小,故A为H元素;B元素原子核外有三种不同的能级且各个能级所填充的电子数相同,
核外电子排布为1s22s22p2,故B为碳元素;D位于短周期,其原子的核外成对电子数是未
成对电子数的3倍,而短周期中原子单电子处于p能级最多有3个,故成对电子总数只能
为6,单电子数为2,核外电子排布为1s22s22p4,则D为O元素;C元素原子最外层P轨道
半充满,原子序数小于氧,故其核外电子排布为1s22s22p3,则C为N元素;E位于ds区且
原子的最外层电子数与A的相同,外围电子排布为3d104s1,则E为Cu。
(1)同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,
为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;
(2)E为Cu元素,Cu2+的电子排布式为1s22s22p63s23p63d9 (或[Ar]3d9) ;(3)HC O 为乙
2 2 4
二酸,分子中C原子形成3个σ键,没有孤对电子,为sp2杂化;分子中共含有7个σ键
和2个π键,故为7:2;(4)原子总数相同、价电子总数相同的微粒互为等电子体,与化
合物CO互为等电子体的阴离子为CN-、C 2-等;(5)C H、NH 分子中均含有18个电子,
2 2 6 2 4
因为NH 分子间存在氢键,所以它们的沸点相差较大;(6)项点:8 = 1,面心:6
2 4
× ×
= 3,所以Au:Cu = 1:3;总质量:3 M(Cu)/N + M(Au)/N ,晶胞体积:a3 cm3,
A A
×
密度=总质量/ 晶胞体积=(197+64×3) / (NAa3)= 389/(N a3);由CaF 的结构知,Cu原子处
A 2
∙ ∙
于面心,所以晶胞中Cu原子个数为6× =3,Au原子处于顶点位置,所以晶胞中Au原子
个数为8× =1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应
位于晶胞内部,则应含有8个H,则化学式为Cu AuH 。
3 8
点睛:本题主要考查了元素推断、电离能、杂化轨道、核外电子排布、等电子体、氢键、
晶胞的计算等知识,综合性较强,有一定难度,解题的难点在第(6)中,注意均摊法的运
用。
答案第9页,总2页21.C sp3、sp2 易溶于水 SiO 是原子晶体,微粒间作用力为共价键。SiCl 是分
2 4
子晶体,微粒间作用力为范德华力,故SiO 熔点高于SiCl 和SiF。SiCl 和SiF 均为分子晶
2 4 4 4 4
体,微粒间作用力为范德华力,结构相似时相对分子质量越大,范德华力越大,故SiCl 熔
4
点高于SiF nm ( , , ) ( , , )
4
【分析】
(1)能量越高越不稳定,越易失电子,所以激发态的微粒易失电子,电离最外层一个电子所
需能量最小,据此分析解答;
(2)根据分子中C原子的价层电子对个数,结合价层电子对互斥理论判断该分子中C原子轨
道杂化类型;抗坏血酸中羟基属于亲水基,增大其水解性;
(3)根据构成微粒的作用力大小分析、比较;
(4)晶体中硼原子与磷原子最近的距离为晶胞体对角线的 ,根据晶体密度与摩尔质量换算
关系计算 ;根据图中各个原子的相对位置确定2、3号原子的坐标。
【详解】
(1)A、有1个电子跃迁到2s轨道的激发态;B、有2个电子跃迁到2s、2p轨道的激发态;
C、有2个电子跃迁到2p轨道的激发态;D、属于基态原子;所以C中电子能量最高,越
不稳定,越易失电子,则电离最外层一个电子所需能量最小;故选:C;
(2) 中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价
层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3
号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;抗坏血酸中羟基属于亲水基,增
大其水解性,所以抗坏血酸易溶于水;
(3)SiO 是原子晶体,原子间以极强的共价键结合,断裂消耗很高的能量,而SiCl 、SiF 都
2 4 4
是由分子通过分子间作用力结合形成的分子晶体,分子间作用力非常微弱,所以SiO 熔点
2
高于SiCl 和SiF。对于由分子构成的分子晶体,若物质结构相似,相对分子质量越大,分
4 4
答案第10页,总2页子间作用力就越大,物质的熔沸点就越高,所以SiCl 熔点高于SiF;
4 4
(4)BP晶体中晶胞参数是anm,晶胞的对角线长度为L= ,根据晶胞结构可知:在晶
体中硼原子与磷原子晶胞体对角线的 ,因此二者的最近的距离为 nm。在一个晶胞
中含有B、P原子个数为P: =4;含有的B原子数目为4个,所以一个晶胞中
含有4个BP,用Mg·mol-1表示磷化硼的摩尔质量,N 表示阿伏加德罗常数的值,则磷化
A
硼晶体的密度 = g/cm3;以晶胞参数为单位长度建
立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
, ,0),则原子2的坐标为( , , ),原子3的坐标为( , , )。
【点睛】
本题考查了物质结构的有关知识。掌握原子的构造原理、晶体结构的有关知识,注意晶体
中B、P原子之间的距离与晶胞棱长的关系,用均摊方法进行计算是本题解答的关键。
答案第11页,总2页