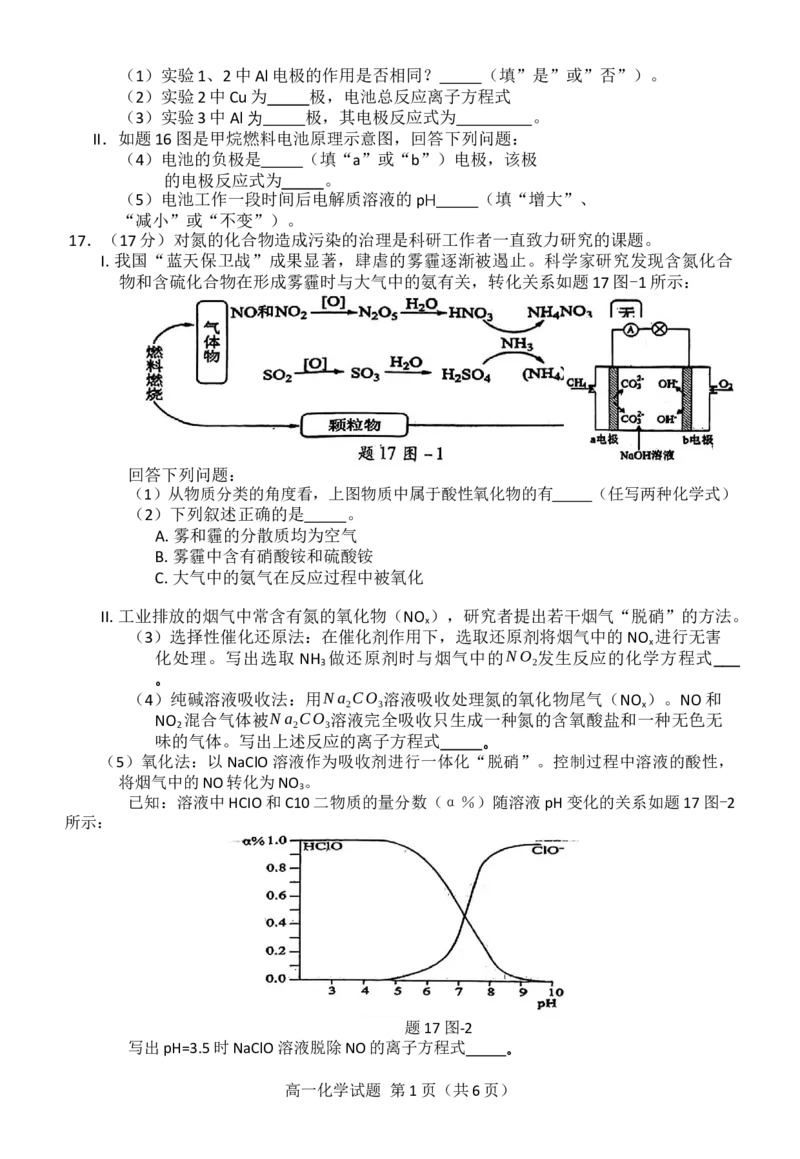
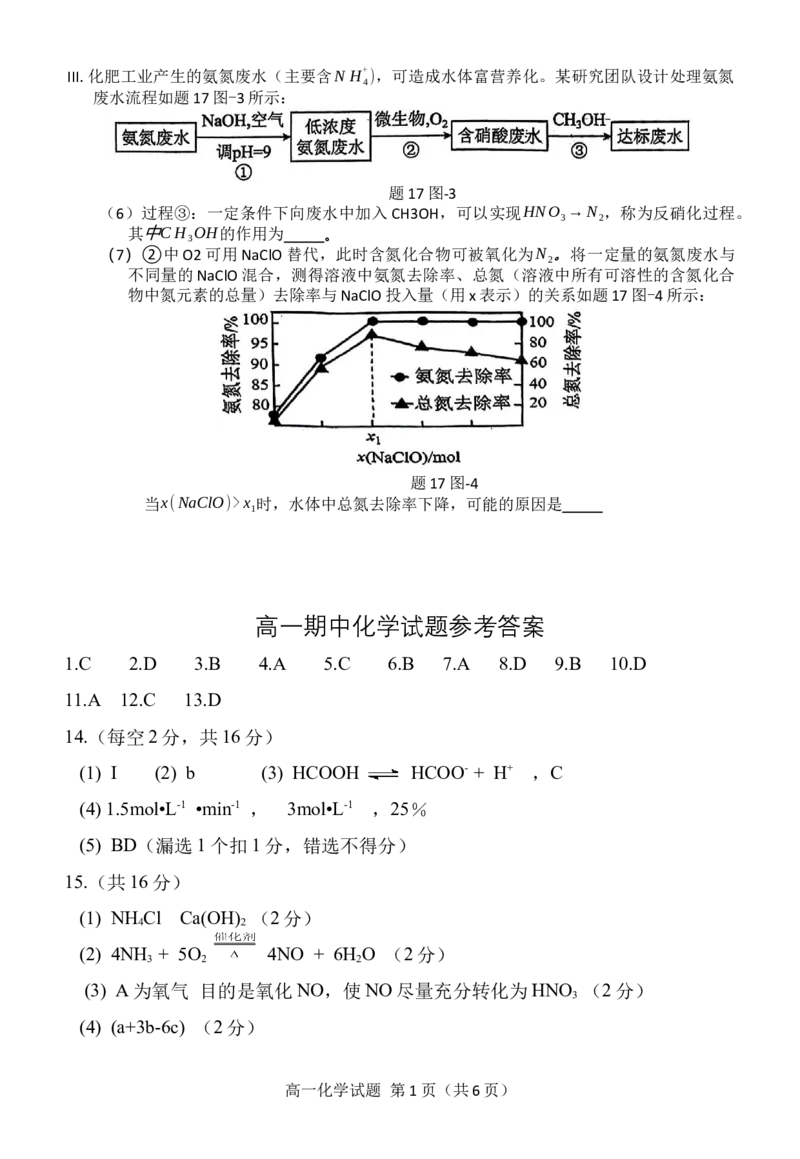
文档内容
2024~2025 学年度第二学期期中考试
高一化学试题
注意事项
考生在答题前请认真阅读本注意事项及各题答题要求
1、本试卷共6页,包含选择题(第 1题~第13题,共13题)、非选择题(第 14题~第
17题,共4题)共两部分。本卷满分100分,考试时间为75分钟。考试结束后,请将答
题卡交回。
2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答
题卡的规定位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用
橡皮擦干净后,再选涂其他答案。作答非选择题,必须用 0.5毫米黑色墨水的签字笔在
答题卡上的指定位置作答,在其他位置作答一律无效。
5.如需作图,必须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗。
本卷可能用到的相对原子质量:H 1 C 12 0 16 Cu 64
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.我国探月工程取得重大进展。月壤中存在一种矿物Ca (PO ) ((OH),下列元素位于元
5 4 3
素周期表VIA族的是
A.H B.P C.0 D.Ca
2.液氨与钠发生反应:2Na+2N H 一定条件2NaN H +H 。下列说法不正确的是
3 2 2
A.H与D互为同位素 B.NaN H 中N元素的化合价为-3
2
C.NH3的球棍模型 D.N H 的电子式为
3
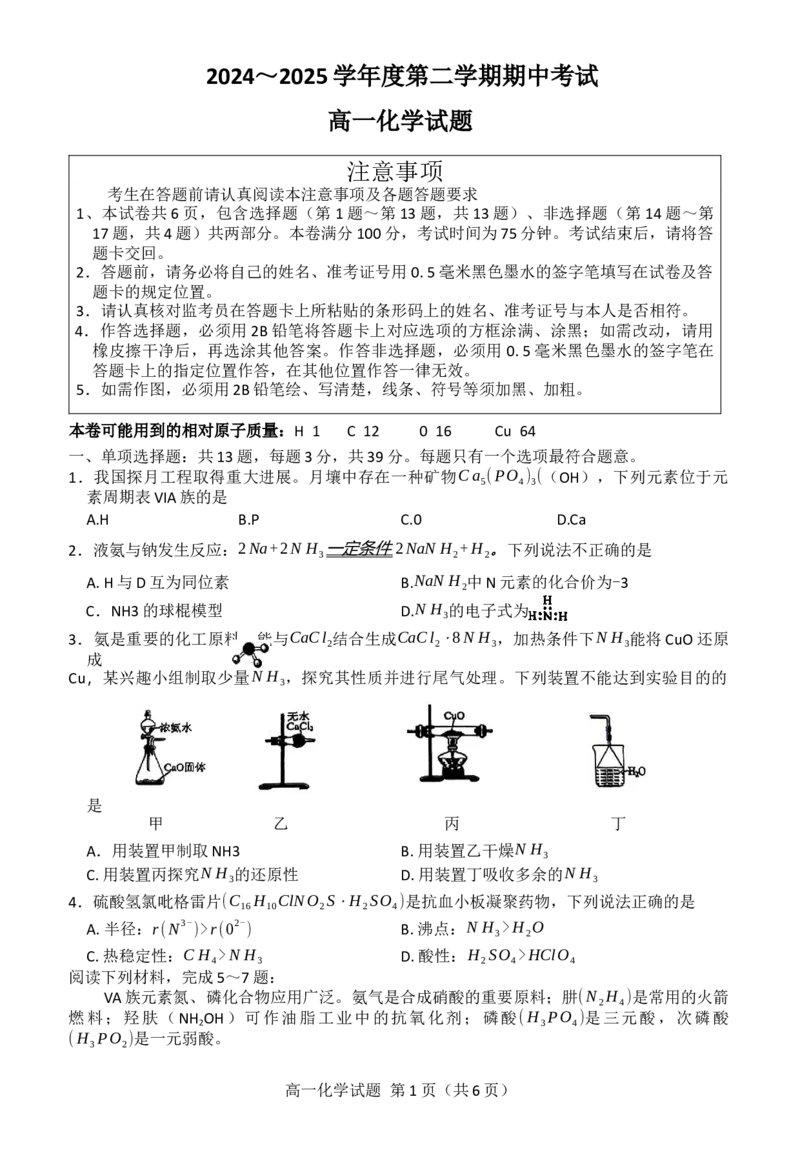
3.氨是重要的化工原料,能与CaCl 结合生成CaCl ⋅8N H ,加热条件下N H 能将CuO还原
2 2 3 3
成
Cu,某兴趣小组制取少量N H ,探究其性质并进行尾气处理。下列装置不能达到实验目的的
3
是
甲 乙 丙 丁
A.用装置甲制取NH3 B.用装置乙干燥N H
3
C.用装置丙探究N H 的还原性 D.用装置丁吸收多余的N H
3 3
4.硫酸氢氯吡格雷片(C H ClNO S⋅H SO )是抗血小板凝聚药物,下列说法正确的是
16 10 2 2 4
A.半径:r(N3- )>r(02- ) B.沸点:N H >H O
3 2
C.热稳定性:CH >N H D.酸性:H SO >HClO
4 3 2 4 4
阅读下列材料,完成5~7题:
VA族元素氮、磷化合物应用广泛。氨气是合成硝酸的重要原料;肼(N H )是常用的火箭
2 4
燃料;羟肤(NH OH)可作油脂工业中的抗氧化剂;磷酸(H PO )是三元酸,次磷酸
2 3 4
(H PO )是一元弱酸。
3 2
高一化学试题 第1页(共6页)5.下列物质的结构与性质或物质性质与用途具有对应关系的是
A.N 化学性质很稳定,N 可用于工业合成氨
2 2
B.NH OH具有氧化性,可作油脂工业中的抗氧化剂
2
C.肼具有还原性,可作为火箭燃料
D.NH 易与酸反应,可用于制取硝酸
3
6.氮及其化合物的转化具有重要应用。下列说法错误的是
A.可用浓盐酸检测输送NH 的管道是否发生泄漏
3
B.自然固氮、人工固氮都是将N 转化为NH
2 3
C.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
D.氮气和氧气在高温条件下发生反应是汽车尾气中氮氧化物的主要成因
7.下列化学反应表示正确的是
A.铜与浓硝酸反应的离子方程式:Cu+4H++2NO-=Cu2++2NO ↑+2H O
3 2 2
B.向AlC13溶液中加入过量浓氨水的离子方程式:Al3++4N H ⋅H O=[Al(OH) ] -+4N H+
3 2 4 4
C. H PO 与足量的NaOH溶液反应的离子方程式:
3 2
D.氨水吸收过量SO 的化学方程式:2N H ⋅H O+SO =(N H ) SO +H O
2 3 2 2 4 2 3 2
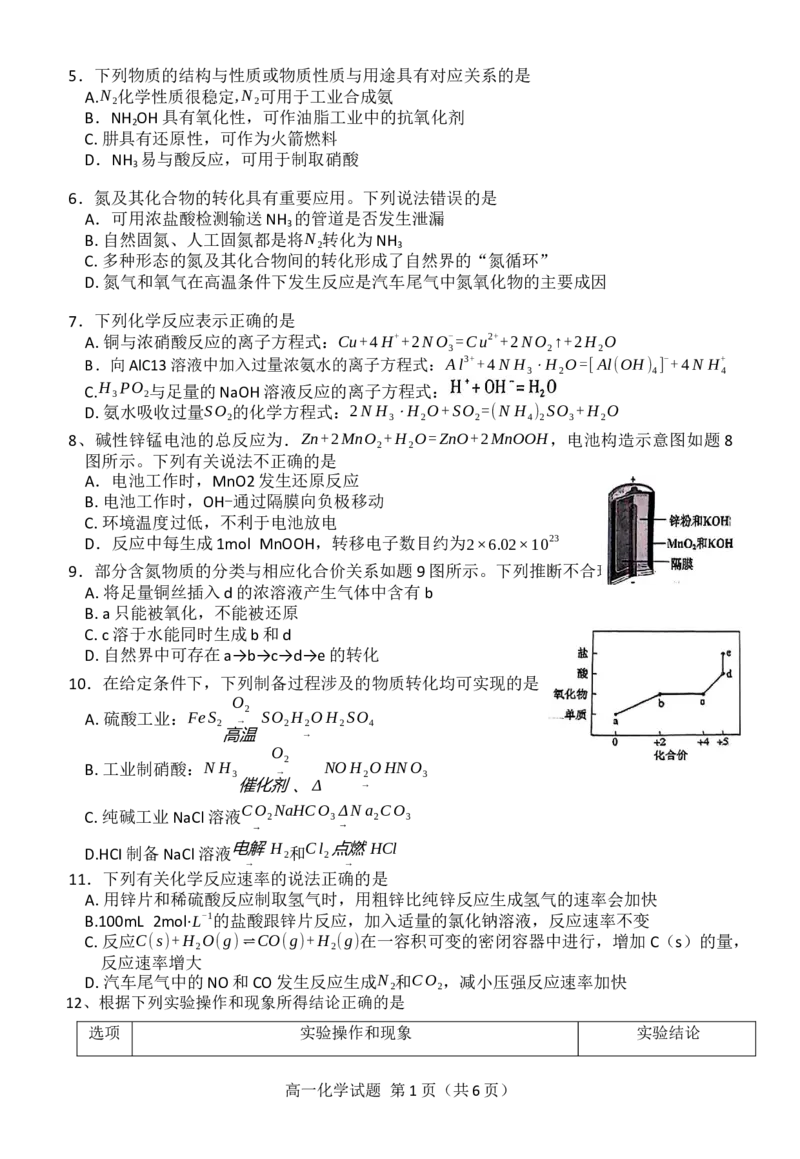
8、碱性锌锰电池的总反应为.Zn+2MnO +H O=ZnO+2MnOOH,电池构造示意图如题 8
2 2
图所示。下列有关说法不正确的是
A.电池工作时,MnO2发生还原反应
B.电池工作时,OH-通过隔膜向负极移动
C.环境温度过低,不利于电池放电
D.反应中每生成1mol MnOOH,转移电子数目约为2×6.02×1023
9.部分含氮物质的分类与相应化合价关系如题9图所示。下列推断不合理的是
A.将足量铜丝插入d的浓溶液产生气体中含有b
B.a只能被氧化,不能被还原
C.c溶于水能同时生成b和d
D.自然界中可存在a→b→c→d→e的转化
10.在给定条件下,下列制备过程涉及的物质转化均可实现的是
O
2
A.硫酸工业:FeS
2 →
SO
2
H
2
OH
2
SO
4
高温 →
O
2
B.工业制硝酸:N H
3 →
NOH
2
OHNO
3
催化剂、Δ →
CO NaHCO ΔNa CO
C.纯碱工业NaCl溶液 2 3 2 3
→ →
D.HCI制备NaCl溶液电解H
2
和
Cl
2
点燃HCl
→ →
11.下列有关化学反应速率的说法正确的是
A.用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率会加快
B.100mL 2mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.反应C(s)+H O(g)⇌CO(g)+H (g)在一容积可变的密闭容器中进行,增加 C(s)的量,
2 2
反应速率增大
D.汽车尾气中的NO和CO发生反应生成N 和CO ,减小压强反应速率加快
2 2
12、根据下列实验操作和现象所得结论正确的是
选项 实验操作和现象 实验结论
高一化学试题 第1页(共6页)A 将灼热的木炭加入浓硝酸中,有红棕色气体产生 木炭在加热条件下能
与浓硝酸反应
B 向溶液X中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于 溶液X中无NH +
4
试管口,试纸不变蓝
C 用铂丝蘸取溶液进行焰色试验,火焰呈黄色 溶液中可能有K+
D 将 0.2mol·L-1FeCl 溶液与 0.1mol·L-1KI 溶液等体积混合,取少 Fe3+与I-的反应有一定
3
量混合液滴加KSCN溶液,溶液变血红色 限度
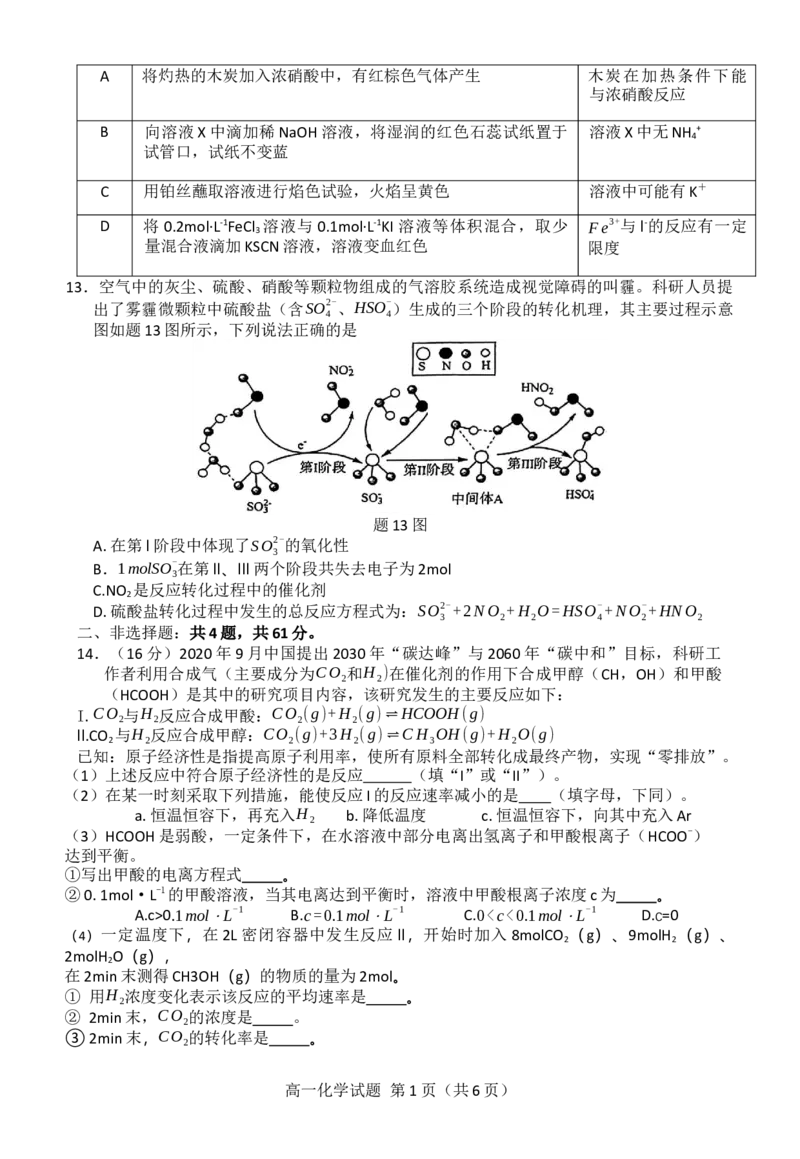
13.空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。科研人员提
出了雾霾微颗粒中硫酸盐(含SO2-、HSO-
)生成的三个阶段的转化机理,其主要过程示意
4 4
图如题13图所示,下列说法正确的是
题13图
A.在第I阶段中体现了SO2-的氧化性
3
B.1molSO-在第II、III两个阶段共失去电子为2mol
3
C.NO 是反应转化过程中的催化剂
2
D.硫酸盐转化过程中发生的总反应方程式为:SO2-+2NO +H O=HSO-+NO-+HNO
3 2 2 4 2 2
二、非选择题:共4题,共61分。
14.(16分)2020年9月中国提出2030年“碳达峰”与2060年“碳中和”目标,科研工
作者利用合成气(主要成分为CO 和H )在催化剂的作用下合成甲醇(CH,OH)和甲酸
2 2
(HCOOH)是其中的研究项目内容,该研究发生的主要反应如下:
I.CO 与H 反应合成甲酸:CO (g)+H (g)⇌HCOOH(g)
2 2 2 2
II.CO 与H 反应合成甲醇:CO (g)+3H (g)⇌CH OH(g)+H O(g)
2 2 2 2 3 2
已知:原子经济性是指提高原子利用率,使所有原料全部转化成最终产物,实现“零排放”。
(1)上述反应中符合原子经济性的是反应 (填“I”或“II”)。
(2)在某一时刻采取下列措施,能使反应I的反应速率减小的是 (填字母,下同)。
a.恒温恒容下,再充入H b.降低温度 c.恒温恒容下,向其中充入Ar
2
(3)HCOOH是弱酸,一定条件下,在水溶液中部分电离出氢离子和甲酸根离子(HCOO-)
达到平衡。
①写出甲酸的电离方程式 。
②0.1mol·L-1的甲酸溶液,当其电离达到平衡时,溶液中甲酸根离子浓度c为 。
A.c>0.1mol⋅L-1 B.c=0.1mol⋅L-1 C.0x 时,水体中总氮去除率下降,可能的原因是
1
高一期中化学试题参考答案
1.C 2.D 3.B 4.A 5.C 6.B 7.A 8.D 9.B 10.D
11.A 12.C 13.D
14.(每空2分,共16分)
(1) I (2) b (3) HCOOH HCOO- + H+ ,C
(4) 1.5mol•L-1 •min-1 , 3mol•L-1 ,25%
(5) BD(漏选1个扣1分,错选不得分)
15.(共16分)
(1) NH Cl Ca(OH) (2分)
4 2
(2) 4NH + 5O 4NO + 6H O (2分)
3 2 2
(3) A为氧气 目的是氧化NO,使NO尽量充分转化为HNO (2分)
3
(4) (a+3b-6c) (2分)
高一化学试题 第1页(共6页)(5) n(Cu) = 44.8g ÷ 64g·mol-1 =0.7mol 1分
气体物质的量n(NO ) = 22.4L ÷ 22.4L·mol-1 = 1 mol 1分
X
由氮元素守恒可得
n(HNO ) = 2n(Cu) +n (NO ) = 0.7mol×2 + 1 mol = 2.4mol 1分
3 X
(其他合理答案参照给分)
(6) ① NH ·H O + NaCl + CO = NH Cl + NaHCO ↓ (2分)
3 2 2 4 3
或 NH +H O + NaCl + CO = NH Cl + NaHCO ↓
3 2 △ 2 4 3
②2NH Cl +MgO === MgCl + 2NH ↑ + H O (3分)
4 2 3 2
16.(共12分)
(1) 否(1分)
(2) 正(1分), 2Al + 6H+ = 2Al3+ + 3H ↑(2分)
2
(3) 负(1分),
Al-3e-+4OH- =[Al(OH) ]-(或Al - 3e- + 4OH- = AlO -+2H O,共2分)
4 2 2
(4) a(1分),CH -8e- + 10OH- = CO 2-+ 7H O (2分),减小(2分)
4 3 2
17.(共17分)
(1) SO SO N O (任写两个,对1个给1分,有错不得分,共2分)
2 3 2 5
(2) B (2分)
(3) 8NH + 6NO 7 N +12H O (3分)
3 2 2 2
(4) NO + NO + CO 2- = 2NO - + CO (3分)
2 3 2 2
(5) 2NO + 3HClO + H O = 2NO - + 3Cl- + 5H+ (3分)
2 3
(此题写成H+ ClO- 不得分)
(6) 还原作用(或还原剂、起还原性等合理答案) (2分)
(7) 部分氨氮被氧化为NO -等可溶性离子留在废水中(2分)
3
高一化学试题 第1页(共6页)