文档内容
郑州一中 27 届(高一)第一次模拟测试化学试题卷
常见元素相对原子质量
氢H:1 碳C:12 氮N:14 氧O:16 氟F:19 钠Na:23
镁Mg:24 铝Al:27 硅Si:28 磷P:31 硫S:32 氯Cl:35.5
钾K:39 钙Ca:40 锰Mn:55 铁Fe:56 铜Cu:64 锌Zn:65
溴Br:80 银Ag:108 碘1:127 钡Ba:137
一.选择题(共16小题,每题4分)
1.用 表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.5mol一氧化碳分子所占体积是11.2L
B. 含有的电子数为
C.欲配制 的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D.从1mol/L的NaOH溶液中取出20mL的 的数目为
2.设 为阿伏加德罗常数的值。下列说法正确的是( )
A.22.4L(标准状况下)Ne和 的混合气体中所含电子总数为
B.常温常压下, 和 的混合气体含有的O原子的数目大于 ,小于
C. 个CO分子和 的质量之比为7:4
D.将2.24L HCl气体通入水中配成100mL溶液,所得溶液的物质的量浓度1mol/L
3.下列物质既能由金属与氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A. B. C. D.
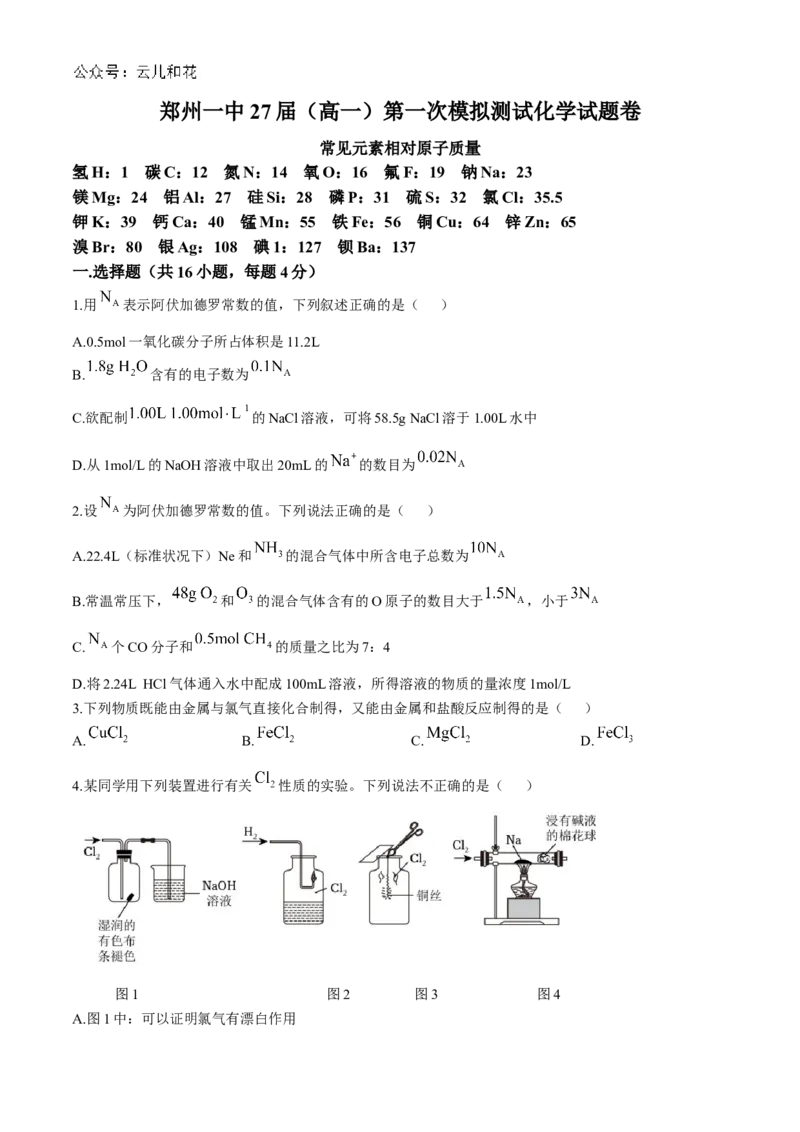
4.某同学用下列装置进行有关 性质的实验。下列说法不正确的是( )
图1 图2 图3 图4
A.图1中:可以证明氯气有漂白作用B.图2中:产生苍白色火焰
C.图3中:向实验后冷却的固体中加水溶解,得到蓝绿色溶液
D.图4中:产生的大量白烟是氯化钠晶体
5.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.新制氯水呈浅黄绿色且有刺激性气味,说明氯水中含
B.向氯水中加入 固体,有气泡产生,说明氯水中含HClO
C.向氯水中加入石蕊溶液,溶液变红后褪色,说明水中含 和HClO
D.向氯水中滴加硝酸酸化的 溶液,产生白色沉淀,说明氯水中含有
6.下列实验过程中,不会产生气体的是( )
A. B. C. D.
7.同温同压下,下列关于相同质量的 和 说法正确的是( )
A.体积之比为1:2 B.密度之比为1:2
C.物质的量之比为1:2 D.原子个数之比为3:8
8.1971年第14届国际计量大会规定: 中所含原子数为阿伏加德罗常数,其近似值为
。而2018年第26届大会对阿伏加德罗常数予以重新规定,即1摩尔精确包含
个基本微粒,该数即为以单位mol⁻¹表示阿伏加德罗常数NA的固定数值。摩尔来源于
拉丁文moles,原意为大量、堆积,是第14届国际计量大会决定增加的国际单位制(Sǐ)的第七个基本单
位。下列有关说法中错误的是( )
①摩尔是国际单位制中七个基本物理量之一
②1mol任何物质都含有约 个原子
③氢原子的摩尔质量是1g
④HCl的摩尔质量等于1molHCl分子的质量
⑤ 中含有1mol碳和2mol氧
A.①②③ B.②③④ C.②③④⑤ D.全部9.室温下某容积固定的密闭容器由可移动的活塞隔成甲、乙两室,向甲中充入一定量的 、 混合气体,
乙中充入 气体,此时活塞位置如图。下列有关说法正确的是( )
A.该图表明,甲室的压强是乙室的2倍,气体分子数量也是乙室的2倍
B.甲室中 、 的总质量不能确定,但总的物质的量一定是2mol
C.将甲室的混合气体充分反应,恢复至室温,最终活塞停留的位置应是刻度3处
D.若甲室混合气体密度是同温同压时H₂密度的30倍,则甲室通入的气体是32g
10.下列科学研究领域中,不属于化学研究范畴的是( )
A.国家游泳馆水立方采用的覆盖膜为先进的EFET膜,具有防火、抗老化等功能
B.两个氢原子核聚变成一个氦核,核反应释放出巨大能量,用于发电
C.在微观层面,操纵分子组装分子材料,并利用结构预测物质化学性质
D.通过实验探究物质性质和规律,用于合成杀死新型冠状病毒的物质
11.营养液是无土栽培的核心和关键,某营养液中含4种离子(忽略微量离子),对离子浓度的要求如下表
所示。
离子种类
______ 0.03 0.03 0.01
浓度( )
该营养液中 的物质的量浓度为( )
A. B. C. D.
12.下列有关物质的量浓度和质量分数的计算正确的是( )
A.98%的浓硫酸的物质的量浓度是49%的硫酸的物质的量浓度的二倍
B.20%的氢氧化钠溶液和30%的氢氧化钠溶液等体积混合,混合后溶液的溶质质量分数为25%
C. , 的硫酸溶液与 , 的硫酸溶液等体积混合,得到 的硫酸
溶液的浓度为
D.25℃时NaCl饱和溶液(密度为 )的物质的量浓度约为5.3mol/L(已知25℃时氯化钠在水中的
溶解度为36克)
13.下列有关物质的量浓度和质量分数的计算正确的是( )
A. 和 各0.1mol分别溶于水形成1L溶液,所得溶液的物质的量浓度不相等B.已知质量分数为98%的硫酸溶液的物质的量的浓度为18.4mol/L,则质量分数为49%的硫酸溶液的物质的
量浓度小于9.2mol/L
C.将 的硫酸溶液与水等体积混合,所得溶液浓度为
D.20℃时,饱和KCl溶液的密度为 ,物质的量浓度为4.0mol/L,则此溶液中KCl的质量分数
为
14.已知两支试管中分别装有等浓度的 和 ,下列操作或判断错误的是( )
选
操作 判断
项
A
分别滴加 溶液 产生沉淀的为 溶液
B
分别滴加少量稀 溶液 产生白色沉淀的为 溶液
C 分别滴加几滴酚酞溶液
溶液红色更深
D 分别逐滴加入等浓度的盐酸
立即产生气泡的为 溶液
15.向一定量的NaOH溶液中通入一定量 气体充分反应后,再向所得溶液中逐滴加入 的盐
酸,产生 的体积与所加盐酸体积之间关系如图所示。则下列判断正确的是( )
A.原NaOH溶液的浓度为
B.通入 的体积(标准状况下)为0.224L
C.所得溶液中溶质成分的物质的量之比
D.所得溶液的溶质成分是NaOH和
16.下列关于部分物质的分类完全正确的是( )
选项 单质 氧化物 纯净物 碱 盐
铝合 熟石
A 冰水混合物 明矾
金 灰
B 氦气 硝酸 纯碱
C 水银 液氧 火碱生石
D 臭氧 干冰 尿素
灰
二.非选择题(每空2分)
17.关于气体,回答下列问题:
(1) 与 的原子数之比为______,同温同压下的密度之比为______。
(2)某汽车安全气囊的气体发生剂为叠氮化钠( ),在受到撞击时分解生成Na和 ,
分解产生的 在标准状况下的体积为______L。
(3) 和 组成的混合气体在标准状况下的密度为 ,其中 的物质的量分数为______。
(4)气体化合物A分子式可表示为 ,已知同温同压下10mL A受热分解生成 和 ,
则A的化学式为______。
(5)标准状况下, 的密度为______(保留3位有效数字)。如果 中含有x个氢原子,则
阿伏加德罗常数的值为______。
18.关于水溶液,回答下列问题:
(1)下列说法中正确的是______。
A.1L水中溶解了40g NaOH后,所得溶液浓度为1mol/L
B.从1L 2mol/L的NaCl溶液中取出0.5L,该溶液的浓度为1mol/L
C.将2.24L HCl气体通入水中制成100mL溶液,所得溶液的物质的量浓度1mol/L
D.配制1L 0.1mol/L的 溶液,需要用25.0g胆矾
(2)2L硫酸铝溶液中含有 ,则溶液中 的物质的量浓度为______。
A.0.5mol/L B.0.75mol/L C.1mol/L D.1.25mol/L
(3)某无土栽培用的营养液,要求KCl、 和 三种原料的物质的量之比为1:4:8。
①配制该营养液后 ,溶液中 ______mol/L。
②若采用 和KCl来配制该营养液,则KCl和 物质的量之比为______。
(4)标准状况下,400体积 溶于1体积水得到氨水溶液( ),所得氨水浓度为
______。
(5)在标准状况下,11.2升甲烷充分燃烧,将生成的气体通入200mL某浓度的氢氧化钠溶液中,恰好完
全反应生成碳酸钠。则所用氢氧化钠溶液的物质的量浓度为______。19.某品牌的“84”消毒液的主要成分为NaClO,浓度为 ,密度为 。请回答下列问
题。
(1)该“84”消毒液的质量分数为______(保留3位有效数字)。
(2)某同学欲用NaClO固体配制240mL“84”消毒液。
①下列仪器中,不需要用到的是______(填字母)。
A.烧杯 B.250mL容量瓶 C.10mL量筒 D.胶头滴管 E.天平
②本次实验需要用托盘天平称取的NaClO固体质量为______。
③误差分析(填“偏大”“偏小”或“无影响”):
A.配制前,容量瓶中有少量蒸馏水:______。
B.定容时俯视容量瓶刻度线:______。郑州一中27届(高一)第一次模拟测试化学试题
参考答案
1 2 3 4 5 6 7 8
D A C A B C B D
9 10 11 12 13 14 15 16
B B C D B A D C
17.(1)1:1,3:2 (2)67.2 (3)5%
(4) (5)0.714g/L 0.5x
18.(1)D (2)B
(3)0.018 9:4
(4)13.01mol/L(13左右都算正确)
(5)5mol/L
19.(1)24.8%
(2)①C ②74.5g ③无影响 偏大